Method Article
Schwimmen induzierte Paralyse zu beurteilen Dopamin Signalisierung in Caenorhabditis elegans
In diesem Artikel
Zusammenfassung
Schwimmen-induziert Lähmung (SWIP) ist ein etablierter Verhaltens-Assay verwendet, um die zugrunde liegenden Mechanismen von Dopamin Signalisierung in Caenorhabditis Elegans (C. Elegans) zu studieren. Allerdings fehlt eine detaillierte Methode, um den Test durchzuführen. Hier beschreiben wir Schritt für Schritt Protokoll für SWIP.
Zusammenfassung
Der Swimming-Assay in diesem Protokoll beschrieben ist, dass Synapsen ein gültige Instrument zur Regulierung der dopaminergen Proteine zu identifizieren. Ähnlich wie bei Säugetieren, Dopamin (DA) steuert mehrere Funktionen in C. Elegans einschließlich Lern- und motorische Aktivität. Bedingungen, die DA Version (z. B. Amphetamin (AMPH) Behandlungen) zu stimulieren oder zu verhindern, dass DA Abstand (z. B. Tieren fehlt DA Transporter (Dat-1) die sind unfähig, reaccumulating DA in den Neuronen) erzeugen einen Überschuss an extrazellulären DA schließlich mit dem Ergebnis gehemmte Fortbewegung. Dieses Verhalten ist besonders deutlich, wenn Tiere im Wasser schwimmen. In der Tat, während Wildtyp Tiere über einen längeren Zeitraum zu schwimmen weiterhin, Dat-1 null Mutanten und Wildtyp behandelt mit AMPH oder Inhibitoren der DA-Transporter auf den Boden des Brunnens sinken und bewegen sich nicht. Dieses Verhalten wird als "Schwimmen induzierte Paralyse" (SWIP) bezeichnet. Obwohl der SWIP-Test gut etabliert ist, fehlt eine detaillierte Beschreibung der Methode. Hier beschreiben wir Schritt für Schritt um SWIP durchzuführen. Um den Test durchzuführen, sind späten larvalen Phase 4 Tiere in einer Glasplatte vor Ort mit Saccharose Kontrolllösung mit oder ohne AMPH platziert. Tiere sind für ihr Verhalten schwimmen erzielte durch Visualisierung unter ein Stereoskop manuell oder automatisch durch die Aufnahme mit einer Kamera auf das Stereoskop montiert. Videos werden dann analysiert verwenden eine Tracking-Software, die eine visuelle Darstellung der Prügel Frequenz und Lähmungen in Form von Heatmaps ergibt. Die manuelle und automatisierte Systeme garantieren eine leicht quantifizierbare Auslesen der Schwimmfähigkeit der Tiere und ermöglichen so Screening für Tiere tragen Mutationen innerhalb des dopaminergen Systems oder für zusätzliche Gene. SWIP ist darüber hinaus lässt sich den Mechanismus der Wirkung von Drogen wie AMPH aufzuklären.
Einleitung
Tiere führen eine Vielzahl von angeborenen und komplexe Verhaltensweisen, die durch verschiedene Neurotransmitter, die von komplizierten Signalisierung Prozesse koordiniert vermittelt werden. Der Neurotransmitter Dopamin (DA) vermittelt hoch konservierte Verhaltensweisen über Arten, darunter lernen, Motorik und Belohnung Verarbeitung.
Boden-Nematoden C. Elegans, zeigt mit einem relativ einfach und gut gemappten Nervensystem nur 302 Neuronen bestehend deutlich komplexe Verhaltensweisen, darunter viele, die DA wie Paarung, lernen, Nahrungssuche, Fortbewegung und Eiablage geregelt sind 1. unter anderen Funktionen, kurze Lebensdauer, einfache Handhabung und die Erhaltung der Signalmoleküle, markieren Sie die Vorteile der Verwendung von C. Elegans als Modell für die Erforschung der neuronalen Grundlagen von konservierten Verhaltensweisen.
Die Zwitter C. Elegans enthält acht dopaminergen Neuronen; Darüber hinaus enthält das Männchen sechs zusätzliche Paare zur Paarung Zwecke. Wie bei Säugetieren diese Neuronen DA zu synthetisieren und express DA Transporter (DAT-1), ein Membranprotein fand ausschließlich in dopaminergen Neuronen, die transportiert, DA in den synaptischen Spalt zurück in den dopaminergen Neuronen freigesetzt. Darüber hinaus die meisten Proteine, die in jedem Schritt der Synthese, Verpackung und Freisetzung von DA sind hoch konserviert zwischen Würmern und Menschen, und wie bei Säugetieren, DA moduliert Fütterung Verhaltensweisen und Fortbewegung in C. Elegans2.
C. Elegans kriecht auf festen Oberflächen und mit einem charakteristischen Prügel Verhalten im Wasser schwimmt. Interessanterweise Mutanten fehlt Ausdruck des DAT-1 (Dat-1) kriechen normalerweise auf festen Untergrund aber nicht schwimmen als in Wasser untergetaucht aufrecht zu erhalten. Dieses Verhalten wurde schwimmen induzierten Lähmungen oder SWIP bezeichnet. Bisherige Experimenten gezeigt, dass SWIP, teilweise durch ein Übermaß an DA in den synaptischen Spalt verursacht wird, die letztlich die postsynaptischen D2-Like-Rezeptoren (DOP-3) overstimulates. Obwohl ursprünglich in Dat-1 Ko Tiere3identifiziert, SWIP wird auch beobachtet, in Wildtyp Tiere mit Medikamenten dieser Block die Aktivität der DAT (z. B. Imipramin4) behandelt und/oder DA Version (z. B. Amphetamin5) induzieren. Auf der anderen Seite zu verhindern, dass pharmakologische oder genetische Manipulationen Abwendung Synthese und Freisetzung von DA und DOP-3-Rezeptor-Funktion sperren SWIP6. Zusammengenommen haben diese bereits veröffentlichten Daten SWIP als ein zuverlässiges Werkzeug, die Auswirkungen auf das Verhalten verursacht durch mutierte Proteine innerhalb von dopaminergen Synapsen3,4,7 zu studieren und für anzuwendende etabliert leiten Sie genetische Bildschirme für die Identifizierung der neuartige rechtliche Wege DA Signalisierung7,8,9,10,11,12beteiligt. Zusätzlich, indem eine leicht quantifizierbare Auslesen des Medikamenten-induzierten Verhalten bei lebenden Tieren SWIP ermöglicht die Aufklärung der Mechanismen der Wirkung von Drogen wie Amphetamin (AMPH) und Azaperone bei der dopaminergen Synapsen5, 6 , 13 , 14 , 15.
Protokolle für die Durchführung der SWIP-Assays wurden vor16beschrieben. Hier beschreiben wir ausführlich die Methodik und das Setup Ausführen des Tests mit dem Ziel, eine visuelle Anleitung für die Gemeinschaft von C. Elegans SWIP effektiv durchführen.
Protokoll
1. Vorbereitung von Lösungen und Medien
- M9 Puffer durch Auflösen von KH2PO4 3,0 g (22,05 mM), Na2HPO4 6,0 g (42,2 mM) vorbereiten und NaCl 5,0 g (85,5 mM) in 1 L autoklaviert deionisiertes Wasser. Nach dem Autoklavieren 1,0 mL 1 M MgSO4 (12 g in einem Endvolumen von 100 mL autoklaviert deionisiertes Wasser) hinzugeben. Mix 100 mL der resultierenden 10 X M9 mit 900 mL autoklaviert deionisiertes Wasser, um eine 1 X Lösung machen.
- Um Ei Puffer zu machen, lösen Sie 6,896 g NaCl (118 mM), 3,578 g KCl (48 mM), 0,294 g CaCl2-2 H2O (2 mM), 0,406 g MgCl2-6 H2O (2 mM) und 5,958 g (25 mM auf) von HEPES in 1 L autoklaviert deionisiertes Wasser. Einstellen Sie pH bis 7.3 mit NaOH.
- Bereiten Sie frische Natriumhypochlorit/NaOH Lösung durch Zugabe von 1 mL ca. 5-6 % Natriumhypochlorit (Chlorid) und 180 µL 10 N NaOH auf 3,8 mL entionisiertem Wasser.
- 60 g Saccharose wiegen und lösen sich im Autoklaven deionisiertes Wasser zu einem Endvolumen von 100 mL bis 60 % Saccharoselösung machen.
- Auflösen von 0,684 g Saccharose in 10 mL autoklaviert deionisiertes Wasser, 200 mM Saccharose zu machen. Prüfen Sie und einstellen Sie der gleichen eine Osmolarität mit XR. 1 mL Aliquots in 1,5 mL Mikrozentrifugenröhrchen und frieren bei-20 ° C.
- 0,184 g AMPH (Molmasse 184.75 g/Mol) wiegen und lösen sich in 10 mL entionisiertem Wasser, eine 100 mM-Stammlösung zu machen. Mix 2 µL der Stammlösung in 400 µL Wasser 0,5 mM funktionierende Lösung zu machen.
-
Bereiten Sie Nährstoff Wachstum Medien (NGM) Platten
- Mix 3 g NaCl (52,65 mM), 20 g Pepton, 25 g Bacto-Agar und 975 mL entionisiertem Wasser in einen 2 L-Erlenmeyer-Kolben. Gehören Sie ein magnetisches rühren Bar und Autoklaven (121 ° C, 15 PSI) für 1 Stunde mit flüssigen Zyklus.
- Abkühlen lassen Sie und behalten Sie die Temperatur bei ca. 50 ° C, indem Sie den Kolben auf einer Heizung unter Rühren. 0,5 mL des Cholesterins (5 mg/mL in Ethanol), 1 mL 1 M MgSO4, 1 mL 1 M CaCl2 und 25 mL 1 M Phosphatpuffer Kalium, pH-Wert 7,4 (108,3 g KH2PO4, 35,6 g K2HPO4 hinzufügen deionisiertes Wasser bis 1 L).
- Pipette 25 mL in 100 mm x 15 mm Petri Platten und lassen die Medien zu festigen. Speichern Sie die Platten auf den Kopf bei 4 ° C in einer Box für bis zu 4 Wochen.
-
Vorbereitung der Lysogeny Brühe (LB) Brühe
- 5 g LB Trockenmischung in 200 mL entionisiertem Wasser in einen Erlenmeyerkolben auflösen. Autoklaven für 30 Minuten unter Verwendung der flüssigen Sterilisation radeln. Lassen Sie die Brühe abkühlen lassen. Für 1-2 Wochen bei Raumtemperatur lagern.
-
Vorbereitung der bakteriellen Platten NA22
- Verwenden Sie einen sterilen Pipettenspitze oder einer sterilen bakterielle Schleife Streifen eine LB-Platte mit einem kleinen Volumen der NA22 E. Coli -Bakterien aus Glycerin und inkubieren Sie die Platte auf dem Kopf stehend in einem Inkubator 37 ° C über Nacht um isolierte Kolonien wachsen. Wählen Sie und führen Sie eine einzige Kolonie in 200 mL LB Brühe zubereitet im Schritt 1,8 ein und über Nacht bei 37 ° C auf ein Schütteln Plattform wachsen zu lassen.
- Verzichten Sie, um die Platten zu säen, 200 µL der bakteriellen Kultur auf die NGM Teller weiter oben in Schritt 1.7 vorbereitet und mit einem sterilen Glas Hockeyschläger zu verbreiten. Lassen Sie die Platten trocknen über Nacht oder länger unter einer Haube und kopfüber in einer luftdichten Box bei 4 ° c lagern
- Um die Wimpern/Platin-Werkzeug, um Würmer holen zu machen, kleben Sie eine dicke Wimpern oder ein Platin-Glühfaden in ein Glas Pasteur pipette mit super-Klebstoff. Schneiden Sie die Spitze der Wimpern in einem Winkel mit einer Rasierklinge. Alternativ kann ein Bunsenbrenner schmelzen die Pipettenspitze Glas um das Platin Filament verwendet werden.
2. C. Elegans Tierhaltung
Hinweis: Kultur von Wildtyp N2C. Elegans Belastung für Escherichia coli NA22 Platten. Die detaillierte Kulturmethoden werden nachfolgend beschrieben.
-
Vorbereitung der Wurm Kultur
- Um eine Starterkultur von Würmern, schneiden Sie ein kleines Stück des Nährbodens aus einer Platte mit gut genährte Tiere und übertragen Sie es auf einen NA22 E. Coli -Bakterien-Teller vorbereitet im Schritt mit einem sterilen Spatel 1,9. 3-4 Tage inkubieren Sie Platten bei 20 ° C. Bestätigen Sie unter einem Stereomikroskop visuell das Vorhandensein von trächtigen Erwachsene.
-
Vorbereitung der synchronisierten Bevölkerung von worms
- Sammeln Sie trächtige Erwachsenen von mindestens 2 Platten durch den Verzicht auf autoklaviert deionisiertes Wassers rund um die Platte mit einer Spritzflasche. Vorsichtig schwenken die Platte, um die Würmer zu verdrängen und die Würmer in einem 15 mL Polystyrol konischem Rohr mit einer Einweg-Kunststoff-Pipette zu sammeln.
- Spin-down das Rohr in einer Zentrifuge bei 140 X g für 2 min, pellet-Würmer, dann überstand mit einer Vakuumpumpe abgesaugt oder mit integriertem Labor Vakuum.
- Aufschwemmen und waschen die Würmer durch das Ausfüllen der Röhre autoklaviert deionisiertes Wasser und Mischung mit Zentrifuge bei 140 X g für 2 min. Aspirieren überstand und wiederholen Sie diese letzte Schritt zwei weitere Male oder bis Würmer klar von Bakterien sind (Wasser wird deutlich, wenn Sie gemischt mit den Würmern).
- Das Wurm-Pellet 5 mL frisch zubereiteten Natriumhypochlorit/NaOH-Lösung (Schritt 1.3) hinzu und schnell mischen mit einem Wirbel. Inkubieren Sie das Rohr auf einer Wippe für ca. 4-8 min. Die Zeit der Inkubation mit Natriumhypochlorit/NaOH Lösung schwankt zwischen 4-8 Minuten anhand der Qualität der Lager Natriumhypochlorit-Lösung (Bleichmittel).
- Setzen Sie einen Tropfen (2-50 µL) Lösung, die Würmer auf einen Glas-Objektträger enthält, und überprüfen Sie alle 2 min unter dem Mikroskop für Wurm Lyse. Bei etwa 70 % der Würmer lysiert und Eier werden freigesetzt, füllen Sie das Rohr mit Ei Puffer in Schritt 1.2 und sofort Zentrifuge für 1 min bei 140 X g pellet-Embryonen und Wurm Schlachtkörper vorbereitet.
- Den Überstand abgesaugt und waschen das Pellet 3 mehrmals durch das Rohr jedes Mal mit Ei-Puffer zu füllen. Spin-down bei 140 X g für 1 min und den Überstand jedes Mal zu entfernen. Das Pellet wird weiß am Ende der Waschgänge.
- Trennen Sie nach der letzten Wäsche die Embryonen von die Toten Kadaver in 30 % Saccharoselösung. 5 mL autoklaviert deionisiertes Wasser zum Pellet, Aufschwemmen dazugeben und 5 mL 60 % Saccharose in Schritt 1.4 vorbereitet. Gründlich mischen und bei 160 X g für 6 min zentrifugieren.
- Verwenden Sie ein Glas Pasteurpipette schwimmende am oberen Meniskus in ein frisches 15 mL konische Röhrchen Embryonen übertragen. Nehmen Sie nicht mehr als 3 bis 4 mL. Entfernen Sie alle verbleibenden Saccharose, waschen die Embryonen 3 Mal mit autoklaviert Wasser durch Zentrifugieren bei 140 X g für 3 min, entfernen des Überstands und resuspending das Pellet (und füllt das Rohr) jedes Mal.
- Wiederholen Sie die Waschungen mit 1 x M9-Puffer. Aufschwemmen Sie nach der letzten Wäsche das Pellet in 10 mL M9. Lassen Sie die Rohre auf einen Shaker über Nacht (nicht mehr als 14 h) für die Eier in die L1-Larven schlüpfen. Würmer bleiben in L1 Larvenstadium aufgrund des Fehlens von Essen.
- Waschen die L1-Larven 3 Mal mit autoklaviert Wasser Pheromone freigegeben durch die Larven durch Zentrifugieren bei 140 X g für 2 min. entfernen Aufschwemmen der Larven in 1 mL Wasser. Machen Sie eine 01:10 Verdünnung der Würmer im Wasser, pipette 10 µL Tropfen auf einen Objektträger, einem Deckgläschen auflegen und die Anzahl der Würmer unter ein Stereoskop. Wiederholen Sie diesen Vorgang zweimal und durchschnittliche Ergebnisse.
- Pipette das Volumen von Worms, das entspricht etwa 1.000 Würmer auf eine NA22-Platte (das zuvor auf Zimmertemperatur gebracht wurde), indem man kleine auf der Platte Tropfen. Lassen Sie die Platte halboffene, bis die Tropfen trocknet aus. Dann decken Sie die Platte ab und inkubieren Sie kopfüber in 20 ° C Inkubator für ca. 44-48 h oder bis die Würmer L4 Spätstadium bestätigten visuell unter einem Stereomikroskop erreichen. Nun können die Würmer, SWIP getestet werden.
(3) SWIP
Hinweis: Wir beschreiben die manuelle Methode zur Beurteilung der SWIP in Wildtyp Würmer mit AMPH behandelt. Wir diskutieren auch kurz die Verfolgung von Würmern und weiteren Analyse der Wurm Kinetik mit einer automatisierten Wurm-Tracker und eine Tracking-Software, die zuvor durch Huber Et Al.10beschrieben wurden.
-
Manuelle Methode für SWIP testen
- Aliquoten 40 µL 200 mOsm/L Zuckerlösung mit oder ohne 0,5 mM Ladeeffekt in eine Glasplatte vor Ort. Unter das Stereoskop Pick 8-10 späten L4 Stadium mit einer Wimper oder Platin Würmer holen und die Abholung in der Platte mit der Lösung bis Würmer aus dem Pick bewegen und in die Lösung schwimmen eintauchen. Beachten Sie die Anzahl der Würmer in den Brunnen holte, der Timer gestartet wird, beobachten und notieren Sie die Anzahl der Würmer, SWIP auf jeder Minutenmarke ausstellen.
- Kopieren Sie die raw-Daten in eine Tabellenkalkulation und berechnen Sie den Prozentsatz der Würmer gelähmt, indem die Anzahl der Würmer gelähmt in jeder Minute durch Gesamtzahl der Würmer in den Assay getestet und mit 100 multiplizieren. Kopieren Sie die prozentuale Werte in eine grafische Darstellung und Statistiksoftware und Handlung die Daten mit prozentuale Werte auf der y-Achse und Zeit auf der X-Achse mit der XY-Diagramm zu formatieren.
- Führen Sie zwei-Wege-ANOVA gefolgt von Post-hoc-Analyse (z.B. Bonferroni Posttest), um statistische Signifikanz unter Kontrolle, AMPH Gruppen und Dauer der Behandlung zu testen.
-
Automatisierte Analyse von SWIP
- Automatisierte Analyse auf einen einzigen Wurm zu einem Zeitpunkt ausführen. Das Protokoll zum set Kamera, die Wurm-Tracker-Software und Skript, um die Tracking-Software Analyse in Hardaway Et Al.16ausführlich beschrieben sind.
- Kurz, legen Sie ein einzelnes späten L4 Stadium Zwitter in eine Glasplatte vor Ort unter Verwendung einer Wimper Pick, wie in der manuellen Methode im Abschnitt 3.1.2 beschrieben. Schwimmen-Videoaufnahmen von einem Wurm zum Zeitpunkt und der Wurm-Tracker-Software verwenden, um die Häufigkeit der Körper Kurven zu berechnen.
- Führen Sie das Skript mit der Tracking-Software Wurm Prügel Frequenz und Heatmaps aus den Wurm-Prügel-Daten zu generieren.
Ergebnisse
Wir präsentieren Ihnen ein Beispiel der SWIP Assay durch AMPH Behandlung induziert. Abbildung 1 zeigt eine schematische Darstellung der Assay-Installation wie oben beschrieben. Für die manuelle Assay, ca. 8-10 Alter synchronisierte Ende L4 Stadium Würmer gesammelt mit einer Wimper oder Platin sind wählen und eine Glasplatte vor Ort gefüllt mit 40 µL 200 mOsm/L Saccharose (Control-Lösung) oder Saccharose mit 0,5 mM Ladeeffekt und getestet für SWIP gelegt.
Wenn Tiere zu stoppen schwimmen (d. h. Exponat SWIP), sie schnell auf den Boden des Brunnens sinken und sich nicht bewegen. Daher ist die Unterscheidung zwischen Tieren, die noch schwimmen auf der Oberfläche des Wassers im Vergleich zu denen, die an der Unterseite des Brunnens stetigen sind sehr einfach. Die meisten der Würmer in Kontrolle Lösung schwimmen ununterbrochen für mindestens 10 Minuten getestet, während unter Ladeeffekt Behandlung erhöht sich die Zahl der Tiere ausstellen SWIP schrittweise. Der maximale Anteil der Tiere ausstellen SWIP ist proportional zur Konzentration der Ladeeffekt verwendet1,5,13. Wenn DAT-1 KO (Dat-1) Würmer in Control-Lösung getestet werden, weisen auf 40-70 % Würmer SWIP innerhalb von 10 Minuten4,13. Dieses Ergebnis ist vergleichbar mit der Anteil der Gelähmte Tiere in Wildtyp Tiere behandelt mit 0,5 mM AMPH (Abbildung 2) gemessen.
Würmer, Saccharose oder Saccharose enthält Ladeeffekt ausgesetzt zeigen keine SWIP in der ersten Minute der Beobachtung (Abbildung 2). Jedoch während Würmer behandelt mit Saccharose 10 Minuten Schwimmen weiterhin, starten Würmer behandelt mit Ladeeffekt SWIP nach 10 Minuten, und nach 2 Minuten der Behandlung ausstellen 66 ± 3 % Tiere zeigen SWIP (Abbildung 2).
Für die automatisierte Analyse werden Videos von Würmern unter Kontrolle oder Ladeeffekt Behandlungen erfasst einen Wurm zu einem Zeitpunkt über eine video-Aufnahme-Software. Ein Computer-tracking-Software wird verwendet, um Wurm Prügel zu verfolgen und die daraus resultierenden Daten werden importiert und analysiert mit dem Software-Anzug. Proben von Heatmaps von Tieren, die Kontrolle oder AMPH ausgesetzt, Anzeige aktiv bewegenden Tieren in rot und gelähmten Würmer in grün, sind in Abbildung 3dargestellt.
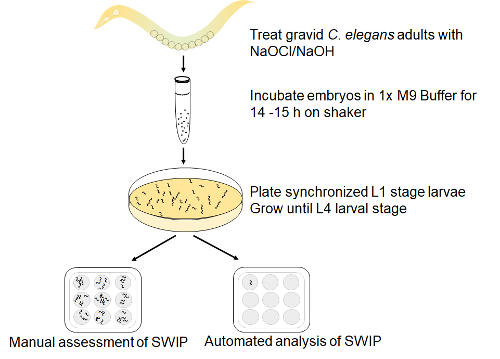
Abbildung 1 : Assay für SWIP eingerichtet. Trächtigen Erwachsenen Wildtyp (N2) Würmer waren mit Natriumhypochlorit/NaOH-Behandlung freizugebende Embryonen lysiert. Die Embryonen wurden schlüpfen und entwickeln in synchronisierten L1-Larven in M9 Puffer für 14 h auf einem Boston-Shaker und dann auf eine NGM Teller ausgesät mit NA22 Bakterien vernickelt. Nach 42-48 h wurden spätere L4 Bühne Larven optisch identifiziert unter den Stereoskop und nahm mit einer Wimper Pick in einem spot Platte mit oder ohne Amphetamin in Saccharose Kontrolllösung und erzielte für SWIP entweder manuell oder durch automatisierte Analyse. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Amphetamin-induzierte SWIP mit manueller Assay. Würmer in Saccharose oder Saccharose mit 0,5 mM Amphetamin (AMPH) wurden visuell für SWIP Verhalten jede Minute mit einem Stereoskop erzielte. Prozent der Tiere, die ausstellenden SWIP berechnet wurde, indem die Anzahl der gelähmt Würmer durch die Gesamtzahl der Würmer für jeden Zeitpunkt untersucht, und dann das Ergebnis mit 100 multipliziert. Der prozentuale Anteil von Würmern ausgesetzt AMPH (blaue Quadrate) zeigt SWIP erhöht Überstunden, während die unbehandelten Würmer (rote Kreise) weiter, während die 10-Minuten-Zeitfenster zu schwimmen. N steht für die Anzahl der Tiere in jeder Gruppe getestet. Fehlerbalken zeigen Standardfehler der Mittel (SEM). Statistischer Signifikanz wurde durch zwei-Wege-ANOVA mit Bonferroni mehrere Vergleichstest (p < 0,0001) bewertet. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Amphetamin-induzierte SWIP über automatisierte Analyse. Videos von Würmern in Saccharose oder Saccharose mit 0,5 mM Ladeeffekt wurden mit einer Kamera auf einen Stereoskop aufgenommen. Schwimmen Videos der einzelnen Würmer wurden mit einem Tracking-Software verfolgt und analysiert, mit tracking-Software-Anzug. Heatmaps wurden aus den Daten generiert, wo rote Bereiche zeigen die Würmer, die sich aktiv bewegen, und Grünflächen gelähmten Würmer. Jede experimentelle Gruppe ist Vertreter von 6 Tieren. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Hier beschreiben wir Schritt für Schritt-Protokoll um einen Verhaltens-Assay, SWIP, in C. Elegansdurchzuführen. Dieses Protokoll ist einfach und unkompliziert ohne großen technischen Hürden, die Herstellung dieser Assay sehr benutzerfreundlich. Dennoch gibt es einige kritische Aspekte, die berücksichtigt werden, um effektiv den Test durchführen müssen.
Darauf sollte geachtet werden, um sicherzustellen, dass die Würmer für den Assay verwendet gut genährt, da diätetische Einschränkung SWIP17betrifft. Schonende Handhabung von Würmern beim Pflücken gut getimten Natriumhypochlorit/NaOH-Behandlung während der Lyse sind wichtige Schritte, wie Trauma während der Kommissionierung (häufiger bei einem Platin Pick) oder längere Exposition von Embryonen zu Natriumhypochlorit/NaOH Lösung können schädigen Sie die Würmer18 dauerhaft und gefährden Sie damit ihre Fähigkeit zu schwimmen.
Sterile Techniken sollten befolgt werden, um Kontaminationen zu vermeiden. Kontamination von den Agarplatten gefährdet die Gesundheit der Tiere und somit verändert ihre Fähigkeit zu schwimmen. Abweichungen in der Anteil der Tiere ausstellen SWIP kann beobachtet werden, dass mit Agarplatten mit verschiedene Stämme von E. Coli -Bakterien (NA22, OP50) ausgesät. In unserem Protokoll verwenden wir NA22 um eine große Anzahl von Würmern zu erzielen.
Glas-Ort Platten, während der SWIP-Assay verwendet werden vorgezogen, Kunststoffplatten, weil sie gründlich, autoklaviert gewaschen werden können und wieder verwendet, wenn verschiedene Arten von Drogen getestet werden.
Ein weiterer wichtiger Faktor in einem SWIP-Assay zu betrachten ist die Osmolarität von der flüssigen Medien, in denen die Tiere getestet19sind. In unserem Protokoll verwenden wir Saccharose, um die Osmolarität des Wassers bis zu 200 mOsm/L zu bringen, die bisher gezeigt wurde, um eine optimale Voraussetzung für die Tiere (Blakely RD. persönliche Kommunikation) sein. Wasser mit einer kontrollierten Osmolarität wird bevorzugt, da sie mögliche Unterschiede in der Qualität des Wassers über mehrere Tests durchgeführt verschiedenen Tagen, Wochen oder Monate beseitigt. Vor allem, aufweisen Dat-1 und Wildtyp mit Ladeeffekt behandelte Tiere nicht SWIP wenn salzige Lösungen (z.B. M9 Lösung) als Kontrolle Medien verwendet werden.
Der Zeitaufwand für die meisten Tiere auszustellen SWIP kann unter verschiedenen Wurm Phasen (L1-L4) leicht verändern. Z.B. berichtet Masoudi Et Al. (2014), dass nach 5 min 80 % des Dat-1 L1 Tiere noch schwimmen, also nur 20 % der Tiere SWIP zeigen. Auf der anderen Seite schwimmen nur 50 % der L4 Dat-1 Tiere noch nach 5 min20. Daher ist es wichtig, dass für SWIP getesteten Tiere im gleichen Alter untersucht werden. Wir haben unsere Tests immer zu spät L4 inszeniert Tierversuche optimiert. Späten L4-Larven haben den Vorteil, leicht erkennbar, unter anderen die Larvenstadien, weil zu diesem Zeitpunkt Tiere ihre Erwachsenengröße erreicht haben und zeigen eine charakteristische dünne Trennlinie zwischen den weißen Fleck in der Mitte ihres Körpers, die später eine Reife Vulva differenzieren. Entscheidend ist auch die Zeitspanne des Assays. Zum Beispiel nach 15 Minuten 90 % von L4 Dat-1 Mutanten weisen SWIP aber zu späteren Zeitpunkt (30 min), nur 60 % von ihnen weisen SWIP20.
Die automatisierte SWIP-Assay menschliche Fehler beseitigt und Hochdurchsatz-Screening in Bezug auf manuelle Tests verbessert. Jedoch tracking-Software-Programme sind zeitaufwendig, da sie nur einen einzigen Wurm gleichzeitig verfolgen können.
In Bezug auf andere DA C. Elegans abhängigen Verhaltensweisen ist SWIP ein zeitsparender Assay. Die basalen Verlangsamung Antwort2 ist beispielsweise nicht Soforttyp-Assay. In der Tat Würmer müssen chronisch mit den Drogen gefüttert werden, und dadurch kann Penetranz und Ziel-Effekte. So kann es nicht so effektiv für Drogen auf den Bildschirm sein.
Eine der wichtigsten Anwendungen der SWIP ist für verschiedene Drogen, dass Ziel der dopaminergen Weg auf den Bildschirm. In Fällen, wo die Medikamente nicht wasserlöslich (z. B. Mazindol) sind, sollten angemessene Verdünnungen durchgeführt werden, um Konzentrationen zu erreichen wo die Träger-Lösung ist nicht giftig für die Würmer. Darüber hinaus sind verschiedene Konzentrationen der gleichen Droge verwendete5,13,14, können Dosis-Wirkungs-Kurven auch analysiert werden. Beispielsweise kann die Rate der Progression (Steigung der Kurve von Tieren pro Minute, Abbildung 2) als Funktion der Konzentration und verwendet, um die Auswirkungen der verschiedenen Drogen (z. B. AMPH Vs Kokain) vergleichen.
Wenn SWIP verwendet wird, um den Mechanismus der Wirkung von Medikamenten an den dopaminergen Synapsen zu untersuchen, sollte geachtet werden wenn Ergebnisse auf andere Tiere ausgedehnt werden. Zum Beispiel wurde Imipramin, einen spezifischen Inhibitor der Säugetier-Noradrenalin-Transporter (NET) zur DA vermitteln SWIP in N2 Tiere4induzieren. C. Elegans ist nicht Programmbenutzer Noradrenalin und drückt somit nicht NET. Allerdings teilt der C. Elegans DA Transporter Homologie mit Säugetieren NET21. Aus diesem Grund zeigen Medikamente, die sind spezifische Inhibitoren von Säugetieren NET und haben nur begrenzte Auswirkungen auf Säugetier-DAT (z. B. Imipramin) hohen Selektivität zu C. Elegans DAT. So könnte Arten Selektivität unserer Fähigkeit, Ergebnisse von C. Elegans auf den Menschen zu extrapolieren beschränken.
Der wichtigste Faktor beim Entwerfen SWIP-Assays ist die Einbeziehung der Experimente, die beweisen, dass SWIP durch das dopaminerge System vermittelt wird. In der Tat könnte beeinträchtigt schwimmen durch andere Faktoren als Gene im Zusammenhang mit der DA-System (z. B. allgemeine Mängel in Kontraktion der Muskeln) generiert werden. Um sicherzustellen, dass SWIP in der Tat durch DA vermittelt wird, gehören die Protokolle Experimente mit Tieren in denen DA erschöpft hat. Dies kann erreicht werden, indem Sie entweder mit Knockout-Tiere, die Ausdruck der Katze-2, C. Elegans homolog von Tyrosin-Hydroxylase, die die Bandbreitenbegrenzung Enzym für DA Synthese oder durch Pre-Behandlung von Wildtyp Tiere mit Reserpin ist, fehlt ein Medikament, das DA Erschöpfung von Vesikeln3verursacht. Zum Beispiel zeigte McDonald Et Al.3 , dass basale SWIP beobachtet in Dat-1 Mutanten wiederhergestellt wurde, wenn diese Tiere mit Reserpin vorbehandelt wurden. Dieses Ergebnis legt nahe, dass SWIP DA vermittelt wird. Auf der anderen Seite demonstriert mit Katze-2, Dat-1 und Mutanten, die Ausdruck eines jeden der dopaminergen Rezeptoren fehlen, Safratowich Et Al. (2014), dass die Spur Amin β-Phenylethylamin (βPEA) SWIP innerhalb 1 Minute nach der Behandlung induziert unabhängig von DA aber durch die direkte Aktivierung von Liganden-gated Ion channel LGC-5514. Die Autoren zeigten, dass βPEA - und DA-induzierte SWIP mechanistisch unterschiedlich und sie können leicht unterschieden werden experimentell. In der Tat, während βPEA-induzierten SWIP ist DA- und Dop-3-unabhängig, es erreicht maximale Werte innerhalb von 1 min. und schnell sinkt nach 2 min14, DA-vermittelten SWIP Katze-2 und Dop-3 abhängig und ist im wesentlichen Null nach 1 Minute (Abbildung 2). So gibt es ein großen Unterschied in der Zeit benötigt, um maximale Wirkung zu erreichen, und dies ermöglicht es, um schnell zwischen den beiden Phänomenen zu unterscheiden: (1) die schnell βPEA-induzierten SWIP innerhalb von 1 Minute durch direkte Aktivierung der LGC-55 Kanäle erhalten und (2) die langsam DA-vermittelten SWIP, die auftritt, wenn ein Überschuss an extrazellulären DA sich im Laufe der Zeit (10-15 min baut) und die DA-Rezeptoren DOP-3 sind überreizt3.
Zusammenfassend ist mit den richtigen Experimente, die die Verwendung von Knockout-Tiere für Schlüsselspieler Gene des dopaminergen Systems (Katze-2, Dat-1, Dop-3) und den Gebrauch von Drogen zum Abbau DA Speicher (Reserpin) gehören, SWIP gewesen. erfolgreich eingesetzt, um die Aufklärung des Mechanismus der Wirkung von Drogen wie AMPH5,13, βPEA14,15 und Azaperone6.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten Dr. Osama Refai von Dr. Randy Blakely Lab zur Orientierung mit der automatisierten Analyse der SWIP danken. Diese Arbeit wurde unterstützt durch die Finanzierung von NIH R01 DA042156, LC.
Materialien
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Reynolds wrap | 1091835 | |
| Amphetamine | Sigma | 51-63-8 | |
| Autoclave | |||
| Bacterial Incubator | New Brunswick scientific | M1352-0000 | |
| Bacteriological grade, Agar | Lab Scientific, Inc | A466 | |
| Bacto (TM) Peptone | BD | REF 211677 | |
| Calcium Chloride (dihydrate) | Sigma-Aldrich | C3881 | |
| Camera | Thorlabs | U-CMAD3 | |
| Centrifuge | Eppendorf 5810R 15amp | E215059 | |
| Cholesterol | Sigma-Aldrich | 57-88-5 | |
| Deionized water | Millipore | Z00QSV0WW | Milli-Q |
| Depression glass spot plate | Corning | Corning, Inc. 722085 | |
| Erlenmeyer flask | ThermoFisher | 4103-0250PK | |
| Eye lash | |||
| Glass slide | Fisherbrand | 12-550-15 | |
| Graphing and statistical software | Prism | Graphpad 5 | |
| HEPES | Sigma-Aldrich | RB=H3375 & H7006 | |
| Hypochlorite | Hawkins | Sodium Hypochlorite 4-6%, USP" 1 gal | |
| LB Broth, Miller | Fisher | BP1426 | |
| Magnesium Chloride (Hexahydrate) | Sigma-Aldrich | RB=M0250 | 500 g |
| Magnesium sulfate (heptahydrate) | Sigma-Aldrich | M1880 | |
| Magnetic stir bar | Fisherbrand | 16-800-510 | |
| Microcentrifuge tubes | ThermoFisher | 69715 | |
| NA 22 bacteria | CGC | ||
| Nystatin | Sigma | 1400-61-9 | |
| Osmometer | Advanced Instruments, Inc | Model 3320 | |
| Pasteur Pipettes | Fisherbrand | 13-678-20A | |
| Petriplates | Falcon | 351007 | |
| pH Meter | Orion VersaStar Pro | IS-68X591202-B 0514 | |
| Polystrine conical tubes | Falcon | 352095 | |
| Potassium Chloride | Sigma-Aldrich | P9541 | |
| Potassium dihydrogen phosphate | Sigma-Aldrich | 7778-77-0 | |
| Potassium Phosphate - DIBASIC | Sigma-Aldrich | P-8281 | |
| Potassium Phosphate - MONOBASIC | Sigma-Aldrich | P0662 | |
| Serological pipettes | VWR | 10ml=89130-898 | |
| Shaker | Reliable Scientific | 55S 12x16 | |
| Sodium Chloride | Fisher | RB=BP358-1 | |
| Sodium dihydrogen Phosphate | Fisher | RB=S381 | |
| Spreadsheet | MS office | Microsoft Excel | |
| Stereo Microscope | Zeiss | Model tlb3. 1 stemi2000 | |
| Sterile Pipette tips | Various | 02-707-400 | |
| Sucrose | Sigma-Aldrich | RB=S5016 | |
| Superglue | Loctite | 1647358 .14 oz. | |
| SwimR sofware | 10.18129/B9.bioc.SwimR | ||
| Tracker 2 | Worm Tracker 2.0 | www.mrc-lmb.cam.ac.uk/wormtracker/ | |
| Video recording software | Virtualdub | http://www.virtualdub.org/ |
Referenzen
- de Bono, M., Villu Maricq, A. Neuronal Substrates of Complex Behaviors in C. elegans. Annual Review of Neuroscience. 28 (1), 451-501 (2005).
- Sawin, E. R., Ranganathan, R., Horvitz, H. R. C. elegans Locomotory Rate Is Modulated by the Environment through a Dopaminergic Pathway and by Experience through a Serotonergic Pathway. Neuron. 26 (3), 619-631 (2000).
- McDonald, P. W., et al. Vigorous Motor Activity in Caenorhabditis elegans Requires Efficient Clearance of Dopamine Mediated by Synaptic Localization of the Dopamine Transporter DAT-1. Journal of Neuroscience. 27 (51), 14216-14227 (2007).
- Carvelli, L., Blakely, R. D., DeFelice, L. J. Dopamine Transporter/Syntaxin 1A Interactions Regulate Transporter Channel Activity and Dopaminergic Synaptic Transmission. Proceedings of the National Academy of Sciences of the United States of America. 105 (37), 14192 (2008).
- Carvelli, L., Matthies, D. S., Galli, A. Molecular mechanisms of amphetamine actions in Caenorhabditis elegans. Molecular Pharmacology. 78 (1), 151-156 (2010).
- Refai, O., Blakely, R. D. Blockade and reversal of swimming-induced paralysis in C. elegans by the antipsychotic and D2-type dopamine receptor antagonist azaperone. Neurochemistry International. , (2018).
- Bermingham, D. P., et al. The Atypical MAP Kinase SWIP-13/ERK8 Regulates Dopamine Transporters through a Rho-Dependent Mechanism. The Journal of Neuroscience. 37 (38), 9288-9304 (2017).
- Nass, R., et al. A genetic screen in Caenorhabditis elegans for dopamine neuron insensitivity to 6-hydroxydopamine identifies dopamine transporter mutants impacting transporter biosynthesis and trafficking. Journal of Neurochemistry. 94 (3), 774-785 (2005).
- Hardaway, J. A., et al. Forward genetic analysis to identify determinants of dopamine signaling in Caenorhabditis elegans using swimming-induced paralysis. G3. 2 (8), 961-975 (2012).
- Hardaway, J. A., et al. Glial Expression of the Caenorhabditis elegans Gene swip-10 Supports Glutamate Dependent Control of Extrasynaptic Dopamine Signaling. Journal of Neuroscience. 35 (25), 9409-9423 (2015).
- Felton, C. M., Johnson, C. M. Dopamine signaling in C. elegans is mediated in part by HLH-17-dependent regulation of extracellular dopamine levels. G3. 4 (6), 1081-1089 (2014).
- Lanzo, A., et al. Silencing of Syntaxin 1A in the Dopaminergic Neurons Decreases the Activity of the Dopamine Transporter and Prevents Amphetamine-Induced Behaviors in C. elegans. Frontiers in Physiology. 9 (576), (2018).
- Safratowich, B. D., Lor, C., Bianchi, L., Carvelli, L. Amphetamine activates an amine-gated chloride channel to generate behavioral effects in Caenorhabditis elegans. The Journal of Biological Chemistry. 288 (30), 21630-21637 (2013).
- Safratowich, B. D., Hossain, M., Bianchi, L., Carvelli, L. Amphetamine Potentiates the Effects of -Phenylethylamine through Activation of an Amine-Gated Chloride Channel. Journal of Neuroscience. 34 (13), 4686-4691 (2014).
- Carvelli, L. Amphetamine activates / potentiates a ligand-gated ion channel. Channels (Austin). 8 (4), 294-295 (2014).
- Hardaway, J. A., et al. et al.An open-source analytical platform for analysis of C. elegans swimming-induced paralysis. Journal of Neuroscience Methods. 232, 58-62 (2014).
- Lüersen, K., Faust, U., Gottschling, D. -. C., Döring, F. Gait-specific adaptation of locomotor activity in response to dietary restriction in Caenorhabditis elegans. The Journal of Experimental Biology. 217, 2480-2488 (2014).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Lamitina, S. T., Morrison, R., Moeckel, G. W., Strange, K. Adaptation of the nematode Caenorhabditis elegans. to extreme osmotic stress. American Journal of Physiology-Cell Physiology. 286 (4), 785-791 (2004).
- Masoudi, N., Ibanez-Cruceyra, P., Offenburger, S. -. L., Holmes, A., Gartner, A. Tetraspanin (TSP-17) Protects Dopaminergic Neurons against 6-OHDA-Induced Neurodegeneration in C. elegans. PLoS Genetics. 10 (12), 1004767 (2014).
- Jayanthi, L. D., et al. The Caenorhabditis elegans gene T23G5.5 encodes an antidepressant- and cocaine-sensitive dopamine transporter. Molecular Pharmacology. 54 (4), 601-609 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten