Method Article
ヒト尿路上皮細胞癌および大腸癌腫瘍増殖および自発性転移に対する患者由来の眼科医異所性Xenograft移植片モデル
要約
このプロトコルは、高品位の尿細胞癌細胞または非肥満糖尿病/重度の組み合わせに大腸癌細胞を直腸内注入することにより、患者由来のオルソトピック異種移植片モデルの生成を記述する。ヒト転移性疾患の進行を模倣するリンパ節間質細胞の影響下で原発性腫瘍増殖および自発的転移のための免疫不全(NOD/SCID)マウス。
要約
癌患者は、膀胱の高品位泌尿器細胞癌(HG-UCC)および大腸癌(CRC)の両方にリンパ節(LN)関与が存在する場合、予後不良を有する。筋肉侵襲性UCC患者の50%以上は、臨床的に局所的な疾患に対する治癒療法にもかかわらず、転移を発症し、5年以内に死亡し、転移性CRCは米国における癌関連死の主要な原因である。患者に見られるUCCおよびCRC転移を一貫して模倣する異種移植片モデルが必要である。本研究は、薬物スクリーニングのためのヒト転移性疾患の進行を模倣するLN間質細胞の影響下で原発性腫瘍増殖および自発的転移のためのUCCおよびCRCの患者由来のオルソトピック異種移植片(PDOX)モデルを生成することを目的としている。新鮮なUCCおよびCRC腫瘍は、HG-UCCおよび大腸腺癌の切除を受けた同意患者からそれぞれ得られた。LN間質細胞(LNSC)アナログHK細胞と共接種し、ルシフェラーゼタグ付きUCC細胞を女性非肥満糖尿病/重篤複合免疫不全(NOD/SCID)マウスに注入した内静脈内(IB)を、CRC細胞を直腸内(IR)に注入した。雄のNOD/SCIDマウス。腫瘍増殖および転移は、生物発光イメージング(BLI)を用いて毎週モニタリングした。犠牲に基づいて、原発性腫瘍およびマウス器官を採取し、計量し、ヘマトキシリンおよびエオシンおよび免疫組織化学染色のためにホルマリン固定した。私達の独特なPDOXモデルでは、異種移植片腫瘍は患者の移植前腫瘍に似ている。HK細胞の存在下では、両方のモデルはBLIおよび腫瘍重量によって測定される高い腫瘍注入率、UCCのための83.3%およびCRCのための96.9%および高い遠くの器官転移率(UCCのための33.3%およびCRCのための53.1%の肺転移を検出した)を有する。さらに、両方のモデルは、手順からの死亡率がゼロです。ヒトHG-UCCおよびCRCに対して、腫瘍の形成、増殖、転移研究を可能にするユニークで再現性の高いPDOXモデルを確立しました。これらのモデルにより、新規治療薬の試験を効率的かつ臨床的に模倣的な方法で行うことができる。
概要
リンパ節転移は、膀胱および大腸癌(CRC)1、2の高品位尿路上皮細胞癌(UCC)を含む多くの固形臓器悪性腫瘍において予後不良指標であることが示されている。筋肉侵襲性UCC(MIUCC)患者の半数以上は、臨床的に局所的な疾患に対する治癒療法にもかかわらず、転移を発症し、5年以内に死亡する。転移性CRCは、米国における癌関連死の主要な原因である。
2018年に米国では、膀胱3、4のUCCにより、推定81,190人の新しい患者と17,240人のがん特異的死亡が発生すると予想されています。患者が主に(70%)非筋肉侵襲性疾患を有し、30%はMIUCC5を有する。臨床的に局所的な疾患に対する治癒療法(全身性嚢胞切除術[RC])にもかかわらず、膀胱のMIUCC患者の半数は依然として転移を発症し、5年以内に死亡する3。リンパ節関与は、RC6、7、8を受けた患者の約20%−25%に見出される。LN陽性患者の5年生存率はRC後も35%未満であり、UCC患者の予後の重要な陰性予測としてLN関与を示唆している。
大腸癌は、米国の男性と女性の両方で診断された3番目に一般的な癌です。患者の転帰は、侵診の深さ、LN関与、遠方の臓器転移などの腫瘍特性および腫瘍微小環境に大きく依存する。CRCの死亡率は、スクリーニングと効果的な手術のために過去10年間に減少したが、CRC患者のほぼ50%が転移または再発性疾患9を発症すると推定される。
小動物モデルは、腫瘍の進行と異なる転移パターンを研究するための迅速で再現性の高い、変更可能なプラットフォームを提供します。現在、患者に見られるCRCおよびUCC転移を一貫して模倣する記述された異種移植片モデルはない。がん遠隔転移の主な経路は、リンパスプレッドを介してである。新しい研究は、LANが腫瘍にユニークな微小環境を提供し、癌細胞が一時的に通過する単なる静止標的であるだけでなく、転移過程で癌細胞と相互作用することによって不可欠な役割を果たしていることを示唆している。実際、我々の研究は、腫瘍の進行および転移の教育および促進に加えて、LN間質微小環境がCRC10、11における薬剤耐性にも関与することを発見した。我々の研究室は最近、患者由来のオルソトピック異種移植片(PDOX)マウスモデル12,13を用いてCRCおよびUcCに対するLN間質細胞(LNSC)の腫瘍性効果を確認した。
PDOXモデルの開発は、翻訳癌研究のための重要なプラットフォームを提供します 14,15.ドナー腫瘍の主要な組織学的および遺伝的特徴を維持することにより、PDOXモデルは通路を越えて安定したままであり、翻訳癌研究のための良好なプラットフォームを作る12,15.PDOXモデルは、臨床結果の予測を可能にする個別化医療戦略の前臨床薬の評価、バイオマーカー同定、前臨床評価に使用されています。現在、LN関与の重要性を考慮し、CRCおよびUCCにおける原発性腫瘍および遠隔臓器転移を一貫して再生することができる記述された異種移植片モデルはない。本研究では,転移性CRCおよびUCC疾患をLNSC関与で再現したNOD/SCIDマウスにおけるPDOXモデルの開発について述べた.
プロトコル
これらの動物研究に記載されているすべての方法は、Ochsnerヘルスシステムの機関動物ケアおよび使用委員会の承認されたガイドラインの下で、動物研究ガイドラインに従って行われました。この研究のためのすべての患者の腫瘍は、Ochsner健康システム調査審査委員会と人間に関する機関委員会の倫理基準に従って癌切除手術を受けている同意された患者から収集されました実験。Ochsnerヘルスシステムの理事会認定病理学者は、腫瘍細胞の顕微鏡的特徴、組織学的タイプ、およびグレードレベルに基づいて患者標本の病理学的診断を決定した。
注:以下のプロトコルは、2つの別々の異種異片片モデル、膀胱壁の電気焼灼によるUCCモデルのステップを説明し、UCC細胞を浸透させ、CRCモデルでの研究のためのCRC細胞の直腸注射を行う。実験の準備とモニタリングのすべてのステップは両方のモデルで同一であり、セクション7と8はそれぞれUCC注入とCRC注入の手順を具体的に説明する。
1. 細胞株の培養
- 完全なRPMI-1640培地でHK細胞を成長させる 10% 胎児ウシ血清、2 nM グルタミン、100 U/mL ペニシリン G、および 100 mg/mL ストレプトマイシンを 37 °C で 5% CO2加湿インキュベーターで補充します。
注:HK細胞は正常なヒト濾胞樹状細胞であり、インビトロ16の≤15通路に対して増殖および拡張することができる。 - 実験の準備をするには、細胞をトリプシン化します。
- 培中を取り出し、ハンクのバランス塩溶液(HBSS)に1%トリプシンの2mLを細胞に加えます。細胞を5%CO2加湿インキュベーターに戻し、37°Cで4分間置きます。
- 10 mLの血清ピペを取り付けたハンドヘルドピペを使用して、皿から15 mLチューブに細胞を集集えます。完全なRPMI-1640培地の8 mLを追加します。
- 40 μL のセルと 40 μL のトリパンブルーを 96 ウェルプレートの単一のウェルに組み合わせます。ヘモサイトメーターに10 μLの混合物を加え、生細胞を数えます。25 mL完全なRPMI-1640培地に100万個の細胞を150mm無菌組織培養処理皿に加え、細胞の増殖を継続する。
注:このステップで調製されたHK細胞懸濁液は、注射のために腫瘍細胞と混合するために1時間以内に使用する必要があります。
2. 患者標本収集
- 切除手術で同意患者15(BlCaPt15、pT3b N1 M0)および37(BlCaPt37、pT3b pN0 M0)からUCC腫瘍を採取する。
- 切除手術で同意患者155(CoCaPt155、T1 N0 M0)および302(CoCaPt302、T1 N0 M0)からCRC腫瘍を採取する。
3. 患者腫瘍の拡大
- ペニシリンG(500 U/mL)およびストレプトマイシン(500 mg/mL)を含む冷菌マッコイの培地で手術時に腫瘍を採取する。
- 6−8週齢の雌NOD/SCIDマウスの左右側に直接腫瘍を移植する。
- 機械的に小さな外科はさみを使用して小片(〜1 mm3)に組織をミンチ。
- 13 G骨髄吸引生検針を用いて左右の側面に皮下に移植組織。
注:8 mm3の総容積を側面の両側に均等に分割してインプラントする。
4. ルシフェラーゼ標識腫瘍のタグ付けと濃縮
- デジタルキャリパーを使用して隔週で腫瘍の成長を測定します。
- 直径1cmで、腫瘍をトランスデュースする。Luc/赤色蛍光タンパク質(RFP)-レンチウイルス(50μL/腫瘍、濃縮高チターレンチウイルスストックからの1:30希釈)を27G針で1cc注射器を用いて腫瘍に直接注入する。
注:患者腫瘍は通常、1−2ヶ月で直径1cmに達する。しかし、成長速度は非常に変動し、腫瘍グレードとタイプを含む多くの要因に基づいています。 - 生きた動物の生物発光イメージング(BLI)によって腫瘍を毎週監視する。
- マウスの重量を量る。150mg/kgルシフェリンを経後に注射し、基板がマウスの体内を循環するのを5分間待ちます。
- 100%酸素、誘導室で1L/分で2.5%イソファランでマウスを麻酔する。
- イソファランの流れと画像を持つBLIイメージングマシンで胃の上にマウスを置きます。Luc/RFP陽性腫瘍領域(偽色バイオ発光画像)の存在を確認するためにシーケンシャル画像を撮る。イメージングが完了したら、マウスをケージに戻します。
5. 酵素消化のための腫瘍の適切な部分を選択します。
- UCCまたはCRC処置の日に、図4.3.1−4.3.3の図のようにルシフェラーゼが腫瘍をタグ付けした画像マウス。
注:皮下腫瘍が成長する時間の長さは、腫瘍の成長の速度と実験で注入される動物の計画数に依存する。 - マウスの側面と画像から腫瘍を収穫します。
- イメージング後のCO2吸入によりマウスを安楽死させる。マウスをCO2室に置き、呼吸停止まで1.4 L/minでガスをオンにし、3分間放置します。
- 70%のエタノールできれいな肌。腫瘍の真上にテントの皮膚。外科的はさみで皮膚に小さな切開を行います。はさみで腫瘍から皮膚を分離する。
- 腫瘍を取り除き、滅菌ペトリ皿に入れます。イメージングマシンで皿全体をイメージします。
- 滅菌はさみまたはメスを使用して、腫瘍および再画像のルシフェラーゼ陽性セクションからルシフェラーゼ陰性セクションを分離します。
- 最も陽性の腫瘍片だけが残るまで繰り返します。
6. 腫瘍の酵素消化
- 層流フードの下で、ミンチルシフェラーゼ陽性腫瘍片(ステップ5.4)を滅菌手術用ハサミを使用して最小の可能な部分にし、無菌50 mL円錐管に入れます。
注:腫瘍を最小の部分にミンチすると、より多くの個々の細胞が得られます。 - HBSSの40 mLにコラゲナーゼIV(1.5mg/mL)、80μLのヒアルロニダーゼ(20mg/mL)、デオキシリボヌクレアーゼI(0.1mg/mL)の160μLを加えてダイジェスト液を調剤する。反転して溶液を混ぜます。
- みじん切り腫瘍に消化液の35−40 mLを添加する。37 °Cでインキュベートし、連続的な回転を2時間行います。
注:腫瘍組織が凝集するのを防ぐために、インキュベーション全体を通して定期的にチューブを激しく振ります。 - 滅菌100 μm細胞ストレーナーを介して消化全体をフィルタリングし、その後40μmセルストレーナーで破片を除去します。流れを保存し、破片を廃棄します。
- HBSSと遠心分離機の20 mLを329 x gで5分間加えてフリーセルを洗浄し、HBSSの30mLでペレットを再懸濁します。
- 10 μLの細胞溶液と90μLのトリパンブルーを96ウェルプレートの単一のウェルに組み合わせます。ヘマキトメーターを使用して生細胞を数えます。
- マウス1匹につき1x 10 4~1x 106の腫瘍細胞を無菌15mL円錐管に移す。マウス1匹につきステップ1.2.3から3 x 105 HK細胞を腫瘍細胞と同じチューブに加えます。
注:総容積が15 mLを超える場合は、無菌50 mL円錐管を使用してください。注射器の使用中に流体の損失を説明するために、研究グループごとに追加の動物のためのより多くの用量を常に計算します。.例えば、グループに5匹のマウスが含まれている場合は、6または7匹のマウスに十分な細胞を作ります。 - 329 x gで5分間遠心分離機は、吸引またはピペッティングのいずれかによって上清を廃棄します。
- 完全なRPMIメディアのCRCモデルでは、UCCモデルではマウスあたり50μL、マウスあたり10μLで細胞を再サスペンドします。使用の準備ができるまで、氷の上にセルサスペンションを保管してください。
7. UCCマウスモデル
- 処置のためのマウスの準備
- 6~8週齢の雌NOD/SCIDマウスを取得します。脱毛クリームを使用して、マウスの腰を剃ります。イソムラン(酸素100%で2.5%、1L/分)で誘導室でマウスを麻酔する。
- 鎮静剤を落ち着かせたら、マウスを鼻で鼻をイソファルーンノーズコーンに入れ、分散電極にしっかりと接地して裸で戻します。
注:つま先のピンチに反応しない場合、マウスは完全に鎮静されます。
- 工程6.9で調製したUCC細胞をアンジオカテスターを用いて膀胱に注入する(図1Aa,Ab)。
- 単極電気焼灼機をセットアップし、4 W. 潤滑ゼリーで24 G無菌アンジオカテーテルを潤滑し、メスマウスの尿道を介して挿入します。
注:わずかな抵抗が感じられるかもしれません。ゆっくりと前方に押すか、アンジオカテスターを取り外し、繰り返します。強制しないでください。カテーテルが入口で曲がる場合は、カテーテルの途中に滅菌ガイドワイヤー(7.2.2を参照)を挿入して安定性を提供します。 - 0.025インチ固定コアストレートガイドワイヤーをアンジオカテレータの端を1mm超完全に挿入します。
メモ:ワイヤは、1 mmの停止点と保証の一貫性を示すために、手順の前にテープでマークされています。 - 単極ピンをガイドワイヤーに1s保持し、膀胱粘膜の電気的刺激を可能にします。
- 新鮮な無菌アンジオカテーテルを1 ccルアーロックシリンジに取り付け、ステップ6.9から集めた細胞の200 μLを引き出します。
注:アンジオカテレータから注射器まで、少なくとも100 μLが失われます。必要なセル懸濁液の量を計算する際に損失量を補正します。 - マウス尿道からガイドワイヤーとアンジオカテターを取り外します。尿道に付着した細胞の注射器でアンジオカテターを挿入します。
注:進歩は以前よりも簡単であるべきです。 - マウス膀胱に50 μLの細胞を植え付けます。細胞が膀胱壁に付着できるように、アンジオカテスターを取り外す前に数秒待ちます。
注:細胞は膀胱に残り、原発性腫瘍に発展する。
- 単極電気焼灼機をセットアップし、4 W. 潤滑ゼリーで24 G無菌アンジオカテーテルを潤滑し、メスマウスの尿道を介して挿入します。
- イソファランの鼻コーンとアースパッドからマウスを取り外します。次の手順で 1 時間マウスを観察します。苦痛の兆候、すなわち、背中を急いだり、呼吸困難になったりする兆候を探してください。
8. CRCマウスモデル
- 誘導室で6~8週齢の雄のNOD/SCIDマウスをイソルラン(酸素100%で2.5%、1L/分)で麻酔する。つま先のピンチで下取りを確認します。
- 麻酔マウスを解剖顕微鏡の下のスフィン位置に置き、イソルランノセコーンに彼らのスナズを固定し、安定性のためにテープで前肢を固定することを確認します。
注:ルーペは、解剖顕微鏡の代わりに使用することができます。小さなオブジェクトを使用すると、尾部の基部の下に配置され、アナスを上昇させる際の視認性と角度を向上させることができます。通常、ガーゼの小さなセクションは、直径1インチの円柱形状に巻き込まれます。 - 湾曲した潤滑鈍い先端の鉗子で肛膜管を拡張し、遠位肛他および直腸粘膜を露出させる。便を取り除く。
- 50 μLガラス注射器に滅菌30G取り外し可能な針を使用して、10μLの腫瘍およびHK細胞(ステップ6.9から)を肛輪管の上の遠位後直腸粘膜1〜2mmに注入する。針の斜角は粘膜で覆われるべきです。骨盤腔内に入らない場合は注意が必要です。
- イソファランの鼻コーンからマウスを取り出します。次の手順で 1 時間マウスを観察します。苦痛の兆候、すなわち、背中を急いだり、呼吸困難になったりする兆候を探してください。
9. 生物発光イメージング
- ルシフェラーゼ活性のための生物発光イメージングシステムを使用して、原発性腫瘍、肝臓、肺転移負荷を毎週監視します。
- UCCまたはCRC実験からマウスを取得し、重量を量る。150 mg/kg ルシフェリンを米腔内に注入し、基質がマウスの体内を循環するのを5分間待ちます。
- 100%酸素、誘導室で1L/分で2.5%イソファランでマウスを麻酔する。
- 鼻をノセコーンに固定したBLIイメージングマシンにマウスを置きます。画像を公開する場合は、対象領域がカメラに向いていることを確認します。UCCおよびCRC注入の場合、腹部側は各画像のカメラに向かう必要があります。画像マウスをサフィン位置に配置します。
10. 臓器と腫瘍の収穫
- 原発性腫瘍発光輝度が1 x 1011光子に達した場合、またはマウスが苦痛の徴候を示す場合(すなわち、体重減少、背中を痛め、過酷な/労働呼吸など)、ルシフェリン後のCO2吸入(ステップ5.2.1のように)によってマウスを安楽死させる注射および全身イメージ投射。
- 肝臓と肺を取り除き、ペトリ皿と画像に入れ、転移を特定します。腫瘍、体重および画像を除去する。周囲温度で48時間、10%中性緩衝ホルマリンで臓器と腫瘍を固定します。
注:組織の移動を避けるために、各器官間の清掃/ワイプハサミと鉗子。
11. 組織学的評価
- パラフィンにホルマリン固定組織を埋め込み、ヘマトキシリンとエオシン(H&E)および免疫組織化学(IHC)染色のためのマイクロトーム上の5μmの厚さで組織をスライスします。
注:パラフィンスライドのすべてのH&E染色は、Ochsnerヘルスシステムの病理学研究室で行われ、この論文のすべてのIHC染色は、Ki67を用いた高温抗原検索後にOchsnerヘルスシステムの研究室で行われ、サイトケラチン20抗体は、続いてビオチン化二次抗体、および製造業者の指示13、17に従ってアビジンビオチン-ペルオキシダーゼ複合体を続ける。
結果
UCC PDOXモデルでは、UCC患者のBlCaPt15またはBlCaPt37細胞は、女性のNOD/SCIDマウス膀胱にHK細胞の存在下に注入された静脈内(IB)であった(図1A)。30人中25人(83.3%)動物は原発性腫瘍を生成し、週次BLIに基づいて時間依存性原発性腫瘍増殖を示した(図1B、Cおよび表1)。同様に、CRC PDOX モデルでは、32 人中 31 人 (96.9%)マウスは、患者のCoCaPt155またはCoCaPt302細胞とHK細胞を注射した場合に原発性腫瘍を増殖させた(図1D-Fおよび表1)。患者腫瘍に応じて、マウス腫瘍の増殖は異なる遅延期間を有し、これは患者の臨床特性の違いを反映している(図1C,F)。
IBおよびIRモデルの両方において、腫瘍細胞注射は、腫瘍細胞注射が発生したオルソトピック原発腫瘍(図2A、B、青色矢印)を生成するだけでなく、多くのマウスが肝臓および/または肺転移を発症した。30人中10人(33.3%)32人中17人(53.1%)HK細胞を有するUCC細胞およびCRC細胞を用いたマウスは、それぞれ、ex vivo BLI(図2A、Bおよび表1)を介して遠くの臓器転移を検出した。
同様の組織形態を確認するために、H&EおよびIHC染色は異種移植片および原発性患者腫瘍を比較して行った。患者膀胱癌の血管病理学は、BlCaPt15およびBlCaPt37(図3A)からの異種移植片で維持された。結果は、患者の原発性腫瘍の筋肉侵襲的増殖パターンに対応する異種移植片腫瘍を示す。ヒト細胞増殖マーカーKi67に特異的な抗体をIHCに用いた。Ki67陽性核染色は、非常に増殖性の高い、急速に成長するヒト腫瘍細胞を示す。異種移植片からの染色結果は、元の外科生検のものと類似していた。同様に、IRモデルでは、H&E染色は、CoCaPt155およびCoCaPt302の両方の異種移植片と患者腫瘍間のアーキテクチャの類似性を示す。シトケラチン20に対する抗体を用いたIHCは、両方のPDOXモデルにおいても同様の腫瘍増殖パターンを示した(図3B)。したがって、我々のPDOXモデルは、UCCおよびCRC患者の臨床進行を要約した。
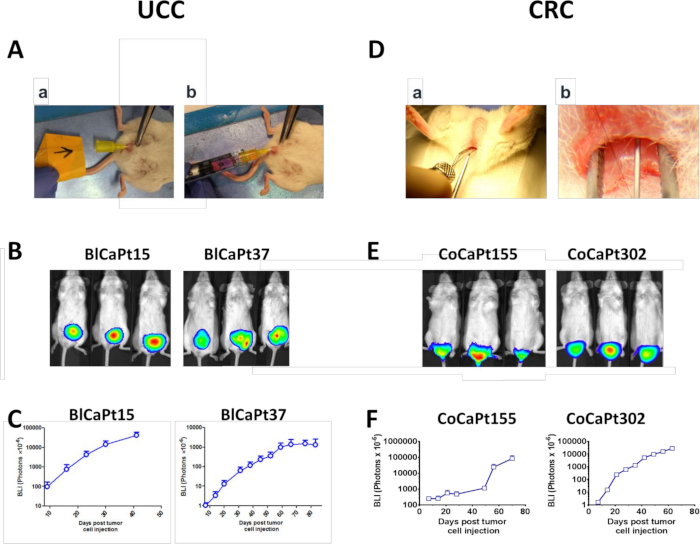
図1:オルトトピックUCCおよびCRCマウスモデル。(A-C)マウス膀胱13へのUCC細胞の内ベシクル(IB)浸入。(Aa)女性のNOD/SCIDマウスの膀胱にアンジオカテーテルを挿入し、ガイドワイヤーを介して膀胱壁に電気焼灼衝撃を加えた。(アブ)ルシフェラーゼタグUCC腫瘍細胞、BlCaPt15(2 x 104細胞)、またはBlCaPt37(5 x 105細胞)を3 x 10 5 LN間質HK細胞を添加し、アンジオカテーテルを介してNOD/SCIDマウス膀胱に注入した。 (D-F)マウス直腸17の粘膜下組織層へのCRC細胞の直腸内(IR)注射。(D) 肛輪管は潤滑性の鈍い先端の鉗子で拡張され、遠位肛他および直腸粘膜へのアクセスを可能にし、30Gの針は、前に斜部が覆われるまで肛他管の上の遠位後直腸サブムコサ1−2mmに挿入された。注射が行われます。ルシフェラーゼタグ付きCRC腫瘍細胞、CoCaPt155(5 x 105細胞)、またはCoCaPt302(1x104細胞)を3 x 105 HK細胞を添加して注射した。腫瘍の負担をモニタリングし、生物発光イメージング(BLI;B および E)UCCまたはCRC細胞にタグ付けされたルシフェラーゼの腫瘍増殖をBLIを介してキネチ的にモニタリングし、画像解析ソフトウェア(CおよびF)を用いて分析した。 この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:PDOXモデルは、自発的な遠隔臓器転移を生み出す。図1と同じ実験から代表的なマウス(トップパネル)、例えば、ルシフェラーゼタグ付きUCC腫瘍細胞、BlCaPt15またはBlCaPt37細胞をHK細胞(A)またはルシフェラーゼタグ付きCRC腫瘍で直腸内に浸透させた。細胞は、HK細胞(B)を持つCoCaPt155またはCoCaPt302細胞を示す。黄色の矢印はマウスの膀胱(A)を示します。犠牲の時に撮影された写真は、腫瘍形成(青い矢印)を示す。壊死で採取された肝臓、肺、腫瘍(中間パネル)とその元生体内BLI(下パネル)は、マウスの肝臓および肺転移ならびにルシフェラーゼ活性を有する腫瘍を示した。この図のより大きなバージョンを表示するには、ここをクリックしてください。
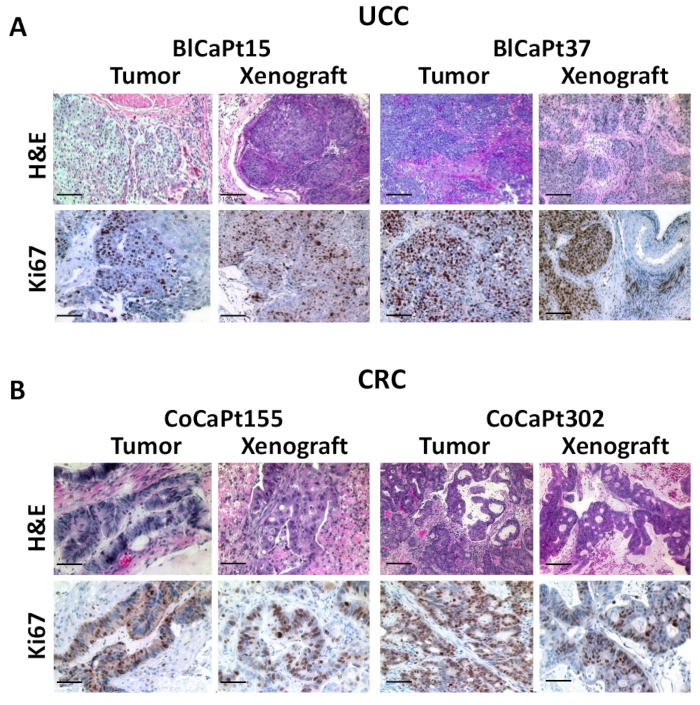
図3:異種移植片腫瘍は、患者の移植前腫瘍に似ている。図1と同じ実験でマウスから採取した患者腫瘍または腫瘍からのパラフィン埋め込み腫瘍組織を、ヒトKi67(A)またはサイトケラチンに対する抗体を用いてH&E(AおよびB)またはIHCによって切除および染色した。 20 (CK20;B)茶色は正の染色を示す。H&E染色は、腫瘍の巣が平滑筋束に解剖することを示す(A)。写真はデジタルデコンボルティング顕微鏡で撮影し、画像解析ソフトウェアで解析した。スケールバー: 100 μm.全ての画像を200×の元の倍率で撮影した。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| 腫瘍インプラント(%) | 肺/肝臓転移 (%) | 死亡率 (%) | |
| UCC、n=30 | 83.3歳 | 33.3歳 | 0 |
| CRC、n=32 | 96.9歳 | 53.1歳 | 0 |
表1:IBおよびIRモデルにおける腫瘍形成、転移、および死亡率の概要
ディスカッション
転移性疾患は、ほとんどの癌患者の死亡率を担当しています。前臨床治療試験では、自発的な遠隔臓器転移でヒト腫瘍の増殖を最も密接にエミュレートするマウスモデルを確立することが重要である。移植された患者腫瘍由来癌細胞(異種移植片)を有するマウスモデルを使用すると、腫瘍生物学および予測バイオマーカーの理解を深めるとともに、新規療法の抗腫瘍効果の試験および予測を可能にする18。多くのモデルは、マウス実験でUCCおよびCRC転移を示すために使用されてきた、例えば、肺疾患19または腫瘍細胞または腫瘍断片の皮下移植を生成する能力を示す静脈内尾静脈注射など、局所的な腫瘍の成長20,21.ある研究室は以前、腫瘍取り込み22を正常に促進するために塩酸治療を使用して膀胱癌マウスモデルを報告した。これらの方法は、信頼性の高い局所成長を生み出し、いくつかの転移活性を示すかもしれませんが、それらは特にヒトで開発された癌の自然な経過に似ておらず、患者18に見られる転移機構を利用しません。 23.他のマウスモデルは、肝臓や腸間膜などの臓器に腫瘍細胞を直接注入することによって腫瘍の増殖を模倣することが報告されたが、腫瘍細胞漏出のリスクを運び、有意な転移を生じなかった。
原発性腫瘍における癌細胞含有量とLN関与24との相関と転移性疾患への原発性腫瘍進行過程における癌細胞/LN間質相互作用の役割を以前に実証した10,12歳,17.転移進行におけるLN間質微小環境の影響に関する前の研究を取り入れ、転移の自然な流れを模倣する直語所モデル(特にPDOXモデル)を確立した。技術的に再現可能な、元の患者腫瘍の不均一性を維持し、一貫した原発性腫瘍および転移結果12、13、17を生成する。LN間質微小環境の腫瘍増強効果を使用することは、ヒトUCCおよびCRCにおいて同様の腫瘍微小環境を提供し、転移カスケード内のすべてのステップを開発し、マウスモデルに必要な癌細胞数を減少させるため重要である。異種移植片の通過数を最小限に抑え、ヒトの腫瘍増殖および転移を密接に模倣する信頼性の高いモデルをもたらす。
MIUCCを開発するための信頼性の高いモデルを作り出すHK細胞の共起を用いて、独自のIB電気刺激法を確立しました。我々のモデルは、粘膜から始まる腫瘍移植によるUCC進行の自然な経過を模倣し、筋肉に至り、その後肺13に転移する。
我々の結果はまた、IRモデルが安全で再現性があり、成功していることを示している。オルトトピックCRCマウスモデルは、原発性腫瘍増殖および自発的遠方転移12,17を特徴とする。IRのプロシージャは速く、学ぶことが容易で、技術的に実行し易く、動物にあまりにもストレスがない。IBおよびIR群は、最終BLI測定前の術後期間において死亡率がゼロ(表1)であった。しかし、このテクニックには練習が必要です。直腸内注射が成功した場合、液体が直腸粘膜に導入され、最終的に図1に示すように触知可能になる原発性腫瘍の成長をもたらす目に見える「気泡」が存在するはずです。腫瘍が骨盤腔内に深く注入された場合、大腸管に取り付けされず、骨盤を満たすために非常に大きくなり、時には閉塞を引き起こす。注射が浅すぎるか、直腸粘膜下層に全く入らない場合は、原発性腫瘍の負担が軽減または不在の結果漏れ出す。
ヒトHG-UCCおよびCRCのための独特で再現可能なPDOXモデルを確立した。これらのモデルは腫瘍形成および転移研究を可能にする。これらのモデルを、LN間質微小環境と患者原発性腫瘍との相互作用を研究し続ける主要な方法として使用できるようになりました。これらのモデルはまた、原発性腫瘍に対するLNSCの腫瘍前作用を妨げる治療法を調査することを可能にする。これらのモデルにより、新規治療薬の試験を効率的かつ臨床的に模倣的に行うことができる。
開示事項
この研究は、Ochsner翻訳医学研究イニシアチブ助成金2014によって部分的にサポートされました。著者は利益相反を宣言しない。
謝辞
著者らは、優れた技術サポートのためにこれらの研究を開始するのを助けたブライアン・ロイター、ダニエル・ベルトーニ、ピーター・ミラー、シャノン・マッケスニーに感謝しています。著者らはまた、ヘザー・グリーン・マトラナ、マーガレット・ヴァリアーノ、スニル・タルワル、マリア・ラティスに対し、患者の同意と腫瘍標本の提供に対する支援に感謝している。
資料
| Name | Company | Catalog Number | Comments |
| Avidin-biotin-peroxidase | Vector Labs Inc | PK-6100 | |
| Biotinylated secondary antibody | Vector Labs Inc | BA-1000 | |
| Collagenase IV (1.5 mg/mL) | Worthington Biochemical Corporation | LS004189 | |
| Deoxyribonuclease I (0.1 mg/mL) | Sigma | D4263 | |
| D-Luciferin (150 mg/kg) | Perkin Elmer | 122796 | |
| Formalin (10% neutral buffered) | Leica | 46129 | |
| glutamine (2 nM) | Fisher Scientific | 35050061 | |
| Hair Removal Cream | Church & Dwight Co., Inc | 1 (800) 248-8820 | |
| Hanks Balanced Salt Solution (HBSS) | Fisher Scientific | SH30016.02 | |
| Hyaluronidase (20 mg/mL) | Sigma | H3884 | |
| Isoflurane | Henry Schein Animal Health | 108333 | |
| Luc/RFP-lentivirus | From our collaborators. See reference 13: Gills, J. et al. A patient-derived orthotopic xenograft model enabling human high-grade urothelial cell carcinoma of the bladder tumor implantation, growth, angiogenesis, and metastasis. Oncotarget. 9, 32718-32729, doi:10.18632/oncotarget.26024 (2018). | ||
| McCoy’s medium | Life Technologies | 110862 | |
| penicillin/streptomycin 100 mL (100 U/mL) | Fisher Scientific | 15140-122 | |
| RPMI-1640 Medium | American Type Culture Collection | 110636 | |
| Trypan Blue | Sigma | T6146 | |
| Trypsin/EDTA | Life Technologies | 15400-054 | |
| Name | Company | Catalog Number | Comments |
| Gas | |||
| 100% Oxygen | Airgas Inc | OX USP200 | |
| 100% CO2 | Airgas Inc | CD USPE | |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| 6-8 week old NOD/SCID Mice (male) | Jackson Lab | 001303 | |
| 6-8 week old NOD/SCID Mice (female) | Jackson Lab | 001303 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Hematoxylin | Sigma | GHS232 | |
| Ki-67 Rabbit Monoclonal Antibody | Thermo Scientific | RM-9106-S | |
| Name | Company | Catalog Number | Comments |
| Tools | |||
| 40 µm cell strainer | Fisher Scientific | 08-771-1 | |
| 100 µm cell strainer | Fisher Scientific | 08-771-19 | |
| 15 mL Conical Tube | Sarstedt | 11799 | |
| 50 mL Conical tube | Sarstedt | 15762 | |
| 150 mm Tissue Culture Dish | USA Scientific Inc | CC7682-3614 | |
| 96 Well plate | USA Scientific Inc | CC7682-7596 | |
| Forceps | Symmetry Surgical Inc | 06-0011 | |
| Surgical scissors | Symmetry Surgical Inc | 02-2011 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 5% CO2 humidified incubator | Thermo Scientific | 3110 | |
| Bioluminescent (BLI) Imaging Machine | Perkin Elmer | CLS136334 | |
| BLI Imaging Machine Software | Perkin Elmer | CLS136334 | |
| Centrifuge | Beckman | 366830 | |
| Deconvoluting Microscope | Intelligent Imaging Innovations | Marianas | |
| Deconvoluting Microscope Imaging Software | Intelligent Imaging Innovations | +1 (303) 607-9429 x1 | |
| Digital caliper | Fowler Tools and Instruments | 54-115-330 | |
| Dissecting microscope | Precision Instruments LLC | (504) 228-0076 | |
| Electrosurgical generator | ValleyLab | FORCE1C20 | |
| Isoflurane Induction Chamber | Perkin Elmer | 119038 | |
| Microtome | American Optical Corporation | 829 | |
| Pipet Aid | Fisher Healthcare | 13-681-15E | |
| Serological pipet (10 mL) | Sarstedt | 86.1254.001 |
参考文献
- Sundlisaeter, E., et al. Lymphangiogenesis in colorectal cancer--prognostic and therapeutic aspects. International Journal of Cancer. Journal international du cancer. 121, 1401-1409 (2007).
- Gout, S., Huot, J. Role of cancer microenvironment in metastasis: focus on colon cancer. Cancer Microenvironment. 1, 69-83 (2008).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: a Cancer Journal for Clinicians. 68, 7-30 (2018).
- Hautmann, R. E., de Petriconi, R. C., Pfeiffer, C., Volkmer, B. G. Radical cystectomy for urothelial carcinoma of the bladder without neoadjuvant or adjuvant therapy: long-term results in 1100 patients. European Urology. 61, 1039-1047 (2012).
- Stein, J. P., et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. Journal of Clinical Oncology. 19, 666-675 (2001).
- Lerner, S. P., et al. The rationale for en bloc pelvic lymph node dissection for bladder cancer patients with nodal metastases: long-term results. The Journal of Urology. 149, 758-764 (1993).
- Poulsen, A. L., Horn, T., Steven, K. Radical cystectomy: extending the limits of pelvic lymph node dissection improves survival for patients with bladder cancer confined to the bladder wall. The Journal of Urology. 160, 2015-2019 (2020).
- Margolin, D. A., et al. Lymph node stromal cells enhance drug-resistant colon cancer cell tumor formation through SDF-1alpha/CXCR4 paracrine signaling. Neoplasia. 13, 874-886 (2011).
- Vermeulen, L., et al. Wnt activity defines colon cancer stem cells and is regulated by the microenvironment. Nature Cell Biology. 12, 468-476 (2010).
- Margolin, D. A., et al. The critical roles of tumor-initiating cells and the lymph node stromal microenvironment in human colorectal cancer extranodal metastasis using a unique humanized orthotopic mouse model. FASEB Journal. 29, 3571-3581 (2015).
- Gills, J., et al. A patient-derived orthotopic xenograft model enabling human high-grade urothelial cell carcinoma of the bladder tumor implantation, growth, angiogenesis, and metastasis. Oncotarget. 9, 32718-32729 (2018).
- Hidalgo, M., et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discovery. 4, 998-1013 (2014).
- Hiroshima, Y., et al. Patient-derived mouse models of cancer need to be orthotopic in order to evaluate targeted anti-metastatic therapy. Oncotarget. 7, 71696-71702 (2016).
- Kim, H. S., Zhang, X., Klyushnenkova, E., Choi, Y. S. Stimulation of germinal center B lymphocyte proliferation by an FDC-like cell line, HK. The Journal of Immunology. 155, 1101-1109 (1995).
- Hite, N., et al. An Optimal Orthotopic Mouse Model for Human Colorectal Cancer Primary Tumor Growth and Spontaneous Metastasis. Diseases of the Colon and Rectum. 61, 698-705 (2018).
- Jager, W., et al. Ultrasound-guided intramural inoculation of orthotopic bladder cancer xenografts: a novel high-precision approach. PloS One. 8, e59536 (2013).
- Schirner, M., et al. Integrin alpha5beta1: a potent inhibitor of experimental lung metastasis. Clinical & Experimental Metastasis. 16, 427-435 (1998).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445, 111-115 (2007).
- Todaro, M., et al. Colon cancer stem cells dictate tumor growth and resist cell death by production of interleukin-4. Cell Stem Cell. 1, 389-402 (2007).
- Lee, J. S., et al. Tumor establishment features of orthotopic murine bladder cancer models. Korean Journal of Urology. 53, 396-400 (2012).
- Hadaschik, B. A., et al. A validated mouse model for orthotopic bladder cancer using transurethral tumour inoculation and bioluminescence imaging. BJU International. 100, 1377-1384 (2007).
- Silinsky, J., et al. CD 133+ and CXCR4+ colon cancer cells as a marker for lymph node metastasis. The Journal of Surgical Research. 185, 113-118 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved