Method Article
Modelli di Xenotrapianto ortotopico derivati dal paziente per carcinoma a cellule uroteliali umane e crescita del tumore del tumore colorettale e metastasi spontanea
In questo articolo
Riepilogo
Questo protocollo descrive la generazione di modelli di xenotrapianto ortotopico derivati dal paziente infondendo inmodo vesicalmente cellule carcinoma a cellule urotemaliali o cellule di cancro colorettale intra-rettale in diabete/grave non obesi immunodeficienza (NOD/SCID) per la crescita primaria del tumore e metastasi spontanee sotto l'influenza delle cellule stromali del linfonodo, che imitano la progressione delle malattie metastatiche umane.
Abstract
I pazienti oncologici hanno una prognosi scarsa quando il coinvolgimento dei linfonodi (LN) è presente sia nel carcinoma a cellule uroteliali di alto grado (HG-UCC) della vescica e del cancro del colon-retto (CRC). Più del 50% dei pazienti con UCC invasivo muscolare, nonostante la terapia curativa per malattie clinicamente localizzate, svilupperà metastasi e morirà entro 5 anni, e il CRC metastatico è una delle principali cause di decessi correlati al cancro negli Stati Uniti. Sono necessari modelli Xenograft che imitano costantemente la metastasi di UCC e CRC osservati nei pazienti. Questo studio ha lo scopo di generare modelli di xenotrapianto ortotopico (DOX) derivati dal paziente di UCC e CRC per la crescita primaria del tumore e metastasi spontanee sotto l'influenza di cellule stromali LN che imitano la progressione delle malattie metastatiche umane per lo screening farmacologico. I tumori freschi di UCC e CRC sono stati ottenuti da pazienti conacchiti sottoposti a resezione rispettivamente per HG-UCC e adenocarcinoma colorettale. Co-inoculate con cellule HK analogiche con cellule nt-lmusali LN (LNSC), cellule UCC con tag luciferasi sono state intra-veseticamente (IB) instillate in topi da parentedeficisi diabetici/gravi (NOD/SCID) inebiti inominati in obliamente (IR) topi maschi NOD/SCID. La crescita tumorale e la metastasi sono state monitorate settimanalmente utilizzando l'imaging della bioluminescenza (BLI). Dopo il sacrificio, i tumori primari e gli organi murini furono raccolti, pesati e fissati in formalina per l'ematossiae e l'eosina e la colorazione immunoistochimica. Nei nostri modelli PDOX unici, i tumori dello xenotrapianto assomigliano ai tumori preimpianto del paziente. In presenza di cellule HK, entrambi i modelli hanno alti tassi di impianto tumorale misurato da PESI BLI e tumorali, 83,3% per UCC e 96,9% per il CRC, e alti tassi di metastasi dell'organo distante (33,3% rilevato metastasi epatica o polmonare per UCC e 53,1% per CRC). Inoltre, entrambi i modelli hanno mortalità zero dalla procedura. Abbiamo stabilito modelli PDOX unici e riproducibili per gli studi umani HG-UCC e CRC, che consentono la formazione di tumori, la crescita e gli studi sulle metastasi. Con questi modelli, il test di nuovi farmaci terapeutici può essere eseguito in modo efficiente e clinicamente mimetico.
Introduzione
È stato dimostrato che la metastasi dei linfonodi (LN) è un indicatore prognostico incattive in molte neoplasie dell'organo solido, tra cui il carcinoma a cellule uroteliali di alto grado (UCC) della vescica e del cancro colorettale (CRC)1,2. Oltre la metà dei pazienti con UCC muscolo-invasivo (MIUCC), nonostante la terapia curativa per la malattia clinicamente localizzata, svilupperà metastasi e morirà entro 5 anni. Il CRC metastatico è una delle principali cause di morte legata al cancro negli Stati Uniti.
Si stima che 81.190 nuovi pazienti e 17.240 decessi specifici per il cancro si verifichino nel 2018 negli Stati Uniti a causa dell'UCC della vescica3,4. Mentre i pazienti saranno prevalentemente (70%) presente con malattia invasiva non muscolare, il 30% avrà MIUCC5. Nonostante la terapia curativa (cistectomia radicale [RC] con o senza chemioterapia sistemica) per la malattia localizzata clinicamente, la metà dei pazienti con MIUCC della vescica svilupperà ancora metastasi e morirà entro 5 anni3. Il coinvolgimento dei linfonodi si trova in circa il 20%-25% dei pazienti che hanno subito RC6,7,8. Il tasso di sopravvivenza a cinque anni nei pazienti positivi a LN è inferiore al 35% anche dopo RC, suggerendo il coinvolgimento di LN come predittore negativo cruciale per la prognosi nei pazienti ucc.
Il cancro colorettale è il terzo cancro più comune diagnosticato sia negli uomini che nelle donne negli Stati Uniti. Gli esiti del paziente dipendono in gran parte dalle caratteristiche tumorali e dal microambiente tumorale, come la profondità di invasione, il coinvolgimento di LN e le metastasi di organi distanti. Anche se il tasso di mortalità nel CRC è diminuito nell'ultimo decennio a causa di screening e interventi chirurgici efficaci, si stima che quasi il 50% dei pazienti crC svilupperà metastasi o malattie ricorrenti9.
I piccoli modelli animali forniscono una piattaforma rapida, riproducibile e modificabile per studiare la progressione del tumore e diversi modelli metastatici. Attualmente non esistono modelli di xenotrapianto descritti che imitano costantemente la metastasi CRC e UCC osservata nei pazienti. La via primaria della metastasi a distanza di cancro è attraverso la diffusione linfatica. Una nuova ricerca suggerisce che le LN forniscono ai tumori un microambiente unico, e non sono solo bersagli fissi in cui le cellule tumorali passano transitoriamente, ma svolgono anche un ruolo fondamentale interagendo con le cellule tumorali nel processo metastatico. Infatti, i nostri studi hanno scoperto che, oltre a educare e promuovere la progressione e le metastasi del tumore, il microambiente stromale LN è anche responsabile della resistenza ai farmaci in CRC10,11. Il nostro laboratorio ha recentemente confermato gli effetti tumorigeni delle cellule stromali LN (LNSC) su CRC e UCC utilizzando modelli murini ortotopici (PDOX) derivati dal paziente12,13.
Lo sviluppo di modelli DoDOX fornisce un'importante piattaforma per la ricerca traslazionale sul cancro14,15. Mantenendo le principali caratteristiche istologiche e genetiche del tumore del donatore, i modelli PDOX rimangono stabili tra i passaggi e rendono buone piattaforme per la ricerca traslazionale sul cancro12,15. I modelli DODoX vengono utilizzati per la valutazione preclinica dei farmaci, l'identificazione dei biomarcatori e la valutazione preclinica di strategie di medicina personalizzate che consentono la previsione degli esiti clinici. Attualmente, non esistono modelli di xenotrapianto descritti che considerino l'importanza del coinvolgimento di LN e siano in grado di riprodurre costantemente il tumore primario e la metastasi dell'organo distante nel CRC e nell'UCC. In questo studio, descriviamo lo sviluppo di modelli PDOX in topi NOD/SCID con riproduzione di malattie metastatiche CRC e UCC con coinvolgimento LNSC.
Protocollo
Tutti i metodi descritti in questi studi sugli animali sono stati condotti secondo le linee guida approvate del Comitato istituzionale per la cura degli animali e l'uso del sistema sanitario di Ochsner e in conformità con le linee guida per la ricerca sugli animali. Tutti i tumori dei pazienti per questo studio sono stati raccolti da pazienti acconsentiti sottoposti a interventi chirurgici di resezione del cancro in conformità con l'Ochsner Health System Investigative Review Board e gli standard etici del Comitato Istituzionale per l'Educazione sperimentazione f. I patologi certificati dal consiglio di Ochsner Health System hanno determinato le diagnosi patologiche dei campioni dei pazienti in base alle caratteristiche microscopiche delle cellule tumorali, al loro tipo istologico e al livello di grado.
NOTA: il protocollo seguente descrive i passaggi per due modelli di xenotrapianto separati, un modello UCC tramite l'elettrocauterizzazione della parete della vescica per infondere le cellule UCC e un'iniezione intrarettale di cellule CRC per lo studio in un modello CRC. Tutti i passaggi per preparare e monitorare gli esperimenti sono identici per entrambi i modelli, mentre le sezioni 7 e 8 descrivono specificamente la procedura per l'instillazione UCC e l'iniezione CRC, rispettivamente.
1. Linee cellulari di coltura
- Coltivano cellule HK nel mezzo RPMI-1640 completo integrato con 10% siero bovino fetale, 2 n N M glutammina, 100 U/mL penicillina G, e 100 mg/mL streptomicina a 37 gradi centigradi in un 5% di CO2 incubatore umido.
NOTA: Le cellule HK sono normali cellule dendritiche follicolari umane e possono essere coltivate ed espanse per 15 passaggi in vitro16. - Per prepararsi a un esperimento, provare le cellule.
- Rimuovere i supporti e aggiungere 2 mL di 1% di prova nella soluzione di sale equilibrato di Hank (HBSS) alle cellule. Rimettere le cellule nell'incubatrice umidificata di CO2 del 5% a 37 gradi centigradi per 4 min.
- Raccogliere le cellule dal piatto in un tubo da 15 mL utilizzando un supporto di pipet portatile con un pipet sierologico da 10 mL attaccato. Aggiungere 8 mL di supporto RPMI-1640 completo.
- Unire 40 -L di cellule e 40 l di trypan blu in un unico pozzo di un pozzo 96. Aggiungere 10 l di miscela a un emocitometro e contare le cellule vive. Aggiungere 1 milione di cellule in 25 mL mezzo RPMI-1640 completo a un piatto trattato con coltura di tessuto sterile da 150 mm per continuare a coltivare le cellule.
NOTA: La sospensione delle cellule HK preparata in questa fase deve essere utilizzata entro un'ora per mescolare con le cellule tumorali per l'iniezione.
2. Raccolta di campioni di pazienti
- Raccogliere i tumori UCC dal paziente acconsentito 15 (BlCaPt15, pT3b N1 M0) e 37 (BlCaPt37, pT3b pN0 M0) a intervento chirurgico di resezione.
- Raccogliere i tumori CRC dal paziente acconsentito 155 (CoCaPt155, T1 N0 M0) e 302 (CoCaPt302, T1 N0 M0) a seguito di un intervento chirurgico di resezione.
3. Espansione del tumore del paziente
- Raccogliere i tumori in chirurgia a freddo sterile McCoy mezzo contenente penicillina G (500 U/mL) e streptomicina (500 mg/mL).
- Impiantare i tumori direttamente sul fianco sinistro e destro dei topi NOD/SCID femminili di 6-8 settimane.
- Tessuti tritati meccanicamente in piccoli pezzi (1 mm3) utilizzando piccole forbici chirurgiche.
- Impianto di tessuto sottocutaneo sul fianco sinistro e destro utilizzando 13 G aghi biopsia aspirazione del midollo osseo.
NOTA: Impiantare un volume totale di 8 mm3 diviso uniformemente su entrambi i lati del fianco.
4. Tagging e arricchimento di tumori con etichettatura luciferate
- Misurare la crescita del tumore bisettimanale utilizzando una pinza digitale.
- A 1 cm di diametro, trasduzione del tumore. Iniettare direttamente nel tumore con una singola dose di proteine fluorescenti Luc/red (RFP)-lentivirus (50 anni/tumore, 1:30 diluizione da concentrato stock di lentivirus alto titro) utilizzando una siringa da 1 cc con un ago da 27 G.
NOTA: Il tumore del paziente raggiunge in genere 1 cm di diametro in 1/2 mesi. Tuttavia, il tasso di crescita è estremamente variabile e basato su una serie di fattori tra cui il grado e il tipo di tumore. - Monitorare il tumore settimanalmente da imaging bioluminescente (BLI) in animali vivi.
- Pesare i topi. Iniettare il topo cosciente con 150 mg/kg luciferina intraperitonealmente e attendere 5 min per il substrato di circolare nel corpo del mouse.
- Anestesizzare il topo con 2,5% isoflurane in 100% ossigeno, 1 L/min in una camera di induzione.
- Posizionare il mouse sullo stomaco in una macchina di imaging BLI con isoflurane che scorre e immagine. Scattare immagini sequenziali per confermare la presenza di regioni tumorali positivi Luc/RFP (immagine bio-luminescente a falsi colori). Riportare il mouse in gabbia al termine dell'imaging.
5. Selezionare la porzione appropriata di tumore per la digestione ezimatica
- Il giorno della procedura UCC o CRC, immagine mouse con luciferasi etichettato tumore come nei passaggi 4.3.1.4.3.3.
NOTA: Il periodo di tempo per la crescita del tumore sottocutaneo dipende dalla velocità di crescita del tumore e dal numero previsto di animali da iniettare nell'esperimento. - Morale del raccolto dal fianco e dall'immagine del topo.
- Eutanasia del topo per inalazione di CO2 dopo l'imaging. Posizionare il topo nella camera CO 2, accendere il gas a 1,4 L/min fino all'arresto respiratorio e lasciare agire per 3 min.
- Pelle pulita con 70% di etanolo. Pelle della tenda direttamente sopra il tumore. Con le forbici chirurgiche fare una piccola incisione nella pelle. Separare la pelle dal tumore con le forbici.
- Rimuovere il tumore e mettere in una sterile petri-dish. Immagine dell'intero piatto in una macchina di imaging.
- Utilizzare forbici sterili o bisturi per separare le sezioni luciferasi-negative dalle sezioni positive luciferasi nel tumore e ri-immagine.
- Ripetere fino a quando rimangono solo pezzi di tumore più altamente positivi.
6. Digestione ezimatica del tumore
- Sotto cappa di flusso laminare, tritare luciferate pezzi di tumore positivi (fase 5.4) nei pezzi più piccoli possibili utilizzando forbici chirurgiche sterili e metterli in uno sterile tubo conico 50 mL.
NOTA: La messa a quota del tumore nei pezzi più piccoli possibili produrrà più cellule individuali. - Preparare la soluzione di digest aggiungendo 10 mL di collagenasi IV (1,5 mg/mL), 80 - L di ialuronidasi (20 mg/mL) e 160 l of deoxyribonuclease I (0,1 mg/mL) a 40 mL di HBSS. Mescolare la soluzione invertendo.
- Aggiungere i 35-40 mL della soluzione di gergo al tumore macinato. Incubare a 37 gradi centigradi con rotazione continua per 2 h.
NOTA: Agitare vigorosamente il tubo periodicamente durante l'incubazione per evitare che il tessuto tumorale si agglomi. - Filtrare l'intera digestione attraverso un colino sterile di 100 m seguito da un colino di 40 m per rimuovere i detriti. Salvare il flusso attraverso e scartare i detriti.
- Lavare le cellule libere aggiungendo 20 mL di HBSS e centrifugare a 329 x g per 5 min. Aspirate il supernatante e resuspend pellet in 30 mL di HBSS.
- Unire 10 l di soluzione cellulare e 90 l di trypan blu in un unico pozzo di una piastra di 96 pozze. Contare le cellule vive usando un emacytometro.
- Trasferire da 1 x 104 a 1 x 106 cellule tumorali per topo in un tubo conico sterile da 15 mL. Aggiungere 3 x 105 cellule HK dal passaggio 1.2.3 per mouse, allo stesso tubo con cellule tumorali.
NOTA: Utilizzare tubo conico sterile da 50 mL se il volume totale supera i 15 mL. Calcolare sempre più dosi per animali aggiuntivi per gruppo di studio per tenere conto della perdita di liquido durante l'uso di siringhe. Ad esempio, se un gruppo contiene 5 mouse, creare un numero sufficiente di cellule per 6 o 7 topi. - Centrifuga a 329 x g per 5 min. Scartare supernatante aspirando o pipettando.
- Risospendere le celle in 50 : L per mouse per il modello UCC o 10 L per mouse per il modello CRC su supporto RPMI completo. Mantenere la sospensione cellulare sul ghiaccio fino a quando non è pronto per l'uso.
7. Modello mouse UCC
- Preparazione dei topi per la procedura
- Ottenere topo NOD/SCID donna di sei-otto settimane. Rasare la parte bassa della parte bassa del mouse utilizzando crema per la rimozione dei peli. Anestesizzare il topo in una camera di induzione con isoflurane (2,5% in 100% di ossigeno, 1 L/min).
- Una volta sedato, posizionare il topo in posizione supina con il muso in un cono naso isoflurano e schiena nuda saldamente messa a terra su un elettrodo dispersivo.
NOTA: Il mouse è completamente sedato se non risponde alla pizzicamento dell'punta.
- Cellule UCC instillate preparate nel passaggio 6.9 alla vescica utilizzando un angiocater (Figura 1Aa,Ab).
- Impostare un elettrocauterio monopolare e impostare una potenza di 4 W. lubrificare un 24 G sterile antheter con gelatina lubrificante e inserto attraverso urgiocaethra del topo femminile.
NOTA: Si può avvertire una leggera resistenza. Spingere delicatamente in avanti o rimuovere angiocate ter e ripetere. Non forzare. Se il catetere si piega all'ingresso, inserire un filo guida sterile (cfr. 7.2.2) a metà catetere per fornire stabilità. - Inserire completamente il filo guida dritto del nucleo fisso da 0,025" 1 mm oltre la fine dell'angiocatheter.
NOTA: Il filo è contrassegnato con nastro prima della procedura per indicare il punto di arresto di 1 mm e assicurare la consistenza. - Tenere il perno monopolare al filo guida per 1 s permettendo irritazione elettrica della mucosa della vescica.
- Attaccare un angiocate sterile fresco a 1 cc siringa luer-lok e redigere 200 -L di cellule raccolte dal punto 6,9.
NOTA: almeno 100 l vengono persi dall'angiocater alla siringa. Compensare il volume di perdita durante il calcolo del volume della sospensione cellulare necessaria. - Rimuovere il filo guida e l'angiocateter dall'uretra del mouse. Inserire angiocathete con siringa di cellule attaccate all'uretra.
NOTA: L'avanzamento dovrebbe essere più facile di prima. - Instillare 50 -L di cellule alla vescica del topo. Attendere alcuni secondi prima di rimuovere l'angiocatheter per consentire alle cellule di aderire alla parete della vescica.
NOTA: Le cellule rimangono nella vescica e si sviluppano in un tumore primario.
- Impostare un elettrocauterio monopolare e impostare una potenza di 4 W. lubrificare un 24 G sterile antheter con gelatina lubrificante e inserto attraverso urgiocaethra del topo femminile.
- Rimuovere il mouse dal cono naso isoflurane e pad di messa a terra. Osservare il mouse per 1 h procedura seguente. Cercare segni di disagio, cioè, schiena inclinata, respirazione affannosa, ecc.
8. Modello mouse CRC
- Anestetizza il topo NOD/SCID di 6-otto settimane con isoflurane (2,5% in 100% di ossigeno, 1 L/min) nella camera di induzione. Confermare la sedazione con un pizzico di dita dei dei imminichi.
- Posizionare il topo anetizzato in posizione supina sotto un microscopio dissezioso, assicurandosi di fissare il muso a un nosecone isoflurano e di fissare i loro arti anteriori con nastro adesivo per la stabilità.
NOTA: Le loupes possono essere utilizzate al posto di un microscopio sezionato. Un piccolo oggetto può essere utilizzato per migliorare la visibilità e l'angolo quando viene posizionato sotto la base della coda, elevando l'ano. Tipicamente, piccole sezioni di garza sono rotolati in una forma a cilindro di diametro di 1 pollice. - Dilatare il canale anale con pinze con tundilo lubrificate curve per esporre la mucosa anale e rettale distale. Rimuovere le feci.
- Utilizzare un ago sterile da 30 G rimovibile su una siringa di vetro da 50 L per iniettare 10 cellule tumorali e HK (dal punto 6.9) nella submucosa rettale posteriore distale da 1 a 2 mm sopra il canale anale. Lo smusso dell'ago deve essere coperto da mucosa. Fare attenzione a non passare nella cavità pelvica.
- Rimuovere il topo dal cono naso isoflurane. Osservare il mouse per 1 h procedura seguente. Cercare segni di disagio, cioè, schiena inclinata, respirazione affannosa, ecc.
9. Imaging bioluminescente
- Monitorare il tumore primario, fegato, e l'onere metastatico polmonare settimanale utilizzando un sistema di imaging bioluminescente per l'attività luciferasi.
- Ottenere un mouse dall'esperimento UCC o CRC e pesare. Iniettare 150 mg/kg luciferina intraperitonealmente e attendere 5 min per il substrato di circolare nel corpo del mouse.
- Anestesizzare il topo con 2,5% isoflurane in ossigeno al 100%, 1 L/min nella camera di induzione.
- Posizionare il mouse nella macchina BLI Imaging con naso fissato in nosecone. Quando si espone per l'immagine, assicurarsi che l'area di interesse sia rivolta verso la fotocamera. Per l'iniezione di UCC e CRC, il lato ventrale deve affrontare la fotocamera per ogni immagine. Mouse immagine in posizione supina.
10. La raccolta di organi e tumori
- Quando la luminosità della luminescenza tumorale primaria raggiunge 1 x 1011 fotoni o se i topi presentano segni di disagio (ad esempio, perdita di peso, schiena inclinata, respirazione dura/fatica, ecc.), eutanasia dei topi da INalalazione DI CO2 (come nel passaggio 5.2.1) dopo luciferina iniezione e l'imaging di tutto il corpo.
- Rimuovere fegato e polmone, mettere in una piastra di Petri e immagine per identificare eventuali metastasi. Rimuovere il tumore, pesare e immagine. Fissare organi e tumore in formalina tamponata al 10% neutra per 48 h a temperatura ambiente.
NOTA: Pulire/pulire forbici e pinze tra ogni organo per evitare il trasferimento di tessuto.
11. Valutazione istologica
- Incorporare i tessuti fissi di formalina nella paraffina e affettare i tessuti a spessore di 5 m su un microtoma per l'ematossia e l'eosina (H&E) e la colorazione immunohistochimica (IHC).
NOTA: tutte le macchie H&E dei vetrini di paraffina sono state effettuate nel laboratorio di patologia del sistema sanitario Ochsner, e tutte le macchie IHC in questo articolo sono state eseguite in un laboratorio di ricerca del sistema sanitario Ochsner dopo il recupero dell'antigene ad alta temperatura utilizzando Ki67 e cytokeratin 20 anticorpi, seguiti da anticorpi secondari biotinylati, e carina-biotina-perossidi secondo le istruzioni del produttore13,17.
Risultati
Nel modello UCC PDOX, le cellule BlCaPt15 o BlCaPt37 dei pazienti UCC sono state instillate inmodo-vesicalmente (IB) in presenza di cellule HK nella vescica muraria NOD/SCID femminile (Figura 1A). Venticinque su trenta (83,3%) gli animali hanno generato tumori primari e hanno mostrato una crescita tumorale primaria dipendente dal tempo in base al BLI settimanale (Figura1B, C e Tabella 1). Analogamente, nel modello CRC DOX, 31 su 32 (96,9%) i topi hanno fatto crescere il tumore primario quando sono stati iniettati intra-rettalmente (IR) con cellule CoCaPt155 o CoCaPt302 dei pazienti più cellule HK (Figura 1D-F e Tabella 1). A seconda del tumore del paziente, la crescita del tumore al topo ha avuto un periodo di latenza diverso, che riflette la differenza nelle caratteristiche cliniche del paziente (Figura 1C,F).
Nei modelli IB e IR, l'iniezione di cellule tumorali non solo ha generato tumori primari ortotopici (Figura 2A, B, frecce blu), ma molti topi testati hanno anche sviluppato metastasi epatiche e/o polmonari. In 10 su 30 (33,3%) e 17 su 32 (53,1%) topi instillati con cellule UCC e cellule CRC con cellule HK, rispettivamente, abbiamo rilevato metastasi di organi distanti tramite BLI ex vivo (Figura 2A,B e Tabella 1).
Per confermare una morfologia tissutale simile, sono state eseguite macchie H&E e IHC confrontando xenografi fti e tumori del paziente primario. L'istopatologia del carcinoma della vescica paziente è stata mantenuta negli xenografori di BlCaPt15 e BlCaPt37 (Figura3A). I risultati mostrano il tumore xenotrapianto corrispondente al modello di crescita invasiva muscolare dei tumori primari dei pazienti. L'anticorpo specifico per il marcatore di proliferazione cellulare umana Ki67 è stato utilizzato in IHC. La colorazione nucleare positiva Ki67 indica cellule tumorali umane altamente proliferanti e in rapida crescita. I risultati di colorazione degli xenoinnesti erano simili a quelli delle biopsie chirurgiche originali. Analogamente, nel modello IR, la colorazione H&E indica la somiglianza dell'architettura tra xenografi e tumori dei pazienti sia di CoCaPt155 che di CoCaPt302. IHC utilizzando anticorpo contro citokeratina 20 ha anche mostrato modello di crescita del tumore simile in entrambi i modelli PDOX (Figura 3B). Così, il nostro modello PDOX ha ricapitolato la progressione clinica dei pazienti UCC e CRC.
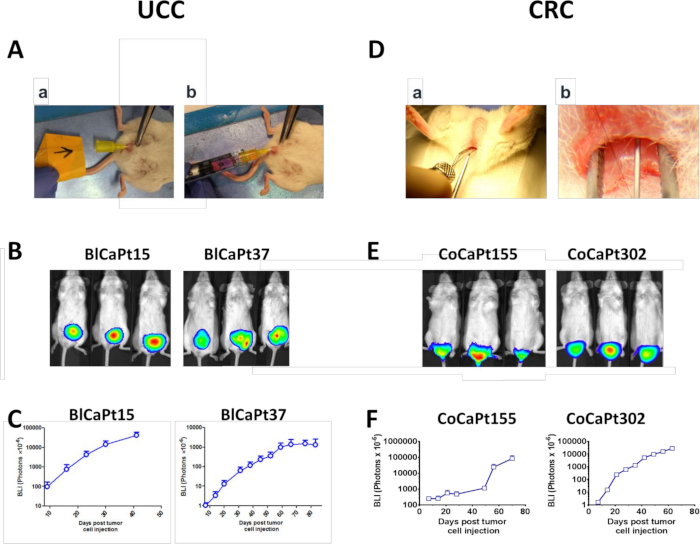
Figura 1: modelli murini ucc e CRC ortotopici. (A-C) Intra-vescicolo (IB) instillazione delle cellule UCC nella vescica del topo13. (Aa) Un angiocathere è stato inserito nella vescica di un topo NOD/SCID femminile e uno shock elettrocauterio è stato applicato alla parete della vescica tramite un filo guida. (Ab) Luciferasi hanno etichettato le cellule tumorali dell'UCC, BlCaPt15 (2 x 104 cellule), o BlCaPt37 (5 x 105 cellule) con l'aggiunta di 3 x 105 LN cellule stromali HK, sono stati instillati nella vescica del topo NOD/ SCID attraverso l'angiocater. (D-F) Iniezione intra-rettale (IR) di cellule CRC nello strato di tessuto submucosale del retto del topo17. (D) Il canale anale è stato dilatato con pinze con punta smussata lubrificate per consentire l'accesso alla mucosa anale e rettale e un ago da 30 G è stato inserito nella submucosa rettale posteriore distal 1x2 mm sopra il canale anale fino a quando la smussatura è stata coperta prima l'iniezione avviene. Luciferate hanno etichettato le cellule tumorali del CRC, CoCaPt155 (5 x 105 cellule), o CoCaPt302 (1 x 104 cellule) con l'aggiunta di 3 x 105 cellule HK sono state iniettate. L'onere tumorale è stato monitorato e quantificato tramite imaging bioluminescente (BLI; B ed E). La crescita tumorale delle cellule UCC o CRC con tag luciferasi è stata monitorata cineticamente tramite BLI e analizzata utilizzando un software di analisi delle immagini (C e F). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: I modelli DODOX producono metastasi spontanee di organi distanti. Topi rappresentativi (pannelli superiori) dagli stessi esperimenti della Figura 1, ad esempio, instillati intra-vesicalmente con cellule tumorali UCC con tag luciferasi, cellule BlCaPt15 o BlCaPt37 con cellule HK (A) o intra-rettalmente con tumore luciferase marcato CRC vengono visualizzate celle CoCaPt155 o CoCaPt302 con celle HK (B). Le frecce gialle indicano la vescica del mouse (A). Le foto scattate al momento del sacrificio indicano la formazione del tumore ortotopico (frecce blu). Fegato, polmone e tumore (pannelli centrali) raccolti a necropsia e la loro ex vivo BLI (pannelli inferiori) hanno mostrato il fegato del topo e la metastasi polmonare, nonché il tumore con attività luciferasi. Fare clic qui per visualizzare una versione più grande di questa figura.
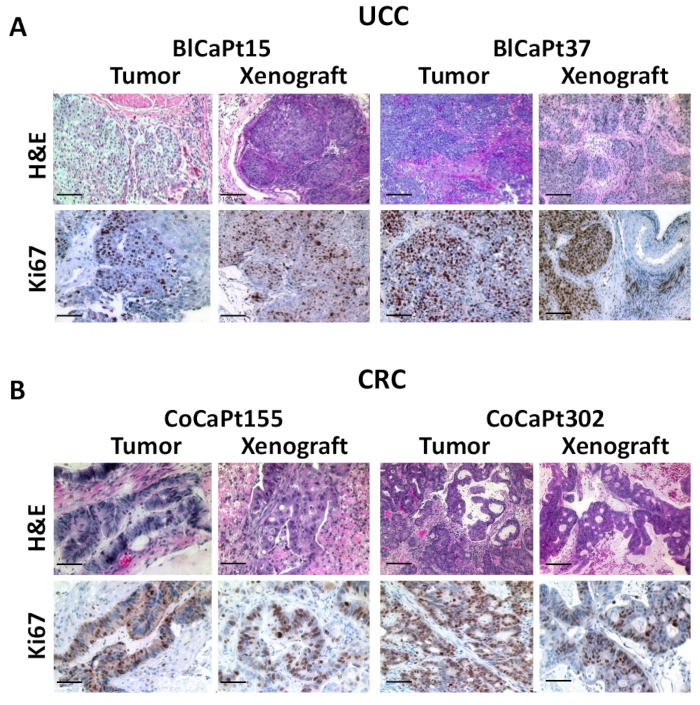
Figura 3: I tumori dello xenotrapianto assomigliano ai tumori preimpianto del paziente. Paraffina tessuto tumorale incorporato da tumori del paziente o tumori raccolti da topi negli stessi esperimenti come nella figura 1 sono stati sezionati e macchiati da H&E (A e B) o IHC con anticorpi contro l'uomo Ki67 (A) o citokeratina 20 (CK20; B). Il colore marrone indica una colorazione positiva. La colorazione H&E mostra i nidi tumorali che si dissigono in fasci muscolari lisci (A). Le fotografie sono state scattate utilizzando un microscopio di deconvoluzione digitale e analizzate con un software di analisi delle immagini. Barre della scala: 100 m. Tutte le immagini sono state scattate in ingrandimento originale di 200 . Fare clic qui per visualizzare una versione più grande di questa figura.
| Impianto tumorale (%) | Metastasi polmonare/epatica (%) | Mortalità (%) | |
| UCC, n. 30 | 83.3 | 33.3 | 0 (in vie |
| CCR, n. 32 | 96,9 9 | 53,1 | 0 (in vie |
Tabella 1: Riepilogo della formazione del tumore, della metastasi e della mortalità nei modelli IB e IR.
Discussione
La malattia metastatica è responsabile della maggior parte dei decessi dei pazienti affetti da cancro. Nei test terapeutici pre-clinici, è fondamentale stabilire modelli murini che emulano più da vicino la crescita del tumore umano con metastasi spontanee di organi distanti. L'utilizzo di modelli murini con cellule tumorali derivate dal tumore del paziente impiantato (xenografi) consente una migliore comprensione della biologia tumorale e dei biomarcatori predittivi, nonché test e previsioni degli effetti antineoplastici di nuove terapie18. Molti modelli sono stati utilizzati per mostrare le metastasi di UCC e CRC negli esperimenti murini, come le iniezioni di vena della coda per via endovenosa che mostrano la capacità di produrre malattie polmonari19 o l'impianto sottocutaneo di cellule tumorali o frammenti tumorali sul fianco per crescita tumorale localizzata20,21. Un laboratorio ha precedentemente riportato un modello di murina del cancro della vescica utilizzando trattamenti di acido cloridrico per promuovere con successo l'assorbimento del tumore22. Mentre questi metodi producono una crescita locale affidabile e possono dimostrare alcune attività metastatiche, non assomigliano specificamente al decorso naturale del cancro sviluppato negli esseri umani e non utilizzano il meccanismo metastatico visto nei pazienti18, 23. Altri modelli murini sono stati segnalati per imitare la crescita del tumore iniettando cellule tumorali direttamente in organi come il fegato o la mesenteria, ma portavano i rischi di perdita di cellule tumorali e non producevano metastasi significative.
In precedenza abbiamo dimostrato la correlazione tra il contenuto delle cellule tumorali nel tumore primario e il coinvolgimento di LN24 e il ruolo dell'interazione stromastro cellula tumorale/LN nel corso della progressione tumorale primaria alla malattia metastatica10 , 12 mila , 17.Incorporando il nostro precedente lavoro sull'influenza del microambiente stromale LN nella progressione metastatica, abbiamo creato modelli ortotopici (in particolare i modelli DODOX) che imitano il corso naturale della diffusione metastatica, tecnicamente riproducibile, preservare l'eterogeneità dei tumori originali del paziente e generare risultati tumorali e metastatici consistenti12,13,17. Utilizzando gli effetti di miglioramento del tumore del microambiente stromale LN è importante perché fornisce un microambiente tumorale simile in UCC umano e CRC, sviluppa tutti i passaggi nella cascata metastatica, riduce il numero di cellule tumorali richiesto nel modello murino che riduce al minimo il numero di passaggi di xenotrapianto e si traduce in un modello affidabile che imita da vicino la crescita del tumore e le metastasi nell'uomo.
Abbiamo stabilito un metodo unico di elettrostimolazione IB utilizzando la co-instillazione di cellule HK che produce un modello affidabile per lo sviluppo di MIUCC. Il nostro modello imita il corso naturale della progressione dell'UCC mediante l'impianto del tumore a partire dalla mucosa, che porta al muscolo, quindi metastasi ai polmoni13.
I nostri risultati mostrano anche che il modello IR è sicuro, riproducibile e di successo. Il modello di topo ortotopico crC presenta la crescita tumorale primaria e la metastasi distante spontanea12,17. La procedura IR è veloce, facile da imparare, tecnicamente facile da eseguire e non troppo stressante per gli animali. I gruppi IB e IR avevano mortalità zero (Tabella 1) nel periodo postoperatorio prima della misurazione finale del BLI. Tuttavia, la tecnica richiede pratica. Se l'iniezione intrarettale ha successo, ci dovrebbe essere una "bolla" visibile che si forma come il fluido viene introdotto nella submucosa rettale e si tradurrà in crescita tumorale primaria che alla fine diventerà palpabile come mostrato Figura 1. Se il tumore è stato iniettato troppo in profondità nella cavità pelvica, sarà scollegato al tratto colorettale e cresce molto grande per riempire il bacino, a volte causando ostruzione. Se l'iniezione è troppo bassa o non entra nello strato submucosale rettale a tutti, perderà con conseguente riduzione o assente carico tumorale primario.
Abbiamo stabilito modelli PDOX unici e riproducibili per hG-UCC e CRC umani. Questi modelli consentono la formazione del tumore e studi di metastasi. Ora possiamo usare questi modelli come metodo primario per continuare a studiare il microambiente stromale LN e la sua interazione con i tumori primari del paziente. Questi modelli ci permetteranno anche di studiare terapie che interferiscono con gli effetti pro-tumorale del LNSC sul tumore primario. Con questi modelli, il test di nuovi farmaci terapeutici può essere eseguito in modo efficiente e in modi clinicamente mimetici.
Divulgazioni
Questo studio è stato parzialmente sostenuto dall'Ochsner Translational Medicine Research Initiative Grant 2014. Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Gli autori ringraziano Brian Reuter, Danielle Bertoni, Peter Miller e Shannon McChesney che hanno contribuito ad avviare questi studi per il loro eccellente supporto tecnico. Gli autori ringraziano anche Heather Green Matrana, Margaret Variano, Sunil Talwar e Maria Latsis per l'assistenza nei pazienti consenzienti e nella fornitura di campioni di tumore.
Materiali
| Name | Company | Catalog Number | Comments |
| Avidin-biotin-peroxidase | Vector Labs Inc | PK-6100 | |
| Biotinylated secondary antibody | Vector Labs Inc | BA-1000 | |
| Collagenase IV (1.5 mg/mL) | Worthington Biochemical Corporation | LS004189 | |
| Deoxyribonuclease I (0.1 mg/mL) | Sigma | D4263 | |
| D-Luciferin (150 mg/kg) | Perkin Elmer | 122796 | |
| Formalin (10% neutral buffered) | Leica | 46129 | |
| glutamine (2 nM) | Fisher Scientific | 35050061 | |
| Hair Removal Cream | Church & Dwight Co., Inc | 1 (800) 248-8820 | |
| Hanks Balanced Salt Solution (HBSS) | Fisher Scientific | SH30016.02 | |
| Hyaluronidase (20 mg/mL) | Sigma | H3884 | |
| Isoflurane | Henry Schein Animal Health | 108333 | |
| Luc/RFP-lentivirus | From our collaborators. See reference 13: Gills, J. et al. A patient-derived orthotopic xenograft model enabling human high-grade urothelial cell carcinoma of the bladder tumor implantation, growth, angiogenesis, and metastasis. Oncotarget. 9, 32718-32729, doi:10.18632/oncotarget.26024 (2018). | ||
| McCoy’s medium | Life Technologies | 110862 | |
| penicillin/streptomycin 100 mL (100 U/mL) | Fisher Scientific | 15140-122 | |
| RPMI-1640 Medium | American Type Culture Collection | 110636 | |
| Trypan Blue | Sigma | T6146 | |
| Trypsin/EDTA | Life Technologies | 15400-054 | |
| Name | Company | Catalog Number | Comments |
| Gas | |||
| 100% Oxygen | Airgas Inc | OX USP200 | |
| 100% CO2 | Airgas Inc | CD USPE | |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| 6-8 week old NOD/SCID Mice (male) | Jackson Lab | 001303 | |
| 6-8 week old NOD/SCID Mice (female) | Jackson Lab | 001303 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Hematoxylin | Sigma | GHS232 | |
| Ki-67 Rabbit Monoclonal Antibody | Thermo Scientific | RM-9106-S | |
| Name | Company | Catalog Number | Comments |
| Tools | |||
| 40 µm cell strainer | Fisher Scientific | 08-771-1 | |
| 100 µm cell strainer | Fisher Scientific | 08-771-19 | |
| 15 mL Conical Tube | Sarstedt | 11799 | |
| 50 mL Conical tube | Sarstedt | 15762 | |
| 150 mm Tissue Culture Dish | USA Scientific Inc | CC7682-3614 | |
| 96 Well plate | USA Scientific Inc | CC7682-7596 | |
| Forceps | Symmetry Surgical Inc | 06-0011 | |
| Surgical scissors | Symmetry Surgical Inc | 02-2011 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 5% CO2 humidified incubator | Thermo Scientific | 3110 | |
| Bioluminescent (BLI) Imaging Machine | Perkin Elmer | CLS136334 | |
| BLI Imaging Machine Software | Perkin Elmer | CLS136334 | |
| Centrifuge | Beckman | 366830 | |
| Deconvoluting Microscope | Intelligent Imaging Innovations | Marianas | |
| Deconvoluting Microscope Imaging Software | Intelligent Imaging Innovations | +1 (303) 607-9429 x1 | |
| Digital caliper | Fowler Tools and Instruments | 54-115-330 | |
| Dissecting microscope | Precision Instruments LLC | (504) 228-0076 | |
| Electrosurgical generator | ValleyLab | FORCE1C20 | |
| Isoflurane Induction Chamber | Perkin Elmer | 119038 | |
| Microtome | American Optical Corporation | 829 | |
| Pipet Aid | Fisher Healthcare | 13-681-15E | |
| Serological pipet (10 mL) | Sarstedt | 86.1254.001 |
Riferimenti
- Sundlisaeter, E., et al. Lymphangiogenesis in colorectal cancer--prognostic and therapeutic aspects. International Journal of Cancer. Journal international du cancer. 121, 1401-1409 (2007).
- Gout, S., Huot, J. Role of cancer microenvironment in metastasis: focus on colon cancer. Cancer Microenvironment. 1, 69-83 (2008).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: a Cancer Journal for Clinicians. 68, 7-30 (2018).
- Hautmann, R. E., de Petriconi, R. C., Pfeiffer, C., Volkmer, B. G. Radical cystectomy for urothelial carcinoma of the bladder without neoadjuvant or adjuvant therapy: long-term results in 1100 patients. European Urology. 61, 1039-1047 (2012).
- Stein, J. P., et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. Journal of Clinical Oncology. 19, 666-675 (2001).
- Lerner, S. P., et al. The rationale for en bloc pelvic lymph node dissection for bladder cancer patients with nodal metastases: long-term results. The Journal of Urology. 149, 758-764 (1993).
- Poulsen, A. L., Horn, T., Steven, K. Radical cystectomy: extending the limits of pelvic lymph node dissection improves survival for patients with bladder cancer confined to the bladder wall. The Journal of Urology. 160, 2015-2019 (2020).
- Margolin, D. A., et al. Lymph node stromal cells enhance drug-resistant colon cancer cell tumor formation through SDF-1alpha/CXCR4 paracrine signaling. Neoplasia. 13, 874-886 (2011).
- Vermeulen, L., et al. Wnt activity defines colon cancer stem cells and is regulated by the microenvironment. Nature Cell Biology. 12, 468-476 (2010).
- Margolin, D. A., et al. The critical roles of tumor-initiating cells and the lymph node stromal microenvironment in human colorectal cancer extranodal metastasis using a unique humanized orthotopic mouse model. FASEB Journal. 29, 3571-3581 (2015).
- Gills, J., et al. A patient-derived orthotopic xenograft model enabling human high-grade urothelial cell carcinoma of the bladder tumor implantation, growth, angiogenesis, and metastasis. Oncotarget. 9, 32718-32729 (2018).
- Hidalgo, M., et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discovery. 4, 998-1013 (2014).
- Hiroshima, Y., et al. Patient-derived mouse models of cancer need to be orthotopic in order to evaluate targeted anti-metastatic therapy. Oncotarget. 7, 71696-71702 (2016).
- Kim, H. S., Zhang, X., Klyushnenkova, E., Choi, Y. S. Stimulation of germinal center B lymphocyte proliferation by an FDC-like cell line, HK. The Journal of Immunology. 155, 1101-1109 (1995).
- Hite, N., et al. An Optimal Orthotopic Mouse Model for Human Colorectal Cancer Primary Tumor Growth and Spontaneous Metastasis. Diseases of the Colon and Rectum. 61, 698-705 (2018).
- Jager, W., et al. Ultrasound-guided intramural inoculation of orthotopic bladder cancer xenografts: a novel high-precision approach. PloS One. 8, e59536 (2013).
- Schirner, M., et al. Integrin alpha5beta1: a potent inhibitor of experimental lung metastasis. Clinical & Experimental Metastasis. 16, 427-435 (1998).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445, 111-115 (2007).
- Todaro, M., et al. Colon cancer stem cells dictate tumor growth and resist cell death by production of interleukin-4. Cell Stem Cell. 1, 389-402 (2007).
- Lee, J. S., et al. Tumor establishment features of orthotopic murine bladder cancer models. Korean Journal of Urology. 53, 396-400 (2012).
- Hadaschik, B. A., et al. A validated mouse model for orthotopic bladder cancer using transurethral tumour inoculation and bioluminescence imaging. BJU International. 100, 1377-1384 (2007).
- Silinsky, J., et al. CD 133+ and CXCR4+ colon cancer cells as a marker for lymph node metastasis. The Journal of Surgical Research. 185, 113-118 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon