Method Article
患者衍生的人类泌尿细胞癌和结肠直肠癌肿瘤生长和自发转移的正交异种移植模型
摘要
该协议描述了患者衍生的正交异种移植模型,通过内在灌输高级尿细胞癌细胞或直肠内注射结肠直肠癌细胞到非肥胖糖尿病/严重组合免疫缺陷(NOD/SCID)小鼠原发性肿瘤生长和自发转移在淋巴结基质细胞的影响下,模拟人类转移性疾病的进展。
摘要
当膀胱和结肠直肠癌 (CRC) 的高级别泌尿细胞癌 (HG-UCC) 中存在淋巴结 (LN) 参与时,癌症患者的预后较差。超过50%的肌肉侵入性UCC患者,尽管对临床局部疾病进行治疗,但会发展转移并在5年内死亡,而转移性CRC是美国癌症相关死亡的主要原因。需要持续模仿UCC和CRC转移的患者异种移植模型。本研究旨在生成UCC和CRC的由患者衍生的正射异种移植(PDOX)模型,用于在LN基质细胞的影响下原发性肿瘤生长和自发转移,模拟药物筛选中的人类转移性疾病的进展。新鲜UCC和CRC肿瘤分别从接受HG-UCC和结肠直肠腺癌切除的同意患者身上获得。与LN基质细胞(LNSC)模拟HK细胞共接种,荧光素酶标记UCC细胞被注射到女性非肥胖糖尿病/严重合并免疫缺陷(NOD/SCID)小鼠中,CRC细胞被注射到内直肠(IR)雄性NOD/SCID小鼠。利用生物发光成像(BLI)每周监测肿瘤生长和转移。牺牲后,对血氧林和欧辛和免疫组织化学染色进行收获、称重和正式固定原发性肿瘤和小鼠器官。在我们独特的PDOX模型中,异种移植肿瘤类似于患者植入前肿瘤。在港细胞中,两种模型均具有高肿瘤植入率,以BLI和肿瘤重量测量,UCC为83.3%,CRC为96.9%,高远器官转移率(UCC检测到肝或肺转移33.3%,CRC检测为53.1%)。此外,两种型号的死亡率均为零。我们为人类HG-UCC和CRC建立了独特的、可重复的PDOX模型,允许肿瘤形成、生长和转移研究。有了这些模型,新型治疗药物的测试可以有效地进行,临床模拟的方式。
引言
研究表明,淋巴结(LN)转移是许多固体器官恶性肿瘤的预后指标差,包括膀胱的高档泌尿细胞癌(UCC)和结肠直肠癌(CRC)1、2。超过一半的肌肉侵入性UCC(MIUCC)患者,尽管对临床局部疾病进行治疗,但会发展转移并在5年内死亡。转移性CRC是美国癌症相关死亡的主要原因。
据估计,2018年美国将有81,190名新患者和17,240名癌症特定死亡,原因是膀胱3、4的UCC。而患者将主要 (70%)目前与非肌肉侵入性疾病,30%将有MIUCC5。尽管临床局部性疾病的用于治疗(根囊切除术[RC],无论是否进行全身化疗),膀胱MIUCC患者的一半仍然会发展转移,并在5年内死亡3。淋巴结参与发现在大约20%-25%的患者经历了RC6,7,8。即使经过 RC,LN 阳性患者的五年生存率也低于 35%,这表明 LN 参与是 UCC 患者预后的关键负预测因素。
结肠直肠癌是美国男性和女性诊断的第三大常见癌症。患者结果主要取决于肿瘤特征和肿瘤微环境,如入侵深度、LN参与和远器官转移。虽然过去十年,由于筛检及有效手术,CRC的死亡率有所下降,但估计近50%的CRC患者会发展为转移或复发性疾病9。
小型动物模型提供了一个快速、可重复和可修改的平台,用于研究肿瘤进展和不同的转移模式。目前没有描述的异种移植模型,持续模仿CRC和UCC转移在患者看到。癌症远距离转移的主要途径是通过淋巴扩散。新的研究表明,LAN为肿瘤提供了独特的微环境,它不仅是癌细胞瞬时通过的固定靶点,而且通过在转移过程中与癌细胞相互作用而起着不可或缺的作用。事实上,我们的研究发现,除了教育和促进肿瘤进展和转移,LN基质微环境也负责在CRC10,11的耐药性。我们的实验室最近使用患者衍生的正交异种移植(PDOX)小鼠模型12、13,确认了LN基质细胞(LNSCs)对CRC和UC的肿瘤效应。
开发PDOX模型为转化癌症研究提供了一个重要的平台。PDOX模型通过保持其供体肿瘤的主要组织学和遗传特征,在各通道之间保持稳定,为转化性癌症研究提供了良好的平台。PDOX 模型正用于临床前药物评估、生物标志物鉴定和个性化药物策略的临床前评估,从而预测临床结果。目前,没有描述异种移植模型考虑LN参与的重要性,并能够持续复制原发肿瘤和遥远的器官转移在CRC和UCC。在这项研究中,我们描述了在NOD/SCID小鼠中,在LNSC参与下,在转移性CRC和UCC疾病的繁殖下,PDOX模型的发展。
研究方案
这些动物研究中描述的所有方法都是根据奥克斯纳卫生系统机构动物护理和使用委员会批准的准则,并按照动物研究指南进行的。本研究的所有患者肿瘤均根据奥克斯纳卫生系统调查审查委员会和人类机构委员会的道德标准,从接受癌症切除手术的同意患者中收集实验。Ochsner 卫生系统的董事会认证病理学家根据肿瘤细胞的微观特征、组织类型和等级水平,确定患者标本的病理诊断。
注:以下协议描述了两个独立的异种移植模型的步骤,一个通过膀胱壁电烧化注入UCC细胞的UCC模型和CRC细胞的内直注射,用于CRC模型的研究。准备和监视实验的所有步骤对于两个模型都是相同的,而第 7 节和第 8 节分别具体描述了 UCC 灌输和 CRC 注射的过程。
1. 培养细胞系
- 在完全RPMI-1640培养基中生长HK细胞,辅以10%胎儿牛血清、2 nM谷氨酰胺、100 U/mL青霉素G和100mg/mL链霉素,在37°C下,在5%CO2加湿培养箱中。
注:香港细胞是正常人体卵泡树突状细胞,可在体外16号通道内生长和扩张15个通道。 - 为了准备一个实验,胰蛋白化细胞。
- 去除介质,在汉克的平衡盐溶液(HBSS)中加入2 mL 1%的胰蛋白酶到细胞中。将细胞放回5%CO2加湿培养箱中,在37°C下放置4分钟。
- 使用手持式移液器将细胞从盘中收集到 15 mL 管中,并连接 10 mL 血清学移液管。添加 8 mL 的完整 RPMI-1640 介质。
- 将40μL的细胞和40μL的锥蓝色锥片混合在96孔板的单个孔中。将10μL的混合物加入血细胞计并计数活细胞。在 25 mL 完整 RPMI-1640 培养基中加入 100 万个细胞,加入 150 mm 无菌组织培养处理的培养皿,以继续生长细胞。
注:此步骤中制备的香港细胞悬浮液必须在一小时内与肿瘤细胞混合注射。
2. 患者标本收集
- 在切除手术时从同意的患者15(BlCaPt15,pT3b N1 M0)和37(BlCaPt37,pT3b pN0 M0)收集UCC肿瘤。
- 在切除手术时,从同意的患者155(CoCaPt155,T1 N0 M0)和302(CoCaPt302,T1 N0 M0)收集CRC肿瘤。
3. 患者肿瘤的扩大
- 在含有青霉素 G (500 U/mL) 和链霉素 (500 mg/mL) 的冷无菌麦考伊介质中收集手术中的肿瘤。
- 将肿瘤直接植入6-8周大雌性NOD/SCID小鼠的左右侧翼。
- 用小手术剪刀将纸巾机械地切成小块(±1毫米3)。
- 使用13G骨髓吸入活检针将组织分皮植入左右侧翼。
注:将总体积为 8 mm3均匀分割到齿面两侧。
4. 标记和浓缩荧光素酶标记肿瘤
- 使用数字卡钳每两周测量肿瘤生长。
- 直径为1厘米,转导肿瘤。使用带 27 G 针头的 1 cc 注射器,直接用单剂量 Luc/红色荧光蛋白 (RFP)-慢病毒 (50 μL/肿瘤,1:30 稀释从浓缩高滴定子慢病毒库存) 注射到肿瘤中。
注:患者肿瘤通常在1⁄2个月内达到1厘米直径。然而,生长速率是极其多变的,并基于许多因素,包括肿瘤的等级和类型。 - 每周通过活体动物的生物发光成像(BLI)监测肿瘤。
- 称量老鼠。在腹内注射150mg/kg荧光素的有意识的小鼠,等待5分钟,使基质在小鼠体内循环。
- 在100%氧气中用2.5%的胶合剂麻醉小鼠,在感应室中麻醉1升/分钟。
- 将鼠标放在带电子烟流和图像的 BLI 成像机的胃上。拍摄顺序图像以确认存在 Luc/RFP 阳性肿瘤区域(假色生物发光图像)。成像完成后,将鼠标返回到保持架。
5. 选择肿瘤的相应部分进行酶消化
- 在 UCC 或 CRC 程序当天,在步骤 4.3.1_4.3.3 中,带有荧光素酶标记肿瘤的图像小鼠。
注:皮下肿瘤的生长时间取决于肿瘤的生长速度和实验中要注射的动物计划数量。 - 从小鼠侧翼和图像收获肿瘤。
- 成像后通过CO2吸入使小鼠安乐死。将鼠标放入CO2室,以1.4升/分钟打开气体,直到呼吸停止,然后离开3分钟。随后进行宫颈脱位。
- 用70%乙醇清洁皮肤。肿瘤正上方的帐篷皮肤。用手术剪刀在皮肤上做一个小切口。用剪刀将皮肤与肿瘤分开。
- 去除肿瘤,并放置在无菌培养皿。在成像机中映像整个盘子。
- 使用无菌剪刀或手术刀将荧光素酶阴性部分从肿瘤中的荧光素酶阳性部分分离,并重新形象。
- 重复,直到只有大多数高度积极的肿瘤片仍然存在。
6. 肿瘤酶消化
- 在层流罩下,用无菌手术剪刀将明丝荧光素酶阳性肿瘤片(步骤5.4)放入尽可能小的肿瘤片中,并将其放入无菌的50 mL锥形管中。
注:将肿瘤切成最小的片段将产生更多的单个细胞。 - 通过在40 mL的HBSS中加入10 mL的胶原酶IV(1.5mg/mL)、80 μL透明质尿酸酶(20mg/mL)和160 μL的脱氧核糖核酸酶I(0.1mg/mL)制备消化液。通过反转混合解决方案。
- 将35~40 mL的消化液加入切碎的肿瘤。在 37°C 孵育,连续旋转 2 小时。
注意:在整个孵育过程中定期大力摇动管,以防止肿瘤组织结块。 - 通过无菌的 100 μm 细胞过滤器过滤整个消化,然后通过 40 μm 细胞过滤器来清除碎屑。保存流过并丢弃碎屑。
- 通过加入20 mL的HBSS和在329 x g的离心机5分钟洗涤游离细胞。 在30 mL的HBSS中吸气和重新悬浮颗粒。
- 将10μL的细胞溶液和90μL的锥片蓝色组合在96孔板的单口中。使用血球仪对活细胞进行计数。
- 将每只小鼠的1 x 104至1 x 106肿瘤细胞转移到无菌的15 mL锥形管中。将3 x 105 HK细胞从每只小鼠步骤1.2.3添加到同一管肿瘤细胞。
注:如果总体积超过15 mL,请使用无菌 50 mL 锥形管。始终计算每个研究组的额外动物的更多剂量,以解释注射器使用过程中液体的流失。例如,如果一组包含 5 个小鼠,则为 6 或 7 个小鼠制作足够的细胞。 - 在329 x g下离心5分钟,通过吸气或移液丢弃上清液。
- 将细胞重新悬浮在 50 μL 每只鼠标中,用于 UCC 型号,或将 CRC 模型在完整的 RPMI 介质中每只鼠标悬浮 10 μL。将细胞悬浮液放在冰上,直到准备好使用。
7. UCC 鼠标型号
- 小鼠的制备程序
- 获得六到八周大的女性NOD/SCID鼠标。使用脱毛霜擦去鼠标的下背部。用异常鲁兰(100%氧气中的2.5%,1升/分钟)在感应室中麻醉小鼠。
- 镇静后,将鼠标放在苏皮内,其鼻塞在一个极值鼻锥中,裸露的背部牢固地接地在分散电极上。
注:如果对脚趾捏没有反应,鼠标将完全镇静。
- 使用血管造影器将步骤6.9中制备的UCC细胞注入膀胱(图1Aa,Ab)。
- 设置单极电烧机,并设置为 4 W 的功率。润滑 24 G 无菌血管器,带润滑果冻,并通过雌性小鼠的尿道插入。
注:可能会感觉到轻微的阻力。轻轻向前推或取出血管,重复。不要用力。如果导管在进入时弯曲,请将无菌导丝(参见 7.2.2)插入导管的半路上,以提供稳定性。 - 将 0.025" 固定芯直导线完全插入到血管末端 1 mm 上。
注:在手术前,电线上标有胶带,以指示 1 mm 停止点并确保一致性。 - 将单极销固定在导丝上 1 s,从而刺激膀胱粘囊。
- 将一个新鲜的无菌血管器连接到1cc luer-lok注射器,并从步骤6.9中抽取200μL的收集细胞。
注: 至少 100 μL 从血管仪丢失到注射器。在计算所需的电池悬浮量时,补偿损失量。 - 从小鼠尿道中取出导丝和血管。插入血管导管与注射器的细胞连接到尿道。
注:进步应该比以前更容易。 - 向小鼠膀胱中灌输50μL的细胞。等待几秒钟,然后取出血管,使细胞粘附在膀胱壁上。
注:细胞留在膀胱中,并发展成原发性肿瘤。
- 设置单极电烧机,并设置为 4 W 的功率。润滑 24 G 无菌血管器,带润滑果冻,并通过雌性小鼠的尿道插入。
- 从离锥体鼻锥和接地垫中取出鼠标。观察鼠标 1 小时以下过程。寻找痛苦的迹象,即驼背、劳累的呼吸等。
8. CRC鼠标型号
- 麻醉六至八周老雄性NOD/SCID小鼠与异常鲁然(2.5%在100%氧气,1L/min)在感应室。用脚趾捏确认镇化。
- 将麻醉小鼠置于解剖显微镜下,确保将其鼻塞固定在一个异常的鼻锥上,并用胶带固定其前四肢,以确保稳定性。
注:可以使用放大镜代替解剖显微镜。当放置在尾部底部下方时,小物体可用于提高视野和角度,从而提升尾声。通常,小段纱布被卷成直径为 1 英寸的圆柱形。 - 用弯曲润滑的钝尖钳子稀释肛门,露出远端肛门和直肠粘管。清除粪便。
- 在50μL玻璃注射器上使用无菌30G可拆卸针头,将10μL的肿瘤和香港细胞(从步骤6.9)注射到肛管上方1至2毫米的远端后直肠子粘管中。针的斜面应覆盖粘粘。小心不要进入骨盆腔。
- 从离锥体鼻锥中取出鼠标。观察鼠标 1 小时以下过程。寻找痛苦的迹象,即驼背、劳累的呼吸等。
9. 生物发光成像
- 每周使用生物发光成像系统监测原发性肿瘤、肝脏和肺转移负担,以进行荧光素酶活性。
- 从 UCC 或 CRC 实验中获得鼠标并称重。注射150mg/kg荧光素在腹中,等待5分钟,使基质在小鼠体内循环。
- 用2.5%的胶合剂在100%氧气中麻醉小鼠,在感应室中1升/分钟。
- 将鼠标放入 BLI 成像机中,鼻子固定在鼻塞内。为图像曝光时,请确保感兴趣区域面向摄像机。对于 UCC 和 CRC 注射,每个图像的通风侧应面向摄像机。图像鼠标在苏普因位置。
10. 收获器官和肿瘤
- 当原发性肿瘤发光辐射达到1 x 1011光子时,或者如果小鼠出现痛苦迹象(即体重减轻、驼背、剧烈/劳力呼吸等),在荧光素后通过CO2吸入(如步骤5.2.1)对小鼠实施安乐死注射和全身成像。
- 取出肝脏和肺,放入培养皿和图像,以识别任何转移。去除肿瘤,称重和图像。在环境温度下将器官和肿瘤固定在10%中性缓冲形式48小时。
注:清洁/擦拭剪刀和每个器官之间的钳子,以避免组织转移。
11. 组织学评价
- 将形式素固定组织嵌入石蜡中,在血氧素和欧辛(H&E)和免疫组织化学(IHC)染色的微托姆上以5μm厚度将组织切片。
注:石蜡幻灯片的所有H&E染色均在奥克斯纳卫生系统病理实验室进行,本文的所有IHC染色均在使用Ki67和Ki67进行高温抗原检索后,在Ochsner卫生系统的研究实验室进行。细胞角蛋白20抗体,其次是生物异位化二级抗体,以及根据制造商说明13、17的阿胶蛋白-生物-过氧化物酶复合物。
结果
在UCC PDOX模型中,UCC患者的BlCaPt15或BlCaPt37细胞在存在香港细胞的情况下被灌输到女性NOD/SCID小鼠膀胱中(图1A)。三十分之二十五(83.3%)动物产生原发性肿瘤,并显示时间依赖性原发性肿瘤增长基于每周BLI(图1B,C和表1)。同样,在 CRC PDOX 模型中,32 个型号中的 31 个(96.9%)小鼠在注射患者CoCaPt155或CoCaPt302细胞加香港细胞时,在直肠内(IR)中生长原发性肿瘤(图1D-F和表1)。根据患者肿瘤的不同,小鼠肿瘤的生长有不同的潜伏期,这反映了患者临床特征的差异(图1C,F)。
在IB和IR模型中,肿瘤细胞注射不仅产生正交原发性肿瘤(图2A,B,蓝色箭头),而且许多被测试的小鼠也发展为肝脏和/或肺转移。在 10 的 30 (33.3%)和 17 出 32 (53.1%)小鼠分别用UCC细胞和CRC细胞与香港细胞一起,通过体外BLI检测出遥远的器官转移(图2A、B和表1)。
为了确认类似的组织形态,H&E和IHC染色进行了比较异种移植和原发性患者肿瘤。患者膀胱癌的组织病理学在BlCaPt15和BlCaPt37的异种移植中维持(图3A)。结果表明,异种移植肿瘤与患者原发性肿瘤的肌肉侵入性生长模式相对应。人体细胞增殖标记Ki67特有的抗体用于IHC。Ki67阳性核染色表明人类肿瘤细胞具有高增殖性、快速生长性。异种移植物的染色结果与原始手术活检的结果相似。同样,在IR模型中,H&E染色表明CoCaPt155和CoCaPt302异种移植物与患者肿瘤之间的结构相似性。IHC使用针对细胞角蛋白20的抗体在两种PDOX模型中也显示了相似的肿瘤生长模式(图3B)。因此,我们的PDOX模型概括了UCC和CRC患者的临床进展。
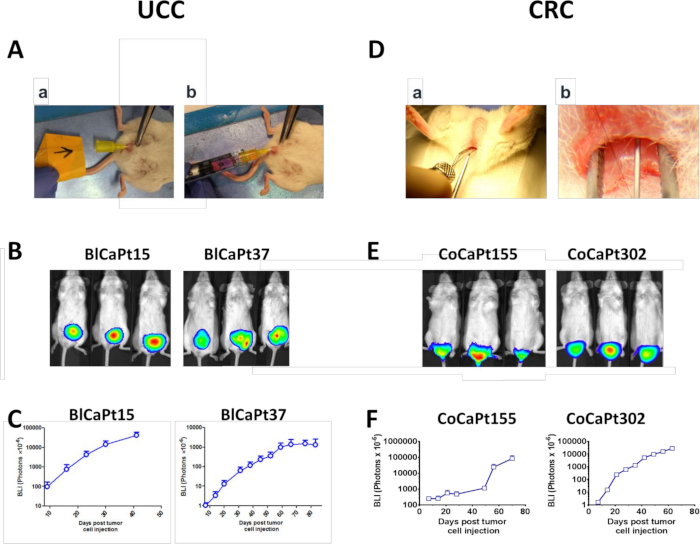
图1:正射UCC和CRC鼠标模型。(A-C)囊内(IB)将UCC细胞注入小鼠膀胱13。(Aa)将血管器插入雌性NOD/SCID小鼠的膀胱,并通过导线对膀胱壁施加电灼性冲击。(Ab)Luciferase 标记 UCC 肿瘤细胞、BlCaPt15 (2 x 104细胞) 或 BlCaPt37 (5 x 105细胞),并添加 3 x 105 LN 基质 HK 细胞,通过血管器注入 NOD/SCID 小鼠膀胱。(D-F)直肠内(IR)将CRC细胞注射到小鼠直肠的亚粘膜组织层17。(D) 肛门管用润滑的钝尖钳扩张,以便进入远端肛门和直肠粘管,并将一根 30 G 针头插入肛门管道上方 1⁄2 mm 的远端后直肠子粘管中,直到前方覆盖斜面注射发生。Luciferase 标记CRC肿瘤细胞,CoCaPt155(5 x 105细胞),或CoCaPt302(1 x 104细胞),并加入3 x 105 HK细胞。通过生物致发光成像(BLI;B和E。通过BLI对荧光素酶标记UCC或CRC细胞的肿瘤生长进行动力学监测,并使用图像分析软件(C和F)进行分析。 请点击此处查看此图的较大版本。

图2:PDOX模型产生自发的远器官转移。与图1相同的实验的代表性小鼠(顶部面板),例如,在片内灌输荧光素酶标记UCC肿瘤细胞,BlCaPt15或BlCaPt37细胞,带有HK细胞(A)或内直肠,荧光素酶标记CRC肿瘤显示带有香港细胞(B)的细胞、CoCaPt155或CoCaPt302细胞。黄色箭头表示鼠标膀胱 (A)。在牺牲时拍摄的照片表明正交肿瘤的形成(蓝色箭头)。在尸体解剖时收集的肝脏、肺和肿瘤(中间板)及其前体 BLI(底部板)显示小鼠肝脏和肺转移以及具有荧光酶活性的肿瘤。请点击此处查看此图的较大版本。
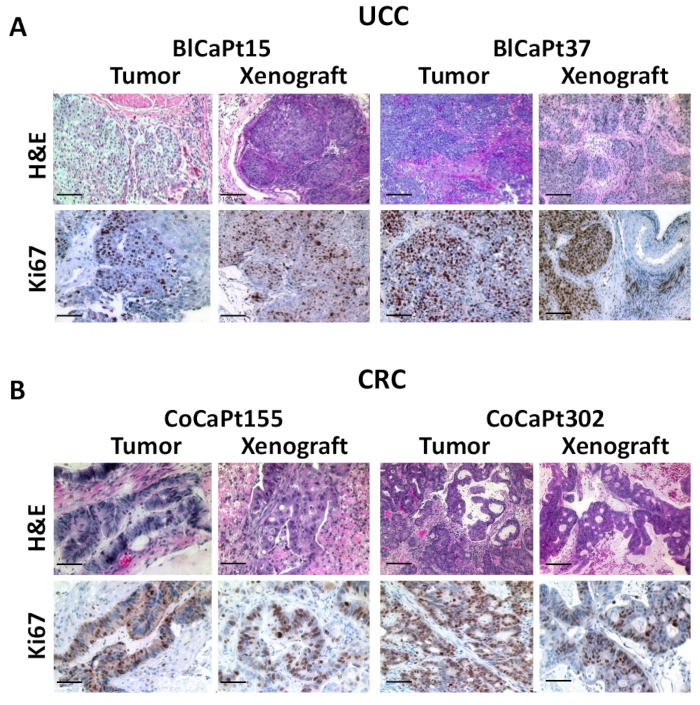
图3:异种移植肿瘤类似于患者植入前肿瘤。在图1的相同实验中从小鼠身上采集的患者肿瘤或肿瘤中,从患者肿瘤或肿瘤中采集的石蜡嵌入肿瘤组织被H&E(A和B)或IHC分割和染色,带有针对人类Ki67 (A) 或细胞角蛋白的抗体20 (CK20;B)棕色表示正染色。H&E 染色显示肿瘤巢穴解剖成平滑的肌肉束 (A)。使用数字解光显微镜拍摄照片,并使用图像分析软件进行分析。刻度条:100 μm。所有图像均以 200Ω 的原始放大倍率拍摄。请点击此处查看此图的较大版本。
| 肿瘤植入物(%) | 肺/肝转移(%) | 死亡率(%) | |
| UCC, n=30 | 83.3 | 33.3 | 0 |
| CRC, n=32 | 96.9 | 53.1 | 0 |
表1:IB和IR模型中肿瘤形成、转移和死亡率的摘要。
讨论
转移性疾病是造成大多数癌症患者死亡的原因。在临床前治疗测试中,建立与自发性远器官转移最密切地模拟人类肿瘤生长的小鼠模型至关重要。使用小鼠模型与植入的患者肿瘤衍生癌细胞(异种移植物)允许更好地了解肿瘤生物学和预测生物标志物,以及测试和预测抗肿瘤效果的新疗法18。许多模型已经用于显示UCC和CRC转移在鼠实验中,如静脉尾静脉注射显示有能力产生肺病19或皮下植入肿瘤细胞或肿瘤片段到侧翼局部肿瘤生长20,21.一家实验室此前报告,一种膀胱癌鼠模型利用盐酸疗法成功促进肿瘤的切除22。虽然这些方法产生可靠的局部生长,并可能证明一些转移活动,它们并不特别类似于在人类中发展的癌症的自然过程,并且没有利用在患者18中看到的转移机制, 23.据报道,其他鼠模型通过将肿瘤细胞直接注射到肝脏或甲流等器官来模拟肿瘤生长,但它们具有肿瘤细胞泄漏的风险,并且没有产生显著的转移。
我们之前已经证明了原发性肿瘤中癌细胞含量与LN参与24的相关性,以及癌细胞/LN基质相互作用在原发性肿瘤进展到转移性疾病过程中的作用10,12,17. 结合我们以前关于LN基质微环境在转移性进展的影响方面的工作,我们建立了模仿转移传播的自然过程的正交模型(特别是PDOX模型),这些模型是技术上可重复,保持原患者肿瘤的异质性,并产生一致的原发性肿瘤和转移结果12,13,17。使用LN基质微环境的肿瘤增强效应很重要,因为它在人类UCC和CRC中提供了类似的肿瘤微环境,在转移级联中发展所有步骤,减少小鼠模型中所需的癌细胞数量,最小化异种移植通道的数量,并产生一个可靠的模型,密切模仿肿瘤生长和转移在人类。
我们利用香港细胞的共同灌输,建立了独特的IB电刺激方法,为MIUCC的发展提供了可靠的模型。我们的模型模仿UCC的自然过程,通过肿瘤植入开始在粘部,导致进入肌肉,然后转移到肺13。
我们的研究结果还表明,红外模型是安全、可重复和成功的。正交CRC小鼠模型具有原发性肿瘤生长和自发性远转移12、17。红外程序快速,易于学习,技术上易于执行,对动物没有太大的压力。IB和IR组在术后阶段在最终BLI测量之前为零死亡率(表1)。但是,该技术需要实践。如果内直肠注射成功,应该有一个可见的"气泡",形成流体被引入直肠子粘囊,并将导致原发性肿瘤生长,最终将变得明显如图1所示。如果肿瘤被注射太深到骨盆腔,它将与结肠直肠不相连,并变得非常大,以填充骨盆,有时造成阻塞。如果注射太浅或根本不进入直肠子膜层,它会泄漏出来,导致减少或缺少原发性肿瘤负担。
我们为人类HG-UCC和CRC建立了独特的、可重复的PDOX模型。这些模型允许肿瘤形成和转移研究。我们现在可以使用这些模型作为主要方法,继续研究LN基质微环境及其与患者原发性肿瘤的相互作用。这些模型还将使我们能够研究干扰LNSC对原发性肿瘤的亲肿瘤效应的疗法。有了这些模型,新型治疗药物的测试可以有效地进行,临床模拟的方式。
披露声明
这项研究得到了2014年奥克斯纳转化医学研究计划资助部分支持。提交人声明没有利益冲突。
致谢
作者感谢布赖恩·鲁特、丹妮尔·贝尔托尼、彼得·米勒和香农·麦切斯尼,他们帮助启动了这些研究,感谢他们出色的技术支持。作者还感谢希瑟·格林·马特拉纳、玛格丽特·瓦里亚诺、苏尼尔·塔尔瓦尔和玛丽亚·拉茨在同意患者和提供肿瘤标本方面给予的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Avidin-biotin-peroxidase | Vector Labs Inc | PK-6100 | |
| Biotinylated secondary antibody | Vector Labs Inc | BA-1000 | |
| Collagenase IV (1.5 mg/mL) | Worthington Biochemical Corporation | LS004189 | |
| Deoxyribonuclease I (0.1 mg/mL) | Sigma | D4263 | |
| D-Luciferin (150 mg/kg) | Perkin Elmer | 122796 | |
| Formalin (10% neutral buffered) | Leica | 46129 | |
| glutamine (2 nM) | Fisher Scientific | 35050061 | |
| Hair Removal Cream | Church & Dwight Co., Inc | 1 (800) 248-8820 | |
| Hanks Balanced Salt Solution (HBSS) | Fisher Scientific | SH30016.02 | |
| Hyaluronidase (20 mg/mL) | Sigma | H3884 | |
| Isoflurane | Henry Schein Animal Health | 108333 | |
| Luc/RFP-lentivirus | From our collaborators. See reference 13: Gills, J. et al. A patient-derived orthotopic xenograft model enabling human high-grade urothelial cell carcinoma of the bladder tumor implantation, growth, angiogenesis, and metastasis. Oncotarget. 9, 32718-32729, doi:10.18632/oncotarget.26024 (2018). | ||
| McCoy’s medium | Life Technologies | 110862 | |
| penicillin/streptomycin 100 mL (100 U/mL) | Fisher Scientific | 15140-122 | |
| RPMI-1640 Medium | American Type Culture Collection | 110636 | |
| Trypan Blue | Sigma | T6146 | |
| Trypsin/EDTA | Life Technologies | 15400-054 | |
| Name | Company | Catalog Number | Comments |
| Gas | |||
| 100% Oxygen | Airgas Inc | OX USP200 | |
| 100% CO2 | Airgas Inc | CD USPE | |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| 6-8 week old NOD/SCID Mice (male) | Jackson Lab | 001303 | |
| 6-8 week old NOD/SCID Mice (female) | Jackson Lab | 001303 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Hematoxylin | Sigma | GHS232 | |
| Ki-67 Rabbit Monoclonal Antibody | Thermo Scientific | RM-9106-S | |
| Name | Company | Catalog Number | Comments |
| Tools | |||
| 40 µm cell strainer | Fisher Scientific | 08-771-1 | |
| 100 µm cell strainer | Fisher Scientific | 08-771-19 | |
| 15 mL Conical Tube | Sarstedt | 11799 | |
| 50 mL Conical tube | Sarstedt | 15762 | |
| 150 mm Tissue Culture Dish | USA Scientific Inc | CC7682-3614 | |
| 96 Well plate | USA Scientific Inc | CC7682-7596 | |
| Forceps | Symmetry Surgical Inc | 06-0011 | |
| Surgical scissors | Symmetry Surgical Inc | 02-2011 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 5% CO2 humidified incubator | Thermo Scientific | 3110 | |
| Bioluminescent (BLI) Imaging Machine | Perkin Elmer | CLS136334 | |
| BLI Imaging Machine Software | Perkin Elmer | CLS136334 | |
| Centrifuge | Beckman | 366830 | |
| Deconvoluting Microscope | Intelligent Imaging Innovations | Marianas | |
| Deconvoluting Microscope Imaging Software | Intelligent Imaging Innovations | +1 (303) 607-9429 x1 | |
| Digital caliper | Fowler Tools and Instruments | 54-115-330 | |
| Dissecting microscope | Precision Instruments LLC | (504) 228-0076 | |
| Electrosurgical generator | ValleyLab | FORCE1C20 | |
| Isoflurane Induction Chamber | Perkin Elmer | 119038 | |
| Microtome | American Optical Corporation | 829 | |
| Pipet Aid | Fisher Healthcare | 13-681-15E | |
| Serological pipet (10 mL) | Sarstedt | 86.1254.001 |
参考文献
- Sundlisaeter, E., et al. Lymphangiogenesis in colorectal cancer--prognostic and therapeutic aspects. International Journal of Cancer. Journal international du cancer. 121, 1401-1409 (2007).
- Gout, S., Huot, J. Role of cancer microenvironment in metastasis: focus on colon cancer. Cancer Microenvironment. 1, 69-83 (2008).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: a Cancer Journal for Clinicians. 68, 7-30 (2018).
- Hautmann, R. E., de Petriconi, R. C., Pfeiffer, C., Volkmer, B. G. Radical cystectomy for urothelial carcinoma of the bladder without neoadjuvant or adjuvant therapy: long-term results in 1100 patients. European Urology. 61, 1039-1047 (2012).
- Stein, J. P., et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. Journal of Clinical Oncology. 19, 666-675 (2001).
- Lerner, S. P., et al. The rationale for en bloc pelvic lymph node dissection for bladder cancer patients with nodal metastases: long-term results. The Journal of Urology. 149, 758-764 (1993).
- Poulsen, A. L., Horn, T., Steven, K. Radical cystectomy: extending the limits of pelvic lymph node dissection improves survival for patients with bladder cancer confined to the bladder wall. The Journal of Urology. 160, 2015-2019 (2020).
- Margolin, D. A., et al. Lymph node stromal cells enhance drug-resistant colon cancer cell tumor formation through SDF-1alpha/CXCR4 paracrine signaling. Neoplasia. 13, 874-886 (2011).
- Vermeulen, L., et al. Wnt activity defines colon cancer stem cells and is regulated by the microenvironment. Nature Cell Biology. 12, 468-476 (2010).
- Margolin, D. A., et al. The critical roles of tumor-initiating cells and the lymph node stromal microenvironment in human colorectal cancer extranodal metastasis using a unique humanized orthotopic mouse model. FASEB Journal. 29, 3571-3581 (2015).
- Gills, J., et al. A patient-derived orthotopic xenograft model enabling human high-grade urothelial cell carcinoma of the bladder tumor implantation, growth, angiogenesis, and metastasis. Oncotarget. 9, 32718-32729 (2018).
- Hidalgo, M., et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discovery. 4, 998-1013 (2014).
- Hiroshima, Y., et al. Patient-derived mouse models of cancer need to be orthotopic in order to evaluate targeted anti-metastatic therapy. Oncotarget. 7, 71696-71702 (2016).
- Kim, H. S., Zhang, X., Klyushnenkova, E., Choi, Y. S. Stimulation of germinal center B lymphocyte proliferation by an FDC-like cell line, HK. The Journal of Immunology. 155, 1101-1109 (1995).
- Hite, N., et al. An Optimal Orthotopic Mouse Model for Human Colorectal Cancer Primary Tumor Growth and Spontaneous Metastasis. Diseases of the Colon and Rectum. 61, 698-705 (2018).
- Jager, W., et al. Ultrasound-guided intramural inoculation of orthotopic bladder cancer xenografts: a novel high-precision approach. PloS One. 8, e59536 (2013).
- Schirner, M., et al. Integrin alpha5beta1: a potent inhibitor of experimental lung metastasis. Clinical & Experimental Metastasis. 16, 427-435 (1998).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445, 111-115 (2007).
- Todaro, M., et al. Colon cancer stem cells dictate tumor growth and resist cell death by production of interleukin-4. Cell Stem Cell. 1, 389-402 (2007).
- Lee, J. S., et al. Tumor establishment features of orthotopic murine bladder cancer models. Korean Journal of Urology. 53, 396-400 (2012).
- Hadaschik, B. A., et al. A validated mouse model for orthotopic bladder cancer using transurethral tumour inoculation and bioluminescence imaging. BJU International. 100, 1377-1384 (2007).
- Silinsky, J., et al. CD 133+ and CXCR4+ colon cancer cells as a marker for lymph node metastasis. The Journal of Surgical Research. 185, 113-118 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。