Method Article
Modelos de xenoinjerto ortotópico derivados del paciente para el carcinoma de células uroteliales humanas y el crecimiento tumoral del cáncer colorrectal y la metástasis espontánea
En este artículo
Resumen
Este protocolo describe la generación de modelos de xenoinjerto ortotópico derivados del paciente inculcando intravesicamente células carcinoma de células uroteliales de alto grado o inyectando intrarectalmente células cancerosas colorrectales en combinación diabética/grave no obesa ratones de inmunodeficiencia (NOD/SCID) para el crecimiento tumoral primario y metástasis espontáneas bajo la influencia de células estromales de ganglios linfáticos, lo que imita la progresión de las enfermedades metastásicas humanas.
Resumen
Los pacientes con cáncer tienen mal pronóstico cuando la afectación del ganglio linfático (LN) está presente tanto en el carcinoma de células uroteliales de alto grado (HG-UCC) de la vejiga y el cáncer colorrectal (CRC). Más del 50% de los pacientes con UCC invasiva muscular, a pesar de la terapia curativa para la enfermedad clínicamente localizada, desarrollarán metástasis y morirán dentro de 5 años, y la CRC metastásica es una de las principales causas de muertes relacionadas con el cáncer en los Estados Unidos. Se necesitan modelos de xenoinjerto que imitan constantemente la metástasis UCC y CRC que se observado en los pacientes. Este estudio tiene como objetivo generar modelos de xenoinjerto ortotópico (PDOX) derivados del paciente de UCC y CRC para el crecimiento tumoral primario y metástasis espontáneas bajo la influencia de células estromales LN imitando la progresión de enfermedades metastásicas humanas para la detección de fármacos. Se obtuvieron tumores frescos de UCC y CRC de pacientes consentidos sometidos a resección de HG-UCC y adenocarcinoma colorrectal, respectivamente. Co-inoculada con células HK analógicas de células estromales LN (LNSC), células UCC etiquetadas con luciferasa se inculcaron intravesically (IB) en ratones femeninos de inmunodeficiencia combinada diabética/grave (NOD/SCID), y las células CRC se inyectaron intrarectalmente (IR) en ratones en ratones diabéticos no obesos/graves combinados de inmunodeficiencia (NOD/SCID), y las células CRC se inyectaron intrarectalmente (IR) en ratones en ratones diabéticos no obesos/graves combinados de inmunodeficiencia (NOD/SCID), y las células CRC se inyectaron intrarectalmente (IR) en ratones en ratones femeninos de inmunodeficiencia diabética no obesa/combinada grave (NOD/SCID), y las células CRC se inyectaron intrarectalmente (IR) en ratones femeninos de inmunodeficiencia diabética no obesa/combinada grave (NOD/SCID), y las células CRC se inyectaron intra ratones macho NOD/SCID. El crecimiento tumoral y la metástasis se monitorizaron semanalmente mediante imágenes de bioluminiscencia (BLI). Tras el sacrificio, se cosecharon, pesaron y fijaron la formalina para la hematoxilina y la eosina y la inmunohistoquímica. En nuestros modelos pDOX únicos, los tumores de xenoinjerto se asemejan a los tumores preimplantacionales del paciente. En presencia de células HK, ambos modelos tienen altas tasas de implantación tumoral medidas por pesos DE BLI y tumorales, 83,3% para UCC y 96,9% para CRC, y altas tasas de metástasis de órganos distantes (33,3% detectada metástasis hepática o pulmonar para UCC y 53,1% para CRC). Además, ambos modelos tienen una mortalidad cero por el procedimiento. Hemos establecido modelos PDOX únicos y reproducibles para HG-UCC y CRC humanos, que permiten la formación de tumores, el crecimiento y los estudios de metástasis. Con estos modelos, las pruebas de nuevos fármacos terapéuticos se pueden realizar de manera eficiente y clínicamente mimética.
Introducción
Se ha demostrado que la metástasis de los ganglios linfáticos (LN) es un indicador de pronóstico deficiente en muchas neoplasias malignas de órganos sólidos, incluido el carcinoma de células uroteliales (UCC) de alto grado de la vejiga y el cáncer colorrectal (CRC)1,2. Más de la mitad de los pacientes con UCC invasiva muscular (MIUCC), a pesar de la terapia curativa para la enfermedad clínicamente localizada, desarrollarán metástasis y morirán en un plazo de 5 años. La CRC metastásica es una de las principales causas de muerte relacionada con el cáncer en los Estados Unidos.
Se estima que en 2018 se producirán 81.190 nuevos pacientes y 17.240 muertes específicas por cáncer en 2018 en los Estados Unidos debido a la UCC de la vejiga3,4. Mientras que los pacientes predominantemente (70%) presente con enfermedad invasiva no muscular, 30% tendrá MIUCC5. A pesar de la terapia curativa (cistectomía radical [RC] con o sin quimioterapia sistémica) para la enfermedad clínicamente localizada, la mitad de los pacientes con MIUCC de la vejiga seguirán desarrollando metástasis y morirán dentro de los 5 años3. La afectación de los ganglios linfáticos se encuentra en aproximadamente el 20% al 25% de los pacientes que han sufrido RC6,7,8. La tasa de supervivencia a cinco años en pacientes con LN positivo es inferior al 35% incluso después de RC, lo que sugiere la afectación de LN como un predictor negativo crucial para el pronóstico en pacientes con UCC.
El cáncer colorrectal es el tercer cáncer más común diagnosticado tanto en hombres como en mujeres en los Estados Unidos. Los resultados del paciente dependen en gran medida de las características tumorales y del microambiente tumoral, como la profundidad de invasión, la afectación del LN y las metástasis de órganos distantes. Aunque la tasa de mortalidad en la CRC disminuyó en la última década debido a la detección y cirugíasefectivas, se estima que casi el 50% de los pacientes con CRC desarrollarán metástasis o enfermedad recurrente 9.
Los modelos animales pequeños proporcionan una plataforma expeditiva, reproducible y modificable para estudiar la progresión tumoral y diferentes patrones metastásicos. Actualmente no hay modelos de xenoinjertos descritos que imitan consistentemente la metástasis CRC y UCC que se ve en los pacientes. La principal vía de la metástasis distante del cáncer es a través de la diseción linfática. Nuevas investigaciones sugieren que los LN proporcionan a los tumores un microambiente único, y no sólo son objetivos estacionarios donde las células cancerosas pasan transitoriamente, sino que también juegan un papel integral al interactuar con las células cancerosas en el proceso metastásico. De hecho, nuestros estudios descubrieron que, además de educar y promover la progresión tumoral y las metástasis, el microambiente estromales LN también es responsable de la resistencia a los fármacos en CRC10,11. Nuestro laboratorio confirmó recientemente los efectos tumorígenos de las células estromales LN (LNSC) en CRC y UCC utilizando modelos de ratón de xenoinjerto ortotópico (PDOX) derivados del paciente12,13.
El desarrollo de modelos PDOX proporciona una plataforma importante para la investigación traslacional del cáncer14,15. Al mantener las principales características histológicas y genéticas de su tumor donante, los modelos PDOX se mantienen estables a través de pasajes y hacen buenas plataformas para la investigación traslacional del cáncer12,15. Los modelos de DODO se utilizan para la evaluación preclínica de fármacos, la identificación de biomarcadores y la evaluación preclínica de estrategias de medicina personalizada que permiten la predicción de los resultados clínicos. Actualmente, no hay modelos de xenoinjerto descritos que consideren la importancia de la afectación del LN y sean capaces de reproducir consistentemente el tumor primario y la metástasis de órganos distantes en CRC y UCC. En este estudio, describimos el desarrollo de modelos PDOX en ratones NOD/SCID con reproducción de enfermedades metastásicas CRC y UCC con afectación lNSC.
Protocolo
Todos los métodos descritos en estos estudios en animales se llevaron a cabo bajo las directrices aprobadas del Comité Institucional de Cuidado y Uso de Animales del Sistema de Salud de Ochsner y de acuerdo con las directrices de investigación en animales. Todos los tumores de pacientes para este estudio fueron recogidos de pacientes consentidos sometidos a cirugías de resección de cáncer de acuerdo con la Junta de Revisión de Investigación del Sistema de Salud de Ochsner y las normas éticas del Comité Institucional de Experimentación. Los patólogos certificados por la Junta en el Sistema de Salud de Ochsner determinaron los diagnósticos patológicos de las muestras de pacientes en función de las características microscópicas de las células tumorales, su tipo histológico y el nivel de grado.
NOTA: El siguiente protocolo describe los pasos para dos modelos de xenoinjerto separados, un modelo DE UCC a través de la electrocauterización de la pared de la vejiga para inculcar células UCC y una inyección intrarectal de células CRC para su estudio en un modelo CRC. Todos los pasos que se preparan y supervisan los experimentos son idénticos para ambos modelos, mientras que las secciones 7 y 8 describen específicamente el procedimiento para la insinversión UCC y la inyección de CRC, respectivamente.
1. Culatar líneas celulares
- Cultivar células DE Hk en medio completo de RPMI-1640 suplementado con suero bovino 10% fetal, 2 nM de glutamina, 100 U/ml de penicilina G y 100 mg/ml de estreptomicina a 37oC en una incubadora humidificada de 5% CO 2.
NOTA: Las células HK son células dendríticas foliculares humanas normales y se pueden cultivar y ampliar para 15 pasajes in vitro16. - Para prepararse para un experimento, intente las células.
- Retire los medios y agregue 2 ml de 1% de trippsina en la solución salina equilibrada (HBSS) de Hank a las células. Vuelva a colocar las células en la incubadora humidificada 5% CO2 a 37 oC durante 4 min.
- Recoja las células del plato en un tubo de 15 ml con una ayuda de pipeta de mano con un pipeta serológico de 10 ml unido. Añadir 8 mL de medio RPMI-1640 completo.
- Combine 40 s de células y 40 l de trippan azul en un solo pozo de una placa de 96 pocillos. Añadir 10 ml de mezcla a un hemocitómetro y contar las células vivas. Agregue 1 millón de células en un medio RPMI-1640 completo de 25 ml a un plato tratado con cultivo de tejido estéril de 150 mm para continuar cultivando las células.
NOTA: La suspensión de células HK preparada en este paso debe utilizarse dentro de una hora para mezclarse con células tumorales para inyección.
2. Recolección de muestras de pacientes
- Recoger los tumores UCC del paciente consentido 15 (BlCaPt15, pT3b N1 M0) y 37 (BlCaPt37, pT3b pN0 M0) en la cirugía de resección.
- Recoger tumores CRC del paciente consentido 155 (CoCaPt155, T1 N0 M0) y 302 (CoCaPt302, T1 N0 M0) en la cirugía de resección.
3. Expansión del tumor del paciente
- Recoger tumores en cirugía en frío medio estéril de McCoy que contiene penicilina G (500 U/ml) y estreptomicina (500 mg/ml).
- Implante tumores directamente en el flanco izquierdo y derecho de los ratones NOD/SCID hembra sin semanas de 6 a 8 semanas.
- Mecánicamente picar los tejidos en trozos pequeños (1 mm3) utilizando pequeñas tijeras quirúrgicas.
- Implante de tejido por vía subcutánea en el flanco izquierdo y derecho utilizando agujas de biopsia de aspiración de médula ósea de 13 G.
NOTA: Implante un volumen total de 8 mm3 dividido uniformemente a ambos lados del flanco.
4. Etiquetado y enriquecimiento de tumores etiquetados con luciferasa
- Mida el crecimiento del tumor cada dos semanas con una pinza digital.
- A 1 cm de diámetro, tumor transducto. Inyectar directamente en el tumor con una sola dosis de Luc/proteína fluorescente roja (RFP)-lentivirus (50 l/tumor, dilución 1:30 a partir de un bote concentrado de lentivirus de alta titer) utilizando una jeringa de 1 cc con una aguja de 27 G.
NOTA: El tumor del paciente normalmente alcanza 1 cm de diámetro en 1 x 2 meses. Sin embargo, la tasa de crecimiento es extremadamente variable y se basa en una serie de factores, incluyendo el grado y el tipo de tumor. - Supervise el tumor semanalmente mediante imágenes bioluminiscentes (BLI) en animales vivos.
- Pesa los ratones. Inyectar ratón consciente con 150 mg/kg de luciferina por vía intraperitoneal y esperar 5 minutos para que el sustrato circule en el cuerpo del ratón.
- Anestetizar el ratón con 2,5% de isoflurano en 100% de oxígeno, 1 L/min en una cámara de inducción.
- Coloque el ratón sobre el estómago en una máquina de imágenes BLI con el flujo de isoflurano y la imagen. Tome imágenes secuenciales para confirmar la presencia de regiones tumorales positivas Luc/RFP (imagen bioluminiscente de color falso). Devuelva el ratón a la jaula después de que se complete la toma de imágenes.
5. Seleccione la porción apropiada del tumor para la digestión enzimática
- El día del procedimiento UCC o CRC, el ratón de la imagen con la luciferasa etiqueta el tumor como en los pasos 4.3.1-4.3.3.
NOTA: El tiempo para que el tumor subcutáneo crezca depende de la velocidad de crecimiento del tumor y del número planificado de animales que se inyectarán en el experimento. - Cosecha el tumor del flanco del ratón y la imagen.
- Euthanizar el ratón por inhalación de CO2 después de la toma de imágenes. Coloque el ratón en la cámara de CO2, encienda el gas a 1,4 L/min hasta que se detenga la vía respiratoria y déjelo encendido durante 3 minutos.
- Limpie la piel con 70% de etanol. Piel de tienda directamente sobre el tumor. Con tijeras quirúrgicas hacer una pequeña incisión en la piel. Separe la piel del tumor con tijeras.
- Retire el tumor y colóquelo en un petri-dish estéril. Imagen de todo el plato en una máquina de imágenes.
- Utilice tijeras estériles o bisturí para separar las secciones negativas de luciferasa de las secciones positivas de luciferasa en el tumor y volver a crear una imagen.
- Repita hasta que solo queden la mayoría de las piezas tumorales altamente positivas.
6. Digestión enzimática del tumor
- Bajo la campana de flujo laminar, mince luciferasa piezas tumorales positivas (paso 5.4) en las piezas más pequeñas posibles utilizando tijeras quirúrgicas estériles y ponerlas en un tubo cónico estéril de 50 ml.
NOTA: La picadura del tumor en las piezas más pequeñas posibles producirá más células individuales. - Preparar la solución digestiva añadiendo 10 ml de colagenasa IV (1,5 mg/ml), 80 ml de hialuronidasa (20 mg/ml) y 160 ml de desoxirribonuclea I (0,1 mg/ml) a 40 ml de HBSS. Mezclar la solución invirtiendo.
- Añadir 35 a 40 ml de la solución digestiva al tumor picado. Incubar a 37oC con rotación continua durante 2 h.
NOTA: Agitar vigorosamente el tubo periódicamente durante la incubación para evitar que el tejido tumoral se agrupe. - Filtrar toda la digestión a través de un colador celular estéril de 100 m seguido de un colador de células de 40 m para eliminar los desechos. Guarde el flujo y deseche los desechos.
- Lave las células libres añadiendo 20 ml de HBSS y centrífuga a 329 x g durante 5 min. Apiratee el sobrenadante y resuspende el pellet en 30 ml de HBSS.
- Combine 10 ml de solución celular y 90 ml de trippan azul en un solo pozo de una placa de 96 pocillos. Cuente las células vivas usando un hemacitómetro.
- Transfiera 1 x 104 a 1 x 106 células tumorales por ratón a un tubo cónico estéril de 15 ml. Agregue 3 x 105 células HK del paso 1.2.3 por ratón, al mismo tubo con células tumorales.
NOTA: Utilice un tubo cónico estéril de 50 ml si el volumen total supera los 15 ml. Calcule siempre más dosis para animales adicionales por grupo de estudio para tener en cuenta la pérdida de líquido durante el uso de la jeringa. Por ejemplo, si un grupo contiene 5 ratones, haga suficientes células para 6 o 7 ratones. - Centrífuga a 329 x g durante 5 min. Deseche el sobrenadante ya sea aspirando o pipeteando.
- Resuspenda las celdas en 50 s por ratón para el modelo UCC o 10 s por ratón para el modelo CRC en medios RPMI completos. Mantenga la suspensión celular sobre hielo hasta que esté lista para su uso.
7. Modelo de ratón UCC
- Preparación de ratones para el procedimiento
- Obtenga un ratón NOD/SCID femenino de seis a ocho semanas de edad. Afeitar la parte inferior de la espalda del ratón usando crema de depilación. Anestetizar el ratón en una cámara de inducción con isoflurano (2,5% en 100% de oxígeno, 1 L/min).
- Una vez sedado, coloque el ratón en posición supina con su hocido en un cono de nariz de isoflurano y la espalda desnuda firmemente puesta a tierra sobre un electrodo dispersivo.
NOTA: El ratón está completamente sedado si no responde al pellizco del dedo del pecho.
- Inculcar células UCC preparadas en el paso 6.9 a la vejiga usando un angiocatéter (Figura1Aa, Ab).
- Configure una máquina de electrocauterización monopolar y ajuste a una potencia de 4 W. Lubricar un angiocatéter estéril de 24 G con gelatina lubricante e insertara a través de la uretra del ratón hembra.
NOTA: Se puede sentir una ligera resistencia. Empuje suavemente hacia adelante o retire el angiocatéter y repita. No fuerces. Si el catéter se dobla al entrar, inserte un cable guía estéril (ver 7.2.2) hasta la mitad del catéter para proporcionar estabilidad. - Inserte completamente el cable guía recto de núcleo fijo de 0.025" 1 mm más allá del extremo del angiocatéter.
NOTA: El cable está marcado con cinta adhesiva antes del procedimiento para indicar el punto de parada de 1 mm y asegurar la consistencia. - Sujete el pasador monopolar al cable guía durante 1 s permitiendo la irritación eléctrica de la mucosa de la vejiga.
- Fije un angiocatéter estéril fresco a la jeringa de 1 cc de luer-lok y extraiga 200 ml de células recogidas del paso 6.9.
NOTA: Se pierden al menos 100 ml del angiocatéter en la jeringa. Compensar el volumen de pérdida al calcular el volumen de la suspensión de la célula necesaria. - Retire el alambre guía y el angiocatéter de la uretra del ratón. Inserte el angiocatéter con la jeringa de las células unidas a la uretra.
NOTA: El avance debe ser más fácil que antes. - Inculcar 50 s de células a la vejiga del ratón. Espere unos segundos antes de extraer el angiocatéter para permitir que las células se adhieran a la pared de la vejiga.
NOTA: Las células permanecen en la vejiga y se convierten en un tumor primario.
- Configure una máquina de electrocauterización monopolar y ajuste a una potencia de 4 W. Lubricar un angiocatéter estéril de 24 G con gelatina lubricante e insertara a través de la uretra del ratón hembra.
- Retire el ratón del cono de la nariz de isoflurano y de la almohadilla de puesta a tierra. Observe el ratón durante 1 h el siguiente procedimiento. Busque signos de angustia, es decir, espalda encorvada, respiración trabajada, etc.
8. Modelo de ratón CRC
- Anestetizar de seis a ocho semanas de edad ratón NOD/SCID con isoflurano (2,5% en 100% oxígeno, 1 L/min) en la cámara de inducción. Confirme la sedación con un pellizco del dedo del dedo del dedo del dedo del sol.
- Coloque el ratón anestesiado en posición supina bajo un microscopio de disección, asegurándose de fijar su hocico a una nosecona de isoflurano y asegurar sus extremidades delanteras con cinta adhesiva para mayor estabilidad.
NOTA: Se pueden utilizar las ledas en lugar de un microscopio de disección. Un objeto pequeño se puede utilizar para mejorar la visibilidad y el ángulo cuando se coloca debajo de la base de la cola, elevando el ano. Típicamente, pequeñas secciones de gasa se enrollan en una forma de cilindro de 1 pulgada de diámetro. - Dilatar el canal anal con fórceps con puntas romas lubricadas curvadas para exponer la mucosa anal y rectal distal. Retire las heces.
- Utilice una aguja estéril extraíble de 30 G en una jeringa de vidrio de 50 ml para inyectar 10 ml de células tumorales y de HK (del paso 6.9) en la submucosa rectal distal de 1 a 2 mm por encima del canal anal. El bisel de la aguja debe estar cubierto por la mucosa. Tenga cuidado de no pasar a la cavidad pélvica.
- Retire el ratón del cono de la nariz de isoflurano. Observe el ratón durante 1 h el siguiente procedimiento. Busque signos de angustia, es decir, espalda encorvada, respiración trabajada, etc.
9. Imágenes bioluminiscentes
- Supervise semanalmente la carga metastásica primaria del tumor, el hígado y los pulmones utilizando un sistema de imágenes bioluminiscente para la actividad de la luciferasa.
- Obtenga un ratón de UCC o CRC experimento y pese. Inyectar 150 mg/kg de luciferina por vía intraperitoneal y esperar 5 minutos a que el sustrato circule en el cuerpo del ratón.
- Ratón anestetiza con 2,5% de isoflurano en 100% de oxígeno, 1 L/min en la cámara de inducción.
- Coloque el ratón en la máquina BLI Imaging con la nariz fijada en nosecone. Al exponer la imagen, asegúrese de que el área de interés esté orientada hacia la cámara. Para la inyección UCC y CRC, el lado ventral debe estar frente a la cámara para cada imagen. Ratón de imagen en posición supina.
10. Recolectordes órganos y tumores
- Cuando el resplandor de luminiscencia tumoral primaria alcanza 1 x 1011 fotones o si los ratones presentan signos de angustia (es decir, pérdida de peso, encorvado, respiración dura/trabajada, etc.), eutanasia ratones por inhalación de CO2 (como en el paso 5.2.1) después de la luciferina inyección e imágenes de todo el cuerpo.
- Retire el hígado y el pulmón, colóquelo en una placa de petri y la imagen para identificar cualquier metástasis. Retire el tumor, pese e imagen. Fijar órganos y tumores en una formalina tamponada neutra al 10% durante 48 h a temperatura ambiente.
NOTA: Limpie/limpie las tijeras y los fórceps entre cada órgano para evitar la transferencia de tejido.
11. Evaluación histológica
- Incruste los tejidos fijos de formalina en la parafina y corte los tejidos a 5 m de espesor en un microtome para la hematoxilina y la eosina (H&E) y la tinción inmunohistoquímica (IHC).
NOTA: Todas las manchas de H&E de diapositivas de parafina se realizaron en el laboratorio de patología del sistema de salud Ochsner, y toda la tinción de IHC en este artículo se realizó en un laboratorio de investigación de Ochsner Health System después de la recuperación de antígenos a alta temperatura usando Ki67 y anticuerpos de citoqueratina 20, seguidos de anticuerpos secundarios biotinylados, y complejos de aviina-biotina-peroxidasa según las instrucciones del fabricante13,17.
Resultados
En el modelo DE DOP UCC, las células BlCaPt15 o BlCaPt37 de los pacientes UCC fueron inculcadas intravesicamente (IB) en presencia de células HK en la vejiga de ratón NOD/SCID femenina (Figura1A). Veinticinco de los treinta (83,3%) los animales generaron tumores primarios y mostraron un crecimiento de tumores primarios dependientes del tiempo basado en BLI semanal (Figura1B,C y Tabla1). Del mismo modo, en el modelo CRC PDOX, 31 de 32 (96,9%) ratones crecieron tumor primario cuando se inyectó intrarectalmente (IR) con células CoCaPt155 o CoCaPt302 de los pacientes más células HK (Figura1D-F y Tabla 1). Dependiendo del tumor del paciente, el crecimiento del tumor de ratón tuvo un período de latencia diferente, que refleja la diferencia en las características clínicas del paciente (Figura1C,F).
En los modelos de IB e IR, la inyección de células tumorales no sólo generó tumores primarios ortotópicos (Figura2A,B, flechas azules), sino que muchos ratones probados también desarrollaron metástasis hepáticas y/o pulmonares. En 10 de 30 (33,3%) y 17 de 32 (53,1%) ratones inculcados con células UCC y células CRC con células HK, respectivamente, detectamos metástasis de órganos distantes a través de EX vivo BLI (Figura2A,B y Tabla1).
Para confirmar la morfología de los tejidos similares, se realizaron tinciones de H&E e IHC comparando xenoinjertos y tumores primarios de pacientes. La histopatología del carcinoma de vejiga paciente se mantuvo en xenoinjertos de BlCaPt15 y BlCaPt37 (Figura3A). Los resultados muestran un tumor de xenoinjerto correspondiente al patrón de crecimiento muscular invasivo de los tumores primarios de los pacientes. El anticuerpo específico del marcador de proliferación celular humana Ki67 se utilizó en IHC. La tinción nuclear positiva ki67 indica células tumorales humanas altamente proliferativas y de rápido crecimiento. Los resultados de tinción de los xenoinjertos fueron similares a los de las biopsias quirúrgicas originales. Del mismo modo, en el modelo IR, la tinción de H&E indica la similitud de la arquitectura entre los xenoinjertos y los tumores de pacientes de CoCaPt155 y CoCaPt302. El uso de IHC contra la citoqueratina 20 también mostró un patrón de crecimiento tumoral similar en ambos modelos de PDOX (Figura3B). Por lo tanto, nuestro modelo PDOX recapitula la progresión clínica del paciente UCC y CRC.
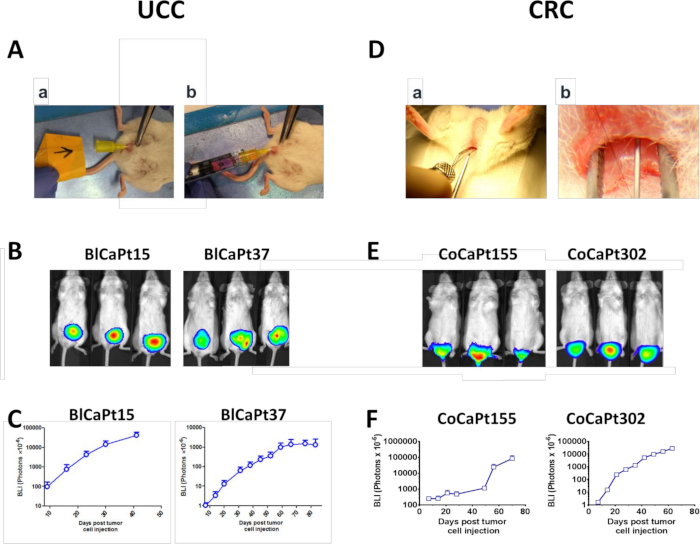
Figura 1: Modelos de ratón Orthotopic UCC y CRC. (A-C) Instilación intravesícula (IB) de células UCC en la vejiga del ratón13. (Aa) Se insertó un angiocatéter en la vejiga de un ratón NOD/SCID femenino y se aplicó un choque electrocauterio a la pared de la vejiga a través de un cable guía. (Ab) Luciferase etiquetó células tumorales UCC, BlCaPt15 (2 x 104 células), o BlCaPt37 (5 x 105 células) con la adición de 3 x 105 Células de HK estromales LN, se inculcaron en la vejiga del ratón NOD/SCID a través del angiocatéter. (D-F) Inyección intrarectal (IR) de células CRC en la capa de tejido submucoso del recto del ratón17. (D) El canal anal se desveló con fórceps de puntas romas lubricadas para permitir el acceso a la mucosa anal y rectal distal y se insertó una aguja de 30 G en la submucosa rectal rectal distal 1 x 2 mm por encima del canal anal hasta que el bisel estaba cubierto antes de que la inyección tiene lugar. Luciferase etiquetó células tumorales CRC, CoCaPt155 (5 x 105 células), o CoCaPt302 (1 x 104 células) con la adición de 3 x 105 células HK se inyectaron. La carga tumoral se controló y cuantificó mediante imágenes bioluminiscentes (BLI; B y E). El crecimiento tumoral de las células UCC o CRC etiquetadas con etiqueta UCC o CRC fue monitoreado cinéticamente a través de BLI y analizado usando software de análisis de imágenes (C y F). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Los modelos PDOX producen metástasis espontáneas de órganos distantes. Ratones representativos (paneles superiores) de los mismos experimentos que en la Figura1, por ejemplo, inculcaron intravesically con luciferasse etiquetadas células tumorales UCC, células BlCaPt15 o BlCaPt37 con células HK (A) o intrarectalmente con luciferasa etiquetada tumor CRC células CoCaPt155 o CoCaPt302 con células HK (B). Las flechas amarillas indican la vejiga del ratón (A). Las fotos tomadas en el momento del sacrificio indican la formación de tumores ortotópicos (flechas azules). Hígado, pulmón y tumor (paneles medios) recogidos en la necropsia y su EX vivo BLI (paneles inferiores) mostraron metástasis pulmonar y hepática de ratón, así como tumor con actividad luciferasa. Haga clic aquí para ver una versión más grande de esta figura.
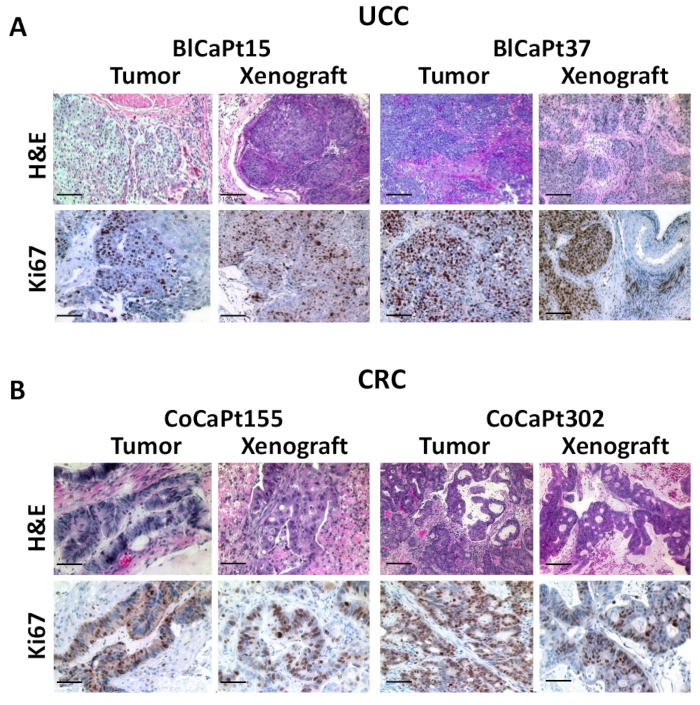
Figura 3: Los tumores de xenoinjerto se asemejan a los tumores preimplantacionales del paciente. El tejido tumoral incrustado de parafina del tumor del paciente o los tumores recogidos de ratones en los mismos experimentos que en la Figura 1 fueron seccionados y manchados por H&E (A y B)o IHC con anticuerpos contra Ki67 (A) humano o citoqueratina 20 (CK20; B). El color marrón indica una tinción positiva. La tinción de H&E muestra nidos tumorales disecándose en haces musculares lisos (A). Las fotografías fueron tomadas utilizando un microscopio desconvolución digital y analizadas con un software de análisis de imágenes. Barras de escala: 100 m. Todas las imágenes fueron tomadas en aumento original de 200o. Haga clic aquí para ver una versión más grande de esta figura.
| Implante tumoral (%) | Metástasis pulmonar/hepática (%) | Mortalidad (%) | |
| UCC, n.o 30 | 83.3 | 33.3 | 0 |
| CRC, n.o 32 | 96.9 | 53.1 | 0 |
Tabla 1: Resumen de la formación de tumores, metástasis y mortalidad en modelos IB e IR.
Discusión
La enfermedad metastásica es responsable de la mayoría de las muertes de pacientes con cáncer. En las pruebas terapéuticas preclínicas, es crucial establecer modelos de ratón que emulen más de cerca el crecimiento tumoral humano con metástasis espontáneas de órganos distantes. El uso de modelos murinos con células cancerosas derivadas de tumores de pacientes implantados (xenoinjertos) permite una mejor comprensión de la biología tumoral y biomarcadores predictivos, así como pruebas y predicción de los efectos antineoplásicos de las nuevas terapias18. Muchos modelos se han utilizado para mostrar metástasis UCC y CRC en experimentos murinos, tales como inyecciones intravenosas de venas de cola que muestran la capacidad de producir enfermedad pulmonar19 o implantación subcutánea de células tumorales o fragmentos tumorales en el flanco para crecimiento tumoral localizado20,21. Un laboratorio informó previamente de un modelo de murino de cáncer de vejiga mediante el uso de tratamientos de ácido clorhídrico para promover con éxito la utilización del tumor22. Si bien estos métodos producen un crecimiento local fiable y pueden demostrar algunas actividades metastásicas, no se asemejan específicamente al curso natural del cáncer desarrollado en los seres humanos y no utilizan el mecanismo metastásico visto en los pacientes18, 23. Otros modelos murinos fueron reportados para imitar el crecimiento tumoral mediante la inyección de células tumorales directamente en órganos como el hígado o la mesentería, pero que llevaban riesgos de fuga de células tumorales y no produjeron metástasis significativas.
Hemos demostrado previamente la correlación entre el contenido de células cancerosas en el tumor primario y la afectación de LN24 y el papel de la interacción estromas de células cancerosas/LN en el curso de la progresión del tumor primario a la enfermedad metastásica10 , 12 , 17. Incorporando nuestro trabajo anterior sobre la influencia del microambiente estromal LN en la progresión metastásica, establecimos modelos ortotópicos (especialmente los modelos DoX) que imitan el curso natural de la diseminación metastásica, son técnicamente reproducible, preservar la heterogeneidad de los tumores originales del paciente, y generar resultados constantes de tumores primarios y metastásicos12,13,17. El uso de los efectos que mejoran el tumor del microambiente estromal LN es importante porque proporciona un microambiente tumoral similar en UCC humano y CRC, desarrolla todos los pasos en la cascada metastásica, reduce el número de células cancerosas requeridoen en el modelo de ratón que minimiza el número de pasajes de xenoinjertos, y da como resultado un modelo confiable que imita de cerca el crecimiento del tumor y las metástasis en humanos.
Hemos establecido un método único de electroestimulación del IB utilizando la co-instilación de células HK que produce un modelo confiable para el desarrollo de MIUCC. Nuestro modelo imita el curso natural de la progresión UCC por implantación tumoral a partir de la mucosa, que conduce al músculo, luego hace metástasis a los pulmones13.
Nuestros resultados también muestran que el modelo IR es seguro, reproducible y exitoso. El modelo de ratón toortópico CRC presenta crecimiento tumoral primario y metástasis distante espontánea12,17. El procedimiento de infrarrojos es rápido, fácil de aprender, técnicamente fácil de realizar y no demasiado estresante para los animales. Los grupos IB e IRtuvieron cero mortalidad (Tabla 1) en el período postoperatorio antes de la medición final de LA BLI. Sin embargo, la técnica requiere práctica. Si la inyección intrarectal es exitosa, debe haber una "burbuja" visible que se forma a medida que el líquido se introduce en la submucosa rectal y dará lugar a un crecimiento del tumor primario que eventualmente se volverá palpable como se muestra en la Figura1. Si el tumor se ha inyectado demasiado profundamente en la cavidad pélvica, no se unirá al tracto colorrectal y crece muy grande para llenar la pelvis, a veces causando obstrucción. Si la inyección es demasiado superficial o no entra en la capa submucosa rectal en absoluto, se filtrará, lo que resultará en una carga tumoral primaria reducida o ausente.
Hemos establecido modelos PDOX únicos y reproducibles para HG-UCC y CRC humanos. Estos modelos permiten la formación de tumores y estudios de metástasis. Ahora podemos utilizar estos modelos como el método principal para seguir estudiando el microambiente estromal LN y su interacción con los tumores primarios del paciente. Estos modelos también nos permitirán investigar terapias que interfieren con los efectos pro-tumorigénicos del LNSC en el tumor primario. Con estos modelos, las pruebas de nuevos fármacos terapéuticos se pueden realizar de manera eficiente y de manera clínica-mimética.
Divulgaciones
Este estudio fue parcialmente apoyado por la Ochsner Translational Medicine Research Initiative Grant 2014. Los autores no declaran conflicto de intereses.
Agradecimientos
Los autores agradecen a Brian Reuter, Danielle Bertoni, Peter Miller y Shannon McChesney que ayudaron a iniciar estos estudios por su excelente apoyo técnico. Los autores también agradecen a Heather Green Matrana, Margaret Variano, Sunil Talwar y Maria Latsis por su ayuda en pacientes consentidos y en el suministro de especímenes tumorales.
Materiales
| Name | Company | Catalog Number | Comments |
| Avidin-biotin-peroxidase | Vector Labs Inc | PK-6100 | |
| Biotinylated secondary antibody | Vector Labs Inc | BA-1000 | |
| Collagenase IV (1.5 mg/mL) | Worthington Biochemical Corporation | LS004189 | |
| Deoxyribonuclease I (0.1 mg/mL) | Sigma | D4263 | |
| D-Luciferin (150 mg/kg) | Perkin Elmer | 122796 | |
| Formalin (10% neutral buffered) | Leica | 46129 | |
| glutamine (2 nM) | Fisher Scientific | 35050061 | |
| Hair Removal Cream | Church & Dwight Co., Inc | 1 (800) 248-8820 | |
| Hanks Balanced Salt Solution (HBSS) | Fisher Scientific | SH30016.02 | |
| Hyaluronidase (20 mg/mL) | Sigma | H3884 | |
| Isoflurane | Henry Schein Animal Health | 108333 | |
| Luc/RFP-lentivirus | From our collaborators. See reference 13: Gills, J. et al. A patient-derived orthotopic xenograft model enabling human high-grade urothelial cell carcinoma of the bladder tumor implantation, growth, angiogenesis, and metastasis. Oncotarget. 9, 32718-32729, doi:10.18632/oncotarget.26024 (2018). | ||
| McCoy’s medium | Life Technologies | 110862 | |
| penicillin/streptomycin 100 mL (100 U/mL) | Fisher Scientific | 15140-122 | |
| RPMI-1640 Medium | American Type Culture Collection | 110636 | |
| Trypan Blue | Sigma | T6146 | |
| Trypsin/EDTA | Life Technologies | 15400-054 | |
| Name | Company | Catalog Number | Comments |
| Gas | |||
| 100% Oxygen | Airgas Inc | OX USP200 | |
| 100% CO2 | Airgas Inc | CD USPE | |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| 6-8 week old NOD/SCID Mice (male) | Jackson Lab | 001303 | |
| 6-8 week old NOD/SCID Mice (female) | Jackson Lab | 001303 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Hematoxylin | Sigma | GHS232 | |
| Ki-67 Rabbit Monoclonal Antibody | Thermo Scientific | RM-9106-S | |
| Name | Company | Catalog Number | Comments |
| Tools | |||
| 40 µm cell strainer | Fisher Scientific | 08-771-1 | |
| 100 µm cell strainer | Fisher Scientific | 08-771-19 | |
| 15 mL Conical Tube | Sarstedt | 11799 | |
| 50 mL Conical tube | Sarstedt | 15762 | |
| 150 mm Tissue Culture Dish | USA Scientific Inc | CC7682-3614 | |
| 96 Well plate | USA Scientific Inc | CC7682-7596 | |
| Forceps | Symmetry Surgical Inc | 06-0011 | |
| Surgical scissors | Symmetry Surgical Inc | 02-2011 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 5% CO2 humidified incubator | Thermo Scientific | 3110 | |
| Bioluminescent (BLI) Imaging Machine | Perkin Elmer | CLS136334 | |
| BLI Imaging Machine Software | Perkin Elmer | CLS136334 | |
| Centrifuge | Beckman | 366830 | |
| Deconvoluting Microscope | Intelligent Imaging Innovations | Marianas | |
| Deconvoluting Microscope Imaging Software | Intelligent Imaging Innovations | +1 (303) 607-9429 x1 | |
| Digital caliper | Fowler Tools and Instruments | 54-115-330 | |
| Dissecting microscope | Precision Instruments LLC | (504) 228-0076 | |
| Electrosurgical generator | ValleyLab | FORCE1C20 | |
| Isoflurane Induction Chamber | Perkin Elmer | 119038 | |
| Microtome | American Optical Corporation | 829 | |
| Pipet Aid | Fisher Healthcare | 13-681-15E | |
| Serological pipet (10 mL) | Sarstedt | 86.1254.001 |
Referencias
- Sundlisaeter, E., et al. Lymphangiogenesis in colorectal cancer--prognostic and therapeutic aspects. International Journal of Cancer. Journal international du cancer. 121, 1401-1409 (2007).
- Gout, S., Huot, J. Role of cancer microenvironment in metastasis: focus on colon cancer. Cancer Microenvironment. 1, 69-83 (2008).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: a Cancer Journal for Clinicians. 68, 7-30 (2018).
- Hautmann, R. E., de Petriconi, R. C., Pfeiffer, C., Volkmer, B. G. Radical cystectomy for urothelial carcinoma of the bladder without neoadjuvant or adjuvant therapy: long-term results in 1100 patients. European Urology. 61, 1039-1047 (2012).
- Stein, J. P., et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. Journal of Clinical Oncology. 19, 666-675 (2001).
- Lerner, S. P., et al. The rationale for en bloc pelvic lymph node dissection for bladder cancer patients with nodal metastases: long-term results. The Journal of Urology. 149, 758-764 (1993).
- Poulsen, A. L., Horn, T., Steven, K. Radical cystectomy: extending the limits of pelvic lymph node dissection improves survival for patients with bladder cancer confined to the bladder wall. The Journal of Urology. 160, 2015-2019 (2020).
- Margolin, D. A., et al. Lymph node stromal cells enhance drug-resistant colon cancer cell tumor formation through SDF-1alpha/CXCR4 paracrine signaling. Neoplasia. 13, 874-886 (2011).
- Vermeulen, L., et al. Wnt activity defines colon cancer stem cells and is regulated by the microenvironment. Nature Cell Biology. 12, 468-476 (2010).
- Margolin, D. A., et al. The critical roles of tumor-initiating cells and the lymph node stromal microenvironment in human colorectal cancer extranodal metastasis using a unique humanized orthotopic mouse model. FASEB Journal. 29, 3571-3581 (2015).
- Gills, J., et al. A patient-derived orthotopic xenograft model enabling human high-grade urothelial cell carcinoma of the bladder tumor implantation, growth, angiogenesis, and metastasis. Oncotarget. 9, 32718-32729 (2018).
- Hidalgo, M., et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discovery. 4, 998-1013 (2014).
- Hiroshima, Y., et al. Patient-derived mouse models of cancer need to be orthotopic in order to evaluate targeted anti-metastatic therapy. Oncotarget. 7, 71696-71702 (2016).
- Kim, H. S., Zhang, X., Klyushnenkova, E., Choi, Y. S. Stimulation of germinal center B lymphocyte proliferation by an FDC-like cell line, HK. The Journal of Immunology. 155, 1101-1109 (1995).
- Hite, N., et al. An Optimal Orthotopic Mouse Model for Human Colorectal Cancer Primary Tumor Growth and Spontaneous Metastasis. Diseases of the Colon and Rectum. 61, 698-705 (2018).
- Jager, W., et al. Ultrasound-guided intramural inoculation of orthotopic bladder cancer xenografts: a novel high-precision approach. PloS One. 8, e59536 (2013).
- Schirner, M., et al. Integrin alpha5beta1: a potent inhibitor of experimental lung metastasis. Clinical & Experimental Metastasis. 16, 427-435 (1998).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445, 111-115 (2007).
- Todaro, M., et al. Colon cancer stem cells dictate tumor growth and resist cell death by production of interleukin-4. Cell Stem Cell. 1, 389-402 (2007).
- Lee, J. S., et al. Tumor establishment features of orthotopic murine bladder cancer models. Korean Journal of Urology. 53, 396-400 (2012).
- Hadaschik, B. A., et al. A validated mouse model for orthotopic bladder cancer using transurethral tumour inoculation and bioluminescence imaging. BJU International. 100, 1377-1384 (2007).
- Silinsky, J., et al. CD 133+ and CXCR4+ colon cancer cells as a marker for lymph node metastasis. The Journal of Surgical Research. 185, 113-118 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados