Method Article
In Vitro 逆に HIV 転写、スプライシングのエージェントの待機時間の高スループット
要約
HIV の効率的な再活性化の機能評価および潜在的な proviruses のクリアランスのための高いスループット プロトコル説明および HIV 転写の介入の影響をテストおよび選択的スプライシングによって適用しました。LTR 駆動の転写に対するエージェントの逆転と融着接続の遅延の効果の代表的な結果を提供しています。
要約
Hiv 感染細胞の貯水池、港湾の免疫システムには見えないままで、現在の抗レトロ ウイルス療法 (カート) では対象にならないウイルスの安定性と潜在的なフォームの存在により不治のまま。転写・ スプライシングは、静止 cd4 陽性 T 細胞の hiv-1 潜伏を補強するために示されています。「衝撃と殺す」アプローチにおける待機時間逆転剤 (LRAs) の使用による潜時の逆転この貯水池をパージする試みで広く研究されているが、ない十分な小型の開発の欠乏のための臨床試験にも成功を示しているこれまでのところ分子を効率的にこの貯水池を混乱させることができます。ここで提示されたプロトコルは、確実かつ効率的に HIV 転写待ち時間逆転エージェント (LRAs) の評価と選択的スプライシングのメソッドを提供します。このアプローチは、フローサイトメトリーによる転写、スプライシング、LRA の効果を同時に測定することができます LTR 駆動のデュアル カラー記者の使用に基づいています。ここで説明されているプロトコルは付着性のセルとして懸濁液の細胞に適しています。高スループットのシステムで多数の薬をテストするために便利です。シンプルに実装してコスト効果の高い方法は技術的にあります。また、フローサイトメトリーの使用セル実行可能性の評価を可能にし従って同時に毒性の薬物。
概要
効果的な長期的な抗レトロ ウイルス療法にもかかわらず HIV は潜伏状態でメモリー cd4 陽性 T 細胞1の統合 provirus として保持します。HIV 1 5 のクロマチン構造 ' 長いターミナル繰り返し (方向 LTR) のプロモーターとエピジェネティック修飾ヒストンのメチル化、脱アセチル化ヒストン脱アセチル化酵素 (HDAC) し、DNA メチル基転移酵素 (DNMT) などにつながる重要なメカニズムは、転写抑制およびこうして統合後待機時間2,3。In vitro におけるウイルス産生を誘導するため待機時間逆転エージェント (LRAs) の大きい変化を調べたし、から生体内で潜在感染休憩 cd4 陽性 T 細胞4,5,6,7 ,8。LRAs 間テスト、HDACi (HDAC の抑制剤)、ベット ブロモ ドメイン阻害剤 (ベティス) クロマチン decondensation と正の転写伸長因子 b (P TEFb) のリリースをそれぞれ誘導する、転写の緩和以降につながる5' LTR の抑圧と HIV 式9,10、11,12,13の活性化。ただし、ex vivo14,15だけ細胞の, HIV mRNA (米国 RNA)、ウイルスの転写を示すものの緩やかな増加がみられたように、これら LRAs により再活性化量は限られていた。重要なは、これら LRAs も潜伏感染細胞の頻度の低下を誘導するために失敗しました。
HIV 式は、スプライシングは、乗算の HIV RNA (MS RNA)17の核外輸送の欠陥と同様、非能率的なスプライシング16によってさらに制限があります。したがってより強力なウイルス生産統合後の異なる側面に影響を与えることができます LRAs の識別の新しいクラスが必要です。さらに、効率的に待機時間を逆に最適な化合物の定義に役立つ新規アッセイの開発が必要です。
ここでは、プロトコルが表示され、HIV LTR 駆動転写、スプライシングの介入の影響の機能評価のための高スループット アプローチを利用します。簡単に言えば、新しい LTR 駆動のデュアル レポーター システム pLTR.gp140/EGFP を色します。RevΔ38/下流 (図 1) は、フローサイトメトリーによって hiv 感染の再活性化を評価するために使用されます。スプライシングは、mRNA (2 kb) の式はDiscosoma の sp赤 (下流) の蛍光蛋白質の表現につながるこの蛍光レポーターで, HIV mRNA (4 kb) の発現は強化された緑の蛍光蛋白質 (EGFP) 式に します。簡単に言えば、蛍光の Env EGFP の融合蛋白質は、gp140unc を使用しました。EGFP、EGFP のコーディング シーケンスが封筒 (Env) の非劈開と切り捨てられた形でフレームに配置された場所。Gp120 と gp41 EGFP、Env の解離を防ぐ胸の谷間サイトをアブレーションする可溶性の Env のアナログは、正しい折り畳みが容易になりますを作成する膜貫通ドメイン前 gp160 タンパク質を切り捨てるため、変更が導入されたとEGFP の発現。それが 4 kb のenvの核細胞質の輸出を仲介する核に局在する Rev セル内の式、時 rev 応答要素 (RRE) との相互作用を介して mRNA。Env の切り捨て gp120 と gp41、A7 3' スプライス部位のある RRE 妥協をしません。このシステムは、HIV - 1 選択的スプライシング ドナー 4 (SD4) をスプライスし、スプライスの受容体 7 (SA7) 結果は 2 kb の mRNA Rev の非機能性タンパク質アミノ酸 38 で切り捨てをエンコード融合した DsRed 蛍光蛋白質、RevΔ38 下流に。簡単に言えば、下流は重複延長18アミノ酸 38 で Rev の 2ndエクソンに挿入されました。MRNA の核輸出を容易にするには、エンコード Rev (pCMV RevNL4.3) 哺乳類発現ベクターは蛍光レポーター構成 (図 2) と co transfected だった。ここで説明したこのユニークな記者のコンス トラクターは、HIV 転写とウイルスのベクトルを使用することがなく、スプライシングの高スループット評価に便利です。
プロトコル
注:クローン作成手順については、変換とシーケンスは、18,19を別の場所で説明します。本プロトコルは哺乳動物発現ベクター (図 3) の導入から開始します。
1. デュアル カラー記者と HEK293T 細胞のトランスフェクションを構築します。
- ダルベッコ変法イーグル培地 (DMEM) 10% (v/v) ウシ胎児血清 (FBS)、ペニシリン (100 U/mL)、37 ° C で 5% CO2インキュベーターでストレプトマイシン (100 μ g/mL) を添加した HEK293T 細胞を養う解凍後、トランスフェクションでそれらを使用する前に 2-3 回通過 HEK293T 細胞実験します。これは解凍の手順から回復する細胞の時間を与えるでしょう。
注意:細胞培養のマイコ プラズマ汚染深刻な問題として残っています。よい実験室の練習および細胞培養の定期試験は、マイコ プラズマ汚染のリスクを減らすし、拡散20を避けるために不可欠です。 - 1:2 1 日播種前にセルを分割し、新鮮な DMEM 培地にそれらを転送します。37 ° C で 5% CO2インキュベーターで 24 h の細胞を養う
- トランスフェクション、前日吸引によりフラスコからメディアを取り出して、ダルベッコ リン酸緩衝生理食塩水 (DPBS) ソリューションのカルシウム (Ca2 +) とマグネシウム (Mg2 +) 無料でセルを洗浄して血清のトレースを削除します。
- 培養容器にトリプシン-EDTA 溶液 (0.05% - PBS で 10 mM) 5 mL を分注、2 〜 5 分の 5% CO2インキュベーターで 37 ° c に置きます。
- セルを取り外したら、さらに細胞に損傷を与えるトリプシン活性を阻害する 10% (v/v) FBS 添加 DMEM の 5 mL を追加します。
- 上下を千切ってに細胞懸濁液をピペットで優しく再懸濁します。
- トリパン ブルー染色 (0.4%) で、セル 1:10 を希釈します。
- 占有しないトリパン ブルー顕微鏡 (対物レンズ 10 倍) と、haemocytometer を使用して生きているセルをカウントします。
- トリパン ブルー色素の希釈係数 (1:10) で染色し、細胞数の平均を取ることと、10,000 を掛け合わせることによって 1 ミリリットルあたりの生菌数を計算します。
- 2 x 10 の4セル 10 %dmem 培の 100 μ l をプレート 24 h の 96 ウェル平底プレートに抗生物質がない政府短期証券。
- 各ウェルの希釈 400 pLTR.gp140/EGFP の ng。RevD38/下流 20 pCMV RevNL4.3の 100 ng pCMV Tat101AD8の ng-50 μ L の血清の自由な媒体でフラグ DNA。優しく混ぜます。Tat なし実験、マッチの空 Tat ベクトル pcDNA3.1 (-) を使用します。
注:エンドトキシン フリーの DNA を使用することを強くお勧めします。そのため、midi や maxiprep 核酸精製キットを用いたエンドトキシン フリー DNA を準備します。1.7 と 1.9 間べき 260/280 OD の比率を測定することによって DNA の純度を決定します。 - 使用前に軽く脂質試薬をミックスし、50 μ L の血清の自由な媒体で 0.65 μ L を希釈します。穏やかに混合し、室温で 5 分間インキュベートします。
- 希薄化後の脂質試薬と希釈した DNA を組み合わせます。
- 穏やかに混合し、室温で 20 分間インキュベートします。曇り、ソリューションが表示されます。
注:1.15 のステップへ進みます。30 分以内 - セルの上に drop-wise 脂質試薬・ DNA 錯体のウェルあたり 100 μ L を分注します。
- ロッキング プレートを前後で軽く混ぜます。
-
37 ° C で 5% CO2加湿インキュベーターで 5 h 用プレートを孵化させなさい
- 各反作用の組合せは単一の井戸 (96 ウェル) の transfection のために十分です。量とピペッティング バリエーションのアカウントと薬と、テストされる組み合わせの数に従ってコンポーネントのボリュームを調整します。すべての条件は通常トリプリケートでテストされます。
- 100 追加の井戸を transfect 補償目的のための CMV 駆動の EGFP とした DsRed エクスプレス DNA プラスミドの ng。
2. Transfected HEK293T の治療細胞遅延剤を反転
注:各試験の前に細胞増殖アッセイと薬物の線量の高低に暴露後、細胞の生存率を測定することにより各 LRA の生理学的条件を決定します。
- 各 LRA 培地で適切な使用濃度に希釈 (例えば、 JQ1(+)) の 1 μ M。
注意:10 mM の濃度に適切な溶媒と凍結乾燥医薬品を再構築します。シングルユース因数 (各 5 μ L) 繰り返し凍結融解サイクルを避けるためにすべて株式 LRAs-80 ° c に格納します。 - 慎重にマルチ チャンネルでトランスフェクション培地を吸引し、100 μ L の培適切な LRA (表 1) に置き換えます。デタッチ transfected HEK293T 細胞培養プレート面から簡単にデタッチするのには知られているを避けるために井戸の壁と一緒に非常に優しく中を追加します。
- 37 ° C で 5% CO2加湿インキュベーターで 48 h 用プレートを孵化させなさい
3 フローサイトメトリー解析のため修正可能な生存染付 Transfected セルの染色
注意:死んだ細胞および残骸の取り外しは、偽陽性を排除し、最高品質の結果を得ることが不可欠です。
- 軽くピペッティング上下 (~ 5 回)、マルチ チャンネルとメディアの泡を回避しながら、ウェルあたりリン酸緩衝生理食塩水 (PBS) の 100 μ L を使用してメディアにセルをデタッチします。必要な場合は、トリプシン EDTA 溶液 (0.05% - PBS で 10 mM) の井戸あたり 35 μ L を使用し、血清を含む培地で中和前に 37 ° C で 5 分間の培養皿からセルをデタッチします。
- 96 ウェル V 底プレートにセルを転送します。
- 4 ° C で 500 × gで 5 分間細胞をスピンし、細胞に触れることがなく媒体/PBS を慎重に吸引します。
- セルを洗浄して 200 μ L の血清タンパク質/無料 PBS で少なくとも 1 時間。
- 4 ° C で 5 分間 500 × gで遠心分離し、プレートを傾斜およびセルに触れることがなく洗浄バッファーを削除して上澄みを廃棄します。
- タンパク質/血清無料 PBS で生存率染料 1: 1000 希釈することによって修正可能性色素の実用的なソリューションを準備します。50 μ L/ウェル希薄化後染色の準備をします。
注:性染料は、青、赤、紫のレーザーでの使用に適した色の範囲で利用できます。凍結乾燥の染料 (コンポーネント A) 50 μ L 無水 DMSO (コンポーネント B) の 1 つのバイアルを再修正可能性色素の原液を準備します。単一使用分注 (1 μ L 各)、-20 ° C でストアを光から保護。 - 希釈性色素の 50 μ L を各ウェルに追加し、マルチ チャンネルの上下にピペッティングにより細胞をミックスします。
- 光から保護、4 ° C で 10-15 分の汚れ。
- 洗浄バッファー (1% ウシ血清アルブミン、2 ミリメートルの EDTA と PBS) の 150 μ L で 1-2 回を洗ってください。
- 500 x gで 4 ° C で 5 分間遠心上清を捨てます。
- 暗闇の中で 4 ° C で 10-15 分の洗浄バッファーの作りたての 1% のホルムアルデヒドの 100 μ L でセルを固定します。
注意:ホルムアルデヒドは非常に有毒であります。手袋と保護のための安全メガネを着用しながら吸入を避けるために発煙のフード 1% ホルムアルデヒド溶液を準備します。 - 洗浄バッファーの 100 μ L に 1-2 回細胞を洗浄します。
- 500 x gで 4 ° C で 5 分間遠心上清を捨てます。
- 洗浄バッファーの 70 μ l 細胞ペレットを再懸濁します。
注:プロトコルはここで一時停止することができます。流れの cytometer で次の日分析のため暗闇の中で 4 ° C で固定セルを格納できます。
4. EGFP とした DsRed フローサイトメトリーとデータ解析による測定
注:流れの cytometer で HIV 転写 (EGFP %) と選択的スプライシング (% した DsRed) を分析します。70 μ m の細胞ストレーナーまたはノズル目詰まりを避けるために 100 μ m ナイロン メッシュを実行する前にサンプルをフィルター処理します。
- Cytometer とコンピューターが少なくとも起動ウォーム アップ レーザーをように使用する前に 10 分。
- サンプルを実行して、データ集録を開始、する前に 0.9% 食塩水で鞘タンクを記入し、廃棄物のタンクに次亜塩素酸ナトリウム タブレットが追加されていることを確認します。
- 空気の泡のためのフロー ・ セルを確認します。
- 探知器およびフィルターの実験に適していることを確認します。
注:EGFP、青色レーザーの使用 (488 nm) および 530/30 バンドパス、下流エクスプレスが黄色のレーザーを使用して検出された最適中 (561 nm) および 610/20 バンドパス。青色レーザー (488 nm)、610/20 帯域通過はした DsRed 発現を検出するも使用できます。 - キャリブレーション ビーズを実行することによって検出器全体の cytometer 性能と感度を確認します。
- 転送を調整 (FSC A) と側 (SSC-A) 散布電圧無染色、主要な人口が画面に表示されるサンプルと明確に識別できます。
注:FSC (前方散乱光)、光計測 SSC (側散乱の場合光)、セル (セル面積またはサイズ) のボリュームに依存する平らな角度に回折に比例している右の角度で光の回折の測定セルの粒度と内部の複雑さ。 - EGFP + した DsRed 検出器と逆に人口の波及を最小限を確保する単染色サンプルを使用して、手動または自動補正を実行します。
注意:補償目的のためには、それぞれ単独で修正可能性色素で染色細胞と同様、単一の色蛍光タンパク質を発現する細胞のサンプルを使用します。分光特性の異なるため EGFP と下流の蛍光タンパク質補償の FITC と PE の補償ビーズを使用しないでください。補正コントロールは、正と負の人口の解決に十分に明るいする必要があります。 - プロットの作成し、蛍光マイナス 1 つ (FMO) コントロールを使用してゲートを設定します。
- 取得し、サンプルあたりの 10,000 の生菌イベントの最小を記録します。レーザー迎撃を通過のダブレットを避けるために中または低速でサンプルを実行します。パルス ジオメトリ ゲートなどを使用して、SSC のダブレットを排除するために SSC H 対。安定性を確認 SSC A 対時間をプロットすることによって実行して、どのようにも流れが実行中にします。
- 実行の最後に、きれいに濃縮洗浄剤と流れの cytometry 流体工学、5 分のための水します。
- シャット ダウン システム、廃棄物を破棄し、再取得後鞘のタンクを埋めます。
- 流れ cytometry データ解析ソフトウェアを使用してデータを分析します。細胞の残骸や塊 (ダブレット) 前方と側面の散布図に基づく除外し、生存率染料染色を使用して死んだ細胞を排除する (負の人口生きているセルを =)。スプライシング製品下流の割合だけでなく、EGFP とした DsRed (図 4) を発現している細胞を識別する/(DsRed + EGFP) (図 5)。
- HIV 転写、スプライシング未処理細胞および個人または LRAs (図 5) の組み合わせにさらされる細胞を比較することによって、LRA の効果を決定します。
結果
HIV-1 の式 (EGFP), こさと次のブロモ ドメイン阻害剤 JQ1 による治療 (下流) 製品の代表的な結果は図 5のとおりです。JQ1(+) と Tat 大幅 EGFP を発現する細胞の割合を増加させた (DMSO を 2.18 と 4.13 FC それぞれ; n = 3), 成績証明書を示す。また、Tat と似たようなレベルにスプライシング製品 (DMSO 上 7.37 FC) の割合だけでなく、下流 (DMSO に 46.6 FC) を発現する細胞の割合の増加に大幅 JQ1(+) (59.6 と 5.83 FC、DMSO をそれぞれ) JQ1(+) の能力を確認します。HIV 転写、スプライシングに。その一方で、立体制御 JQ1(-) による治療は HIV 転写、スプライシング、プロトコルの成功を確認 JQ1(+) 効果を廃止します。
最近の出版物、RNA 解析 HIV の蓄積スプライス JQ1(+) 治療21以下の成績証明書で示されている.実際には、我々 のデータは、JQ1(+) によるこのモデルの EGFP とした DsRed 発現によってミラー化された, とスプライシングのトラン スクリプトのレベルで一貫した変更を明らかにしました。これらの結果は、EGFP とした DsRed 発現細胞が HIV 転写、スプライシングを誘導するブロモ ドメイン阻害剤 JQ1(+) の能力を反映することを示します。
要約すると、我々 は、pLTR.gp140/EGFP の使用を検証しました。HIV 1 転写、スプライシング LRAs の効果の評価のための高スループット セットアップ RevΔ38/した DsRed 記者。LRA または高められた毒性の最適量スカッドな結果をもたらします。細胞生存率を維持しながら使用される薬剤の量を最適化すると、結果の精度が向上します。
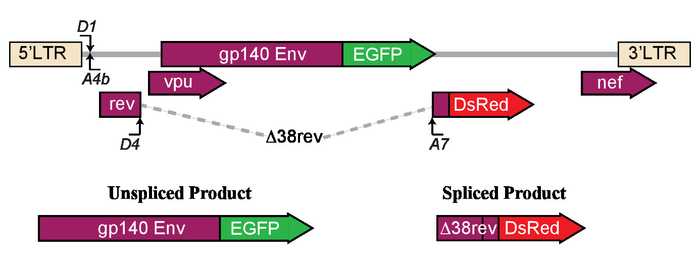
図 1: LTR 駆動の転写に対するエージェントの逆転と選択的スプライシング、レーテンシーの影響を決定するために使用するモデルの模式。いずれかの, 封筒 (Env) のタンパク質が融合した LTR 構造表現緑色蛍光タンパク質 (EGFP) を強化または下流の Δ38rev タンパク質スプライシングします。この図は、コーリイら21から転載されています。この図の拡大版を表示するのにはここをクリックしてください。

図 2: デザインを構築します。(A) pLTR.gp140/EGFP。RevΔ38/した DsRed スプライシング記者は EGFP (gp140 EGFP) および非機能的な Rev 蛋白融合した封筒の式は 38 アミノ酸した DsRed 蛍光蛋白質 (RevΔ38 した DsRed) に溶けるで切り捨てられますことができます。(B) pCMV RevNL4.3 Rev 蛋白発現をことができます。(C) pCMV Tat101AD8-フラグを C 末端のフラグ タグ付き Tat101(AD8) 蛋白質の表現できます。発現プラスミドは、PCR の重複および制限のダイジェストを使用して構築されます。すべてのベクトル マップは、バージョン 4.1.9 SnapGeneソフトウェアを使用して作成されました。この図の拡大版を表示するのにはここをクリックしてください。

図 3: エージェントを逆転させる HIV 待ち時間の迅速な評価のための設計を分析します。現在 HIV 1 転写、スプライシング LRAs の効果の評価法 i) を播種しています HEK293T 細胞の ii) トランスフェクション前日式ベクトル iii) LRA 治療が続きます。iv) 細胞は、48 時間後治療の流れの cytometry によって分析されます。このプロトコルを使用して (3 通) で 96 条件に 32 は、プレートごとテストでした。この図の拡大版を表示するのにはここをクリックしてください。
表 1: プレート セットアップ、必要なコントロールの代表的な例です。列 1 に 3 は、Tat などのプラス (+) のコントロールだけでなく、ない薬と溶媒のみ (DMSO 1: 5000) とマイナス (-) コントロールに対応 (100 ng)、PMA/PHA ホルボール ミリスチン酸酢酸/なの = (10 nM PMA、10 μ g/mL PHA)、(+/-) (1 μ M)、JQ1 VOR ボリノスタット (=0.5 μ M)、およびパン = パノビノスタット (30 nM)。不明な LRAs は濃度 (15.625 〜 1000 nM) の範囲で 3 通でテストされます。補償目的の細胞だけでなく、単一の色の蛍光蛋白質 (EGFP + とした DsRed +) の各を発現する細胞性染料で染色、無染色の細胞は、それぞれの実行に含まれます。このファイルをダウンロードするここをクリックしてください。

図 4: 流れの cytometry の分析で使用される戦略をゲートします。ゲートの戦略の第一歩は、前方および側面散布図は、これらの細胞のサイズと粒度のプロパティに基づいて興味のセルの区別を可能に基づいています。このゲートが寛大なように細胞残渣および密度プロットの左下隅で発見された死んだ細胞を除去しながら、すべてのイベントを含めることが可能であることをお勧めします。性色素を用いた生細胞のゲーティング、SSC-H 対 SSC A、さらに狭いパルス ジオメトリを使用してデータセットのダブレットを取り出します。最後に、ダンプ チャンネル (バイオレット) と EGFP または下流を使用興味のセルを定義します。蛍光マイナス 1 つ (FMO) コントロールの使用は興味の人口の定義と対象のチャネルで別の螢光色素からスピル オーバーの問題への対応において重要です。買収後、に、流れ cytometry データ解析ソフトウェアを使用してデータを分析します。この図は、適応形・ コーリイら21で転載されています。この図の拡大版を表示するのにはここをクリックしてください。

図 5: HIV 転写、スプライシングに及ぼすブロモ ドメイン阻害剤の代表の結果。(A) 事例 2 つパラメーター デュアル カラー蛍光融合細胞から密度をプロットした DsRed 対 EGFP (-Tat)、100 と transfected セル pCMV Tat101AD8の ng-DMSO、JQ1 フラグ (+ Tat) と細胞処理 (+) または JQ1 (-)。EGFP、下流やスプライシングは、製品を表現するセルの平均値 (B) 割合 (%) (下流/した DsRed + EGFP) 3 の独立した実験からが表示されます。DMSO に各条件の比較は、2 つの ANOVA テストを使用して行われました。統計的に有意な比較が表示されるのみ。p < 0.05;p < 0.01;p < 0.001。黒い線を表す、mean±SEM。 DMSO (1: 5000)、JQ1 (+) と JQ1(-) (1 μ m)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
測定前のヴィヴォ ウイルス再活性化の難しさを考えると、モデルは、潜伏を含む HIV 待ち時間を研究するために時間をかけて開発された生体外で幅広い感染 T 細胞-ライン (J-ラッツ、ACH2、U1)、(の休息の潜在的な感染症の主要なモデルO ' doherty、レヴィン、グリーン、スピナ モデル) または事前活性化 cd 4 + T 細胞 (サフ、マリーニ、Planelles、Siliciano、カーン モデル) 単一のラウンドまたはレプリケーション主務記者ウイルス22。HIV 待機時間静止 cd4 陽性 T 細胞の生理学的条件をモデル化するには、デュアル蛍光レポーター系続いた LTR 駆動ギャグ eGFP マーカーと場所に CMV 駆動 mCherry イワン ・ サドースキーのグループによって開発された rgh 氏 (赤-緑-HIV) 記者などNef23。同じようなデュアル カラー記者ウイルス、デュオ-蛍光は EGFP の LTR 駆動式と EF1α プロモーター24によって駆動 mCherry 蛍光マーカー E. バードン研究室によって開発されました。このシステムで、EGFP は Nef の代わりに provirus の 3' 末端に挿入されました。両方のこれらのシステムのエンベロープの削除を複数回感染症の防止します。さらに、2 つの蛍光タンパク質の組み合わせにより検出、生産的 (eGFP + mCherry +) および潜伏 (eGFP-mCherry +) 感染細胞の。ただし、デュアル カラー記者ウイルスのいくつかの欠点は、潜伏感染細胞の直接伝染は T 細胞23,24の細胞活性状態に大きく依存して cd 4 + T 細胞で顕著だった。実際には、感染率が非常に低いが cd4 陽性 T 細胞を安静時のこれらの 2 つの記者のウイルスを使用して観察された: rgh 氏23 0.1%、DuoFluo250.2%。また、として、CMV プロモーターは、非活性化細胞26,27,28, 非アクティブな CMV の下位レベルで発現すること示されているまたは EF1α プロモーターが潜伏感染の過小評価につながる集団。
生成し、遅延と高スループット試金でウイルス再活性化の確立を研究する新しい HIV 記者ベクトルを特徴としました。当社のスクリーニング法にいくつかの利点には、転写、スプライシング同時に、ii) 単一の実験、iii) 迅速に評価多数の薬または組み合わせをテストする機能を査定する能力 i) 費用対効果、フローサイトメトリー (30-45 分典型的な読み取り時間 96 well プレート蛍光パラメーターの数とは無関係の)、による LRAs の影響 iv) 高ダイナミック レンジ, v) 自動化されたハイスループット トランスフェクションとロボット アームと HTS ・ プラットフォーム、フローサイトメトリーに最適vii 流れ cytometry ワークスペース テンプレートを使用してデータの六速硬化) 懸濁液および付着性のセル、viii に最適) モデルおよび発光プレート リーダー測定 (デュアル ルシフェラーゼ ホタル、Renilla)、ix への適応性の簡略化)スケーラビリティ (96 および 384 ウェル パテ形式)。
HIV スプライシング レポーターを用いたフローサイトメトリーによる HIV LTR 駆動転写・ スプライシングしたがって EGFP と下流の蛍光蛋白質発現をアクティブに、LRA または LRAs の組み合わせの傾向を検査できます。ただし、小説 LRAs の相乗効果をテストする前に強くお勧め単一の薬剤の濃度の範囲への露出の後の細胞の生存率を測定することにより各 LRA の生理学的な条件を決定します。したがって、ライブとデッド細胞のマーカーを含むは、偽陽性を排除し、最高品質の結果を得るために不可欠です。流れフローサイトメトリー分析の別の重要な側面は、補正コントロールや FMO です。EGFP + した DsRed や逆に人口の波及を最小限を確保する単独でステンド グラス サンプルを使用するを強くお勧めします。また、細胞の蛍光のアカウントに重要な無染色の細胞を含みます。最後に、cytometer 性能と感度で検出器間での通常のコントロールは、時間の長い期間に渡る研究のサンプルで測定を行う場合に主が重要です。
プロトコル セクションでは説明しません、スプライシング レポーター システムのいくつかの制限があります。詳細については、私たちの前の出版物 (コーリイ et al, 2018) を参照してください。エクスポート、部分的または HIV mRNA の, 亜種はウイルス蛋白質 Rev とこれら mRNA 種29,の30,31,32回転応答要素 (RRE) との連動性によって促進されます。Rev の乗算の核保持の主要なブロックを回避することができました私たちシステムの過剰発現は融着接続し、潜伏感染 T 細胞17の転写やスプライシングの LRAs の誘発を理解することに焦点を当てる, Mrna を観察したがってウイルス再活性化します。さらに、当社のシステムは、3 プラスミドのトランスフェクションを必要とすることを考える選んだ HEK293T 細胞のためこれらの細胞の高いトランスフェクション効率。癌細胞株と比較して T 細胞における細胞因子の異なる時空の可用性を負う、HEK293T 細胞 T 細胞および初代培養細胞、素晴らしいを提供するかもしれない取得スプライシング記者の結果を検証することが重要です。自分の限られた transfectability のための技術的な課題は。したがって、代替の DNA 配信試薬の懸濁細胞 (例えば、Jurkat) の transfection のため特に効果的であることが示されている、DMRIE-C などのトランスフェクションや Amaxa nucleofector やネオンなどの nucleofection メソッドの使用トランスフェクション システム主な cd 4 + T 細胞を含む transfect に困難なセルに単一または複数のプラスミドの効率的かつ信頼性の高い配信を容易に実証されています。また、前述の transfection 方法を使用して遅延の一次電池モデルでフルレングスのウイルスのコンテキストでこの記者のシステムをテストするのには興味深いででしょう。実際には、ホスト転写、スプライシング因子 rCD4 + T 細胞の伸長性の違い、LRA の潜在 provirus を再アクティブ化する能力があります。最後に、転写とバイスタンダー細胞の選択的スプライシング LRA に影響を与えることができるかどうか、およびレプリケーション有能なウイルスを引き起こすことができるかどうか、我々 のモデルは扱いません。しかし、我々 は、これはレプリケーション有能なウイルス培養上清中の生産につながる細胞の HIV 米国と MS RNA の増加を測定することにより疑うと思います。これは、ゴールド スタンダード定量的ウイルス伸長試金 (QVOA)33を行い確認でした。
待ち時間と効率的なウイルス再活性化を確保するための複雑な性質のため多面的な組合せ戦略は必要な34にあります。待ち時間16,35,36,の設立に重要な役割を再生する以前示されている転写、スプライシングなど複数の経路を刺激する必要がある潜在的な治療37. 私たち LTR 駆動スプライシング レポーターできるようになる階段、転写、スプライシング、最適なターゲットすることができます薬の高スループット スクリーニング低いにつながる効率的な相乗効果ことができます見つける分子の機会が増え線量とこうして各薬品の毒性。
開示事項
著者が明らかに何もありません。
謝辞
この作業は、プロジェクト助成金 APP1129320 とオーストラリアの NHMRC からのプログラム助成金 APP1052979 によって支持されました。この仕事の成功の不可欠な構成要素とアドバイスを提供するため博士アダム ウィートリー、博士マリーナ アレクサンダー、ジェニー l. アンダーソン博士とミシェル Y. リーに感謝します我々 はまた、彼らのアドバイスや本研究で使用される流れの cytometer を維持するために寛大な支援の DMI の流れ施設スタッフを感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| HEK293T cells (Human Embryonic Kidney cells) | ATCC | CRL-3216 | Replicates vectors carrying the SV40 region of replication. |
| Dulbecco's Modified Eagle's Medium (DMEM 1x + GlutaMAX-I) | Gibco | 10569-010 | + 4.5 g/L D-Glucose + 110 mg/L Sodium Pyruvate |
| Fetal Bovine serum | Gibco | 10099-141 | Origin Australia |
| Penicillin-Streptomycin | Sigma | P4458 | |
| Dulbecco's phosphate buffered saline (DPBS), no calcium, no magnesium | Gibco | 14190-136 | |
| Trypan blue Stain, 0.4% | Gibco | 15250 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Lipofectamine 2000 | Invitrogen | 11668-019 | Lipid transfection reagent |
| Opti-MEM I (1x) reduced serum medium | Gibco | 31985-070 | Serum free medium |
| NucleoBond Xtra Maxi | Marcherey-Nagel | 740414.50 | |
| pEGFP-N1 plasmid | Clontech (TaKaRa) | 6085-1 | Expression of EGFP in mammalian cells, CMVIE promoter. |
| pDsRed-Express-N1 | Clontech (TaKaRa) | 632429 | Expression of DsRed-Express in mammalian cells, CMVIE promoter. |
| pLTR.gp140/EGFP.RevD38/DsRed | Addgene | 115775 | |
| pCMV-RevNL4.3 | Addgene | 115776 | |
| pCMV-Tat101AD8-Flag | Addgene | 115777 | |
| Dimethyl sulfoxide (DMSO) | Millipore | 67-68-5 | |
| JQ1(+) | Cayman Chemical | 11187 | Stock at 10 mM in DMSO; working concentration 1 μM |
| JQ1(-) | Cayman Chemical | 11232 | Stock at 10 mM in DMSO; working concentration 1 μM |
| Phorbol Myristate Acetate (PMA) | Sigma-Aldrich | 16561-29-8 | Stock at 100 μg/mL in DMSO; working concentration 10 nM |
| Phytohaemagglutinin (PHA) | Remel | HA15/R30852701 | Stock at 1 μg/μL in PBS; working concentration 10 μg/mL |
| Vorinostat (VOR) | Cayman Chemical | 10009929 | Stock at 10 mM in DMSO; working concentration 0.5 μM |
| Panobinostat (PAN) | TRC | P180500 | Stock at 10 mM in DMSO; working concentration 30 nM |
| CellTiter 96 AQueous One Solution Cell Proliferation Assay | Promega | 63581 | |
| Venor GeM Classic | Minerva Biolabs | 11-1100 | Mycoplasma Detection Kit, PCR-based |
| Name | Company | Catalog Number | Comments |
| Flow cytometry reagents | |||
| LSR Fortessa | BD Biosciences | Flow cytometer (4 lasers-blue, red, violet and yellow) | |
| LSR II | BD Biosciences | Flow cytometer (3 lasers-blue, red and violet) | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit | Life Technologies | L34976 | Viability dye: for 633 or 635 nm excitation, 400 assays. Component A and B are both provided in the kit. |
| Bovine Serum Albumin | Sigma | A2153 | |
| EDTA 0.5M pH8 | Gibco | 15575-038 | |
| Formaldehyde Solution 37/10 (37%) | Chem-Supply | FA010 | |
| BD FACS Diva CS&T Research Beads | BD Biosciences | 655050 | Calibration beads |
| Sphero Rainbow Calibration Particles (8 peaks) | BD Biosciences | 559123 | 3.0 - 3.4 mm |
| Sheath solution | Chem-Supply | SA046 | 90 g NaCl in 10 L water |
| HAZ-Tabs | Guest Medical | H8801 | Chlorine release tablets for disinfection |
| Decon 90 | Decon Laboratories Limited | N/A | Concentrated cleaning agents of flow cytometer. Working solution Decon 90 5%. |
| Sodium Hypochlorite (12-13% Solution) | Labco | SODHYPO-5L | Concentrated cleaning agents of flow cytometer. Working solution bleach 1%. |
| 7x | MPBio | IM76670 | Concentrated cleaning agents of flow cytometer. Working solution 7x 1%. |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Tissue culture flasks (75 cm2, canted neck, cap vented) | Corning | 430641U | |
| Tissue culture plates (96 well flat bottom with lid) | Costar | 3599 | |
| Tissue culture plates (96 well V-bottom without lid) | Costar | 3896 | |
| Centrifuge tubes (10 mL) | SARSTEDT | 62.9924.284 | 100x16 mm |
| Centrifuge tubes (50 mL) | CellStar | 227261 | 30x115 mm |
| Microcentrifuge tubes (1.5 mL) | Corning Axygen | MCT-150-C | |
| Serological Pipette (25 mL), sterile | Corning | CLS4489-200EA | |
| Serological Pipette (10 mL), sterile | Corning | CLS4488-200EA | |
| Serological Pipette (5 mL), sterile | Corning | CLS4487-200EA | |
| Reagent reservoirs (50 mL), sterile | Corning | CLS4470-200EA | |
| 5 mL Round-Bottom polystyrene test tube, with cell-strainer cap | Corning | 352235 | 12 x 75 mm style, 70 mm |
| Nylon Mesh | SEFAR | 03-100/32 | 100 mm |
| Titertube Micro test tubes, bulk | BIO-RAD | 2239391 | microfacs tubes |
| 5 mL Round-Bottom polystyrene test tube, without cap | Corning | 352008 | 12x75 mm style |
| Snap Caps for 12x75 mm Test Tubes | Corning | 352032 | |
| Counting chamber, Neubauer improved double net ruling, bright-line (Haemocytometer, LO-Laboroptik) | ProSciTech | SVZ4NIOU | 3x3 large squares of 1 mm2; Depth 0.100 mm; volume 0.1 mL; area minimum 0.0025 mm2 |
| Coverslips (Menzel-Gläser) | Grale Scientific | HCS2026 | 20 x 26 mm |
| Microscope | Nikon TMS | 310528 | |
| Centrifuge 5810R refrigerated | Eppendorf | 5811000487 | with rotor A-4-81 including adapters for 15/50 mL conical tubes |
| FLUOstar Omega microplate reader | BMG Labtech | N/A | Plate reader for cell proliferation assay. Filter 490 nm. |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| FACS Diva | BD Biosciences | Flow cytometer data acquisition and analysis program, version 8.0.1 | |
| FlowJo | FlowJo | FlowJo 10.4.2 | Flow cytometer data analysis program, FlowJo Engine v3.05481 |
| Omega | BMG Labtech | FLUOstar multi-user reader control, version 5.11 | |
| Omega - Data Analysis | BMG Labtech | MARS | FLUOstar data analysis, version 3.20R2 |
| Microsoft Excel | Microsoft | Excel:mac 2011 | version 14.0.0 |
| Prism | GraphPad | Prism 7 | version 7.0c |
参考文献
- Siliciano, J. D., et al. Long-term follow-up studies confirm the stability of the latent reservoir for HIV-1 in resting CD4+ T cells. Nature Medicine. 9 (6), 727-728 (2003).
- Khoury, G., et al. Ch. 8. HIV vaccine and cure - The Path Towards Finding an Effective Cure and Vaccine. 1075, Springer Nature. Adv Exp Med Biol (2018).
- Van Lint, C., Bouchat, S., Marcello, A. HIV-1 transcription and latency: an update. Retrovirology. 10, 67(2013).
- Archin, N. M., et al. HIV-1 Expression Within Resting CD4+ T Cells After Multiple Doses of Vorinostat. Journal of Infectious Diseases. 210, 728-735 (2014).
- Elliott, J. H., et al. Activation of HIV Transcription with Short-Course Vorinostat in HIV-Infected Patients on Suppressive Antiretroviral Therapy. PLoS Pathogens. 10, (2014).
- Leth, S., et al. Combined effect of Vacc-4x, recombinant human granulocyte macrophage colony-stimulating factor vaccination, and romidepsin on the HIV-1 reservoir (REDUC): a single-arm, phase 1B/2A trial. The Lancet HIV. 3, e463-e472 (2016).
- Rasmussen, T. A., et al. Panobinostat, a histone deacetylase inhibitor, for latent-virus reactivation in HIV-infected patients on suppressive antiretroviral therapy: a phase 1/2, single group, clinical trial. The Lancet HIV. 1, e13-e21 (2014).
- Søgaard, O. S., et al. The Depsipeptide Romidepsin Reverses HIV-1 Latency In Vivo. PLoS Pathogens. 11, (2015).
- Bartholomeeusen, K., Xiang, Y., Fujinaga, K., Peterlin, B. M. Bromodomain and extra-terminal (BET) bromodomain inhibition activate transcription via transient release of Positive Transcription Elongation Factor b (P-TEFb) from 7SK small nuclear ribonucleoprotein. Journal of Biological Chemistry. 287, 36609-36616 (2012).
- Boehm, D., et al. BET bromodomain-targeting compounds reactivate HIV from latency via a Tat-independent mechanism. Cell Cycle. 12, 452-462 (2013).
- Contreras, X., et al. Suberoylanilide hydroxamic acid reactivates HIV from latently infected cells. Journal of Biological Chemistry. 284 (11), 6782-6789 (2009).
- Rasmussen, T. A., et al. Comparison of HDAC inhibitors in clinical development: effect on HIV production in latently infected cells and T-cell activation. Human Vaccines & Immunotherapeutics. 9 (5), 993-1001 (2013).
- Wei, D. G., et al. Histone deacetylase inhibitor romidepsin induces HIV expression in CD4 T cells from patients on suppressive antiretroviral therapy at concentrations achieved by clinical dosing. PLoS Pathogens. 10 (4), e1004071(2014).
- Blazkova, J., et al. Effect of histone deacetylase inhibitors on HIV production in latently infected, resting CD4(+) T cells from infected individuals receiving effective antiretroviral therapy. Journal of Infectious Diseases. 206 (5), 765-769 (2012).
- Bullen, C. K., Laird, G. M., Durand, C. M., Siliciano, J. D., Siliciano, R. F. New ex vivo approaches distinguish effective and ineffective single agents for reversing HIV-1 latency in vivo. Nature Medicine. 20 (4), 425-429 (2014).
- Yukl, S. A., et al. HIV latency in isolated patient CD4+T cells may be due to blocks in HIV transcriptional elongation, completion, and splicing. Science Translational Medicine. 10, (2018).
- Lassen, K. G., Ramyar, K. X., Bailey, J. R., Zhou, Y., Siliciano, R. F. Nuclear retention of multiply spliced HIV-1 RNA in resting CD4+T cells. PLoS Pathogens. 2, 0650-0661 (2006).
- Alexander, M. R., Wheatley, A. K., Center, R. J., Purcell, D. F. J. Efficient transcription through an intron requires the binding of an Sm-type U1 snRNP with intact stem loop II to the splice donor. Nucleic Acids Research. 38, 3041-3053 (2010).
- Anderson, J. L., Johnson, A. T., Howard, J. L., Purcell, D. F. J. Both Linear and Discontinuous Ribosome Scanning Are Used for Translation Initiation from Bicistronic Human Immunodeficiency Virus Type 1 env mRNAs. Journal of Virology. 81, 4664-4676 (2007).
- Nikfarjam, L., Farzaneh, P. Prevention and detection of Mycoplasma contamination in cell culture. Cell J. 13 (4), 203-212 (2012).
- Khoury, G., et al. HIV latency reversing agents act through Tat post translational modifications. Retrovirology. 15 (1), 36(2018).
- Hakre, S., Chavez, L., Shirakawa, K., Verdin, E. HIV latency: experimental systems and molecular models. FEMS Microbiology Reviews. 36 (3), 706-716 (2012).
- Dahabieh, M. S., et al. Direct non-productive HIV-1 infection in a T-cell line is driven by cellular activation state and NFkappaB. Retrovirology. 11, 17(2014).
- Calvanese, V., Chavez, L., Laurent, T., Ding, S., Verdin, E. Dual-color HIV reporters trace a population of latently infected cells and enable their purification. Virology. 446 (1-2), 283-292 (2013).
- Chavez, L., Calvanese, V., Verdin, E. HIV Latency Is Established Directly and Early in Both Resting and Activated Primary CD4 T Cells. PLoS Pathogens. 11 (6), e1004955(2015).
- Hunninghake, G. W., Monick, M. M., Liu, B., Stinski, M. F. The promoter-regulatory region of the major immediate-early gene of human cytomegalovirus responds to T-lymphocyte stimulation and contains functional cyclic AMP-response elements. Journal of Virology. 63 (7), 3026-3033 (1989).
- Reeves, M., Sinclair, J. Aspects of human cytomegalovirus latency and reactivation. Current Topics in Microbiology and Immunology. 325, 297-313 (2008).
- Sambucetti, L. C., Cherrington, J. M., Wilkinson, G. W., Mocarski, E. S. NF-kappa B activation of the cytomegalovirus enhancer is mediated by a viral transactivator and by T cell stimulation. EMBO Journal. 8 (13), 4251-4258 (1989).
- Kula, A., et al. Characterization of the HIV-1 RNA associated proteome identifies Matrin 3 as a nuclear cofactor of Rev function. Retrovirology. 8, 60(2011).
- Kula, A., Marcello, A. Dynamic Post-Transcriptional Regulation of HIV-1 Gene Expression. Biology (Basel). 1 (2), 116-133 (2012).
- Yedavalli, V. S., Jeang, K. T. Rev-ing up post-transcriptional HIV-1 RNA expression. RNA Biology. 8 (2), 195-199 (2011).
- Zolotukhin, A. S., et al. PSF acts through the human immunodeficiency virus type 1 mRNA instability elements to regulate virus expression. Molecular and Cellular Biology. 23 (18), 6618-6630 (2003).
- Laird, G. M., Rosenbloom, D. I., Lai, J., Siliciano, R. F., Siliciano, J. D. Measuring the Frequency of Latent HIV-1 in Resting CD4(+) T Cells Using a Limiting Dilution Coculture Assay. Methods in Molecular Biology. 1354, 239-253 (2016).
- Cary, D. C., Peterlin, B. M. Targeting the latent reservoir to achieve functional HIV cure. F1000Res. 5, (2016).
- Han, Y., et al. Resting CD4+ T cells from human immunodeficiency virus type 1 (HIV-1)-infected individuals carry integrated HIV-1 genomes within actively transcribed host genes. Journal of Virology. 78 (12), 6122-6133 (2004).
- Laird, G. M., et al. Ex vivo analysis identifies effective HIV-1 latency - reversing drug combinations. Journal of Clinical Investigation. 125, 1901-1912 (2015).
- Lenasi, T., Contreras, X., Peterlin, B. M. Transcriptional interference antagonizes proviral gene expression to promote HIV latency. Cell Host Microbe. 4 (2), 123-133 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved