Method Article
慢性血栓塞栓性肺高血圧症の大型動物モデルにおける急性右心不全の誘導とフェノタイピング
要約
慢性肺高血圧症の大型動物モデルにおいて、急性右心不全を誘導し表現するプロトコルを提示する。このモデルは、治療介入をテストしたり、右心の指標を開発したり、急性右心不全病態生理学の理解を深めるために使用できます。
要約
慢性肺高血圧症(PH)の状況における急性右心不全(ARHF)の発症は、短期的な結果の低下と関連している。右心室の形態学的および機能的なフェノタイピングは、ARHF患者における血行力学的妥協の文脈において特に重要である。ここでは、慢性PHの前に説明した大型動物モデルにおいてARHFを誘導する方法、および表現型に、金標準法(すなわち、圧力体積PVループ)を用いた動的、右心室機能および非侵襲的臨床的に利用可能な方法(すなわち、エコーカルジオグラフィ)を用いて説明する。慢性PHは、5週間の間、週に1回、左肺動脈結紮と右下葉塞栓症によって豚に最初に誘導される。16週間後、ARHFは、生理的圧力に対する収縮期肺圧の比が0.9に達するまで、または収縮期の全身圧が90mmHg以下になるまで、生理的な肺塞栓を続けて連続した体積負荷によって誘発される。血行力学は、ドブタミン注入(2.5 μg/kg/minから7.5 μg/kg/分)で復元されます。PVループと心エコーは各条件の間に行われます。各条件は、誘導、血行力学的安定化およびデータ取得のために約40分を必要とします。9匹のうち、2匹は肺塞栓症の直後に死亡し、7はプロトコルを完成させ、モデルの学習曲線を示す。このモデルは平均肺動脈圧の3倍の増加を誘発した。PVループ分析は、心室と動脈の結合が体積負荷後に保存され、急性肺塞栓症の後に減少し、ドブタミンで回復したことを示した。心エコーの獲得は、良好な品質で形態および機能の右心室パラメータを定量化することを可能にする。我々は、モデル内の右心室虚血病変を同定した。モデルは、異なる治療法を比較したり、ARHFの文脈で右心室形態と機能の非侵襲的なパラメータを検証するために使用することができます。
概要
急性右心不全(ARHF)は、最近、右心室(RV)充填および/または減少したRV流量出力に起因する全身性鬱血との急速進行性症候群として定義されている。ARHFは、左の心不全、急性肺塞栓症、急性心筋梗塞、肺高血圧症(PH)などのいくつかの条件で発生する可能性があります。PHの場合、ARHF発症は、短期死亡または緊急肺移植の40%のリスクに関連している2,3,4。ここでは、慢性肺高血圧症の設定におけるARHFの大型動物モデルの作成方法と、心エコー検査と気圧容積ループを用いて右心室を評価する方法について説明する。
ARHFの病態生理学的特徴は、RV圧力過負荷、体積過負荷、RV出力の減少、中心静脈圧の増加および/または全身圧の低下を含む。慢性PHでは、肺血管抵抗の増加にもかかわらず心拍出量を維持することを可能にするRV収縮性の初期増加がある。したがって、慢性PH上のARHFの文脈では、右心室は、特に向知性支持下で、ほぼ等体性圧力を生成することができる。一緒に取ると、慢性PHのARHFとイノトロープによる血行性回復は、最近の大型動物モデル5に記載されているように、急性RV虚血病変の発症につながります。イトロープの増加は、虚血性病変をさらに発症し、最終的に末期臓器機能不全および悪い臨床転帰の発症につながる可能性のあるエネルギー需要の増加を生み出す。しかし、主に体液管理、イノトロープ、体外循環サポートの役割に関して、PH上のARHF患者を管理する方法についてのコンセンサスはありません。その結果、急性右心不全の大型動物モデルは、ARHF臨床管理に関する前臨床データを提供するのに役立つ可能性がある。
治療に対する応答を定量化する第一歩として、右心室を表現する簡単で再現可能な方法が必要である。現在までに、ARHF患者のRV形態と機能をより良く表現する方法についてのコンセンサスはありません。RV収縮性(すなわち、収縮する本質的な能力)および心室-動脈結合(すなわち、心室後負荷によって正規化された収縮性;心室適応の指標)を評価するための金標準法は、圧力体積(PV)ループの分析である。この方法は、右心カテーテル法と、下の静脈に挿入されたバルーンを用いたRVプリロードの一過性の減少を必要とするため、2回侵襲的である。臨床現場では、右心室を評価するための非侵襲的かつ反復可能な方法が必要である。心臓磁気共鳴(CMR)は、右心室の非侵襲的評価のためのゴールドスタンダードと考えられています。集中治療室(ICU)で管理されている慢性PHのARHF患者では、CMRの使用は患者の不安定な血行力学的状態のために制限されるかもしれません。また、CMR評価を繰り返し、夜間を含め、1日数回、そのコストおよび限られた利用可能性のために制限され得る。逆に、心エコー検査は、ICU患者における非侵襲的、再現性、低コストのRV形態および機能評価を可能にする。
大型動物モデルは、侵襲的な血行力学パラメータと非侵襲的パラメータとの関係に焦点を当てた前臨床試験を行うのに理想的です。大きな白豚の解剖学は人間に近いです。その結果、ヒトに記述された心エコーパラメータのほとんどは、ブタで定量化可能である。心エコー研究のために考慮しなければならない人間と豚の心臓の間にいくつかの小さなバリエーションが存在します。.豚は、憲法上のデキストロカルディアと心臓軸のわずかに反時計回りの回転を提示します。その結果、アピカル4チャンバービューは、アピカル5チャンバービューになり、音響窓は、xiphoid付録の下に配置されます。さらに、パラスターナル長軸と短軸の眺め音響窓は胸骨の右側に位置しています。
ここでは、慢性血栓塞栓性PHの大型動物モデルでARHFを誘導し、ドブタミンを用いて血行力学的に回復させる新しい方法について述べている。また、ドブタミンによる血行力学的修復後2〜3時間以内にモデル内に存在するRV虚血性病変を報告する。また、各条件でのRV PVループおよび心エコーRVパラメータを取得して、RVの形態や機能の動的変化に関する洞察を得る方法を説明する。慢性血栓塞栓性PHおよびPVループ法の大型動物モデルとして、先に説明した6、これらのセクションについて簡単に説明する。また、ブタモデルでは難しいと考えられる心エコー評価の結果も報告した。モデル内で繰り返し心エコーを実現する方法について説明します。
この研究で報告された慢性PHのARHFのモデルは、異なる治療戦略を比較するために使用することができる。RV表現型の方法は、急性肺塞栓症7、RV心筋梗塞8、急性呼吸窮迫症候群または 左心室障害に関連する右心不全10 または左心室機械的循環サポート11のような臨床的に関連する状況を模倣する他の大型動物モデルに使用することができる。
プロトコル
この研究は、全米医学研究協会による実験動物ケアの原則に従い、マリー・ラネロングー病院の動物実験に関する地元の倫理委員会によって承認されました。
1. 慢性血栓塞栓症PH
- 慢性血栓塞栓性PHを先に説明したとおりに誘導する 6,12.
- 簡単に言えば、約20kgの大きな白い豚(sus sus scrofa)に慢性血栓塞栓性PHのモデルを誘導する。週0(閉心性心膜)で左開腹術を経て左肺動脈結紮の合字を行う;N-ブチル-2-シアノアクリル酸と2 mLの脂質コントラスト色素(リピオドール)を含む軟部組織接着剤1 mLで構成された混合溶液を用いて、右下葉肺動脈(週0.2mL〜0.4 mL)の塞栓を毎週行う。
- 心エコー検査の実現可能性を改善するために、左肺動脈結紮時の週0でキシフィウ16切除術を行う。これを行うには、xiphoidプロセスの前に4cmの縦切開を行う。ダイアサーミーナイフを使用してキシフォイドプロセスを取り外します。皮下プランと、実行中の縫合糸で皮膚を閉じます。
- 上記と同じプロトコルを使用して、第10週に右下葉肺塞栓症を追加する(ステップ1.2)。
- 急性肺塞栓症によって誘発された急性右心病変を避けるために、最後の右下葉塞栓術(第16週)の6週間後にARHF誘導(セクション6)モデルを実行する。
注:右心不全の他の大きな動物モデルを使用することができ、または他の病理学的状態は、慢性血栓塞栓性PHモデルで誘発することができる。
2. 動物の位置とカテーテルの配置
- 前述のように全身麻酔を行う6.
- 簡単に言えば、動物を12時間断食させてください。次いで、前投薬のためにケタミン塩酸塩(30mg/kg)の筋肉内注射を行う。フェンタニル(0.005mg/kg)、プロポフォール(2mg/kg)、シサトラキュリウム(0.3mg/kg)の静脈内に耳静脈を通して静脈内ボーラスを行い、7フランスのプローブでブタを非選択的に挿管する。
- 吸入2%イソフルラン、フェンタニル(0.004 mg/kg)およびプロポフォール(3mg/kg)の連続注入で全身麻酔を維持する。
- 全身麻酔誘導後、豚を前足で背中に少し広げた位置に置き、副表皮心エコーの取得を可能にする(セクション3)。
- 滅菌場の配置前に、デバイス電極を腕と脚(心エコーグラフ、血力学的獲得用ワークステーション)に配置します。
- セルディンガー法13を使用して、8-フランスのシースを頸静脈に入れる。
- 18G(1.3 mm x 48 mm)のIVカテーテルを頸静脈に導入します。
- 45°の向きで、マニュバの上に2cmで中間線に経皮穿刺を行います。
- 静脈逆流を得た後、カテーテル(0.035インチ/0.089 mm、180 cm、角度付き)にガイドワイヤーを挿入します。
- 透視検査で上の大静脈にガイドワイヤーの正しい配置を確認し、ガイドワイヤー上の8-フランスのシースを上の静脈に処分します。
注:ガイドワイヤーは、脊椎の右の境界に沿って下の大静脈を通過するときに正しく配置されます。
- 18G(1.3 mm x 48 mm)のIVカテーテルを頸静脈に導入します。
- 右大腿血管の分割を行い、体液充填カテーテルを右大腿動脈に導入し、全身圧を連続的に監視し、バルーン拡張カテーテルを次のように大腿静脈を通して下胸静脈に入る。
- 鼠径部で4cmの横切開を行う。
- ベックマンレトラクターを配置し、デバチー鉗子とメッツェンバウムはさみを使用して大腿静脈と大腿動脈の前面を分割します。
- 20 G カテーテルを直接視覚的制御下の大腿動脈に配置し、液体充填カテーテルを使用して使い捨てトランスデューサに接続し、連続的な全身血圧モニタリングを行います。
注:平均血圧は60 mmHg以上でなければなりません。 - 18 G カテーテルを使用して、ガイドワイヤー (0.035 インチ/ 0.089 mm、180 cm、角度付き) を、下の静脈を介して大腿静脈に挿入します。
- 眼管内制御下の心膜内レベルで、下の大静脈を通してガイドワイヤーにバルーン拡張カテーテルを挿入します。
- 後眼視を用いてCアームで蛍光コントロールを行います。バルーンの可視マーカーを、透視制御の下でダイヤフラムレベルのすぐ上に置きます。バルーンを配置するときにガイドワイヤを取り外します。
- 大腿静脈からの出血を避けるために静脈拡張バルーンカテーテルの周りに5.0ポリプロピレンモノフィラメント縫合糸で財布を縫う。
3. 心エコー検査
- 全身麻酔および機械的換気の下で動物の位置とカテーテルの配置(セクション2)の直後に心エコー検査を行います。
- 終気満期無呼吸時に少なくとも3つの心周期のためのシネループフォーマットの各心エコー図を取得する。
- 2次元およびティッシュドップラーモードですべてのビューを取得します。
- xiphoidプロセスの下で、アペカル5チャンバービューを取得します。
- 胸骨の右側にあるパラスターナル短軸と長軸ビューを取得します。
- 連続およびパルスドップラーモードを使用して弁力流を取得します。
- 外側三尖環および外側および中隔僧帽弁環の組織ドップラー信号を取得する。
注:心エコーの獲得と解釈のための人間の心エコー評価のための最新のガイドラインを使用してください14。
4. 右心カテーテル法
- 心臓エコー(セクション3)後、および圧力量ループの取得前に右心カテーテル法を行う(セクション5)
- スワンガンツカテーテルを使い捨てトランスデューサにリンクします。
- 以前に頸静脈(セクション2.4)に挿入された8-フランスのシースにスワンガンツカテーテルを導入し、平均右心房、右心室および肺動脈圧を取得する。必要に応じて、蛍光検査の下にカテーテルを置きます。
注:流体充填カテーテルが生理液で十分にパージされていることを確認し、圧力信号の減衰を避けるために気泡を取り除きます。 - スワンガンツカテーテルを肺動脈に入れた後、メーカーの指示で説明されているように熱希釈法で心拍出量を測定します。ストロークの音量計算のための心拍数を同時に測定します。
- 心拍出量の過大評価を避けるために、生理食物が4°Cであることを確認してください。
- 使い捨て可能なトランスデューサをPVループのワークステーションに接続して、流体充填カテーテルに由来する圧力をライブ取得します。
5. コンダクタンス法による圧力体積ループ獲得
注: このセクションは以前に公開されています15。
- 導電カテーテルを、透視制御下で右心室に導入します。
- 圧力量ループの「 ライブ」取得を使用して品質信号を確認します。
- 最適な信号(すなわち、生理学的形状を有する反時計回りのPVループ)を得るために十分な電極を活性化する。
- メーカーの指示に従ってワークフローの圧力と体積キャリブレーションステップをフォローアップします(血液伝導率、平行体積、ストローク量キャリブレーション=アルファキャリブレーション)。
注:スワンガンツカテーテルを使用して外部のストロークを各条件に繰り返すことができます。一方、他のキャリブレーションステップは一度だけ実行できます。 - 定常状態で、急性予負荷低減(すなわち、下の静脈の急性閉塞)の間に、終末無呼吸時にPVループファミリーを獲得する。
- 条件ごとに少なくとも 3 つの取得を実行します (安定 + IVC オクルージョン)。
6. 体積および圧力過多による急性右心不全の誘導(図1)。
- 3ステップの生理食糸を用いて、体積過多を誘導する(約2時間)。
- フリーフロー注入出力で15 mL/kgの最初の注入を開始します。
- 各注入の終了後に血行力学的安定化後5分(右心カテーテル、PVループおよび心エコー図)測定を行います。
- 測定終了後すぐに15 mL/kgの2回目の容積注入を開始します。
- 測定終了後すぐに30 mL/kgの生理食土の3巻の注入を開始します。
注意:ボリュームローディングは、使用される動物モデルに応じて血行力低下または肺水腫を誘発する可能性があります。このモデルでは、容積負荷は、心拍出量の増加、安定した右心房圧および保存された心室-動脈結合を特徴とする適応応答を明らかにした。
注: 呼吸や血行力学的耐性が悪い場合は、ボリュームローディングを停止できます。
- 反復性肺塞栓症で圧力過多を誘発する。
- 5フランスの血管造影カテーテルを頸部鞘を通して、肺の右下葉肺動脈に透視制御下に挿入します。
- N-ブチル-2-シアノクリレートと2 mLの脂質造影色素を含む軟部組織接着剤の1 mLで構成される混合溶液の0.15 mLのボーラスで右下葉肺動脈を塞栓する。カテーテルを10mLの生理液で洗い流します。
- 全身圧と肺動脈圧を用いて、塞栓後2分間の血行力学的応答を評価する。
- 血力学的妥協を得るまで2分ごとに0.15 mLの塞栓を繰り返す(すなわち、収縮期の全身圧比>0.9以上の収縮期の全身圧<90 mmHgまたは収縮期肺圧)。
注意:肺塞栓症は、重度の血行力学的妥協を誘発し、時には不可逆的に、即時死に至る可能性がある。塞栓処理ステップを開始する前に、血行力学的支持(循環停止の場合にはドブタミンプロトコルまたはエピネフリン)を開始する準備をしておく。PVループと心エコーモニタリングを開始する準備が整います。このステップは、重度の血行力学的妥協に関連する可能性があるため、スワンガンツカテーテルを用いた右心カテーテルは、ドブタミン支持を早く開始するように避けることができる。
7. ドブタミンによる全身血行力の回復を誘導する
- 血行力学的妥協に達し、PVループおよび心エコーの獲得を行った後、2.5 μg/kg/minでドブタミン注入を開始します。
注:他の薬剤や治療は、この時点で開始することができます。 - 血力学的安定化のために10〜15分待ちます。
- 右心カテーテル法、PVループ、心エコーの獲得を行います。
- ドブタミン注入量を5μg/kg/分に増やす。
- 血行性安定化と繰り返し取得のために15分待ちます。
- 右心カテーテル法、PVループ、心エコーの取得を繰り返します。
- ドブタミン注入量を7.5 μg/kg/分に上げる。
注:他の用量、薬物または治療を開始することができます。
8. 安楽死と心臓組織の収穫
- プロトコルの最後に、振動鋸を使用して中央値のステロトミーを行います。
- 心膜を開き、塩化カリウム(0.2 g/kg)の致死溶液を注入する。
- 心臓を収穫する。病理学的および分子的評価のための右および左心室自由壁のサンプルを選択しなさい。
注:右心室の病理学的評価と統計の方法は、以前に報告されました5。
結果
可能
我々は、以前に報告された大型動物CTEPHモデルにおけるARHF誘導の9つの連続した手順の結果を説明する5。プロトコルの持続時間は、麻酔誘導、設置、血管アクセス/カテーテルの配置、体積/圧力過負荷の誘導および血行力学的修復、データ取得および安楽死を含む、完了するまで約6時間であった。各血行力学的状態は、条件の誘導、血行力安定化およびデータ取得を達成するために約40分を必要とします。
プロトコルは、学習曲線を表す9匹のうち7匹で達成された。これらの説明の後に、3 つの追加のプロトコルが正常に達成されました (公開されていません)。2つのプロトコル障害の原因は、肺塞栓症相後の不可逆的な血行力障害の誘導であった。
PVループは、右心カテーテルと心臓エコーの後にエピネフリンボーラスを伴う迅速な全身血行性修復を提供する必要があるため、血力学的妥協時に7匹中1匹で獲得されなかった。この場合、ドブタミンはエピネフリンによる全身血行力の回復直後に開始された。
流体力学とRV機能に及ぼす体積と圧力過多の影響
急性の体積負荷はARHFを誘導せず、むしろ慢性PHモデルの適応表現型を強調した。容積負荷では、心房の出力は右心房圧を増加させることなく増加し、心室と動脈の結合は安定したままでした(図2)。
血行性妥協基準は、1匹の動物では1匹の塞栓、2匹の動物では2匹、5匹では3匹の塞栓、1匹の動物では4匹の塞栓術の後に達成された。2匹の動物がPEの直後に死んだ(1匹の塞栓を持つ1匹の動物と4つの塞栓を持つ1匹の動物)。別の動物では、重度の低血圧は、PVループおよび心エコーデータ取得の前にエピネフリンボーラスとドブタミンの即時開始を必要としました。急性肺塞栓症の直後に起こる2人の死亡は、右心腔の急性血栓症と関連していた( 図3に示すように)。
血行力学的妥協は、心拍出量、脳卒中量および心室-動脈結合(Ees/ea)の有意な減少に関連していたのに対し、RV収縮性は安定したままでした(図2)。右心房圧と平均肺動脈圧の2倍の増加があった。
ARHFに対するドブタミン効果
ドブタミンは正常範囲内で心拍出量、脳卒中容積、および心室-動脈結合を回復させた(図2)。
心エコー撮影
エコーカルディグラフィは、プロトコル中のRVサイズおよび機能の動的変化を定量化することが可能であった(図4)。心エコーパラメータは、エピネフリンボーラスとドブタミンの即時開始を必要とする肺塞栓症の後に重度の血力学的妥協を有する1動物では評価されなかった。
RV PVループ
圧力量ループ解析では、RV末端-収縮期のエラストと心室-動脈結合の動的定量が可能になりました(図2 および 図5)。
右心室虚血性病変
ヘマチン、エオジン、およびサフラン染色後、RV自由壁の下脳内および下方膜層におけるRV虚血病変を観察した(図6)。虚血性病変は、ピノティック核を有する過好性心筋細胞のクラスターによって特徴付けられた。

図1:プロトコルの概要 PH, 肺高血圧;VL1、15 mL/kgの生理液量で積み込む。VL2、生理学の15 mL/kg;VL3、生理学の30 mL /kg;ARHF, 急性右心不全;PE、肺塞栓症。*全身収縮期圧<90mmHgまたは収縮期肺/全身圧比>0.9。この図は5から修正されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
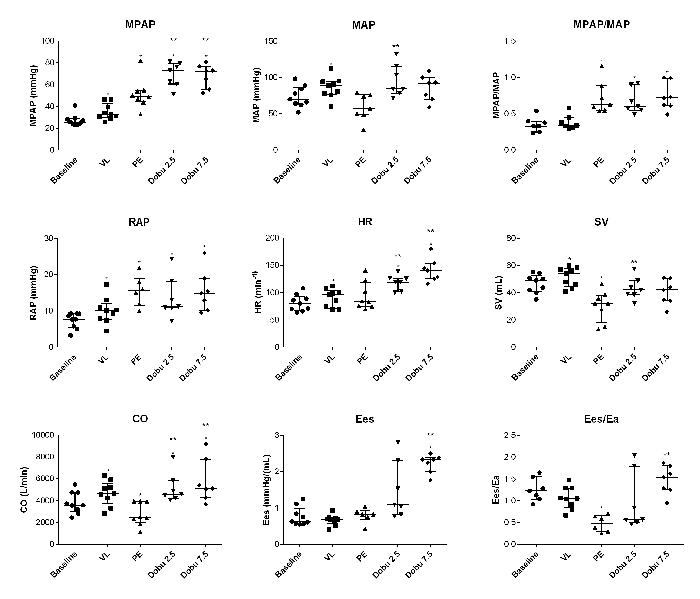
図2:個々の血行力および圧力量ループの動的変化 MPAP, 平均肺動脈圧;MAP, 平均動脈圧;RAP、右心房圧;HR、心拍数;SV、ストロークボリューム;CO、心拍出量;イーズ;右心室終期エラスト;えっ、動脈のエラスティックス。プロットは中央値と四分位数の範囲です。*P<0.05 とベースラインの比較;比較は、グラフパッドプリズム6でウィルコクソンマッチペア署名ランクテストを使用して行われました。この図は5から修正されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:プロトコル障害の原因の例: 肺塞栓症後の急性右心血栓症(矢印)は、不可逆的な血行力学的妥協、即時死およびプロトコル障害を引き起こす。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:代表的な心エコーウィンドウと結果 (A) アペカル5チャンバ(A5C)ビューの取得位置。 (B) パラスターン短軸(PSSAX)ビューの取得位置。(C) プロトコルの異なるステップの間のA5CおよびPSSAXのビューの動的心エコー評価。VL、ボリュームローディング。PE, 肺塞栓症;ドブ2.5、ドブタミン2.5μg/kg/分;ドブ 7.5, ドブタミン 7.5 μg/kg/分. *右心室;**左心室。この図は5から修正されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:代表的なダイナミックRVマルチビート圧力ボリュームループPH, 肺高血圧;PE, 肺塞栓症;Ees、終期収縮期のエラストネス(黒い線は*とラベル付けされています)。Ea, 動脈のエラスティックス (黒い線のラベルが付いた **);Ees/Ea、腹腔動脈結合。この図は5から修正されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
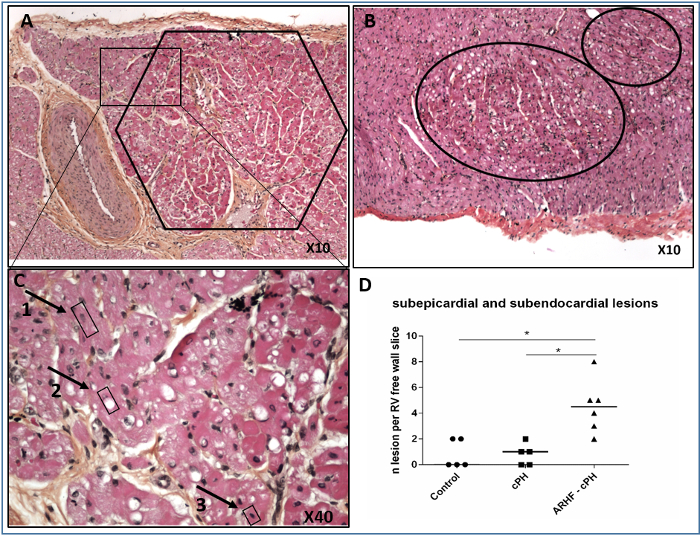
図6:サブ心内膜および下心膜層における代表的なRV虚血性病変。 (A)下上皮虚血性病変;(B) 脳内膜虚血性病変;(C)正常核を有する下上皮性病変の境界の拡大(1)、内陰球性空転(2)及びピノシック核(3)。(d)慢性肺高血圧症および健康なコントロールを有する動物、急性右心不全(ARHF)を有する動物からのRV自由壁の2cmの長さのサンプルにおける皮下および下頭脳性虚血性病変の個々の数;プロットは中央値です。比較は、グラフパッドプリズム6とマンホイットニー検定を使用して行われました。*P<0.05.この図は5から修正されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
我々は、ドブタミンによる体積及び圧力過大および血行力学的修復を含む大型動物モデルにおける慢性PHのARHFの主要な病態生理学的特徴をモデル化する方法を説明する。また、プロトコル中に作成された各条件で右心室の動的変化を表現するために血行力学的およびイメージングデータを取得する方法を報告した。これらの方法は、特に流体管理および不向性サポートに関して、ARHFの分野で将来の研究プロトコルを構築するためのバックグラウンドデータを提供することができる。
血行力学的妥協を誘発することは、動物の予期せぬ即時死のリスクのために、モデルの重要なステップでした。その結果、小さな塞栓量を伴う進行性肺塞栓症を誘発することをお勧めします。肺塞栓症の時に、研究者はすぐにデータ取得と血行力学的サポートを開始する準備ができているはずです。私たちの経験では、プロトコルが完成した7匹のうち6匹の動物のうち6匹でドブタミンを開始する前に、PVループ獲得と心エコーを実現することができました。
右心室を表現する重要なステップは、包括的な血行力学、PVループおよび心エコーデータを得る。右心カテーテル法により、各状態の心臓出力と脳卒中の体積変化を推定することができます。心拍出量および脳卒中容積の変化は、心エコー検査でさらに評価することができる。この心拍出量と打撃量のマルチモーダル分析は、PVループの外部容積較正をより良く変化させます。重要なことに、PVループパラメータの絶対値と変化率は、各状況に対して実行される外部方法で心拍出量と脳卒中量変化を含めることによって、より正確に定量化することができます。
我々は、体積負荷が血行力学的妥協を誘発するのではなく、心室と動脈の結合を維持した心拍出量、脳卒中量および全身圧の増加を観察した際に、PHモデルの適応表現型を明らかにすることを観察した。したがって、我々のモデルでは、初期体積負荷は、急性肺塞栓症後の心拍出量および脳卒中量の大きな低下を観察する条件を提供し、したがってモデルの感受性を増加させた。今後の研究では、血力学的妥協時の体積負荷または流体の枯渇の影響を決定する必要があります。
プロトコルには、いくつかの制限があります。このプロトコルは浮腫の原因を分析するために構築されたものではありませんが、興味深い研究分野を表す可能性があります。プロトコルのもう 1 つの制限は、時間消費とすべての手順を実行するために必要なスキルです。体積負荷相は、プロトコルから短縮または除去することができるが、これは、急性肺塞栓症後の心拍出量および脳卒中量の絶対値の低下をもたらす可能性がある。プロトコルを実行するために必要なスキルは、蛍光検査の下にカテーテルを配置し、心エコー検査を行い、PVループ品質をリアルタイムで分析するために、いくつかの研究者の協力を必要とします。RVボリュームの3次元評価は行わなかったことを認めます。RV PVループ評価のためのRVボリュームキャリブレーションの精度を高める可能性があるため、RVボリュームの3次元評価を目指します。最初のステップの 1 つは、メソッドの実現可能性を評価することです。さらに、当社のプロトコルは、侵襲的なRV評価のための手術室や蛍光検査などの特定の施設を必要とします。
我々の知る限りでは、慢性PHを有するARHFの最初の動物モデルについて述べた。これまでの研究では、急性肺動脈収縮後のドブタミンおよびレボシミンダンによる右心室の動的変化が報告された。また、我々のグループでは、血行力学的妥協のない慢性PHのドブタミン注入を用いてRV予備を定量化した。マルチビートPVループは、最終収縮期のエラストを定量化するゴールドスタンダード法と考えられており、これは読み込み条件16とは無関係に心室収縮性を表します。RV エラストアンス (Ees=終端収縮期のエラスト) 絶対値は、いくつかの方法論的限界があるので、注意して解釈する必要があります。主な限界は、終点収縮点の定義と外部法による体積較正の精度(熱希釈および心エコー検査)17である。心室-動脈結合(Ees/Ea)比として知られる、動脈のエラストネスに対するエンドシストリックエラストの比率(脳卒中体積比に対するEa=エンド・シストリック圧)は、外部容積較正による誤差を減少させます。心室と動脈の結合は、後負荷の増加に対するRV収縮性の適応を捉える肺高血圧症の分野で大きな関心を持つ。RVの後負荷適応を測定する方法は、PH18,19,20患者のより良いフェノタイピングを有するため、近年大きな関心を集めています。
我々の方法は、心室の評価を用いて、以前に公表された値21 とRV関数推定と一致する腹腔-動脈結合(すなわち、Ees/Ea)の値を提供した。このプロトコルでは、血行力学的妥協の文脈で行うと急性大静脈閉塞が安全であることを示す。さらに、大型動物モデルにおけるRV心エコー評価は、RVリモデリング22を有する以前に報告されたマウスモデルと比較して異なるRV機能パラメータを定量化することができた小動物モデルにおけるRV心エコー評価から相補的であった。
この研究で説明されている方法は、ARHFの分野における主要な問題に対処することを目的としたさまざまな研究プロトコルに使用することができる。第一に、これらの方法は、慢性PH.に関するARHFの文脈で異なる治療戦略を比較することを目的とした研究プロトコルを実行するために使用することができ、反復および同時PVループおよび心エコー検査評価は、臨床的関心の異なる状況で心エコー検査指数を検証することを可能にすることができる。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、投資ダベニールプログラムの一環としてフランス国立研究庁(ANR)が監督する公的助成金によって支えられている(参照:ANR-15RHUS0002)。
資料
| Name | Company | Catalog Number | Comments |
| Radiofocus Introducer II | Terumo | RS+B80K10MQ | catheter sheath |
| Equalizer, Occlusion Ballon Catheter | Boston Scientific | M001171080 | ballon for inferior vena cava occlusion |
| Guidewire | Terumo | GR3506 | 0.035; angled |
| Vigilance monitor | Edwards | VGS2V | Swan-Ganz associated monitor |
| Swan-Ganz | Edwards | 131F7 | Swan-Ganz catheter 7 F; usable lenghth 110 cm |
| Echocardiograph; Model: Vivid 9 | General Electrics | GAD000810 and H45561FG | Echocardiograph |
| Probe for echo, M5S-D | General Electrics | M5S-D | Cardiac ultrasound transducer |
| MPVS-ultra Foundation system | Millar | PL3516B49 | Pressure-volume loop unit; includes a powerLab16/35, MPVS-Ultra PV Unit, bioamp and bridge amp and cables |
| Ventricath 507 | Millar | VENTRI-CATH-507 | conductance catheter |
| Lipiodol ultra-fluid | Guerbet | 306 216-0 | lipidic contrast dye |
| BD Insyte Autoguard | Becton, Dickinson and Company | 381847 | IV catheter |
| Arcadic Varic | Siemens | A91SC-21000-1T-1-7700 | C-arm |
| Prolene 5.0 | Ethicon | F1830 | polypropilene monofil |
参考文献
- Harjola, V. P., et al. Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology. European Journal of Heart Failure. 18 (3), 226-241 (2016).
- Haddad, F., et al. Characteristics and outcome after hospitalization for acute right heart failure in patients with pulmonary arterial hypertension. Circulation: Heart Failure. 4 (6), 692-699 (2011).
- Sztrymf, B., et al. Prognostic factors of acute heart failure in patients with pulmonary arterial hypertension. European Respiratory Journal. 35 (6), 1286-1293 (2010).
- Huynh, T. N., Weigt, S. S., Sugar, C. A., Shapiro, S., Kleerup, E. C. Prognostic factors and outcomes of patients with pulmonary hypertension admitted to the intensive care unit. Journal of Critical Care. 27 (6), 739(2012).
- Boulate, D., et al. Early Development of Right Ventricular Ischemic Lesions in a Novel Large Animal Model of Acute Right Heart Failure in Chronic Thromboembolic Pulmonary Hypertension. Journal of Cardiac Failure. 23 (12), 876-886 (2017).
- Noly, P. E., et al. Chronic Thromboembolic Pulmonary Hypertension and Assessment of Right Ventricular Function in the Piglet. Journal of Visualized Experiments. (105), e53133(2015).
- Kerbaul, F., et al. Effects of levosimendan versus dobutamine on pressure load-induced right ventricular failure. Critical Care Medicine. 34 (11), 2814-2819 (2006).
- Ratliff, N., Peter, R., Ramo, B., Somers, W., Morris, J. A model for the production of right ventricular infarction. The American journal of pathology. 58 (3), 471(1970).
- Ballard-Croft, C., Wang, D., Sumpter, L. R., Zhou, X., Zwischenberger, J. B. Large-animal models of acute respiratory distress syndrome. The Annals of Thoracic Surgery. 93 (4), 1331-1339 (2012).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circulation: Heart Failure. 2 (3), 262-271 (2009).
- Letsou, G. V., et al. Improved left ventricular unloading and circulatory support with synchronized pulsatile left ventricular assistance compared with continuous-flow left ventricular assistance in an acute porcine left ventricular failure model. The Journal of Thoracic and Cardiovascular Surgery. 140 (5), 1181-1188 (2010).
- Mercier, O., et al. Piglet model of chronic pulmonary hypertension. Pulmonary Circulation. 3 (4), 908-915 (2013).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: a new technique. Acta Radiologica. (5), 368-376 (1953).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal - Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Guihaire, J., et al. Right ventricular reserve in a piglet model of chronic pulmonary hypertension. European Respiratory Journal. 45 (3), 709-717 (2015).
- Burkhoff, D. Pressure-volume loops in clinical research: a contemporary view. Journal of the American College of Cardiology. 62 (13), 1173-1176 (2013).
- Sagawa, K. The end-systolic pressure-volume relation of the ventricle: definition, modifications and clinical use. Circulation. 63 (6), 1223-1227 (1981).
- Amsallem, M., et al. Load Adaptability in Patients With Pulmonary Arterial Hypertension. The American Journal of Cardiology. 120 (5), 874-882 (2017).
- Dandel, M., Knosalla, C., Kemper, D., Stein, J., Hetzer, R. Assessment of right ventricular adaptability to loading conditions can improve the timing of listing to transplantation in patients with pulmonary arterial hypertension. The Journal of Heart and Lung Transplantation. 34 (3), 319-328 (2015).
- Vanderpool, R. R., et al. RV-pulmonary arterial coupling predicts outcome in patients referred for pulmonary hypertension. Heart. 101 (1), 37-43 (2015).
- Boulate, D., et al. Pulmonary Hypertension. , Springer. 241-253 (2016).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved