Method Article
Induktion und Phänotypisierung der akuten Rechtsherzinsuffizienz in einem Großtiermodell der chronischen thromboembolischen pulmonalen Hypertonie
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll vor, um eine akute Rechtsherzinsuffizienz in einem großen Tiermodell mit chronischer pulmonaler Hypertonie zu induzieren und zu phänotypisieren. Dieses Modell kann verwendet werden, um therapeutische Interventionen zu testen, Rechtsherzmetriken zu entwickeln oder das Verständnis der Pathophysiologie der akuten Rechtsherzinsuffizienz zu verbessern.
Zusammenfassung
Die Entwicklung einer akuten Rechtsherzinsuffizienz (ARHF) im Zusammenhang mit chronischer pulmonaler Hypertonie (PH) ist mit schlechten kurzfristigen Ergebnissen verbunden. Die morphologische und funktionelle Phänotypisierung des rechten Ventrikels ist im Rahmen der hämodynamischen Kompromittierung bei Patienten mit ARHF von besonderer Bedeutung. Hier beschreiben wir eine Methode zur Induktion von ARHF in einem zuvor beschriebenen Großtiermodell des chronischen PH und zum Phänotyp der rechtsventrikulären Funktion unter Verwendung der Goldstandardmethode (dh Druckvolumen-PV-Schleifen) und mit einer nicht-invasiven klinisch verfügbaren Methode (dh Echokardiographie). Chronischer pH-Wert wird bei Schweinen zunächst durch die Ligatur der linken Lungenarterie und die Embolie des rechten Unterlappens mit biologischem Klebstoff einmal wöchentlich für 5 Wochen induziert. Nach 16 Wochen wird ARHF durch sukzessive Volumenbelastung mit Kochsalzlösung induziert, gefolgt von einer iterativen Lungenembolie, bis das Verhältnis des systolischen Lungendrucks zum systemischen Druck 0,9 erreicht oder bis der systolische systemische Druck unter 90 mmHg sinkt. Die Hämodynamik wird mit der Dobutamininfusion (von 2,5 μg/kg/min bis 7,5 μg/kg/min) wiederhergestellt. PV-Schleifen und Echokardiographie werden während jeder Bedingung durchgeführt. Jede Bedingung benötigt etwa 40 Minuten für Induktion, hämodynamische Stabilisierung und Datenerfassung. Von 9 Tieren starben 2 unmittelbar nach einer Lungenembolie und 7 absolvierten das Protokoll, das die Lernkurve des Modells veranschaulicht. Das Modell induzierte einen 3-fachen Anstieg des mittleren Lungenarteriendrucks. Die PV-Loop-Analyse zeigte, dass die ventrikulo-arterielle Kopplung nach Volumenbelastung erhalten blieb, nach akuter Lungenembolie abnahm und mit Dobutamin wiederhergestellt wurde. Echokardiographische Aufnahmen ermöglichten es, rechtsventrikuläre Parameter der Morphologie und Funktion mit guter Qualität zu quantifizieren. Wir identifizierten rechtsventrikuläre ischämische Läsionen im Modell. Das Modell kann verwendet werden, um verschiedene Behandlungen zu vergleichen oder nicht-invasive Parameter der rechtsventrikulären Morphologie und Funktion im Kontext von ARHF zu validieren.
Einleitung
Akute Rechtsherzinsuffizienz (ARHF) wurde kürzlich als ein schnell fortschreitendes Syndrom mit systemischer Stauung definiert, das sich aus einer gestörten rechtsventrikulären (RV) Füllung und / oder einer verminderten RV-Flussleistung ergibt1. ARHF kann bei verschiedenen Erkrankungen wie linksseitiger Herzinsuffizienz, akuter Lungenembolie, akutem Myokardinfarkt oder pulmonaler Hypertonie (PH) auftreten. Im Falle von PH ist der Beginn der ARHF mit einem 40%igen Risiko für eine kurzfristige Mortalität oder eine dringende Lungentransplantation verbunden2,3,4. Hier beschreiben wir, wie man ein großes Tiermodell von ARHF im Setting der chronischen pulmonalen Hypertonie erstellt und wie man den rechten Ventrikel mittels Echokardiographie und Druck-Volumen-Schleifen bewertet.
Zu den pathophysiologischen Merkmalen von ARHF gehören RV-Drucküberlastung, Volumenüberlastung, eine Abnahme der RV-Leistung, eine Erhöhung des zentralvenösen Drucks und / oder eine Abnahme des systemischen Drucks. Bei chronischer PH kommt es zu einer anfänglichen Zunahme der RV-Kontraktilität, die es ermöglicht, das Herzzeitvolumen trotz der Zunahme des pulmonalen Gefäßwiderstands zu erhalten. Daher kann der rechte Ventrikel im Rahmen von ARHF bei chronischem PH nahezu isosystemische Drücke erzeugen, insbesondere unter inotroper Unterstützung. Zusammengenommen führen ARHF bei chronischem PH und hämodynamische Wiederherstellung mit Inotropen zur Entwicklung akuter RV-ischämischer Läsionen, wie kürzlich in unserem Großtiermodell5 beschrieben. Der Anstieg der Inotrope erzeugt einen erhöhten energetischen Bedarf, der ischämische Läsionen weiter entwickeln und schließlich zur Entwicklung von Endorganfunktionsstörungen und schlechten klinischen Ergebnissen führen kann. Es gibt jedoch keinen Konsens darüber, wie Patienten mit ARHF auf PH behandelt werden sollen, hauptsächlich in Bezug auf Flüssigkeitsmanagement, Inotrope und die Rolle der extrakorporalen Kreislaufunterstützung. Folglich kann ein großes Tiermodell für akute Rechtsherzinsuffizienz dazu beitragen, präklinische Daten zum klinischen Management von ARHF bereitzustellen.
Als ersten Schritt zur Quantifizierung des Ansprechens auf die Therapie werden einfache und reproduzierbare Methoden zum Phänotyp des rechten Ventrikels benötigt. Bis heute gibt es keinen Konsens darüber, wie die Morphologie und Funktion von Patienten mit ARHF besser phänotypisiert werden kann. Die Goldstandardmethode zur Bewertung der RV-Kontraktilität (d.h. der intrinsischen Kontraktionsfähigkeit) und der ventrikulo-arteriellen Kopplung (d.h. der durch ventrikuläre Nachlast normalisierte Kontraktilität; ein Index der ventrikulären Anpassung) ist die Analyse von Druck-Volumen-Schleifen (PV). Diese Methode ist zweimal invasiv, da sie eine Katheterisierung des rechten Herzens und eine vorübergehende Verringerung der RV-Vorbelastung mit einem Ballon erfordert, der in die untere Hohlvene eingeführt wird. In der klinischen Praxis werden nicht-invasive und wiederholbare Methoden zur Beurteilung des rechten Ventrikels benötigt. Die kardiale Magnetresonanz (CMR) gilt als Goldstandard für die nicht-invasive Beurteilung des rechten Ventrikels. Bei Patienten mit ARHF unter chronischer PH, die auf der Intensivstation (ICU) behandelt werden, kann die Anwendung von CMR aufgrund des instabilen hämodynamischen Zustands des Patienten eingeschränkt sein; Darüber hinaus können wiederholte CMR-Auswertungen mehrmals täglich, auch nachts, aufgrund ihrer Kosten und begrenzten Verfügbarkeit eingeschränkt sein. Umgekehrt ermöglicht die Echokardiographie nicht-invasive, reproduzierbare und kostengünstige RV-Morphologie und Funktionsbewertungen bei Intensivpatienten.
Großtiermodelle sind ideal, um präklinische Studien durchzuführen, die sich auf die Beziehung zwischen invasiven hämodynamischen Parametern und nicht-invasiven Parametern konzentrieren. Die Anatomie des großen weißen Schweins ist dem Menschen nahe. Folglich sind die meisten der beim Menschen beschriebenen echokardiographischen Parameter bei Schweinen quantifizierbar. Zwischen Menschlichem und Schweineherz bestehen einige geringfügige Unterschiede, die bei echokardiographischen Studien berücksichtigt werden müssen. Schweine zeigen eine konstitutionelle Dextrokardie und eine leicht gegen den Uhrzeigersinn gerichtete Rotation der Herzachse. Dadurch wird die apikale 4-Kammer-Ansicht zu einer apikalen 5-Kammer-Ansicht und das Akustikfenster befindet sich unterhalb des Xiphoid-Blinddarms. Darüber hinaus befinden sich auf der rechten Seite des Brustbeins parasternale Achsansichten mit langen und kurzen Achsen.
Hier beschreiben wir eine neuartige Methode, um ARHF in einem großen Tiermodell des chronisch thromboembolischen PH zu induzieren und die Hämodynamik unter Verwendung von Dobutamin wiederherzustellen. Wir berichten auch über RV-ischämische Läsionen, die im Modell innerhalb von 2-3 Stunden nach hämodynamischer Wiederherstellung mit Dobutamin vorhanden sind. Darüber hinaus beschreiben wir, wie RV-PV-Schleifen und echokardiographische RV-Parameter bei jeder Bedingung erfasst werden können, um Einblicke in die dynamischen Veränderungen in der Morphologie und Funktion von RV zu erhalten. Da zuvor das Großtiermodell des chronisch thromboembolischen PH und die PV-Loop-Methoden beschrieben wurden6, werden diese Abschnitte kurz beschrieben. Außerdem berichteten wir über Ergebnisse von echokardiographischen Auswertungen, die in Schweinemodellen als potenziell schwierig angesehen werden. Wir werden die Methoden erklären, um eine wiederholte Echokardiographie im Modell zu erreichen.
Das in dieser Studie berichtete Modell von ARHF zur chronischen PH kann verwendet werden, um verschiedene therapeutische Strategien zu vergleichen. Die Methoden der RV-Phänotypisierung können in anderen großen Tiermodellen verwendet werden, die klinisch relevante Situationen wie akute Lungenembolie7, RV-Myokardinfarkt8, akutes Atemnotsyndrom9 oder Rechtsherzinsuffizienz im Zusammenhang mit linksventrikulärem Versagen10 oder linksventrikulärer mechanischer Kreislaufunterstützung11 nachahmen.
Protokoll
Die Studie entsprach den Grundsätzen der Labortierpflege gemäß der National Society for Medical Research und wurde vom lokalen Ethikkomitee für Tierversuche im Hospital Marie Lannelongue genehmigt.
1. Chronische thromboembolische PH
- Induzieren Sie chronische thromboembolische PH wie zuvor beschrieben6,12.
- Kurz gesagt, induzieren Sie ein Modell der chronischen thromboembolischen pH-Werte bei etwa 20 kg großen weißen Schweinen (sus scrofa). Führen Sie eine Ligatur der ligatur der linken Lungenarterie durch eine linke Thorakotomie in Woche 0 durch (geschlossenes Perikard); und wöchentlich eine Embolisation der rechten Lungenarterie des unteren Lappens (0,2 ml bis 0,4 ml pro Woche) mit einer Mischlösung durchführen, die aus 1 ml Weichteilkleber einschließlich N-Butyl-2-cyanoacrylat und 2 ml Lipidkontrastfarbstoff (Lipiodol) für 5 Wochen besteht.
- Führen Sie eine Xyphoïdeektomie in Woche 0 zum Zeitpunkt der Ligatur der linken Lungenarterie durch, um die Durchführbarkeit der Echokardiographie zu verbessern. Führen Sie dazu einen 4 cm langen Längsschnitt vor dem Xiphoid-Prozess durch. Entfernen Sie den Xyphoid-Prozess mit einem Diathermiemesser. Schließen Sie den subkutanen Plan und die Haut mit einer laufenden Naht.
- Führen Sie in Woche 10 eine zusätzliche Lungenembolie im rechten Unterlappen durch, indem Sie das gleiche Protokoll verwenden, das oben beschrieben wurde (Schritt 1.2).
- Führen Sie das ARHF-Induktionsmodell (Abschnitt 6) 6 Wochen nach der letzten rechten unteren Lappenembolisation (Woche 16) durch, um akute Rechtsherzläsionen zu vermeiden, die durch akute Lungenembolien induziert werden.
HINWEIS: Ein anderes großes Tiermodell der Rechtsherzinsuffizienz kann verwendet werden, oder andere pathologische Zustände können im chronisch-thromboembolischen PH-Modell induziert werden.
2. Tierhaltung und Katheterplatzierung
- Führen Sie eine Vollnarkose wie zuvor beschrieben durch6.
- Lassen Sie das Tier kurz 12 h fasten. Führen Sie dann eine intramuskuläre Injektion von Ketaminhydrochlorid (30 mg/kg) zur Prämedikation durch. Führen Sie einen intravenösen Bolus von Fentanyl (0,005 mg/kg), Propofol (2 mg/kg) und Cisatracurium (0,3 mg/kg) intravenös durch eine Ohrvene durch und intubieren Sie das Schwein nicht selektiv mit einer 7 französischen Sonde.
- Aufrechterhaltung der Vollnarkose mit inhalativem 2% Isofluran, kontinuierliche Infusion von Fentanyl (0,004 mg/kg) und Propofol (3 mg/kg).
- Positionieren Sie das Schwein nach der Einleitung der Vollnarkose mit den Vorderbeinen auf dem Rücken in einer leicht gespreizten Position, um eine parasternale echokardiographische Erfassung zu ermöglichen (Abschnitt 3).
- Platzieren Sie die Geräteelektroden vor dem Einsetzen der sterilen Felder an Armen und Beinen (Echokardiograph, Workstation für hämodynamische Aufnahmen).
- Legen Sie nach der Seldinger Methode13 eine 8-französische Scheide in die Vena jugularis.
- Führen Sie einen 18 G (1,3 mm x 48 mm) IV-Katheter in die Jugularvene ein.
- Führen Sie eine perkutane Punktion an der Mittellinie 2 cm über dem Manubrium mit einer 45°-Ausrichtung durch.
- Nachdem Sie einen venösen Reflux erhalten haben, führen Sie einen Führungsdraht in den Katheter ein (0,035 Zoll / 0,089 mm, 180 cm, abgewinkelt).
- Überprüfen Sie die korrekte Platzierung des Führungsdrahtes in der oberen Hohlvene mit Durchleuchtung und entsorgen Sie die 8-französische Scheide auf dem Führungsdraht in die obere Hohlvene.
HINWEIS: Der Führungsdraht wird richtig platziert, wenn er entlang des rechten Randes der Wirbelsäule durch die untere Hohlvene verläuft.
- Führen Sie einen 18 G (1,3 mm x 48 mm) IV-Katheter in die Jugularvene ein.
- Führen Sie eine Teilung der rechten Femurgefäße durch, um einen flüssigkeitsgefüllten Katheter in die rechte Oberschenkelarterie zur kontinuierlichen systemischen Drucküberwachung einzuführen, und einen Ballondilatationskatheter in die vena cava inferior durch die Oberschenkelvene wie folgt.
- Führen Sie einen 4 cm langen Querschnitt an der Leistengegend durch.
- Legen Sie einen Beckman-Retraktor auf und teilen Sie die vordere Seite der Oberschenkelvene und der Oberschenkelarterie mit einer Debackey-Pinzette und einer Metzenbaum-Schere.
- Legen Sie einen 20 G-Katheter unter direkter visueller Kontrolle in die Oberschenkelarterie und verbinden Sie ihn mit einem mit Flüssigkeit gefüllten Katheter an einen Einwegwandler, um eine kontinuierliche systemische Blutdrucküberwachung zu erhalten.
HINWEIS: Der mittlere Blutdruck sollte kontinuierlich über 60 mmHg liegen. - Verwenden Sie einen 18 G Katheter, um einen Führungsdraht (0,035 Zoll / 0,089 mm, 180 cm, abgewinkelt) durch die untere Hohlvene in die Oberschenkelvene unter fluoroskopischer Kontrolle einzuführen.
- Führen Sie einen Ballondilatationskatheter auf dem Führungsdraht durch die untere Hohlvene auf intraperikarder Ebene unter fluoroskopischer Kontrolle ein.
- Führen Sie die fluoroskopische Kontrolle mit einem C-Bogen unter Verwendung einer anteroposterioren Ansicht durch. Platzieren Sie die sichtbaren Markierungen des Ballons unmittelbar über dem Zwerchfellniveau unter fluoroskopischer Kontrolle. Entfernen Sie den Führungsdraht, wenn der Ballon platziert wird.
- Nähen Sie eine Handtasche mit einer 5.0 Polypropylen-Monofilamentnaht um den venösen Dilatationsballonkatheter, um Blutungen aus der Oberschenkelvene zu vermeiden.
3. Echokardiographie
- Führen Sie die Echokardiographie direkt nach der Tierpositionierung und der Katheterplatzierung (Abschnitt 2) bei Tieren durch, die noch unter Vollnarkose und mechanischer Beatmung stehen.
- Erfassen Sie jede echokardiographische Ansicht im Cine-Loop-Format für mindestens 3 Herzzyklen während der endexspiratorischen Apnoe.
- Erfassen Sie alle Ansichten in den Modi 2-Dimension und Tissue Doppler.
- Erwerben Sie die apikale 5-Kammer-Ansicht unter dem Xiphoid-Prozess.
- Erfassen Sie die parasternalen Kurz- und Langachsenansichten auf der rechten Seite des Brustbeins.
- Erfassen Sie die Valvularströmung mit kontinuierlichen und gepulsten Dopplermodi.
- Erfassen Sie Gewebe-Doppler-Signale des lateralen Trikuspidalannulus und des lateralen und septalen Mitralannulus.
HINWEIS: Verwenden Sie die neuesten Richtlinien für die echokardiographische Beurteilung beim Menschen für echokardiographische Erfassungen und Interpretationen14.
4. Katheterisierung des rechten Herzens
- Durchführung der Rechtsherzkatheteruntersuchung nach dem Herzecho (Abschnitt 3) und vor der Druck-Volumen-Schleifenerfassung (Abschnitt 5)
- Verbinden Sie den Swan-Ganz-Katheter mit dem Einwegwandler.
- Führen Sie den Swan-Ganz-Katheter in die juguläre 8-French-Hülle ein, die zuvor in die Jugularvene eingeführt wurde (Abschnitt 2.4), und erwerben Sie den mittleren rechten Vorhof-, rechtsventrikulären und pulmonalen Arteriendruck. Legen Sie den Katheter bei Bedarf unter Fluoroskopie.
HINWEIS: Überprüfen Sie, ob flüssigkeitsgefüllte Katheter gut mit Kochsalzlösung gereinigt sind, und entfernen Sie Luftblasen, um eine Drucksignaldämpfung zu vermeiden. - Nachdem Sie den Swan-Ganz-Katheter in die Lungenarterie gelegt haben, messen Sie das Herzzeitvolumen mit der Thermodilutionsmethode, wie in den Anweisungen des Herstellers erläutert; Messen Sie gleichzeitig die Herzfrequenz für die Berechnung des Schlagvolumens.
- Stellen Sie sicher, dass die Kochsalzlösung bei 4 °C liegt, um eine Überschätzung des Herzzeitvolumens zu vermeiden.
- Schließen Sie den Einwegwandler an die PV-Loop-Arbeitsstation an, um die Drücke von flüssigkeitsgefüllten Kathetern live zu erfassen.
5. Erfassung des Druckvolumenkreislaufs mit der Leitfähigkeitsmethode
HINWEIS: Dieser Abschnitt wurde bereits veröffentlicht15.
- Führen Sie den Leitfähigkeitskatheter unter fluoroskopischer Kontrolle in den rechten Ventrikel ein.
- Überprüfen Sie das Qualitätssignal mithilfe der " live"-Erfassung von Druck-Volumen-Schleifen.
- Aktivieren Sie geeignete Elektroden, um ein optimales Signal zu erhalten (d. H. PV-Schleifen gegen den Uhrzeigersinn mit physiologischer Form).
- Verfolgen Sie die Druck- und Volumenkalibrierungsschritte des Workflows gemäß den Anweisungen des Herstellers (Blutleitfähigkeit, Parallelvolumen, Hubvolumenkalibrierung = Alpha-Kalibrierung).
HINWEIS: Schlaganfall extern mit dem Swan-Ganz-Katheter kann für jede Bedingung wiederholt werden; während die anderen Kalibrierschritte nur einmal durchgeführt werden können. - Erwerben Sie PV-Loop-Familien in stationären Zuständen und während der akuten Vorlastreduktion (d. H. Akute Okklusion der unteren Hohlvene) während der endexspiratorischen Apnoe.
- Führen Sie mindestens 3 Akquisitionen pro Bedingung durch (stetige + IVC-Okklusion).
6. Induktion der akuten Rechtsherzinsuffizienz durch Volumen- und Drucküberlastung (Abbildung 1).
- Induzieren Sie eine Volumenüberlastung mit einer 3-stufigen Kochsalzinfusion (ca. 2 h).
- Beginnen Sie die erste Infusion von 15 ml/kg Kochsalzlösung mit einem frei fließenden Infusionsausgang.
- Führen Sie die Messungen (Rechter Herzkatheterismus, PV-Schleifen und echokardiographische) 5 min nach der hämodynamischen Stabilisierung nach dem Ende jeder Infusion durch.
- Beginnen Sie unmittelbar nach Dem Ende der Messungen mit der zweiten Volumeninfusion von 15 ml/kg.
- Beginnen Sie unmittelbar nach Dem Ende der Messungen mit der dritten Volumeninfusion von 30 ml/kg Kochsalzlösung.
VORSICHT: Die Volumenbelastung kann je nach verwendetem Tiermodell zu einer hämodynamischen Kompromittierung oder einem Lungenödem führen. In diesem Modell zeigte die Volumenbelastung eine adaptive Reaktion, die durch eine Erhöhung des Herzzeitvolumens, einen stabilen rechten Vorhofdruck und eine erhaltene ventrikulo-arterielle Kopplung gekennzeichnet ist.
HINWEIS: Die Volumenbelastung kann bei schlechter respiratorischer oder hämodynamischer Toleranz gestoppt werden.
- Induzieren Sie eine Drucküberlastung mit iterativer Lungenembolie.
- Führen Sie einen 5 französischen angiographischen Katheter durch die Jugularscheide unter fluoroskopischer Kontrolle in die rechte Lungenarterie des Unterlappens ein.
- Embolisieren Sie die rechte Lungenarterie des unteren Lappens mit einem Bolus von 0,15 ml einer gemischten Lösung, die aus 1 ml Weichteilkleber einschließlich N-Butyl-2-Cyanacrylat und 2 ml lipidischem Kontrastfarbstoff besteht. Waschen Sie den Katheter mit 10 ml Kochsalzlösung aus.
- Bewerten Sie das hämodynamische Ansprechen 2 Minuten nach der Embolisation unter Verwendung des systemischen Drucks und des Lungenarteriendrucks.
- Wiederholen Sie Embolien von 0,15 ml alle 2 Minuten, bis ein hämodynamischer Kompromiss erreicht ist (d. h. systolischer Systemdruck <90 mmHg oder systolischer Lungendruck über dem systolischen systemischen Druckverhältnis >0,9).
VORSICHT: Eine Lungenembolie kann zu schweren hämodynamischen Beeinträchtigungen führen, die manchmal irreversibel sind und zum sofortigen Tod führen. Bevor Sie mit dem Embolisationsschritt beginnen, seien Sie bereit, mit der hämodynamischen Unterstützung zu beginnen (Dobutamin-Protokoll oder Adrenalin im Falle eines Kreislaufstillstands). Seien Sie bereit, PV-Schleifen und echokardiographische Überwachung zu starten. Da dieser Schritt mit einer schweren hämodynamischen Beeinträchtigung verbunden sein kann, kann eine Rechtsherzkatheterisierung mit dem Swan-Ganz-Katheter vermieden werden, um früher mit der Dobutaminunterstützung zu beginnen.
7. Induzieren Sie die Wiederherstellung der systemischen Hämodynamik mit Dobutamin
- Nachdem Sie einen hämodynamischen Kompromiss erreicht und PV-Schleifen und echokardiographische Akquisitionen durchgeführt haben, beginnen Sie mit der Dobutamininfusion bei 2,5 μg/kg/min.
HINWEIS: Andere Medikamente oder Behandlungen können zu diesem Zeitpunkt begonnen werden. - Warten Sie 10 bis 15 Minuten auf die hämodynamische Stabilisierung.
- Führen Sie Rechtsherzkatheterisierungen, PV-Schleifen und echokardiographische Aufnahmen durch.
- Erhöhen Sie die Dosis der Dobutamin-Infusion auf 5 μg/kg/min.
- Warten Sie 15 Minuten auf die hämodynamische Stabilisierung und wiederholte Akquisitionen.
- Wiederholen Sie die Katheterisierung des rechten Herzens, PV-Schleifen und echokardiographische Aufnahmen.
- Erhöhen Sie die Dosis der Dobutamin-Infusion auf 7,5 μg/kg/min.
HINWEIS: Andere Dosen, Medikamente oder Behandlungen können eingeleitet werden.
8. Euthanasie und Herzgewebeentnahme
- Führen Sie am Ende des Protokolls eine mittlere Sternotomie mit einer oszillierenden Säge durch.
- Öffnen Sie das Perikard und injizieren Sie eine tödliche Kaliumchloridlösung (0,2 g/kg).
- Ernte das Herz; Proben der rechten und linken ventrikulären Freiwand für pathologische und molekulare Auswertungen auswählen.
ANMERKUNG: Die Methoden für die pathologischen Beurteilungen des rechten Ventrikels und für die Statistik wurden zuvor berichtet5.
Ergebnisse
Machbarkeit
Wir beschreiben die Ergebnisse von 9 aufeinanderfolgenden Verfahren der ARHF-Induktion in einem zuvor berichteten CTEPH-Modell für Großtiere5. Die Dauer des Protokolls betrug etwa 6 Stunden, einschließlich Anästhesieinduktion, Installation, Gefäßzugang / Katheterplatzierungen, Induktion von Volumen- / Drucküberlastung und hämodynamischer Wiederherstellung, Datenerfassung und Euthanasie. Jede hämodynamische Erkrankung benötigt etwa 40 Minuten, um die Induktion des Zustands, die hämodynamische Stabilisierung und die Datenerfassung zu erreichen.
Das Protokoll wurde bei 7 von 9 Tieren erreicht, was die Lernkurve darstellt. Drei zusätzliche Protokolle wurden erfolgreich erreicht, nachdem diese beschrieben (nicht veröffentlicht) wurden. Die Ursache für die 2 Protokollausfälle war die Induktion eines irreversiblen hämodynamischen Versagens nach der Lungenemboliephase.
PV-Schleifen wurden bei 1 von 7 Tieren zum Zeitpunkt der hämodynamischen Kompromittierung nicht erworben, da nach dem Rechten Herzkatheterismus und dem Herzecho eine schnelle systemische hämodynamische Wiederherstellung mit einem Epinephrinbolus durchgeführt werden musste. In diesem Fall wurde Dobutamin unmittelbar nach der Wiederherstellung der systemischen Hämodynamik mit Adrenalin begonnen.
Auswirkungen von Volumen- und Drucküberlastung auf hämodynamik und RV-Funktion
Akute Volumenbelastung induzierte keine ARHF, sondern hob den adaptiven Phänotyp des chronischen PH-Modells hervor. Bei Volumenbelastung stieg das Herzzeitvolumen ohne Erhöhung des rechten Vorhofdrucks an, während die ventrikulo-arterielle Kopplung stabil blieb (Abbildung 2).
Hämodynamische Kompromisskriterien wurden nach 1 Embolus bei 1 Tier, 2 Embolien bei 2 Tieren, 3 Embolien bei 5 Tieren und 4 Embolien bei 1 Tier erreicht. Zwei Tiere starben unmittelbar nach PE (1 Tier mit 1 Embolus und 1 Tier mit 4 Embolien). Bei einem anderen Tier erforderte eine schwere Hypotonie einen Epinephrin-Bolus und den sofortigen Beginn von Dobutamin vor pv-loop- und echokardiographischen Datenerfassungen. Die 2 Todesfälle, die unmittelbar nach einer akuten Lungenembolie auftraten, waren mit einer akuten Thrombose der rechten Herzhöhlen assoziiert (wie in Abbildung 3 dargestellt).
Der hämodynamische Kompromiss war mit einer signifikanten Abnahme des Herzzeitvolumens, des Schlagvolumens und der ventrikulo-arteriellen Kopplung (Ees/ea) verbunden, während die RV-Kontraktilität stabil blieb (Abbildung 2); Es gab einen zweifachen Anstieg des rechten Vorhofdrucks und des mittleren Lungenarteriendrucks.
Dobutamin-Wirkung auf ARHF
Dobutamin stellte ein Herzzeitvolumen, ein Schlagvolumen und eine ventrikulo-arterielle Kopplung im normalen Bereich wieder her (Abbildung 2).
Echokardiographie
Die Echokardiographie war durchführbar und lieferte eine Quantifizierung dynamischer Änderungen der RV-Größe und -Funktion während des Protokolls (Abbildung 4). Echokardiographische Parameter wurden bei 1 Tier mit schwerer hämodynamischer Beeinträchtigung nach Lungenembolie, die einen Epinephrinbolus und sofortigen Beginn des Dobutamins erforderte, nicht beurteilt.
RV PV-loops
Die Druckvolumenschleifenanalyse ermöglichte die dynamische Quantifizierung der endsystolischen Elastanz von RV und der ventrikulo-arteriellen Kopplung (Abbildung 2 und Abbildung 5).
Rechtsventrikuläre ischämische Läsionen
Nach Hämatein-, Eosin- und Safranfärbung beobachteten wir RV-ischämische Läsionen im Subendokard und in den subepikardialen Schichten der RV-Freiwand (Abbildung 6). Die ischämischen Läsionen waren durch Cluster von hypereosinophilen Kardiomyozyten mit piprotischem Kern gekennzeichnet.

Abbildung 1: Protokollzusammenfassung. PH, pulmonale Hypertonie; VL1, Volumenbeladung mit 15 ml/kg Kochsalzlösung; VL2, 15 ml/kg Kochsalzlösung; VL3, 30 ml/kg Kochsalzlösung; ARHF, akute Rechtsherzinsuffizienz; PE, Lungenembolie. *systemischer systolischer Druck <90 mmHg oder systolisches pulmonal-systemisches Druckverhältnis >0,9. Diese Zahl wurde von 5 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
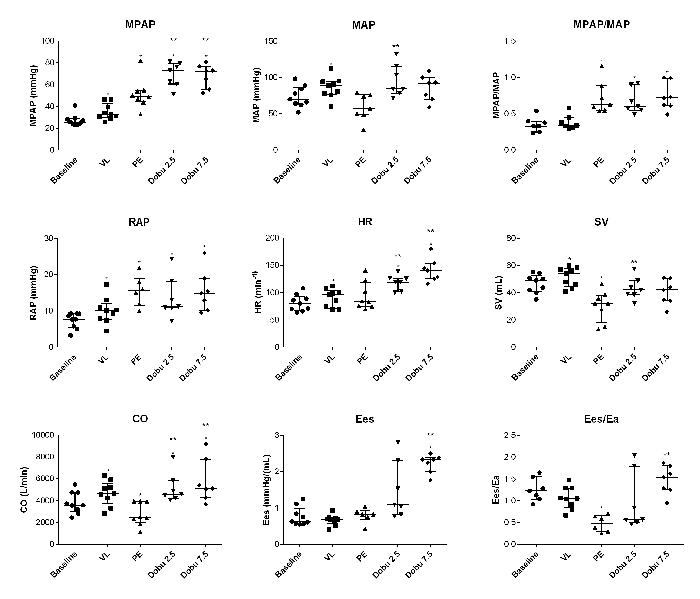
Abbildung 2: Individuelle hämodynamische und dynamische Änderungen der Druck-Volumen-Schleife. MPAP, mittlerer Lungenarteriendruck; MAP, mittlerer arterieller Druck; RAP, rechter Vorhofdruck; HR, Herzfrequenz; SV, Hubvolumen; CO, Herzzeitvolumen; Ees; rechtsventrikuläre endsystolische Elastanz; Ea, arterielle Elastanz. Plots sind der Median- und Interquartilsbereich. *P<0,05 im Vergleich zum Ausgangswert; Vergleiche wurden unter Verwendung von Wilcoxon Matched-Pairs-Signierrangtests mit GraphPad Prism 6 durchgeführt. Diese Zahl wurde von 5 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Beispiel für die Ursache des Protokollversagens: akute Rechtsherzthrombose (Pfeil) nach Lungenembolie, verantwortlich für irreversible hämodynamische Kompromittierung, sofortigen Tod und Protokollversagen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative echokardiographische Fenster und Ergebnisse. (A) Position für die Erfassung der apikalen 5-Kammer-Ansicht (A5C). (B) Position zur Erfassung der parasternalen Kurzachsenansicht (PSSAX). (C) Dynamische echokardiographische Auswertungen der A5C- und PSSAX-Ansichten während der verschiedenen Schritte des Protokolls. VL, Volumenladung; PE, Lungenembolie; Dobu 2,5, Dobutamin 2,5 μg/kg/min; Dobu 7,5, Dobutamin 7,5 μg/kg/min. *rechter Ventrikel; **linker Ventrikel. Diese Zahl wurde von 5 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Repräsentative dynamische RV-Multibeat-Druck-Volumen-Schleifen. PH, pulmonale Hypertonie; PE, Lungenembolie; Ees, endsystolische Elastanz (schwarze Linie mit der Aufschrift *); Ea, arterielle Elastanz (schwarze Linie beschriftet **); Ees/Ea, ventrikulo-arterielle Kopplung. Diese Zahl wurde von 5 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
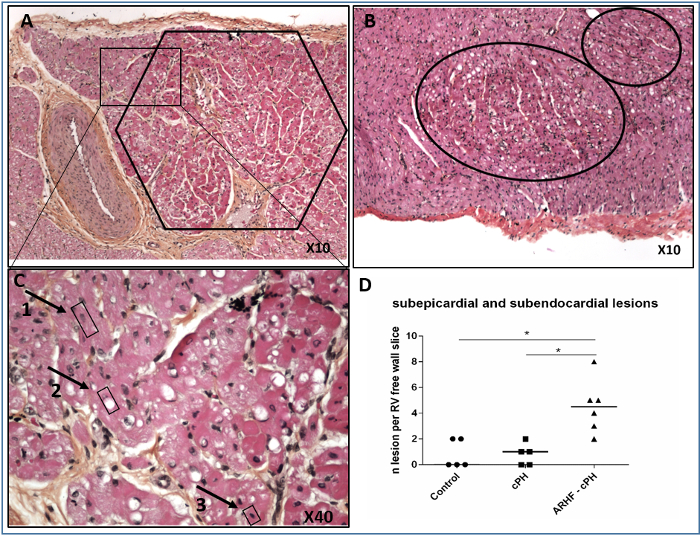
Abbildung 6: Repräsentative RV-ischämische Läsionen im Subendokard und in den Sub-Epicardium-Schichten. (A) Subepicardiale ischämische Läsion; B) subendokardiale ischämische Läsionen; (C) Vergrößerung einer Grenze einer subepikardialen ischämischen Läsion mit normalen Kernen (1), intrazytoplasmatische Vakuolisierung (2) und pyknotischen Kernen (3). (D) individuelle Anzahl subendokarder und subepikarder ischämischer Läsionen in 2 cm langen Proben von RV-Freiwand von Tieren mit akuter Rechtsherzinsuffizienz (ARHF) bei chronischer pulmonaler Hypertonie (PH), Tieren mit chronischem pH-Wert und gesunden Kontrollen; Plots sind Mediane. Die Vergleiche wurden mit dem Mann-Whitney-Test mit GraphPad Prism 6 durchgeführt. *S<0.05. Diese Zahl wurde von 5 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir beschreiben eine Methode, um wichtige pathophysiologische Merkmale von ARHF an chronischem PH in einem großen Tiermodell zu modellieren, einschließlich Volumen- und Drucküberlastung und hämodynamischer Wiederherstellung mit Dobutamin. Wir berichteten auch, wie man hämodynamische und bildgebende Daten erfasst, um die dynamischen Veränderungen des rechten Ventrikels bei jedem während des Protokolls erzeugten Zustand zu phänotypisieren. Diese Methoden können Hintergrunddaten liefern, um zukünftige Forschungsprotokolle im Bereich ARHF aufzubauen, insbesondere in Bezug auf Fluidmanagement und inotrope Unterstützung.
Die Herbeiführung eines hämodynamischen Kompromisses war ein kritischer Schritt im Modell, da das Risiko eines unerwarteten und sofortigen Todes des Tieres bestand. Folglich empfehlen wir, eine progressive Lungenembolie mit kleinen Embolusvolumina zu induzieren. Zum Zeitpunkt der Lungenembolie sollten die Forscher bereit sein, sofort mit der Datenerfassung und hämodynamischen Unterstützung zu beginnen. Nach unserer Erfahrung konnten wir die PV-Loop-Akquisitionen und die Echokardiographie vor Beginn des Dobutamins bei 6 von 7 Tieren, bei denen das Protokoll abgeschlossen wurde, realisieren.
Der entscheidende Schritt zum Phänotyp des rechten Ventrikels besteht darin, umfassende hämodynamische, PV-Schleifen- und echokardiographische Daten zu erhalten. Die Rechtsherzkatheterisierung ermöglicht es, die Veränderungen des Herzzeitvolumens und des Schlagvolumens für jede Erkrankung abzuschätzen. Veränderungen des Herzzeitvolumens und des Schlagvolumens können mit der Echokardiographie weiter ausgewertet werden. Diese multimodale Analyse von Herzzeitvolumen und Schlagvolumen verändert die externe Volumenkalibrierung der PV-Loops besser. Wichtig ist, dass absolute Werte und Änderungsraten von PV-Loop-Parametern genauer quantifiziert werden können, indem Änderungen des Herzzeitvolumens und des Schlagvolumens mit externen Methoden für jede Situation einbezogen werden.
Wir beobachteten, dass die Volumenbelastung keinen hämodynamischen Kompromiss induzierte, sondern den adaptiven Phänotyp des PH-Modells zeigte, da wir einen Anstieg des Herzzeitvolumens, des Schlagvolumens und des systemischen Drucks bei erhaltener ventrikulo-arterieller Kopplung beobachteten. Daher bot in unserem Modell die anfängliche Volumenbelastung die Voraussetzungen, um einen starken Abfall des Herzzeitvolumens und des Schlagvolumens nach akuter Lungenembolie zu beobachten, wodurch die Empfindlichkeit des Modells erhöht wurde. Zukünftige Studien sollten die Auswirkungen von Volumenbelastung oder Flüssigkeitsmangel zum Zeitpunkt der hämodynamischen Kompromittierung bestimmen.
Unser Protokoll hat mehrere Einschränkungen. Dieses Protokoll wurde nicht entwickelt, um die Ursache des Ödems zu analysieren, aber es kann ein interessantes Forschungsgebiet darstellen. Eine weitere Grenze des Protokolls ist der Zeitaufwand und die Fähigkeiten, die erforderlich sind, um alle Schritte auszuführen. Die Volumenladephase kann verkürzt oder aus dem Protokoll entfernt werden, dies kann jedoch zu einer geringeren Abnahme des absoluten Wertes des Herzzeitvolumens und des Schlagvolumens nach akuten Lungenembolien führen. Die für die Durchführung des Protokolls erforderlichen Fähigkeiten erfordern die Zusammenarbeit mehrerer Forscher, um den Katheter unter Fluoroskopie zu stellen, die Echokardiographie durchzuführen und die PV-Loop-Qualität in Echtzeit zu analysieren. Wir erkennen an, dass wir keine 3-dimensionalen Bewertungen der RV-Volumina durchgeführt haben. Unser Ziel ist es, 3-dimensionale Auswertungen von RV-Volumina zu entwickeln, da dies eine höhere Präzision bei der RV-Volumenkalibrierung für RV-PV-Loop-Auswertungen bieten kann. Einer der ersten Schritte wäre die Bewertung der Machbarkeit der Methode. Darüber hinaus erfordert unser Protokoll spezifische Einrichtungen wie einen Operationssaal und eine Durchleuchtung für invasive RV-Bewertungen.
Unseres Wissens haben wir das erste Tiermodell von ARHF mit chronischem PH beschrieben. Frühere Studien berichteten über dynamische Veränderungen des rechten Ventrikels mit Dobutamin und Levosimendan nach akuter Verengung der Lungenarterie7. In unserer Gruppe quantifizierten wir auch die RV-Reserve mittels Dobutamin-Infusion bei chronischem PH ohne hämodynamischen Kompromiss15. Multibeat-PV-Schleifen gelten als die Goldstandardmethode zur Quantifizierung der endsystolischen Elastanz, die die ventrikuläre Kontraktilität unabhängig von den Belastungsbedingungen darstellt16. RV-Elastanz (Ees =end systolische Elastanz) absolute Werte sollten mit Vorsicht interpretiert werden, da es mehrere methodische Grenzen gibt. Die Hauptgrenzen sind die Definition des endsystolischen Punktes und die Genauigkeit der Volumenkalibrierung mit externen Methoden (Thermodilution und Echokardiographie)17. Das Verhältnis von endsystolischer Elastanz zu arterieller Elastanz (Ea = endsystolisches Druck-über-Hubvolumen-Verhältnis), das sogenannte Ventrikulo-Arterie-Kopplungsverhältnis (Ees / Ea), reduziert die Fehler aufgrund der externen Volumenkalibrierung. Die ventrikulo-arterielle Kopplung ist im Bereich der pulmonalen Hypertonie von großem Interesse, da sie die Anpassung der RV-Kontraktilität an eine erhöhte Nachlast erfasst. Methoden zur Messung der RV-Anpassung an die Afterload haben in den letzten Jahren großes Interesse geweckt, da sie eine bessere Phänotypisierung von Patienten mit PH18,19,20 aufweisen.
Unsere Methoden lieferten Werte der ventrikulo-arteriellen Kopplung (d.h. Ees/Ea), die mit zuvor veröffentlichten Werten21 und mit der RV-Funktionsschätzung mittels Echokardiographie übereinstimmen. In diesem Protokoll zeigen wir, dass eine akute Vena-Cava-Okklusion sicher ist, wenn sie im Rahmen einer hämodynamischen Kompromittierung durchgeführt wird. Darüber hinaus war die echokardiographische RV-Bewertung im Großtiermodell komplementär zur echokardiographischen RV-Bewertung in Kleintiermodellen, da sie es ermöglichte, verschiedene RV-Funktionsparameter im Vergleich zu zuvor berichteten Mäusemodellen mit RV-Remodeling zu quantifizieren22.
Die in dieser Studie beschriebenen Methoden können für verschiedene Forschungsprotokolle verwendet werden, um Schlüsselfragen im Bereich arHF zu beantworten. Erstens können diese Methoden verwendet werden, um Forschungsprotokolle durchzuführen, die darauf abzielen, verschiedene Behandlungsstrategien im Kontext von ARHF bei chronischem PH zu vergleichen. Zweitens können iterative und simultane PV-Schleifen- und echokardiographische Bewertungen es ermöglichen, echokardiographische Indizes in verschiedenen Situationen von klinischem Interesse zu validieren.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wird durch einen öffentlichen Zuschuss unterstützt, der von der französischen Nationalen Forschungsagentur (ANR) im Rahmen des Programms Investissements d'Avenir (Referenz: ANR-15RHUS0002) überwacht wird.
Materialien
| Name | Company | Catalog Number | Comments |
| Radiofocus Introducer II | Terumo | RS+B80K10MQ | catheter sheath |
| Equalizer, Occlusion Ballon Catheter | Boston Scientific | M001171080 | ballon for inferior vena cava occlusion |
| Guidewire | Terumo | GR3506 | 0.035; angled |
| Vigilance monitor | Edwards | VGS2V | Swan-Ganz associated monitor |
| Swan-Ganz | Edwards | 131F7 | Swan-Ganz catheter 7 F; usable lenghth 110 cm |
| Echocardiograph; Model: Vivid 9 | General Electrics | GAD000810 and H45561FG | Echocardiograph |
| Probe for echo, M5S-D | General Electrics | M5S-D | Cardiac ultrasound transducer |
| MPVS-ultra Foundation system | Millar | PL3516B49 | Pressure-volume loop unit; includes a powerLab16/35, MPVS-Ultra PV Unit, bioamp and bridge amp and cables |
| Ventricath 507 | Millar | VENTRI-CATH-507 | conductance catheter |
| Lipiodol ultra-fluid | Guerbet | 306 216-0 | lipidic contrast dye |
| BD Insyte Autoguard | Becton, Dickinson and Company | 381847 | IV catheter |
| Arcadic Varic | Siemens | A91SC-21000-1T-1-7700 | C-arm |
| Prolene 5.0 | Ethicon | F1830 | polypropilene monofil |
Referenzen
- Harjola, V. P., et al. Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology. European Journal of Heart Failure. 18 (3), 226-241 (2016).
- Haddad, F., et al. Characteristics and outcome after hospitalization for acute right heart failure in patients with pulmonary arterial hypertension. Circulation: Heart Failure. 4 (6), 692-699 (2011).
- Sztrymf, B., et al. Prognostic factors of acute heart failure in patients with pulmonary arterial hypertension. European Respiratory Journal. 35 (6), 1286-1293 (2010).
- Huynh, T. N., Weigt, S. S., Sugar, C. A., Shapiro, S., Kleerup, E. C. Prognostic factors and outcomes of patients with pulmonary hypertension admitted to the intensive care unit. Journal of Critical Care. 27 (6), 739(2012).
- Boulate, D., et al. Early Development of Right Ventricular Ischemic Lesions in a Novel Large Animal Model of Acute Right Heart Failure in Chronic Thromboembolic Pulmonary Hypertension. Journal of Cardiac Failure. 23 (12), 876-886 (2017).
- Noly, P. E., et al. Chronic Thromboembolic Pulmonary Hypertension and Assessment of Right Ventricular Function in the Piglet. Journal of Visualized Experiments. (105), e53133(2015).
- Kerbaul, F., et al. Effects of levosimendan versus dobutamine on pressure load-induced right ventricular failure. Critical Care Medicine. 34 (11), 2814-2819 (2006).
- Ratliff, N., Peter, R., Ramo, B., Somers, W., Morris, J. A model for the production of right ventricular infarction. The American journal of pathology. 58 (3), 471(1970).
- Ballard-Croft, C., Wang, D., Sumpter, L. R., Zhou, X., Zwischenberger, J. B. Large-animal models of acute respiratory distress syndrome. The Annals of Thoracic Surgery. 93 (4), 1331-1339 (2012).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circulation: Heart Failure. 2 (3), 262-271 (2009).
- Letsou, G. V., et al. Improved left ventricular unloading and circulatory support with synchronized pulsatile left ventricular assistance compared with continuous-flow left ventricular assistance in an acute porcine left ventricular failure model. The Journal of Thoracic and Cardiovascular Surgery. 140 (5), 1181-1188 (2010).
- Mercier, O., et al. Piglet model of chronic pulmonary hypertension. Pulmonary Circulation. 3 (4), 908-915 (2013).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: a new technique. Acta Radiologica. (5), 368-376 (1953).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal - Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Guihaire, J., et al. Right ventricular reserve in a piglet model of chronic pulmonary hypertension. European Respiratory Journal. 45 (3), 709-717 (2015).
- Burkhoff, D. Pressure-volume loops in clinical research: a contemporary view. Journal of the American College of Cardiology. 62 (13), 1173-1176 (2013).
- Sagawa, K. The end-systolic pressure-volume relation of the ventricle: definition, modifications and clinical use. Circulation. 63 (6), 1223-1227 (1981).
- Amsallem, M., et al. Load Adaptability in Patients With Pulmonary Arterial Hypertension. The American Journal of Cardiology. 120 (5), 874-882 (2017).
- Dandel, M., Knosalla, C., Kemper, D., Stein, J., Hetzer, R. Assessment of right ventricular adaptability to loading conditions can improve the timing of listing to transplantation in patients with pulmonary arterial hypertension. The Journal of Heart and Lung Transplantation. 34 (3), 319-328 (2015).
- Vanderpool, R. R., et al. RV-pulmonary arterial coupling predicts outcome in patients referred for pulmonary hypertension. Heart. 101 (1), 37-43 (2015).
- Boulate, D., et al. Pulmonary Hypertension. , Springer. 241-253 (2016).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten