Method Article
Inducción y fenotipado de la insuficiencia cardíaca derecha aguda en un modelo animal grande de hipertensión pulmonar tromboembólica crónica
En este artículo
Resumen
Presentamos un protocolo para inducir y fenotipar una insuficiencia cardíaca derecha aguda en un modelo animal grande con hipertensión pulmonar crónica. Este modelo se puede utilizar para probar intervenciones terapéuticas, para desarrollar métricas del corazón derecho o para mejorar la comprensión de la fisiopatología de la insuficiencia cardíaca derecha aguda.
Resumen
El desarrollo de insuficiencia cardíaca derecha aguda (ARHF) en el contexto de la hipertensión pulmonar crónica (HP) se asocia con malos resultados a corto plazo. El fenotipado morfológico y funcional del ventrículo derecho es de particular importancia en el contexto del compromiso hemodinámico en pacientes con ARHF. Aquí, describimos un método para inducir ARHF en un modelo animal grande previamente descrito de PH crónica, y para fenotipar, dinámicamente, la función ventricular derecha utilizando el método estándar de oro (es decir, bucles pv de presión-volumen) y con un método no invasivo clínicamente disponible (es decir, ecocardiografía). La HP crónica se induce primero en cerdos por ligadura de la arteria pulmonar izquierda y embolia del lóbulo inferior derecho con pegamento biológico una vez a la semana durante 5 semanas. Después de 16 semanas, la ARHF es inducida por cargas sucesivas de volumen con solución salina seguida de embolia pulmonar iterativa hasta que la relación entre la presión pulmonar sistólica sobre la presión sistémica alcanza 0,9 o hasta que la presión sistémica sistólica disminuye por debajo de 90 mmHg. La hemodinámica se restaura con infusión de dobutamina (de 2,5 μg/kg/min a 7,5 μg/kg/min). Los bucles fotovoltaicos y la ecocardiografía se realizan durante cada afección. Cada condición requiere alrededor de 40 minutos para la inducción, la estabilización hemodinámica y la adquisición de datos. De 9 animales, 2 murieron inmediatamente después de la embolia pulmonar y 7 completaron el protocolo, que ilustra la curva de aprendizaje del modelo. El modelo indujo un aumento de 3 veces en la presión media de la arteria pulmonar. El análisis pv-loop mostró que el acoplamiento ventriculo-arterial se conservó después de la carga de volumen, disminuyó después de la embolia pulmonar aguda y se restauró con dobutamina. Las adquisiciones ecocardiográficas permitieron cuantificar parámetros ventriculares derechos de morfología y función con buena calidad. Se identificaron lesiones isquémicas del ventrículo derecho en el modelo. El modelo se puede utilizar para comparar diferentes tratamientos o para validar parámetros no invasivos de la morfología y función del ventrículo derecho en el contexto de la ARHF.
Introducción
La insuficiencia cardíaca derecha aguda (ARHF) se ha definido recientemente como un síndrome rápidamente progresivo con congestión sistémica resultante de un llenado deficiente del ventrículo derecho (RV) y/o una reducción de la producción de flujo de RV1. La ARHF puede ocurrir en varias afecciones, como insuficiencia cardíaca del lado izquierdo, embolia pulmonar aguda, infarto agudo de miocardio o hipertensión pulmonar (HP). En el caso de la HP, el inicio de la ARHF se asocia con un riesgo del 40% de mortalidad a corto plazo o trasplante pulmonar urgente2,3,4. Aquí, describimos cómo crear un modelo animal grande de ARHF en el contexto de la hipertensión pulmonar crónica y cómo evaluar el ventrículo derecho utilizando ecocardiografía y asas presión-volumen.
Las características fisiopatológicas de ARHF incluyen sobrecarga de presión de RV, sobrecarga de volumen, una disminución en la salida de RV, un aumento en la presión venosa central y / o una disminución en la presión sistémica. En la HP crónica, hay un aumento inicial en la contractilidad de RV que permite preservar el gasto cardíaco a pesar del aumento de la resistencia vascular pulmonar. Por lo tanto, en el contexto de arHF en la HP crónica, el ventrículo derecho puede generar presiones casi isosistémicas, particularmente bajo soporte inotrópico. En conjunto, la ARHF sobre la HP crónica y la restauración hemodinámica con inotropos conducen al desarrollo de lesiones isquémicas agudas de RV, como se describió recientemente en nuestro modelo animal grande5. El aumento de inotropos crea una mayor demanda energética que puede desarrollar aún más lesiones isquémicas y, finalmente, conducir al desarrollo de disfunción del órgano final y malos resultados clínicos. Sin embargo, no hay consenso sobre cómo manejar a los pacientes con ARHF en la HP, principalmente con respecto al manejo de líquidos, los inotropos y el papel del soporte circulatorio extracorpóreo. En consecuencia, un modelo animal grande de insuficiencia cardíaca derecha aguda puede ayudar a proporcionar datos preclínicos sobre el manejo clínico de la ARHF.
Como primer paso para cuantificar la respuesta a la terapia, se necesitan métodos simples y reproducibles para fenotipar el ventrículo derecho. Hasta la fecha, no hay consenso sobre cómo fenotipar mejor la morfología y función del RV de los pacientes con ARHF. El método estándar de oro para evaluar la contractilidad de RV (es decir, la capacidad intrínseca para contraerse) y el acoplamiento ventriculo-arterial (es decir, contractilidad normalizada por la poscarga ventricular; un índice de adaptación ventricular) es el análisis de los bucles de presión-volumen (PV). Este método es dos veces invasivo porque requiere cateterismo cardíaco derecho y una reducción transitoria de la precarga de RV utilizando un balón insertado en la vena cava inferior. En la práctica clínica, se necesitan métodos no invasivos y repetibles para evaluar el ventrículo derecho. La resonancia magnética cardíaca (CMR) se considera el estándar de oro para la evaluación no invasiva del ventrículo derecho. En pacientes con ARHF en PH crónica que se manejan en la unidad de cuidados intensivos (UCI), el uso de CMR puede ser limitado debido a la condición hemodinámica inestable del paciente; además, las evaluaciones repetidas de CMR, varias veces al día, incluso por la noche, pueden verse limitadas debido a su costo y disponibilidad limitada. Por el contrario, la ecocardiografía permite evaluaciones de morfología y función de RV no invasivas, reproducibles y de bajo costo en pacientes de UCI.
Los modelos animales de gran tamaño son ideales para realizar estudios preclínicos centrados en la relación entre parámetros hemodinámicos invasivos y parámetros no invasivos. La gran anatomía del cerdo blanco está cerca de los humanos. En consecuencia, la mayoría de los parámetros ecocardiográficos descritos en humanos son cuantificables en cerdos. Existen algunas variaciones menores entre el corazón humano y el corazón de cerdo que deben tenerse en cuenta para los estudios ecocardiográficos. Los cerdos presentan una dextrocardia constitucional y una rotación ligeramente en sentido contrario a las agujas del reloj del eje cardíaco. Como resultado, la vista apical de 4 cámaras se convierte en una vista apical de 5 cámaras y la ventana acústica está situada debajo del apéndice xifoide. Además, las ventanas acústicas paraesternales de eje largo y corto están situadas en el lado derecho del esternón.
Aquí, describimos un método novedoso para inducir ARHF en un modelo animal grande de PH tromboembólico crónico y para restaurar la hemodinámica utilizando dobutamina. También informamos lesiones isquémicas rv rv presentes en el modelo dentro de las 2-3 horas posteriores a la restauración hemodinámica con dobutamina. Además, describimos cómo adquirir bucles fotovoltaicos de RV y parámetros de RV ecocardiográficos en cada condición, proporcionando información sobre los cambios dinámicos en la morfología y función de RV. Como se describió previamente el modelo animal grande de PH tromboembólico crónico y los métodos pv-loop6, estas secciones se describirán brevemente. Además, se informaron los resultados de las evaluaciones ecocardiográficas que se consideran potencialmente difíciles en modelos porcinos. Explicaremos los métodos para lograr ecocardiográficos repetidos en el modelo.
El modelo de ARHF sobre la HP crónica reportado en este estudio se puede utilizar para comparar diferentes estrategias terapéuticas. Los métodos de fenotipado de RV pueden utilizarse en otros modelos animales de gran tamaño que imitan situaciones clínicamente relevantes como la embolia pulmonar aguda7, el infarto de miocardio de RV8, el síndrome de dificultad respiratoria aguda9 o la insuficiencia cardíaca derecha asociada a insuficiencia ventricular izquierda10 o soporte circulatorio mecánico ventricular izquierdo11.
Protocolo
El estudio cumplió con los principios del cuidado de animales de laboratorio según la Sociedad Nacional de Investigación Médica y fue aprobado por el comité de ética local para experimentos con animales en el Hospital Marie Lannelongue.
1. PH tromboembólico crónico
- Inducir la HP tromboembólica crónica como se ha descrito anteriormente6,12.
- Brevemente, inducir un modelo de HP tromboembólico crónico en alrededor de 20 kg de cerdos blancos grandes (sus scrofa). Realizar una ligadura de la ligadura de la arteria pulmonar izquierda a través de una toracotomía izquierda en la semana 0 (pericardio cerrado); y realizar semanalmente una embolización de la arteria pulmonar del lóbulo inferior derecho (0,2 mL a 0,4 mL por semana) con una solución mixta compuesta por 1 mL de pegamento de tejidos blandos incluyendo N-butil-2-cianoacrilato y 2 mL de colorante de contraste lipídico (lipiodol) durante 5 semanas.
- Realizar una xifoïdectomía en la semana 0 en el momento de la ligadura de la arteria pulmonar izquierda para mejorar la viabilidad de la ecocardiografía. Para hacer esto, realice una incisión longitudinal de 4 cm frente al proceso xifoide. Retire el proceso de xifoides con un cuchillo de diatermia. Cierre el plan subcutáneo y la piel con una sutura de carrera.
- Realice una embolia pulmonar adicional del lóbulo inferior derecho en la semana 10 utilizando el mismo protocolo explicado anteriormente (paso 1.2).
- Realizar el modelo de inducción ARHF (sección 6) 6 semanas después de la última embolización del lóbulo inferior derecho (semana 16) para evitar lesiones cardíacas derechas agudas inducidas por embolias pulmonares agudas.
NOTA: Se puede utilizar otro modelo animal grande de insuficiencia cardíaca derecha, o se pueden inducir otras afecciones patológicas en el modelo de HP crónico-tromboembólico.
2. Posicionamiento de animales y colocación de catéteres
- Realizar anestesia general como se describió anteriormente6.
- Brevemente, deje que el animal ayune durante 12 h. Luego realice una inyección intramuscular de clorhidrato de ketamina (30 mg / kg) para la premedicación. Realizar un bolo intravenoso de fentanilo (0,005 mg/kg), Propofol (2 mg/kg) y cisatracurio (0,3 mg/kg) por vía intravenosa a través de una vena del oído e intubar de forma no selectiva al cerdo con una sonda francesa de 7.
- Mantener la anestesia general con isoflurano al 2% inhalado, infusión continua de fentanilo (0,004 mg/kg) y propofol (3 mg/kg).
- Después de la inducción de la anestesia general, coloque al cerdo boca arriba con las patas delanteras ligeramente extendidas para permitir la adquisición ecocardiográfica paraesternal (sección 3).
- Coloque los electrodos del dispositivo en los brazos y las piernas (ecocardiógrafo, estación de trabajo para adquisiciones hemodinámicas) antes de la colocación de los campos estériles.
- Coloque una vaina de 8 franceses en la vena yugular utilizando el método de Seldinger13.
- Introduzca un catéter intravenoso de 18 G (1,3 mm x 48 mm) en la vena yugular.
- Realizar una punción percutánea en la línea media a 2 cm por encima del manubrio con una orientación de 45°.
- Después de obtener un reflujo venoso, inserte un alambre guía en el catéter (0.035 pulgadas / 0.089 mm, 180 cm, en ángulo).
- Verifique la colocación correcta del alambre guía en la vena cava superior con fluoroscopia y deseche la vaina de 8 franceses en el alambre guía en la vena cava superior.
NOTA: El alambre guía se coloca correctamente cuando pasa a través de la vena cava inferior a lo largo del borde derecho de la columna vertebral.
- Introduzca un catéter intravenoso de 18 G (1,3 mm x 48 mm) en la vena yugular.
- Realice una división de los vasos femorales derechos para introducir un catéter lleno de líquido en la arteria femoral derecha para un monitoreo continuo de la presión sistémica y un catéter de dilatación con balón en la vena cava inferior a través de la vena femoral de la siguiente manera.
- Realice una incisión transversal de 4 cm en la ingle.
- Coloque un retractor de Beckman y divida la cara anterior de la vena femoral y de la arteria femoral con una pinza Debackey y unas tijeras Metzenbaum.
- Coloque un catéter de 20 G en la arteria femoral bajo control visual directo y conéctelo a un transductor desechable con un catéter lleno de líquido para obtener un monitoreo continuo de la presión arterial sistémica.
NOTA: La presión arterial media debe estar continuamente por encima de 60 mmHg. - Use un catéter de 18 G para insertar un alambre guía (0.035 pulgadas / 0.089 mm, 180 cm, en ángulo) en la vena femoral a través de la vena cava inferior bajo control fluoroscópico.
- Inserte un catéter de dilatación con balón en el alambre guía a través de la vena cava inferior a nivel intrapericárdico bajo control fluoroscópico.
- Realice el control fluoroscópico con un brazo en C utilizando una vista anteroposterior. Coloque los marcadores visibles del balón inmediatamente por encima del nivel del diafragma bajo control fluoroscópico. Retire el alambre guía cuando se coloque el globo.
- Cose un bolso con una sutura de monofilamento de polipropileno 5.0 alrededor del catéter de balón de dilatación venosa para evitar el sangrado de la vena femoral.
3. Ecocardiografía
- Realizar la ecocardiografía inmediatamente después del posicionamiento del animal y la colocación del catéter (sección 2) en animales aún bajo anestesia general y ventilación mecánica.
- Adquiera cada vista ecocardiográfica en formato de bucle de cine durante al menos 3 ciclos cardíacos durante la apnea espiratoria final.
- Adquiera todas las vistas en los modos Doppler de 2 dimensiones y tejido.
- Adquiera la vista apical de 5 cámaras bajo el proceso xifoide.
- Adquiera las vistas paraesternales de eje corto y largo en el lado derecho del esternón.
- Adquirir flujo valvular utilizando modos Doppler continuo y pulsado.
- Adquirir señales Doppler tisulares del anillo tricúspide lateral y del anillo mitral lateral y septal.
NOTA: Utilice las últimas guías para la evaluación ecocardiográfica en humanos para adquisiciones e interpretaciones ecocardiográficas14.
4. Cateterismo cardíaco derecho
- Realizar el cateterismo cardíaco derecho después del eco cardíaco (sección 3) y antes de las adquisiciones del asa presión-volumen (sección 5)
- Conecte el catéter Swan-Ganz al transductor desechable.
- Introducir el catéter Swan-Ganz en la vaina yugular 8-Francesa previamente insertada en la vena yugular (sección 2.4) y adquirir presiones medias de la arteria auricular derecha, ventricular derecha y pulmonar. Coloque el catéter bajo fluoroscopia si es necesario.
NOTA: Verifique que los catéteres llenos de líquido estén bien purgados con solución salina y retire las burbujas de aire para evitar la amortiguación de la señal de presión. - Después de colocar el catéter Swan-Ganz en la arteria pulmonar, mida el gasto cardíaco con el método de termodilución según lo explicado por las instrucciones del fabricante; medir simultáneamente la frecuencia cardíaca para el cálculo del volumen sistólico.
- Asegúrese de que la solución salina esté a 4 °C para evitar la sobreestimación del gasto cardíaco.
- Conecte el transductor desechable a la estación de trabajo pv-loop para la adquisición en vivo de presiones derivadas de catéteres llenos de líquido.
5. Adquisición del bucle de volumen de presión utilizando el método de conductancia
NOTA: Esta sección ha sido publicada anteriormente15.
- Introducir el catéter de conductancia en el ventrículo derecho bajo control fluoroscópico.
- Verifique la señal de calidad utilizando la adquisición " en vivo" de bucles presión-volumen.
- Activar electrodos adecuados para obtener una señal óptima (es decir, bucles fotovoltaicos en sentido contrario a las agujas del reloj con forma fisiológica).
- Seguimiento de los pasos de calibración de presión y volumen del flujo de trabajo de acuerdo con las instrucciones del fabricante (conductividad sanguínea, volumen paralelo, calibración del volumen sistólico = calibración alfa).
NOTA: El accidente cerebrovascular externo con el catéter Swan-Ganz se puede repetir para cada condición; mientras que los otros pasos de calibración se pueden realizar una sola vez. - Adquirir familias de bucle PV en estados estables y durante la reducción aguda de la precarga (es decir, la oclusión aguda de la vena cava inferior) durante la apnea espiratoria final.
- Realizar al menos 3 adquisiciones por condición (constante + oclusión IVC).
6. Inducción de insuficiencia cardíaca derecha aguda por sobrecarga de volumen y presión (Figura 1).
- Inducir sobrecarga de volumen utilizando una infusión salina de 3 pasos (alrededor de 2 h).
- Comience la primera infusión de 15 ml/kg de solución salina con una salida de infusión de flujo libre.
- Realizar las mediciones (cateterismo cardíaco derecho, PV-loops y ecocardiográfico) 5 min después de la estabilización hemodinámica después del final de cada infusión.
- Inicie la segunda infusión de volumen de 15 ml/kg inmediatamente después del final de las mediciones.
- Comience la infusión de tercer volumen de 30 ml/kg de solución salina inmediatamente después del final de las mediciones.
PRECAUCIÓN: La carga de volumen puede inducir compromiso hemodinámico o edema pulmonar dependiendo del modelo animal utilizado. En este modelo, la carga de volumen reveló una respuesta adaptativa caracterizada por el aumento del gasto cardíaco, la presión auricular derecha estable y el acoplamiento ventriculo-arterial preservado.
NOTA: La carga de volumen se puede detener en caso de mala tolerancia respiratoria o hemodinámica.
- Inducir sobrecarga de presión con embolia pulmonar iterativa.
- Inserte un catéter angiográfico francés 5 a través de la vaina yugular en la arteria pulmonar del lóbulo inferior derecho bajo control fluoroscópico.
- Embolizar la arteria pulmonar del lóbulo inferior derecho con un bolo de 0,15 mL de una solución mixta compuesta por 1 mL de pegamento de tejidos blandos incluyendo N-butil-2-cianoacrilato y 2 mL de colorante de contraste lipídico. Lave el catéter con 10 ml de solución salina.
- Evaluar la respuesta hemodinámica 2 minutos después de la embolización utilizando la presión sistémica y la presión arterial pulmonar.
- Repetir embolias de 0,15 ml cada 2 minutos hasta obtener compromiso hemodinámico (es decir, presión sistémica sistólica <90 mmHg o presión pulmonar sistólica sobre la relación de presión sistémica sistólica >0,9).
PRECAUCIÓN: La embolia pulmonar puede inducir un compromiso hemodinámico grave, a veces irreversible, que conduce a la muerte inmediata. Antes de comenzar el paso de embolización, prepárese para comenzar el soporte hemodinámico (protocolo de dobutamina o epinefrina en caso de paro circulatorio). Prepárese para iniciar los bucles fotovoltaicos y el monitoreo ecocardiográfico. Como este paso puede estar asociado con un compromiso hemodinámico grave, se puede evitar el cateterismo cardíaco derecho con el catéter Swan-Ganz para comenzar el soporte de dobutamina antes.
7. Inducir la restauración de la hemodinámica sistémica con dobutamina
- Después de alcanzar el compromiso hemodinámico y realizar bucles PV y adquisiciones ecocardiográficas, comience la infusión de dobutamina a 2,5 μg / kg / min.
NOTA: Se pueden iniciar otros medicamentos o tratamientos en este momento. - Espere de 10 a 15 minutos para la estabilización hemodinámica.
- Realizar cateterismo cardíaco derecho, PV-loops y adquisiciones ecocardiográficas.
- Aumente la dosis de infusión de dobutamina a 5 μg/kg/min.
- Espere 15 minutos para la estabilización hemodinámica y las adquisiciones repetidas.
- Repetir el cateterismo cardíaco derecho, las asas PV y las adquisiciones ecocardiográficas.
- Aumente la dosis de infusión de dobutamina a 7,5 μg/kg/min.
NOTA: Se pueden iniciar otras dosis, medicamentos o tratamientos.
8. Eutanasia y recolección de tejido cardíaco
- Al final del protocolo, realice una esternotomía mediana utilizando una sierra oscilante.
- Abra el pericardio e inyecte una solución letal de cloruro de potasio (0,2 g/kg).
- Cosecha el corazón; seleccionar muestras de las paredes libres del ventrículo derecho e izquierdo para evaluaciones patológicas y moleculares.
NOTA: Los métodos para las evaluaciones patológicas del ventrículo derecho y para las estadísticas fueron reportados previamente5.
Resultados
Viabilidad
Describimos los resultados de 9 procedimientos consecutivos de inducción de ARHF en un modelo CTEPH de animales grandes previamente reportado5. La duración del protocolo fue de alrededor de 6 horas para completarse, incluyendo la inducción de anestesia, la instalación, el acceso vascular / colocación de catéteres, la inducción de sobrecarga de volumen / presión y la restauración hemodinámica, la adquisición de datos y la eutanasia. Cada condición hemodinámica requiere alrededor de 40 minutos para lograr la inducción de la condición, la estabilización hemodinámica y la adquisición de datos.
El protocolo se logró en 7 de cada 9 animales, lo que representa la curva de aprendizaje. Tres protocolos adicionales se lograron con éxito después de estos descritos (no publicados). La causa de los 2 fallos del protocolo fue la inducción de un fallo hemodinámico irreversible después de la fase de embolia pulmonar.
Los bucles PV no se adquirieron en 1 de cada 7 animales en el momento del compromiso hemodinámico debido a la necesidad de proporcionar una restauración hemodinámica sistémica rápida con un bolo de epinefrina después del cateterismo cardíaco derecho y el eco cardíaco. En este caso, la dobutamina se inició inmediatamente después de la restauración de la hemodinámica sistémica con epinefrina.
Efectos de la sobrecarga de volumen y presión sobre la hemodinámica y la función RV
La carga aguda de volumen no indujo ARHF, sino que destacó el fenotipo adaptativo del modelo de HP crónica. Con la carga de volumen, el gasto cardíaco aumentó sin aumento de la presión auricular derecha, mientras que el acoplamiento ventriculo-arterial se mantuvo estable (Figura 2).
Los criterios de compromiso hemodinámico se alcanzaron después de 1 émbolo en 1 animal, 2 émbolos en 2 animales, 3 émbolos en 5 animales y 4 émbolos en 1 animal. Dos animales murieron inmediatamente después de la EP (1 animal con 1 émbolo y 1 animal con 4 émbolos). En otro animal, la hipotensión severa requirió un bolo de epinefrina y el inicio inmediato de la dobutamina antes de la adquisición de datos ecocardiográficos y de asa PV. Las 2 muertes ocurridas inmediatamente después de la embolia pulmonar aguda se asociaron con trombosis aguda de las cavidades cardíacas derechas (como se ilustra en la Figura 3).
El compromiso hemodinámico se asoció con una disminución significativa del gasto cardíaco, el volumen sistólico y el acoplamiento ventriculo-arterial (Ees/ea), mientras que la contractilidad de RV se mantuvo estable (Figura 2); hubo un aumento de dos veces en la presión auricular derecha y la presión media de la arteria pulmonar.
Efecto de la dobutamina sobre el ARHF
La dobutamina restauró el gasto cardíaco, el volumen sistólico y el acoplamiento ventriculo-arterial dentro del rango normal (Figura 2).
Ecocardiografía
La ecocardiografía fue factible proporcionando cuantificación de los cambios dinámicos en el tamaño y la función del RV durante el protocolo (Figura 4). Los parámetros ecocardiográficos no se evaluaron en 1 animal con compromiso hemodinámico grave después de una embolia pulmonar que requirió un bolo de epinefrina y el inicio inmediato de la dobutamina.
Bucles fotovoltaicos RV
El análisis del bucle de volumen de presión permitió la cuantificación dinámica de la elastancia sistólica final de RV y el acoplamiento ventriculo-arterial (Figura 2 y Figura 5).
Lesiones isquémicas del ventrículo derecho
Después de la tinción de hemateína, eosina y azafrán, observamos lesiones isquémicas de RV en las capas subendocárdicas y subepicárdicas de la pared libre de RV (Figura 6). Las lesiones isquémicas se caracterizaron por grupos de cardiomiocitos hipereosinofílicos con núcleo picnótico.

Figura 1: Resumen del protocolo. PH: hipertensión pulmonar; VL1, carga volumétrica con 15 mL/kg de solución salina; VL2, 15 ml/kg de solución salina; VL3, 30 ml/kg de solución salina; ARHF: insuficiencia cardíaca derecha aguda; EP: embolia pulmonar. *presión sistólica sistémica <90 mmHg o relación presión pulmonar/sistémica sistólica >0,9. Esta cifra ha sido modificada a partir de5. Haga clic aquí para ver una versión más grande de esta figura.
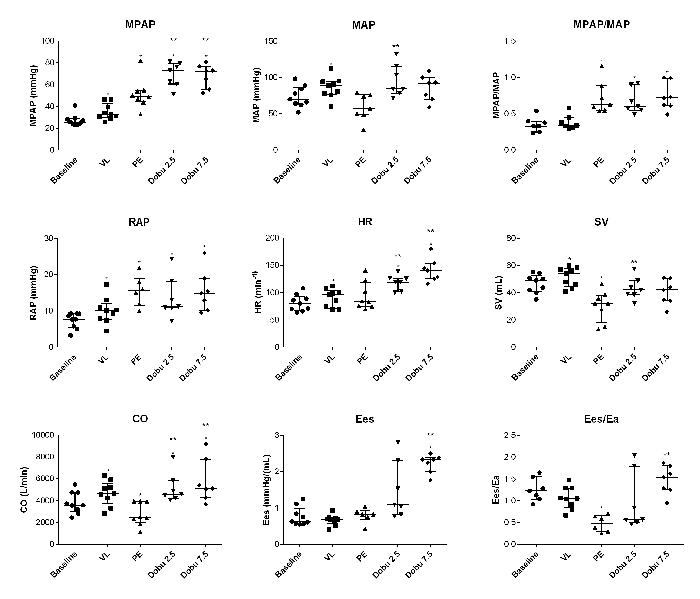
Figura 2: Cambios dinámicos individuales en el bucle hemodinámico y de presión-volumen. MPAP: presión media de la arteria pulmonar; MAP: presión arterial media; RAP: presión auricular derecha; HR, frecuencia cardíaca; SV: volumen sistólico; CO: gasto cardíaco; Ees; elastancia sistólica final del ventrículo derecho; Ea, elastancia arterial. Las parcelas son medianas y de rango intercuartílico. *P<0,05 en comparación con el valor basal; las comparaciones se realizaron utilizando las pruebas de rango firmado de pares emparejados de Wilcoxon con GraphPad Prism 6. Esta cifra ha sido modificada a partir de5. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ejemplo de causa de fallo del protocolo: trombosis cardíaca derecha aguda (flecha) después de la embolia pulmonar responsable del compromiso hemodinámico irreversible, muerte inmediata e insuficiencia del protocolo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Ventanas y resultados ecocardiográficos representativos. (A) Posición para la adquisición de la vista apical de 5 cámaras (A5C). (B) Posición para la adquisición de la vista de eje corto paraesternal (PSSAX). (C) Evaluaciones ecocardiográficas dinámicas de las vistas A5C y PSSAX durante los diferentes pasos del protocolo. VL, carga de volumen; EP: embolia pulmonar; Dobu 2,5, dobutamina 2,5 μg/kg/min; Dobu 7.5, dobutamina 7.5 μg/kg/min. *ventrículo derecho; **ventrículo izquierdo. Esta cifra ha sido modificada a partir de5. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Bucles dinámicos representativos de presión-volumen multibeat rv. PH: hipertensión pulmonar; EP: embolia pulmonar; Ees, elastancia sistólica final (línea negra etiquetada *); Ea, elastancia arterial (línea negra etiquetada **); Ees/Ea, acoplamiento ventriculo-arterial. Esta cifra ha sido modificada a partir de5. Haga clic aquí para ver una versión más grande de esta figura.
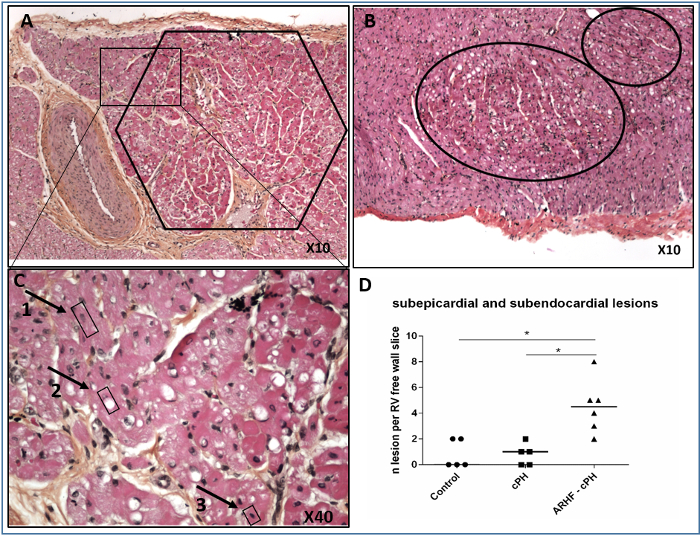
Figura 6: Lesiones isquémicas RV representativas en el subendocardio y en las capas subepigordianas. (A) Lesión isquémica subepicárdica; (B) Lesiones isquémicas subendocárdicas; (C) Ampliación de un borde de una lesión isquémica subepicárdica con núcleos normales (1), vacuolización intracitoplasmática (2) y núcleos picnóticos (3). (D) números individuales de lesiones isquémicas subendocárdicas y subepicardicas en muestras de 2 cm de longitud de rv de pared libre de animales con insuficiencia cardíaca derecha aguda (ARHF) en hipertensión pulmonar crónica (PH), animales con PH crónica y controles sanos; las parcelas son medianas. Las comparaciones se realizaron mediante la prueba de Mann-Whitney con GraphPad Prism 6. *P<0,05. Esta cifra ha sido modificada a partir de5. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Describimos un método para modelar las principales características fisiopatológicas de arHF en la HP crónica en un modelo animal grande que incluye sobrecarga de volumen y presión y restauración hemodinámica con dobutamina. También informamos cómo adquirir datos hemodinámicos y de imágenes para fenotipar los cambios dinámicos del ventrículo derecho en cada condición creada durante el protocolo. Estos métodos pueden proporcionar datos de fondo para construir futuros protocolos de investigación en el campo de ARHF, particularmente con respecto al manejo de fluidos y el soporte inotrópico.
Inducir el compromiso hemodinámico fue un paso crítico en el modelo debido al riesgo de muerte inesperada e inmediata del animal. En consecuencia, recomendamos inducir la embolia pulmonar progresiva con pequeños volúmenes de émbolo. En el momento de la embolia pulmonar, los investigadores deben estar listos para comenzar inmediatamente las adquisiciones de datos y el apoyo hemodinámico. En nuestra experiencia, pudimos realizar las adquisiciones de bucle fotovoltaico y la ecocardiografía antes de comenzar con dobutamina en 6 de cada 7 animales en los que se completó el protocolo.
El paso crítico para fenotipar el ventrículo derecho es obtener datos completos de hemodinámica, asa PV y ecocardiográfica. El cateterismo cardíaco derecho permite estimar el gasto cardíaco y los cambios en el volumen sistólico para cada afección. Los cambios en el gasto cardíaco y el volumen sistólico se pueden evaluar más a fondo con ecocardiografía. Este análisis multimodal del gasto cardíaco y el volumen sistólico cambia mejor la calibración del volumen externo de los bucles fotovoltaicos. Es importante destacar que los valores absolutos y las tasas de cambios de los parámetros del bucle fotovoltaico se pueden cuantificar con mayor precisión al incluir el gasto cardíaco y los cambios en el volumen sistólico con métodos externos realizados para cada situación.
Observamos que la carga de volumen no indujo compromiso hemodinámico, sino que reveló el fenotipo adaptativo del modelo de HP, ya que observamos un aumento en el gasto cardíaco, el volumen sistólico y la presión sistémica con acoplamiento ventriculo-arterial preservado. Por lo tanto, en nuestro modelo, la carga de volumen inicial proporcionó las condiciones para observar una caída importante en el gasto cardíaco y el volumen sistólico después de la embolia pulmonar aguda, lo que aumentó la sensibilidad del modelo. Los estudios futuros deben determinar el efecto de la carga de volumen o el agotamiento de líquidos en el momento del compromiso hemodinámico.
Nuestro protocolo tiene varias limitaciones. Este protocolo no fue construido para analizar la causa del edema, pero puede representar un área de investigación interesante. Otro límite del protocolo es el consumo de tiempo y las habilidades requeridas para realizar todos los pasos. La fase de carga de volumen puede acortarse o eliminarse del protocolo, pero esto puede resultar en una disminución menor en el valor absoluto del gasto cardíaco y el volumen sistólico después de embolias pulmonares agudas. Las habilidades requeridas para realizar el protocolo requieren la colaboración de varios investigadores para colocar el catéter bajo fluoroscopia, realizar la ecocardiografía y analizar en tiempo real la calidad del bucle PV. Reconocemos que no realizamos evaluaciones en 3 dimensiones de los volúmenes de RV. Nuestro objetivo es desarrollar evaluaciones tridimensionales de los volúmenes de RV, ya que puede proporcionar más precisión en la calibración del volumen de RV para las evaluaciones de bucle fotovoltaico de RV. Uno de los primeros pasos sería evaluar la viabilidad del método. Además, nuestro protocolo requiere instalaciones específicas como un quirófano y fluoroscopia para evaluaciones invasivas de RV.
Hasta donde sabemos, hemos descrito el primer modelo animal de ARHF con PH crónica. Estudios previos informaron cambios dinámicos del ventrículo derecho con dobutamina y levosimendán después de la constricción aguda de la arteria pulmonar7. En nuestro grupo, también cuantificamos la reserva de RV mediante infusión de dobutamina en la HP crónica sin compromiso hemodinámico15. Los bucles fotovoltaicos multibeat se consideran el método estándar de oro para cuantificar la elastancia sistólica final, que representa la contractilidad ventricular independientemente de las condiciones de carga16. Los valores absolutos de la elastancia RV (Ees=elastancia sistólica final) deben interpretarse con precaución ya que existen varios límites metodológicos. Los principales límites son la definición del punto sistólico final y la precisión de la calibración del volumen con métodos externos (termodilución y ecocardiografía)17. La relación entre la elastancia sistólica final sobre la elastancia arterial (Ea=presión sistólica final sobre la relación volumen sistólico), conocida como relación de acoplamiento ventrículo-arterial (Ees/Ea), reduce los errores debidos a la calibración externa del volumen. El acoplamiento ventriculo-arterial es de gran interés en el campo de la hipertensión pulmonar, ya que captura la adaptación de la contractilidad de RV al aumento de la poscarga. Los métodos de medición de la adaptación del RV a la poscarga han ganado gran interés en los últimos años porque tiene un mejor fenotipado de los pacientes con PH18,19,20.
Nuestros métodos proporcionaron valores de acoplamiento ventriculo-arterial (es decir, Ees/Ea) consistentes con valores publicados previamente21 y con estimación de la función RV mediante ecocardiografía. En este protocolo, demostramos que la oclusión aguda de la vena cava es segura cuando se realiza en el contexto del compromiso hemodinámico. Además, la evaluación ecocardiográfica de RV en el modelo animal grande fue complementaria de la evaluación ecocardiográfica de RV en modelos de animales pequeños, ya que permitió cuantificar diferentes parámetros de función de RV en comparación con los modelos de ratones previamente informados con remodelación de RV22.
Los métodos descritos en este estudio se pueden utilizar para diferentes protocolos de investigación con el objetivo de abordar preguntas clave en el campo de ARHF. En primer lugar, estos métodos se pueden utilizar para realizar protocolos de investigación con el objetivo de comparar diferentes estrategias de tratamiento en el contexto de la ARHF sobre la HP crónica. En segundo lugar, la evaluación iterativa y simultánea de PV-loop y ecocardiográfica puede permitir validar los índices ecocardiográficos en diferentes situaciones de interés clínico.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo está respaldado por una subvención pública supervisada por la Agencia Nacional de Investigación de Francia (ANR) como parte del Programa Investissements d'Avenir (referencia: ANR-15RHUS0002).
Materiales
| Name | Company | Catalog Number | Comments |
| Radiofocus Introducer II | Terumo | RS+B80K10MQ | catheter sheath |
| Equalizer, Occlusion Ballon Catheter | Boston Scientific | M001171080 | ballon for inferior vena cava occlusion |
| Guidewire | Terumo | GR3506 | 0.035; angled |
| Vigilance monitor | Edwards | VGS2V | Swan-Ganz associated monitor |
| Swan-Ganz | Edwards | 131F7 | Swan-Ganz catheter 7 F; usable lenghth 110 cm |
| Echocardiograph; Model: Vivid 9 | General Electrics | GAD000810 and H45561FG | Echocardiograph |
| Probe for echo, M5S-D | General Electrics | M5S-D | Cardiac ultrasound transducer |
| MPVS-ultra Foundation system | Millar | PL3516B49 | Pressure-volume loop unit; includes a powerLab16/35, MPVS-Ultra PV Unit, bioamp and bridge amp and cables |
| Ventricath 507 | Millar | VENTRI-CATH-507 | conductance catheter |
| Lipiodol ultra-fluid | Guerbet | 306 216-0 | lipidic contrast dye |
| BD Insyte Autoguard | Becton, Dickinson and Company | 381847 | IV catheter |
| Arcadic Varic | Siemens | A91SC-21000-1T-1-7700 | C-arm |
| Prolene 5.0 | Ethicon | F1830 | polypropilene monofil |
Referencias
- Harjola, V. P., et al. Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology. European Journal of Heart Failure. 18 (3), 226-241 (2016).
- Haddad, F., et al. Characteristics and outcome after hospitalization for acute right heart failure in patients with pulmonary arterial hypertension. Circulation: Heart Failure. 4 (6), 692-699 (2011).
- Sztrymf, B., et al. Prognostic factors of acute heart failure in patients with pulmonary arterial hypertension. European Respiratory Journal. 35 (6), 1286-1293 (2010).
- Huynh, T. N., Weigt, S. S., Sugar, C. A., Shapiro, S., Kleerup, E. C. Prognostic factors and outcomes of patients with pulmonary hypertension admitted to the intensive care unit. Journal of Critical Care. 27 (6), 739(2012).
- Boulate, D., et al. Early Development of Right Ventricular Ischemic Lesions in a Novel Large Animal Model of Acute Right Heart Failure in Chronic Thromboembolic Pulmonary Hypertension. Journal of Cardiac Failure. 23 (12), 876-886 (2017).
- Noly, P. E., et al. Chronic Thromboembolic Pulmonary Hypertension and Assessment of Right Ventricular Function in the Piglet. Journal of Visualized Experiments. (105), e53133(2015).
- Kerbaul, F., et al. Effects of levosimendan versus dobutamine on pressure load-induced right ventricular failure. Critical Care Medicine. 34 (11), 2814-2819 (2006).
- Ratliff, N., Peter, R., Ramo, B., Somers, W., Morris, J. A model for the production of right ventricular infarction. The American journal of pathology. 58 (3), 471(1970).
- Ballard-Croft, C., Wang, D., Sumpter, L. R., Zhou, X., Zwischenberger, J. B. Large-animal models of acute respiratory distress syndrome. The Annals of Thoracic Surgery. 93 (4), 1331-1339 (2012).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circulation: Heart Failure. 2 (3), 262-271 (2009).
- Letsou, G. V., et al. Improved left ventricular unloading and circulatory support with synchronized pulsatile left ventricular assistance compared with continuous-flow left ventricular assistance in an acute porcine left ventricular failure model. The Journal of Thoracic and Cardiovascular Surgery. 140 (5), 1181-1188 (2010).
- Mercier, O., et al. Piglet model of chronic pulmonary hypertension. Pulmonary Circulation. 3 (4), 908-915 (2013).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: a new technique. Acta Radiologica. (5), 368-376 (1953).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal - Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Guihaire, J., et al. Right ventricular reserve in a piglet model of chronic pulmonary hypertension. European Respiratory Journal. 45 (3), 709-717 (2015).
- Burkhoff, D. Pressure-volume loops in clinical research: a contemporary view. Journal of the American College of Cardiology. 62 (13), 1173-1176 (2013).
- Sagawa, K. The end-systolic pressure-volume relation of the ventricle: definition, modifications and clinical use. Circulation. 63 (6), 1223-1227 (1981).
- Amsallem, M., et al. Load Adaptability in Patients With Pulmonary Arterial Hypertension. The American Journal of Cardiology. 120 (5), 874-882 (2017).
- Dandel, M., Knosalla, C., Kemper, D., Stein, J., Hetzer, R. Assessment of right ventricular adaptability to loading conditions can improve the timing of listing to transplantation in patients with pulmonary arterial hypertension. The Journal of Heart and Lung Transplantation. 34 (3), 319-328 (2015).
- Vanderpool, R. R., et al. RV-pulmonary arterial coupling predicts outcome in patients referred for pulmonary hypertension. Heart. 101 (1), 37-43 (2015).
- Boulate, D., et al. Pulmonary Hypertension. , Springer. 241-253 (2016).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados