Method Article
マウス屈筋腱損傷および修復手術
要約
手に屈筋腱は、一般的に損なわれた手の機能につながる、負傷しています。しかし、瘢痕組織の治癒反応は十分に特徴付けされていません。屈筋腱の治癒のマウスモデルは、ここに示されています。このモデルは、治癒過程の全体的な理解を高め、治癒を改善するための治療法を評価することができます。
要約
腱は、ほぼ全身の動きを促進する、骨格筋と骨をつなぎます。手には、屈筋腱(FTS)は、指や一般的な手の機能の屈曲を可能にします。 FTへの傷害は一般的であり、十分な治癒は、多くの場合、過剰な瘢痕組織と腱と周囲の組織との間の癒着に損なわれています。しかし、少しはFT修復の分子と細胞成分について知られています。そのために、運動の障害範囲を含む、ヒトにおける治癒の多くの側面を再現すると、機械的特性を低下FT修復のマウスモデルを開発し、以前に記載されています。ここでは、この外科手術手順の詳細なデモが離断およびマウス後足における屈筋digitorumの長い(FDL)腱のその後の修復を含む、提供されます。この技術は、遺伝子の獲得または機能喪失の効果を評価し、EFFIをテストするために、異なる細胞型の系統解析を実施するために使用することができ治癒過程における薬理学的介入のcacy。 ⅰ)離断し、修復が発生し、マウスの後足の中間部におけるFDLの腱は、滑膜シースに囲まれていません。しかし、このモデルには2つの主要な制限があります。したがって、このモデルは、瘢痕形成プロセスへのシースの潜在的寄与を考慮していません。 ⅱ)修復部位の完全性を保護するために、FTは、おそらく増加した瘢痕形成に寄与し、腱の機械的な力を減少させること、myotendinous接合部で放出されます。フローサイトメトリー分析のために治癒過程中FTの肉芽組織から十分な細胞の単離は困難なことが証明されています。これらの細胞を濃縮するための細胞学遠心分離が使用される代替方法であり、免疫蛍光標識を行うことができるの細胞調製物の生成を可能にします。この方法では、FT治癒の間、細胞又は対象のタンパク質の定量化が可能となります。
概要
屈筋前腕の筋肉やデジタル鞘と協調して手作業では屈筋腱は、数字の屈曲と手の把握機能を有効にします。屈筋腱は手の掌側面に沿って実行します。この比較的表面的な場所は、多くの場合、手の外傷の間に屈筋腱の損傷につながります。腱は瘢痕組織の応答ではなく、正常な腱組織1の再生を通じて癒します。この瘢痕組織は、腱への連続性を提供するが、機能は劇的に健康な腱に比べて減少します。腱-瘢痕組織の複合材料は、破裂する可能性が高く、修復腱をレンダリングする、損なわれた機械的性質1を特徴とします。また、瘢痕組織は、腱のサイズおよびバルクの増加をもたらす、天然の腱のコラーゲン線維構造の組織化を欠いています。腱鞘部の解剖学的制約、腱サイズであっても適度な増加を考えることができます大幅に赤滑走腱の機能、動作および手の機能の、したがって数字範囲をUCE。
屈筋腱に1960年の怪我、手のゾーンIIで特に以前には、日常的に起因するこれらの修理2で発生した治癒における重篤な合併症に修復されませんでした。手のこの領域は、「だれの土地3 'と呼ばれていました。しかし、外科技術、縫合糸パターンと物理療法リハビリテーションプロトコールの改善は劇的に屈筋腱の修理2の成果を改善しています。これらの進歩にもかかわらず、修理の40%までは手の機能4を阻害するために十分な接着形成をもたらします。したがって、生物学的アプローチは、治癒を改善するために必要とされます。残念ながら、非常に少ないが、細胞および分子レベルでの腱の治癒過程について知られています。したがって、目標は、基本understandinを改善するために使用することができるマウスモデルを開発することでした治癒を改善するために新規な治療標的を同定するための手段としての屈筋腱の治癒および瘢痕形成の処置の細胞および分子成分のgでした。
より大きな動物モデルは、屈筋腱の治癒過程の理解を促進に尽力してきました。犬とウサギの研究は屈筋腱5,6の内因性および外因性の治癒能力、固定化7に癒着形成の相対を最小限に抑えることで、早期に制御受動運動の重要性だけでなく、治癒過程8上の異なる縫合パターンの両方の効果を実証しています、9。また、イヌのモデルは、治癒10を改善するために翻訳組織工学的ア プローチをテストする際に有用でした。しかし、相対的なコスト、マウス特異的試薬の利用可能性、およびグローバルKNOCの生成を容易にするなどの大型動物モデルにマウスモデルの相対的なを使用していくつかの重要な利点は、ありますK-アウトまたは組織特異的欠失/過剰発現コンストラクト。また、屈筋腱11に対して人間とマウスとの間の機能的類似性はマウスモデルの開発に潜在的有用性を示しています。
屈筋腱の切断と修復を模倣豊富な瘢痕組織および減損の機械的特性の形成を含む臨床治癒の多くの側面のマウスモデルの開発。ここで説明したモデルは、修復部位を保護するためにmyotendinous接合部におけるFDLの切断に起因する臨床実践の真の要約ではありません。修理が発生した腱の中間部分を覆う全く滑膜シースがないのでさらに、このモデルは、治癒反応に滑膜鞘細胞の寄与を考慮していません。これらの制限にもかかわらず、このモデルは、よりクロことをマウスモデルにおいて実証されるように、まだ持っている、運動制限癒着の発生範囲の利点を有していますエリーの臨床シナリオに近似しています。このモデルは、ノックアウトマウスモデル12,13を評価するため、および治癒14-17を改善するための別の薬理学的ア プローチを試験するために使用されてきました。組織学的、免疫組織化学を使用して、このモデルの解析およびin situハイブリダイゼーションでは、治癒の間に重要な遺伝子やタンパク質の局在化に重要な洞察を提供することができます。しかし、組織学のみ断面空間分析を提供し、組織全体を通じて定量化を許可しません。フローサイトメトリー、より定量的なアプローチであるが、細胞のごく限られた数のマウスモデルにおける治癒腱組織から単離することができ、その数はさらに固定、透過処理、および洗浄工程中に減少します。アカウントにこれを取って、フローサイトメトリーをすることは、必要とされる動物の数に実現不可能なアプローチになります。別の方法は、順番にこの小細胞集団の大部分を維持することが必要ですさらに癒しの環境を特徴づけます。ここに示され、これを達成するために使用される方法は、免疫細胞化学、続いてスライドガラス上に細胞学遠心分離によって単離された細胞の濃度を含みます。本研究EDU(5-エチニル2'deoxyuridine、チミジンアナログ)に取り込みおよびその後の標識化は、治癒部位での細胞の相対的な増殖状態を決定するために使用しました。このアプローチは、細胞増殖、遺伝子ノックアウトまたは過剰発現の薬理学的治療の有効性を試験するために、または異なる細胞集団を同定し、定量化するために適用することができます。
プロトコル
ロチェスター大学の動物研究に関する大学委員会は、すべての動物実験を承認しました。十12週齢の雌のC57BL / 6Jマウスを使用しました。
屈筋腱の手術のための動物の調製(〜15分)
- オートクレーブ手術器具は、滅菌を通して滅菌手袋を着用し、無菌手術野を維持します。
- 体重に応じケタミンの量(80mg / kg)およびキシラジン(10mg / kg)を腹腔内注射(IP)を介して、マウスを麻酔。つま先ピンチ反射の不在を経て鎮静の深さを確認してください。
- 皮下注射を介して先制鎮痛(ブプレノルフィン、0.05から0.1ミリグラム/キログラム)を管理します。乾燥から目を防ぐために、眼軟膏を適用します。
- 全体後肢に毛皮をクリッピングすることにより、手術部位を準備します。 70%エタノールに続いポビドンヨード、で連続的にスクラビングすることにより、皮膚を殺菌し、再度、ポビドンヨードと。
2。マウス屈筋腱損傷および修復手術(〜10分)
- ふくらはぎの内側面に表面的に見屈筋digitorumの長い(FDL)腱を検索します。メスを用いて、腱を露出させるためにマイクロはさみで皮膚の小さい0.5〜1センチメートル切開を行います。
- 周囲の組織からFDLの腱を分離し、myotendinous接合にそれをトレースするために鉗子を使用してください。後脛骨動脈を避けるように注意しながら、それを解放するために春のはさみで、この接合部で腱をカットします。
- 5-0ナイロン縫合糸で皮膚を閉じます。
注:FDL離断および修理は(2.4ステップ)実体顕微鏡を使用して実行する必要があります。 - 春のマイクロはさみを使用して、後肢の後外側面上に3mmの切開を行います。静かに組織の損傷を最小限に抑え、FDLの腱を識別することを確認しながら、ピンセットで周囲の軟組織と筋肉を撤回。
- 静かにFDLの腱を上げ、完全にマイルを使用してそれを横断しますCRO-はさみ。定期的に生理食塩水でそれを濡らすことにより、腱の乾燥を避け、8-0縫合糸で修正されたケスラーパターンで一緒にFDLの腱の両端を縫合。
- 腱の上に軟組織と筋肉を交換し、その後、5-0ナイロン縫合糸で切開を閉じます。
- 麻酔から回復するまで、体温を維持するために、37°Cにスライドウォーマーセットにマウスを置きます。
- 術後増加発声やフリルの毛皮などの障害または感染の徴候のためのマウスを監視します。マウスは、もはや痛みや苦痛の徴候を示すまで12時間ごとに鎮痛剤としてブプレノルフィン(50μL/マウス)を注入していません。
- マウスは、次のステップに進む前に10日、手術後の期間のために治癒することができます。
注:細胞は、任意の時点手術後に収穫することができます。ここでは、10日は、この時点で組織の比較的高い細胞充実性を与えられたこれらの代表的な実験のために選択されます。
3. Labeliサイクリング細胞のngの(〜10分)
- EDU(5-エチニル2'deoxyuridine)溶液を調製し(滅菌リン酸緩衝生理食塩水中の10mg / mlで[PBS]は+ 1%ジメチルスルホキシド[DMSO]溶解度を増加させます)。
- 屠殺前24時間腹腔内注射を介して、100μlのEDU(50mg / kg)をマウスに注入します。
細胞診遠心分離4.収穫細胞(2.5時間、約30分のハンズオンタイム)
- PBSで3 mg / mlでコラゲナーゼIを準備します。
- せいぜい3 L /分の流量で二酸化炭素窒息を介してマウスを安楽死させる、および二次指標として頸椎脱臼を行います。
- 上記のステップ2.4を使用して修復腱を見つけて、マイクロはさみで損傷部位の両側に約2mmを切断することにより腱組織を分離します。
- 3 mg / mlでコラゲナーゼの1ミリリットルとペトリ皿の中メスでミンチ組織は、その後、組織を破壊するために18 G針を通して数回混合物を渡します。 1.5ミリリットル遠心管に混合物を収集します。
- 振盪しながら37℃で1時間腱組織を消化します。
- スピン組織ダウン(5分間300×gで)、吸引コラゲナーゼは、その後、数回ピペッティングによりPBS中500μlの3%ウシ血清アルブミン(BSA)を用いて細胞/組織を再懸濁します。
- 70μmのセルストレーナーを介してフィルタ細胞懸濁液破片や腱の大部分を削除し、37℃のインキュベーターに確保しておきます。
- 別の1.5ミリリットル遠心管に腱組織を配置し、ピペッティング、1ミリリットルコラゲナーゼ溶液でリフレッシュしてミックスダウンします。
- 振盪しながら37℃で組織をさらに1時間インキュベートします。
- ピペッティングにより、数回上下PBS中500μlの3%BSAに再懸濁し、その後、消化された腱組織(5分間、300×gで)をスピンダウン。
- その後、血球計数器を用いて細胞をカウントし、4.3.3で単離されたサスペンションと結合し、70μmのセルストレーナーを介して細胞懸濁液をフィルタリングします。
- PBS中3%BSAで一度より多くの細胞を洗浄し、その後、3-6に再懸濁X 10 4個 /100μlの。
- 正に荷電したスライドに細胞診漏斗を取り付け、スライドキャリアにロック。細胞診の遠心分離機に装置全体を挿入し、漏斗に100μlの細胞懸濁液を追加します。スライドの上で細胞を分散するために5分間、300×gで遠心分離します。
EDU(2時間、〜45分のハンズオンタイム)を検出するために5.免疫細胞化学
注:すべてのインキュベーション工程は、フルオロフォアの光退色を制限するために、暗闇の中で行われるべきです。
- 手順を以下に必要なソリューションを最小限に抑えるために、疎水性バリアペンでサークル細胞は、その後すぐに室温(RT)でPBS 15分で150μlの3%パラホルムアルデヒドで固定します。
- PBS中150μlの3%BSAで5分間二回洗浄します。
- 室温でPBSで20分間0.5%トリトンX-100で透過処理細胞。
- 5.1.1のように繰り返し洗浄ステップ。
- EDU反応cocktを準備します使用前に30分以上ないキットの指示に従ってAIL。
- RTで30分間インキュベート、各スライドに150μlのカクテルを追加します。
- 5.1.1のように繰り返し洗浄ステップ。
- 室温でPBS 30分に2000:Hoechst33342が1に希釈した150μlの核の対比でインキュベートします。
- 150μlの1×PBSで5分間二回洗浄します。
- 追加1-2は、気泡を防止するために、ゆっくりと下カバースリップその後、細胞への抗フェードマウンティング培地を廃棄します。
- 室温で暗所で一晩硬化させるためにメディアをマウントできるようにします。
- スライドにカバースリップをシールするために明確なマニキュアを使用してください。
- DAPI(Hoeschst33342)を検出することが可能な励起/発光フィルターを備えた蛍光顕微鏡を用いて40倍の倍率での画像スライド、及びテキサスレッド(アレクサフルオロ594)。
結果
ふくらはぎに位置屈筋digitorumの長い(FDL)筋肉は、myotendinousから近位に実行屈筋腱( 図1Aに青色で概説され、 図2Aに組織学的に示される)を介して、マウスの後足の数字を曲げるように作用します接合部および遠位指節で終了。後足の桁(赤い矢印、 図1A)に分岐し、近位の屈筋腱の治癒のこのモデルでは、FDLの腱が離断され、半ば足で修理します。実験的な分析を妨げる修理、の破裂を防ぐために、腱(及び隣接する筋肉)がmyotendinous接合( 図1B、 図1Cに示されているリリースの黄色の矢印)で、カット、または解放されます。このステップは、臨床シナリオの代表ではありませんが、損傷部位に負担を減少させることによって修復を保護することが重要である。 図2D図2Cに示す修復が成功に比べ、破裂屈筋腱修復の組織学的一例です。後者では、肉芽組織の表示が大幅に無傷腱( 図2B)と比較して細胞性の増加、およびこの細胞集団は、その後、免疫細胞化学、続いてスライド上に細胞学遠心分離によってさらに分析することができる。 図3は、評価するために使用される実験手順を概説します新たに合成されたDNAにEDUの取り込みを介して、修理後10日間腱の治癒から採取した細胞の増殖状態。 EDUの標識は、したがって、図4に見られるように積極的に、生きたマウスにおけるEDUパルス後24時間の期間中に増殖した細胞のみを示している。癒しの腱の肉芽組織における増殖の定量的評価は、次にポイント計数することによって決定することができます全体の細胞調製物の。 prolifeのこのようにして、ベースライン比は、各時点で確立することができ、遺伝的または薬理学的介入に起因する任意の変化を評価することができます。
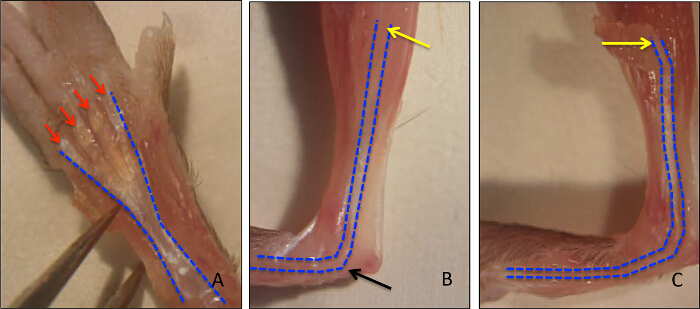
図1は:. マウス後肢解剖学と屈筋Digitorum長い腱の同定。屈筋digitorumの長い(FDL)は、マウスの後足の桁を曲がると(FDLが青に概説)ここでそれを後足の掌側面に沿って走ります数字(赤矢印)(図1A)に分岐。近位、FDLの腱はmyotendinousジャンクション(黄色の矢印)(図1B)で終わる、子牛に、足根管(黒い矢印)を介して実行されます。破裂を防ぐためにmyotendinous接合部の腱の放出は、図1Cに示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
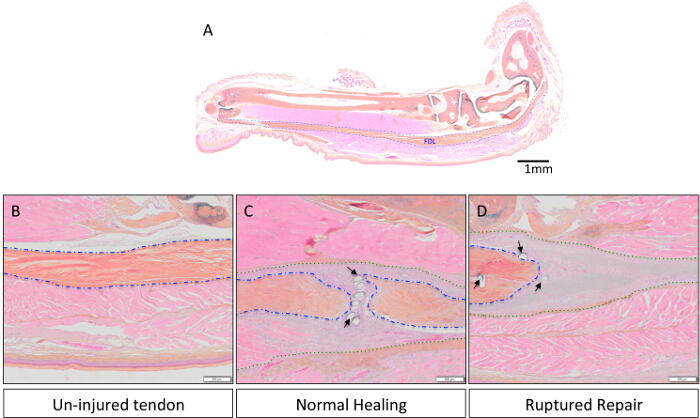
図2: 未負傷し、正常な治癒と破裂屈筋腱修理の代表的な組織学的画像は、マウス後肢におけるFDLの腱の解剖学は、図2Aに示されています。スケールバーは1mmでを表します。図2B-Dで、腱は無傷で破裂修理(図2C&2D、それぞれ)に損傷を受けていない腱組織(図2B)を比較するために8倍速で拡大されます。全体後足のサンプルは、中性緩衝ホルマリンで固定し、パラフィンに包埋し、3μmのセクションに切断し、以前に13を説明したようにアルシアンブルー/ヘマトキシリン/オレンジGで染色しました。ネイティブ腱が青に概説され、腱/肉芽組織複合体は緑で概説し、黒い矢印は、縫合糸を示しています。スケールバーは200μmで表す。 Pリースこの図の拡大版をご覧になるにはこちらをクリックしてください。
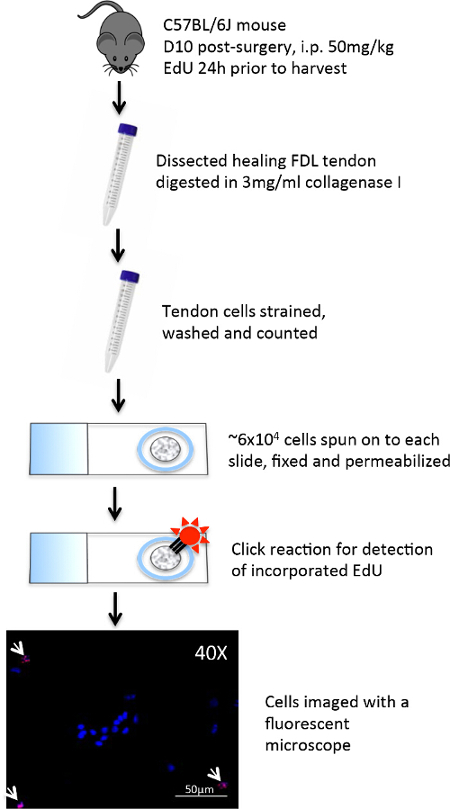
図 3: 実験手順は、EDUがクリック-それを化学細胞製剤に FDLの腱の治癒後10日目手術はマウスの後肢から解剖した上で実行します 。腱は、その後、ミンチ、私は細胞を解離するコラゲナーゼで2時間消化しました。細胞懸濁液は、破片を除去するために緊張し、そして〜6×10 4個の細胞を、細胞学遠心機を用いて、正に荷電したガラススライド上に単層に紡糸しました。細胞は、疎水性バリアペンで丸で囲まれ、その後パラホルムアルデヒドですぐに固定しました。トリトンX-100で透過処理した後、細胞を、EDU検出カクテルで処理し、クリックケミストリー反応は、組み込まれたEDUにアレクサフルオロ594を結合しました。ヘキスト33342核染色として使用し、細胞WERました eは、蛍光顕微鏡で10-40Xで分析した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
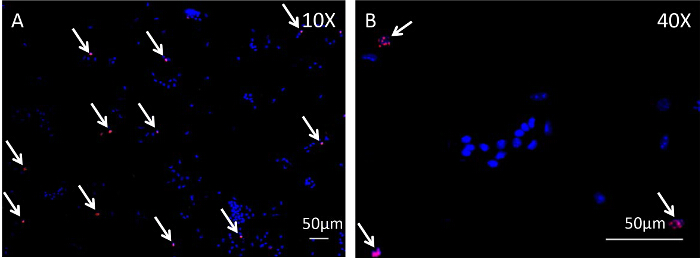
図4: 屈筋腱ヒーリングヒーリングFDLの腱の間にサイクリングEDU標識細胞の免疫細胞化学分析は、マウスの後足10日後に手術から採取し、細胞懸濁液を得るために、コラゲナーゼで消化し ました。遠心分離は、画像EDUの取り込みを免疫細胞化学に続いて、スライド上の単層、中にこれらの細胞を分散させるために使用されました。図4Aおよび図4Bは、免疫細胞化学分析後の細胞のそれぞれ10倍と40倍で撮影した画像です。核染色ヘキスト33342は青で、EDUを組み込んだ細胞は赤が点在しています。スケールバーは50μmで表します。href = "https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/54433/54433fig4large.jpg"ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
完全離断および長趾屈筋腱の修復のマウスモデルのための外科的処置は、本研究で提示されています。また細胞診遠心機で小細胞集団を濃縮する新たなアプリケーションは、屈筋腱の治癒中の細胞環境の定量的免疫細胞化学分析を可能にする、実証されています。屈筋腱修復のこのモデルは、ノックアウトモデルを用いて、治癒過程の変化または薬理学的介入を評価するために使用することができる再現可能な治癒応答を実証します。手術後、炎症反応は、細胞が損傷部位と線維組織のカルス形成され始めるに動員されている間に、24時間以内に開始されます。増殖期は14から21日の間の接着の形成につながる、大幅に増加細胞性および修復部位での無秩序な細胞外マトリックスの豊富な沈着を伴う4日目、およそで続きます。組織リモデリングのコンティnues 35日目を通して、その時点で継続性と屈筋腱の組織が 復元され、細胞性は18に削減されます。
現在、ここに提示されている1つに加えて、屈筋腱修復のいくつかのマウスモデルがあります。 Tsubone ら、屈筋腱の治癒19のin vitroモデルを記載しています。このモデルは、経時的な遺伝子発現の変化を評価することができるが、それは外因性の細胞や生体内で起こる炎症性/サイトカイン環境の変化の募集を考慮することはできません。 インビボでは 、部分的な離断の2つのモデルが、切開または切除のいずれかを使用して開発されています欠陥20,21。さらに最近、Wong らは 、マウスモデル22に屈筋腱損傷のゾーンIIモデルを特徴とします。それは治癒過程に滑液鞘由来細胞の寄与を定義することができ、これは、重要な開発です。しかし、定量化しません滑走機能の変化は、このモデルを用いて説明されています。各モデルは、技術的な使いやすさ、臨床的意義と解剖学を含め、検討しなければならない独自の利点と限界があります。ここで説明したモデルの主な制限は、癒しの腱は、さらなる分析のために、それが使用不能、評価の前に破裂することがあるということです。十分な細胞を回収することは、これらの状況下では実現不可能作られ、腱断裂は、上記の標準的治癒プロセスに従わないとして任意の組織化学的分析は、実行可能でないです。癒しの腱に負担を減少させるために近位にFDLの腱を解放すると、それが臨床的に関連していないという事実にもかかわらず、したがって、予防のための重要なステップです。一方的に手術を行うことも破裂の速度を低下させます。別の制限は、滑膜シースがこのモデルで負傷されたFDLの腱のセグメントを囲むしないよう、周囲の腱鞘細胞の寄与を追跡することができないことです。
jove_content ">この屈筋腱修復モデルの重要な機能は、それが治癒部位での細胞の評価を可能にすることである。免疫蛍光/免疫組織化学(IHC)は、これらの細胞を特徴付けるために使用することができる一般的な生物学的技術である。IHCを一意に適しているものの空間情報を決意するためには、組織の深さ全体にわたって組織または細胞組成の変化を見逃すことができる。主に定性的な方法であり、集団の定量化は困難である。フローサイトメトリー細胞を単離する可能性、定義定量化するために理想的なアプローチを示します細胞内マーカーの検出のための(各マウスからの平均×10 5〜2)フローサイトメトリー分析のために、このモデルの収率が非常に低い細胞数から腱組織を治癒するが、単離および消化。治癒、および固定/透過化工程の間集団低減immunocytoche続いて単離された細胞を濃縮する細胞診の遠心分離を使用して、さらにこの数。、Mistryさんは、これらの小さな細胞集団を特徴付ける方法を提供します。この技術の重要な利点は、十分な細胞を得るために一緒にサンプルをプールする必要がないことです。したがって、各マウスは、分析のために個々のサンプルを表しています。これらの細胞調製物を生成する際に重要な考慮事項は、分析のために採取した組織の一貫性を維持しています。周囲の筋肉や筋膜は肉芽組織に付着することがあり、慎重に切除しなければなりません。この方法は、スライド上に固定する前に、細胞の最小限の処理を含むので、さらなる分析のために単離された細胞の大部分を保持します。このようにして、修復部位に付着組織を構成する細胞のほぼ全集団を定量的免疫細胞化学によって評価することができます。本研究では、増殖細胞によってEDU取り込み、この細胞学的手法の適用を実証するために使用されるが、それはより複雑で深い特徴付けOにも使用することができます屈筋腱の治癒に関与する不均一な細胞集団F。それは腱の治癒における肉芽組織に関連する細胞中の細胞マーカーの共局在を決定することを可能にするように、この技術の将来の応用が、腱の治癒に関与する細胞集団の深さより特性評価につながる可能性があります。開示事項
The authors declare that they have no competing financial interests
謝辞
この作品は、部分的に手パイロット賞、NIH / NIAMS 1K01AR068386-01(AEL)とNIAMS / NIH P30AR061307の手術のためのアメリカの社会によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Surgical preparation | |||
| C57BL/6J mice | Jackson Laboratories | 000664 | |
| Ketamine | Hospira | NDC# 0409-2051-05 | |
| Xylazine | Lloyd Inc. | NDC# 61311-482-10 | |
| Buprenorphine | Par Pharmaceutical Inc. | NDC# 42023-179-10 | |
| 0.9% sodium chloride irrigation | Hospira | NDC# 0409-6138-03 | For preparation of ketamine/xylazine and buprenorphine solutions |
| 1 ml syringe | BD | 309659 | |
| 30 G needle | BD | 305106 | |
| Povidone-Iodine solution | Aplicare | 82-226 | |
| 70% ethanol | |||
| Puralube vet opthalmic ointment | Dechra Veterinary Products | NDC# 17033-211-38 | |
| Name | Company | Catalog Number | Comments |
| Surgical tools | |||
| Portable balance 200 g | Ohaus | SP202 | |
| Spring scissors | Fine Science Tools | 15124-12 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Needle holders | Fine Science Tools | 91201-13 | |
| Micro spring scissors | Fine Science Tools | 15003-08 | |
| Micro needle holders | Fine Science Tools | 12061-02 | |
| 5-0 nylon sutures | Ethicon | 668G | |
| 8-0 microsurgery nylon sutures | Ethicon | 2808G | |
| Lab-Line histology slide warmer | Barnstead International | 26025 | |
| Name | Company | Catalog Number | Comments |
| Cytospin method | |||
| Collagenase Type I, lyophilized | Life Technologies | 1700-017 | |
| Bovine Serum Albumin | Cell Signaling Technologies | 9998S | |
| 1x PBS | Thermo Fisher | 10010-023 | |
| Cytology funnels | Fisher HealthCare | 10-354 | |
| HistoBond+ microscope slides | VWR | 16005-110 | |
| Cytospin 2 centrifuge | Shandon | SH-CYTO2 | |
| Name | Company | Catalog Number | Comments |
| Immunocytochemistry | |||
| Slide staining tray with black lid | IHC World | M920-2 | |
| Click-iT Plus EdU Imaging Kit | Life Technologies | C10639 | Includes EdU and Hoeschst 33342 |
| Immedge hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| ProLong Diamond mounting medium | Thermo Fisher | P36970 | |
| Glass coverslips 24 x 50 mm #1.5 | |||
| Clear nail polish |
参考文献
- Lin, T. Biomechanics of tendon inury and repair. J Biomech. 37, 865-877 (2004).
- Strickland, J. W. Development of flexor tendon surgery: twenty-five years of progress. J Hand Surg [Am]. 25, 214-235 (2000).
- Bunnell, S. Repair of tendons in the fingers and description of two new instruments. Surg Gynecol Obstet. 26, 103-110 (1918).
- Aydin, A., et al. Single-stage flexor tendoplasty in the treatment of flexor tendon injuries. Acta Orthop Traumatol Turc. 38, 54-59 (2004).
- Gelberman, R. H., Steinberg, D., Amiel, D., Akeson, W. Fibroblast chemotaxis after tendon repair. J Hand Surg Am. 16, 686-693 (1991).
- Lundborg, G., Rank, F. Experimental intrinsic healing of flexor tendons based upon synovial fluid nutrition. J Hand Surg Am. 3, 21-31 (1978).
- Aoki, M., Kubota, H., Pruitt, D. L., Manske, P. R. Biomechanical and histologic characteristics of canine flexor tendon repair using early postoperative mobilization. J Hand Surg Am. 22, 107-114 (1997).
- Kim, H. M., et al. Technical and biological modifications for enhanced flexor tendon repair. J Hand Surg Am. 35, 1031-1037 (2010).
- Aoki, M., Manske, P. R., Pruitt, D. L., Kubota, H., Larson, B. J. Work of flexion after flexor tendon repair according to the placement of sutures. Clin Orthop Relat Res. , 205-210 (1995).
- Zhao, C., et al. Award for Outstanding Orthopaedic Research: Engineering flexor tendon repair with lubricant, cells, and cytokines in a canine model. Clin Orthop Relat Res. 472, 2569-2578 (2014).
- Wong, J., Bennett, W., Ferguson, M. W., McGrouther, D. A. Microscopic and histological examination of the mouse hindpaw digit and flexor tendon arrangement with 3D reconstruction. J Anat. 209, 533-545 (2006).
- Katzel, E. B., et al. Impact of Smad3 loss of function on scarring and adhesion formation during tendon healing. J. Orthop. Res. 29, 684-693 (2011).
- Loiselle, A. E., et al. Bone marrow-derived matrix metalloproteinase-9 is associated with fibrous adhesion formation after murine flexor tendon injury. PloS one. 7, e40602 (2012).
- Lee, D. J., et al. Parathyroid hormone 1-34 enhances extracellular matrix deposition and organization during flexor tendon repair. J Orthop Res. 33, 17-24 (2015).
- Geary, M. B., et al. Systemic EP4 Inhibition Increases Adhesion Formation in a Murine Model of Flexor Tendon Repair. PloS one. 10, e0136351 (2015).
- Loiselle, A. E., et al. Development of antisense oligonucleotide (ASO) technology against Tgf-beta signaling to prevent scarring during flexor tendon repair. J Orthop Res. 33, 859-866 (2015).
- Orner, C. A., Geary, M. B., Hammert, W. C., O'Keefe, R. J., Loiselle, A. E. Low-dose and short-duration Matrix Metalloproteinase 9 Inhibition does not affect adhesion formation during murine flexor tendon healing. Plast Reconstr Surg. , (2016).
- Loiselle, A. E., et al. Remodeling of murine intrasynovial tendon adhesions following injury: MMP and neotendon gene expression. J Orthop Res. 27, 833-840 (2009).
- Tsubone, T., et al. Effect of TGF-beta inducible early gene deficiency on flexor tendon healing. J Orthop Res. 24, 569-575 (2006).
- Beason, D. P., Kuntz, A. F., Hsu, J. E., Miller, K. S., Soslowsky, L. J. Development and evaluation of multiple tendon injury models in the mouse. J Biomech. 45, 1550-1553 (2012).
- David, M. A., et al. Tendon repair is compromised in a high fat diet-induced mouse model of obesity and type 2 diabetes. PloS one. 9, e91234 (2014).
- Wong, J. K., et al. The cellular biology of flexor tendon adhesion formation: an old problem in a new paradigm. Am J Pathol. 175, 1938-1951 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved