Method Article
Murino tendine flessore Lesioni e Chirurgia riparazione
In questo articolo
Riepilogo
tendini flessori della mano sono comunemente feriti, portando a mano la funzione compromessa. Tuttavia, la risposta di guarigione tessuto cicatriziale non è ben caratterizzato. Un modello murino di tendine flessore guarigione è dimostrata qui. Questo modello può migliorare la comprensione globale del processo di guarigione e valutare approcci terapeutici per migliorare la guarigione.
Abstract
Tendine collega muscolo scheletrico e ossa, facilitando il movimento di quasi tutto il corpo. Nella mano, tendini flessori (FTS) consentono la flessione delle dita e funzione generale mano. Lesioni ai FTS sono comuni, e la guarigione soddisfacente è spesso compromessa a causa di tessuto cicatriziale in eccesso e aderenze tra il tendine e il tessuto circostante. Tuttavia, poco si sa circa le componenti molecolari e cellulari del FT riparazione. A tal fine, un modello murino di FT di riparazione che riassume molti aspetti della guarigione negli esseri umani, tra cui gamma ridotta di movimento e una diminuzione delle proprietà meccaniche, è stato sviluppato e descritto in precedenza. Qui è prevista una dimostrazione approfondita di questa procedura chirurgica, che coinvolge transezione e successiva riparazione del tendine flessore lungo delle dita (FDL) nella zampa posteriore murino. Questa tecnica può essere utilizzata per condurre analisi lineage di tipi cellulari, valutare gli effetti di aumento di gene o perdita di funzione, e per testare l'efficacia di interventi farmacologici nel processo di guarigione. Tuttavia, ci sono due limitazioni principali per questo modello: i) il tendine FDL nella porzione centrale della zampa posteriore murino, dove la transezione e riparazione verificano, non è circondato da una guaina sinoviale. Pertanto questo modello non tiene conto per il potenziale contributo della guaina al processo di formazione della cicatrice. ii) per proteggere l'integrità del sito di riparazione, il FT viene rilasciata a livello della giunzione miotendinea, diminuendo le forze meccaniche del tendine, probabilmente contribuire ad una maggiore formazione di cicatrici. Isolamento di cellule sufficiente dal tessuto di granulazione del FT durante il processo di guarigione per analisi citofluorimetrica ha dimostrato impegnativo; citologia centrifugazione concentrare queste cellule è un metodo usato in alternativa, e permette di generazione di preparazioni di cellule in cui può essere eseguita l'etichettatura immunofluorescenza. Con questo metodo, la quantificazione di cellule o proteine di interesse durante FT guarigione diventa possibile.
Introduzione
tendini flessori del lavoro manuale di concerto con i muscoli flessori dell'avambraccio e guaine digitali per consentire la flessione delle cifre e afferrando funzione della mano. tendini flessori corrono lungo il lato palmare della mano; questa posizione relativamente superficiale si traduce spesso in lesioni ai tendini flessori durante un trauma alla mano. I tendini guarire attraverso una risposta tessuto cicatriziale piuttosto che rigenerazione dei tessuti normali tendine 1. Mentre questo tessuto cicatriziale fornisce continuità al tendine, funzione viene drasticamente diminuita rispetto al tendine sano. Compositi tessuto tendineo-cicatrice sono caratterizzati da proprietà meccaniche deteriorate 1, rendendo i tendini riparati più probabilità di rottura. Inoltre, il tessuto cicatriziale manca l'organizzazione della struttura nativa fibre collagene tendine, causando un aumento della dimensione del tendine e bulk. Dati i vincoli anatomiche dell'unità tendine-guaina, anche un modesto aumento delle dimensioni del tendine può drasticamente rossouce la funzione scivolante del tendine, e quindi gamma cifre di movimento e funzione della mano.
Prima di lesioni del 1960 ai tendini flessori, in particolare quelli nella zona II della mano, non sono stati regolarmente riparato a causa delle gravi complicanze nella guarigione sorte con queste riparazioni 2. Questa zona della mano è stato indicato come 'terra di nessuno' 3. Tuttavia, i miglioramenti delle tecniche chirurgiche, i modelli di sutura e protocolli di riabilitazione di terapia fisica sono notevolmente migliorato i risultati del tendine flessore riparazioni 2. Nonostante questi progressi, fino al 40% delle riparazioni provocare la formazione di aderenze sufficiente a impedire la funzione della mano 4. Di conseguenza, un approccio biologico è necessario per migliorare la guarigione. Purtroppo, molto poco si sa circa il processo di guarigione del tendine a livello cellulare e molecolare. Così, l'obiettivo era quello di sviluppare un modello murino che potrebbe essere utilizzato per migliorare la understandin fondamentaleg dei componenti cellulari e molecolari del tendine flessore guarigione e la risposta formazione di cicatrici, come un mezzo per identificare nuovi bersagli terapeutici per migliorare la guarigione.
modelli animali più grandi hanno svolto un ruolo fondamentale nel favorire la comprensione del processo di guarigione del tendine flessore. Canine e coniglio studi hanno dimostrato sia la capacità di guarigione intrinseca ed estrinseca dei tendini flessori 5,6, l'importanza del movimento passivo anticipato controllato per minimizzare la formazione di aderenze relativa immobilizzazione 7, nonché gli effetti di diversi modelli di sutura sul processo di guarigione 8 , 9. Inoltre, il modello canino è stato utile in fase di test traslazionali approcci di ingegneria tissutale per migliorare la guarigione 10. Tuttavia, ci sono diversi importanti vantaggi nell'uso di un modello murino rispetto ad un grande modello animale, compreso il relativo costo, disponibilità di reagenti specifici murine, e la facilità di generare Knoc globalek-out o costrutti cancellazione / iperespressione tessuto-specifici. Inoltre, le somiglianze funzionali tra umano e topi rispetto ai tendini flessori 11 indicano la potenziale utilità nello sviluppo di un modello murino.
Sviluppo di un modello murino di tendine flessore transezione e riparazione imita molti aspetti della guarigione clinica, tra cui la formazione di abbondante tessuto cicatriziale e deteriorate proprietà meccaniche. Il modello qui descritto non è un vero ricapitolazione della pratica clinica a causa transezione del FDL all'incrocio miotendinea per proteggere il sito di riparazione. Inoltre, questo modello non tiene conto del contributo delle cellule sinoviali guaina alla risposta di guarigione, in quanto non vi è alcuna guaina sinoviale che copre la porzione centrale del tendine dove avviene la riparazione. Nonostante queste limitazioni, questo modello ha il vantaggio di gamma generatrice di aderenze movimento limitativo, che deve ancora essere dimostrata in modelli murini che più closely approssimare la situazione clinica. Questo modello è stato utilizzato per valutare knock-out modelli di topo 12,13, e per testare diversi approcci farmacologici per migliorare la guarigione 14-17. Istologica analisi di questo modello, utilizzando immunoistochimica e ibridazione in situ, in grado di fornire spunti importanti per la localizzazione dei geni chiave e proteine durante la guarigione. Tuttavia, l'istologia fornisce solo una analisi spaziale trasversale e non consente la quantificazione durante tutto il tessuto. Citometria a flusso rappresenta un approccio più quantitativo, ma solo un numero molto limitato di cellule può essere isolato dal tessuto guarigione tendine nel modello murino, e questo numero è ulteriormente diminuito durante fasi di fissazione, permeabilizzazione, e lavaggio. Prendendo questo in considerazione, citometria a flusso diventa un approccio impraticabile a causa del numero di animali che sarebbe necessaria. Un metodo alternativo è necessario per preservare la maggior parte di questa piccola popolazione di cellule in ordineper caratterizzare ulteriormente l'ambiente di guarigione. Il metodo utilizzato per ottenere questo, qui illustrato, coinvolge la concentrazione delle cellule isolate mediante citologia centrifugazione su un vetrino, seguito da immunocitochimica. Nel presente studio EdU (5-etinil-2'deoxyuridine, un analogo della timidina) l'inserimento e la successiva etichettatura è stato utilizzato per determinare lo stato proliferativo delle cellule relativa al luogo di guarigione. Questo approccio può essere applicato per testare l'efficacia dei trattamenti farmacologici sulla proliferazione cellulare, gene knock-out o sovraespressione, o per identificare e quantificare diverse popolazioni cellulari.
Protocollo
Il Comitato Università per la ricerca degli animali presso l'Università di Rochester ha approvato tutti gli esperimenti sugli animali. Dieci-12 settimane vecchio C57BL femmina / 6J sono stati utilizzati.
1. Preparazione degli animali per la chirurgia del tendine flessore (~ 15 min)
- strumenti chirurgici autoclave per sterilizzare, indossare guanti sterili in tutto, e mantenere un campo operatorio sterile.
- Anestetizzare il topo mediante iniezione intraperitoneale (ip) con un volume di ketamina (80 mg / kg) e xilazina (10 mg / kg) corrispondenti al peso corporeo. Confermare la profondità della sedazione via dell'assenza di toe-pinch reflex.
- Somministrare l'analgesia preventiva (buprenorfina, 0,05-0,1 mg / kg) per via sottocutanea. Applicare una pomata oftalmica per evitare che gli occhi si secchi.
- Preparare il sito chirurgico dal ritaglio della pelliccia sull'intero arto posteriore. Sterilizzare la pelle con il lavaggio in sequenza con povidone iodio, seguito dal 70% di etanolo, e di nuovo con povidone iodio.
2. Murino tendine flessore Lesioni e Chirurgia di riparazione (~ 10 min)
- Trova il tendine flessore lungo delle dita (FDL), visto superficialmente nella parte mediale del polpaccio. Usando un bisturi, fare una piccola 0,5-1 cm incisione nella pelle con micro-forbici per esporre il tendine.
- Utilizzare pinze per separare il tendine FDL dal tessuto circostante e risalire fino al bivio miotendinea. Tagliare il tendine a questo incrocio con le forbici a molla per rilasciarlo, avendo cura di evitare l'arteria tibiale posteriore.
- Chiudere la pelle con 5-0 punti di sutura in nylon.
Nota: La transezione e riparazione (punti 2,4) FDL devono essere eseguiti utilizzando uno stereomicroscopio. - Eseguire un'incisione 3 millimetri sopra l'aspetto postero della zampa posteriore con molle micro-forbici. ritrarre delicatamente il tessuto molle circostante e muscolare con una pinza, facendo in modo di ridurre al minimo i danni ai tessuti, e identificare il tendine FDL.
- Delicatamente sollevare il tendine FDL e completamente transetto utilizzando micro-forbici. Suturare le estremità del tendine FDL insieme in un modello Kessler modificato con 8-0 suture, evitando l'essiccazione del tendine bagnando periodicamente con soluzione salina.
- Sostituire tessuti molli e muscoli sopra il tendine, quindi chiudere l'incisione con 5-0 punti di sutura in nylon.
- Posizionare topi su un vetrino più caldo insieme a 37 ° C, per mantenere la temperatura corporea fino recuperato da anestesia.
- Monitorare topi post-operatoria per i segni di deterioramento o infezione tra cui una maggiore vocalizzi e pelliccia arruffata. Iniettare buprenorfina (50 ml / mouse) come analgesico ogni 12 ore fino a quando i topi mostrano più segni di dolore o disagio.
- Consentire topi per guarire per un periodo di 10 giorni dopo l'intervento chirurgico prima di proseguire per i prossimi passi.
Nota: Le celle possono essere raccolte in qualsiasi momento-punto di post-intervento chirurgico. Qui, 10 giorni sono scelti per questi esperimenti rappresentativi indicati relativamente elevata cellularità del tessuto in questo momento.
3. Labeling di cellule proliferanti (~ 10 min)
- Preparare EdU (5-etinil-2'deoxyuridine) soluzione (10 mg / ml in soluzione salina tamponata sterile fosfato [PBS] + 1% Dimetilsolfossido [DMSO] per aumentare la solubilità).
- Iniettare topi con 100 microlitri EdU (50 mg / kg) mediante iniezione ip 24 ore prima del sacrificio.
4. Celle di raccolta per citologia centrifugazione (2,5 ore, ~ 30 minuti Hands-on Time)
- Preparare 3 mg / ml di collagenasi I in PBS.
- Euthanize mouse mediante anidride carbonica asfissia con una portata non superiore 3 L / min, ed eseguire dislocazione cervicale come misura secondaria.
- Individuare il tendine riparato con passo 2.4, e isolare tessuto tendineo tagliando circa 2 mm su entrambi i lati del sito della lesione con micro-forbici.
- tessuto Mince con bisturi in una capsula di Petri con 1 ml di 3 mg / ml di collagenasi, quindi passare la miscela attraverso un 18 ago G più volte per rompere il tessuto. Raccogliere composto in una provetta da 1,5 ml centrifuga.
- Digest tessuto tendineo per 1 ora a 37 ° C con agitazione.
- Spin tessuto verso il basso (300 xg per 5 min), aspirare collagenasi, quindi risospendere le cellule / tessuti con albumina 500 microlitri 3% di siero bovino (BSA) in PBS pipettando su e giù diverse volte.
- sospensione cellulare filtro attraverso un colino cella di 70 micron per rimuovere i detriti e grossi pezzi di tendine, e mettere da parte in un incubatore a 37 °.
- Mettere tessuto tendineo in un'altra provetta da centrifuga da 1,5 ml, e aggiornare con 1 ml di soluzione di collagenasi, pipettando su e giù per mescolare.
- Incubare tessuto un'altra ora a 37 ° C con agitazione.
- Spin down tessuto tendineo digerito (300 xg per 5 min), poi risospendere in 500 microlitri 3% BSA in PBS pipettando su e giù parecchie volte.
- Filtrare sospensione cellulare attraverso un colino cella di 70 micron, si combinano con sospensioni isolato in 4.3.3, poi contare le cellule con un emocitometro.
- Lavare le cellule ancora una volta con 3% BSA in PBS, poi risospendere per 3-6x 10 4/100 microlitri.
- Fissare un imbuto citologia a una diapositiva carica positiva e bloccare nel supporto scorrevole. Inserire l'intero apparato in una centrifuga citologico e aggiungere sospensione cellulare 100 microlitri all'imbuto. Centrifugare a 300 xg per 5 minuti per disperdere le cellule al vetrino.
5. Immunocitochimica per rilevare EdU (2 ore, ~ 45 min Hands-on Time)
Nota: Tutte le fasi di incubazione devono essere eseguiti al buio per limitare photobleaching di fluorofori.
- cellule di cerchio con una penna barriera idrofobica per minimizzare soluzione necessaria per i seguenti passaggi, quindi fissare immediatamente con 150 microlitri 3% paraformaldeide in PBS 15 min a temperatura ambiente (RT).
- Lavare due volte per 5 minuti con 150 microlitri 3% BSA in PBS.
- cellule permeabilize con 0,5% Triton-X 100 in PBS 20 minuti a temperatura ambiente.
- Ripetere la fase di lavaggio come al punto 5.1.1.
- Preparare EdU cockt reazioneail secondo le istruzioni del kit non più di 30 minuti prima dell'uso.
- Aggiungere cocktail 150 microlitri per ogni diapositiva, incubare 30 minuti a temperatura ambiente.
- Ripetere la fase di lavaggio come al punto 5.1.1.
- Incubare con 150 ml di contrasto nucleare Hoechst33342 diluito 1: 2000 in PBS 30 minuti a temperatura ambiente.
- Lavare due volte per 5 minuti con 150 ml PBS 1X.
- Aggiungere 1-2 gocce medie a celle di montaggio anti-sbiadimento, poi lentamente vetrino inferiore per evitare bolle.
- Lasciare mezzo di montaggio per curare una notte al buio a temperatura ambiente.
- Utilizzare smalto trasparente per sigillare il coprioggetto alla diapositiva.
- Le diapositive di immagini a 40X con lo zoom utilizzando un microscopio a fluorescenza dotato di filtri di eccitazione / emissione in grado di rilevare DAPI (Hoeschst33342) e Texas Red (Alexa Fluor 594).
Risultati
Il flessore lungo delle dita (FDL) del muscolo, che si trova al polpaccio, agisce a flettere le cifre della zampa del mouse posteriori tramite il tendine flessore (evidenziato in blu nella figura 1A, e mostrato istologicamente in figura 2A), che si estende prossimalmente dal miotendinea giunzione e termina in falangi distali. In questo modello di tendine flessore guarigione, il tendine FDL viene sezionato e riparato a metà piede, prossimale alla biforcazione per le cifre del zampa posteriore (frecce rosse, Figura 1A). Per impedire la rottura della riparazione, che esclude analisi sperimentale, il tendine (e muscoli adiacenti) viene tagliato, o rilasciati, all'incrocio miotendinea (freccia gialla in figura 1B, rilascio mostrato nella Figura 1C). Mentre questo passo non è rappresentativo dello scenario clinica, è fondamentale per proteggere la riparazione diminuendo pressione sul sito della lesione. Figura 2Dè un esempio istologico di una rottura riparazione del tendine flessore, rispetto ad una riparazione di successo mostrato nella Figura 2C. In quest'ultimo, i display di tessuto di granulazione notevolmente aumentato cellularity rispetto al tendine indenne (Figura 2B), e questa popolazione di cellule possono poi essere ulteriormente analizzate mediante citologia centrifugazione su un vetrino seguita da immunocitochimica. Figura 3 delinea la procedura sperimentale utilizzata per valutare lo stato proliferativo delle cellule raccolte da guarire tendini 10 giorni post-riparazione tramite EdU incorporazione nel DNA di nuova sintesi. Etichettatura EdU mostra quindi solo le cellule che attivamente proliferavano durante il periodo di 24 ore dopo l'impulso EdU in topi vivi, come si vede nella figura 4. Una valutazione quantitativa della proliferazione del tessuto di granulazione del tendine guarigione può quindi essere determinato dal punto conteggio dell'intero preparazione cellulare. In questo modo, una linea di base di proliferazione può essere stabilita in ogni punto del tempo, e le eventuali modifiche dovute a interventi genetici o farmacologici può essere valutata.
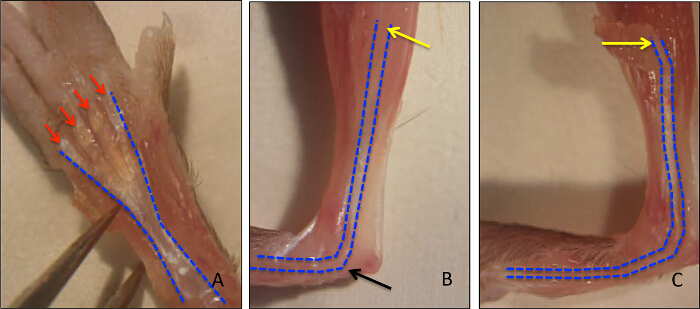
Figura 1 :. murino Hind Paw Anatomia e Identificazione del flessore Longus tendine. Il flessore lungo delle dita (FDL) flette le cifre nella zampa del mouse posteriori e corre lungo il lato palmare della zampa posteriore (FDL delineata in blu), dove biforca in cifre (frecce rosse) (Figura 1A). Prossimale, il tendine FDL attraversa il tunnel tarsale (freccia nera), in vitello, che termina all'incrocio miotendinea (freccia gialla) (Figura 1B). Il rilascio del tendine a livello della giunzione miotendinea per evitare la rottura è mostrato in Figura 1C. Clicca qui per vedere una versione più grande di questa figura.
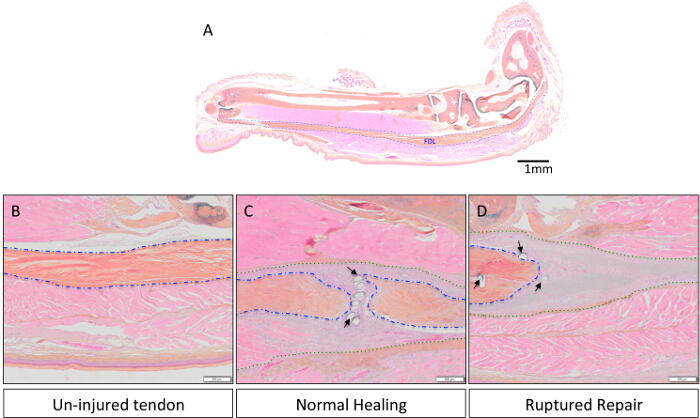
Figura 2:. Rappresentativi istologiche Immagini di Un-feriti, guarigione normale e Rottura del tendine flessore Riparazioni L'anatomia del tendine FDL nella zampa posteriore murino è mostrato nella Figura 2A. Barra di scala rappresenta 1 mm. Nelle figure 2B-D, il tendine viene ingrandita a 8X per confrontare indenne tessuto tendineo (Figura 2B) per una riparazione intatto e rottura (Figure 2C e 2D, rispettivamente). Interi campioni zampa posteriore sono stati fissati in formalina tamponata neutra, inclusi in paraffina, tagliato a 3 sezioni micron, e colorati con Alcian blu / ematossilina / arancio G come descritto in precedenza 13. tendine nativo è delineata in blu, composito tendine / tessuto di granulazione è delineato nella verde e frecce nere indicano punti di sutura. Barre di scala rappresentano 200 micron. Pleasing clicca qui per vedere una versione più grande di questa figura.
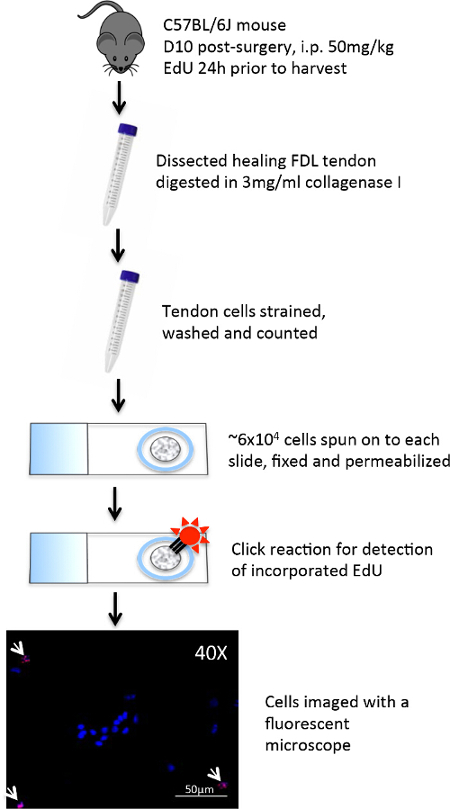
Figura 3: Procedura sperimentale per eseguire EdU Click-it Chimica su preparazioni di cellule Il giorno 10 post-operatorio di guarigione tendini FDL stati sezionati da topo zampe posteriori.. I tendini sono stati sminuzzati poi digeriti per due ore in collagenasi I dissociare le cellule. La sospensione cellulare è stato teso per rimuovere i detriti, e ~ 6 x 10 4 cellule sono state filata in un monostrato su vetrini carichi positivamente utilizzando una centrifuga citologia. Le cellule sono state cerchiati con una penna barriera idrofobica e poi fissate immediatamente con paraformaldeide. Dopo permeabilizzazione con Triton X-100, le cellule sono state trattate con un sistema di rilevamento cocktail EdU, e una reazione chimica click legati Alexa Fluor 594 a incorporato edu. Hoechst 33342 è stato utilizzato come colorazione nucleare, e le cellule wer e analizzati a 10-40X con un microscopio a fluorescenza. Cliccate qui per vedere una versione più grande di questa figura.
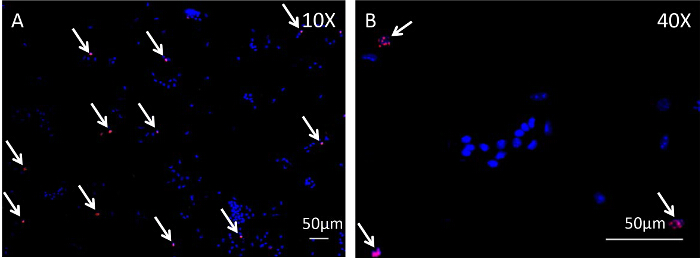
Figura 4:. Analisi immunocitochimica di cellule ciclismo edu-etichettati Durante tendini tendine flessore guarigione Healing FDL sono state raccolte dalle zampe posteriori di topi di 10 giorni post-operatorio e digerito con collagenasi per ottenere una sospensione cellulare. La centrifugazione è stata usata per disperdere queste cellule in un monostrato su vetrini, seguito da immunocitochimica all'immagine EdU incorporazione. Figura 4A e 4B sono immagini prese a 10X e 40X, rispettivamente, delle cellule seguenti analisi immunocitochimica. macchia nucleare Hoechst 33342 è blu, e le cellule che hanno incorporato EdU sono punteggiate di rosso. Barre di scala rappresentano 50 micron.href = "https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/54433/54433fig4large.jpg" target = "_ blank"> Clicca qui per vedere una versione più grande di questa figura.
Discussione
La procedura chirurgica per un modello murino di completo transection e riparazione del flessore lungo delle dita tendine è presentato in questo studio. Inoltre è dimostrato una nuova applicazione di concentrare piccole popolazioni cellulari con citologia centrifuga, per consentire analisi immunocitochimica quantitativa dell'ambiente cellulare durante tendine flessore guarigione. Questo modello di riparazione tendine flessore dimostra una risposta di guarigione riproducibile, che può essere usato per valutare i cambiamenti nel processo di guarigione utilizzando modelli knockout o con intervento farmacologico. Dopo l'intervento chirurgico, una reazione infiammatoria inizia entro 24 ore, durante il quale le cellule sono reclutati per il sito del pregiudizio e del callo di tessuto fibroso comincia a formarsi. Una fase proliferativa segue a circa quattro giorni, coinvolgendo notevolmente aumentato cellularità ed abbondante deposizione di matrice extracellulare disorganizzato al sito di riparazione, che porta alla formazione di aderenze tra 14-21 giorni. Rimodellamento tissutale contiNues attraverso giorno 35, in cui la continuità di tempo e di organizzazione del tendine flessore viene ripristinato, e cellularità è ridotto 18.
Attualmente, esistono diversi modelli murini di flessore riparazione tendinea oltre a quella qui presentata. Tsubone et al., Hanno descritto un modello in vitro di tendine flessore guarigione 19. Anche se questo modello può valutare i cambiamenti nell'espressione genica nel corso del tempo, non si può spiegare il reclutamento di cellule estrinseche o cambiamenti di ambiente infiammatorio / citochina che si verifica in vivo. In vivo, due modelli di transezione parziale sono stati sviluppati utilizzando incisionali o escissionale difetti 20,21. Più recentemente, Wong et al., Caratterizzato un modello Zone II di lesioni tendine flessore in un modello murino 22. Questo è uno sviluppo importante, in quanto consente il contributo delle cellule guaina derivate sinoviali al processo di guarigione da definire. Tuttavia, non quantificabile cambiamenti nella funzione di scorrimento sono state descritte utilizzando questo modello. Ogni modello ha i suoi vantaggi e le limitazioni che devono essere considerati, tra cui la facilità tecnica, rilevanza clinica e anatomia. Una limitazione principale del modello qui descritto è che il tendine guarigione può rompersi prima della valutazione, rendendolo inutilizzabile per ulteriori analisi. Raccolta cellule sufficiente è fatto impraticabile in queste circostanze e ogni analisi istochimiche non è praticabile, come tendine rotto non segue il processo di guarigione standard descritto sopra. Rilasciando il tendine FDL prossimalmente per diminuire sforzo sul tendine guarigione è pertanto un passo critico per la prevenzione, nonostante il fatto che non è clinicamente rilevante. Condurre l'intervento unilaterale abbassa anche il tasso di rottura. Un'altra limitazione è l'incapacità di monitorare il contributo delle cellule guaina peri-tendinei, come la guaina sinoviale non circonda il segmento di FDL tendine che è ferito in questo modello.
jove_content "> Un importante funzione di questo flessore modello tendine riparazione è che permette la valutazione delle cellule nel sito di guarigione. immunofluorescenza / immunoistochimica (IHC) è una tecnica biologica comune che può essere utilizzato per caratterizzare queste cellule. Mentre IHC è particolarmente adatto per la determinazione delle informazioni spaziali, è sostanzialmente un metodo qualitativo. le variazioni di tessuti o composizione cellulare per tutta la profondità del tessuto può perdere, e la quantificazione delle popolazioni è difficile. flusso rappresenta citometria un approccio ideale per definire, quantificare e potenzialmente isolare cellule popolazioni durante la guarigione. Tuttavia, l'isolamento e la digestione del tessuto tendineo guarigione da questo modello rendimenti numero di cellule molto bassi per l'analisi di citometria di flusso (1-2 x 10 5 in media da ogni mouse), e la fissazione / passaggi permeabilizzazione per la rilevazione di markers intracellulari riduce questo numero ulteriormente. Usando citologia centrifugazione per concentrare le cellule isolate, seguita da immunocytocheMistry, fornisce un modo per caratterizzare queste piccole popolazioni di cellule. Un significativo vantaggio di questa tecnica è che non vi è alcuna necessità di mettere in comune i campioni insieme per ottenere cellule sufficiente; pertanto ogni topo rappresenta un singolo campione per l'analisi. Una considerazione importante nella generazione di questi preparati cellulari è mantenere la coerenza nel tessuto raccolto per l'analisi. muscolo circostante e la fascia possono aderire al tessuto di granulazione e devono essere attentamente sezionato via. Poiché questo metodo comporta la trasformazione minima delle cellule prima del fissaggio su guide, mantiene una maggioranza di cellule isolate per ulteriori analisi. In questo modo, quasi l'intera popolazione di cellule che compongono il tessuto adesione al sito di riparazione può essere valutata quantitativamente tramite immunocitochimica. Nel presente studio, EdU incorporazione dalle cellule proliferanti viene usato per dimostrare l'applicazione di questa tecnica citologia, tuttavia, può essere utilizzato anche per più complessa e approfondita caratterizzazione of le popolazioni cellulari eterogenee coinvolte nel tendine flessore guarigione. Le future applicazioni di questa tecnica può portare a più in profondità caratterizzazione delle popolazioni cellulari coinvolte nella guarigione del tendine, in quanto consente di determinare co-localizzazione di marcatori cellulari delle cellule associate con il tessuto di granulazione nella guarigione del tendine.Divulgazioni
The authors declare that they have no competing financial interests
Riconoscimenti
Questo lavoro è stato parzialmente sostenuto dalla Società Americana di Chirurgia della Mano Pilot Award e NIH / NIAMS 1K01AR068386-01 (a AEL) e NIAMS / NIH P30AR061307.
Materiali
| Name | Company | Catalog Number | Comments |
| Surgical preparation | |||
| C57BL/6J mice | Jackson Laboratories | 000664 | |
| Ketamine | Hospira | NDC# 0409-2051-05 | |
| Xylazine | Lloyd Inc. | NDC# 61311-482-10 | |
| Buprenorphine | Par Pharmaceutical Inc. | NDC# 42023-179-10 | |
| 0.9% sodium chloride irrigation | Hospira | NDC# 0409-6138-03 | For preparation of ketamine/xylazine and buprenorphine solutions |
| 1 ml syringe | BD | 309659 | |
| 30 G needle | BD | 305106 | |
| Povidone-Iodine solution | Aplicare | 82-226 | |
| 70% ethanol | |||
| Puralube vet opthalmic ointment | Dechra Veterinary Products | NDC# 17033-211-38 | |
| Name | Company | Catalog Number | Comments |
| Surgical tools | |||
| Portable balance 200 g | Ohaus | SP202 | |
| Spring scissors | Fine Science Tools | 15124-12 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Needle holders | Fine Science Tools | 91201-13 | |
| Micro spring scissors | Fine Science Tools | 15003-08 | |
| Micro needle holders | Fine Science Tools | 12061-02 | |
| 5-0 nylon sutures | Ethicon | 668G | |
| 8-0 microsurgery nylon sutures | Ethicon | 2808G | |
| Lab-Line histology slide warmer | Barnstead International | 26025 | |
| Name | Company | Catalog Number | Comments |
| Cytospin method | |||
| Collagenase Type I, lyophilized | Life Technologies | 1700-017 | |
| Bovine Serum Albumin | Cell Signaling Technologies | 9998S | |
| 1x PBS | Thermo Fisher | 10010-023 | |
| Cytology funnels | Fisher HealthCare | 10-354 | |
| HistoBond+ microscope slides | VWR | 16005-110 | |
| Cytospin 2 centrifuge | Shandon | SH-CYTO2 | |
| Name | Company | Catalog Number | Comments |
| Immunocytochemistry | |||
| Slide staining tray with black lid | IHC World | M920-2 | |
| Click-iT Plus EdU Imaging Kit | Life Technologies | C10639 | Includes EdU and Hoeschst 33342 |
| Immedge hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| ProLong Diamond mounting medium | Thermo Fisher | P36970 | |
| Glass coverslips 24 x 50 mm #1.5 | |||
| Clear nail polish |
Riferimenti
- Lin, T. Biomechanics of tendon inury and repair. J Biomech. 37, 865-877 (2004).
- Strickland, J. W. Development of flexor tendon surgery: twenty-five years of progress. J Hand Surg [Am]. 25, 214-235 (2000).
- Bunnell, S. Repair of tendons in the fingers and description of two new instruments. Surg Gynecol Obstet. 26, 103-110 (1918).
- Aydin, A., et al. Single-stage flexor tendoplasty in the treatment of flexor tendon injuries. Acta Orthop Traumatol Turc. 38, 54-59 (2004).
- Gelberman, R. H., Steinberg, D., Amiel, D., Akeson, W. Fibroblast chemotaxis after tendon repair. J Hand Surg Am. 16, 686-693 (1991).
- Lundborg, G., Rank, F. Experimental intrinsic healing of flexor tendons based upon synovial fluid nutrition. J Hand Surg Am. 3, 21-31 (1978).
- Aoki, M., Kubota, H., Pruitt, D. L., Manske, P. R. Biomechanical and histologic characteristics of canine flexor tendon repair using early postoperative mobilization. J Hand Surg Am. 22, 107-114 (1997).
- Kim, H. M., et al. Technical and biological modifications for enhanced flexor tendon repair. J Hand Surg Am. 35, 1031-1037 (2010).
- Aoki, M., Manske, P. R., Pruitt, D. L., Kubota, H., Larson, B. J. Work of flexion after flexor tendon repair according to the placement of sutures. Clin Orthop Relat Res. , 205-210 (1995).
- Zhao, C., et al. Award for Outstanding Orthopaedic Research: Engineering flexor tendon repair with lubricant, cells, and cytokines in a canine model. Clin Orthop Relat Res. 472, 2569-2578 (2014).
- Wong, J., Bennett, W., Ferguson, M. W., McGrouther, D. A. Microscopic and histological examination of the mouse hindpaw digit and flexor tendon arrangement with 3D reconstruction. J Anat. 209, 533-545 (2006).
- Katzel, E. B., et al. Impact of Smad3 loss of function on scarring and adhesion formation during tendon healing. J. Orthop. Res. 29, 684-693 (2011).
- Loiselle, A. E., et al. Bone marrow-derived matrix metalloproteinase-9 is associated with fibrous adhesion formation after murine flexor tendon injury. PloS one. 7, e40602 (2012).
- Lee, D. J., et al. Parathyroid hormone 1-34 enhances extracellular matrix deposition and organization during flexor tendon repair. J Orthop Res. 33, 17-24 (2015).
- Geary, M. B., et al. Systemic EP4 Inhibition Increases Adhesion Formation in a Murine Model of Flexor Tendon Repair. PloS one. 10, e0136351 (2015).
- Loiselle, A. E., et al. Development of antisense oligonucleotide (ASO) technology against Tgf-beta signaling to prevent scarring during flexor tendon repair. J Orthop Res. 33, 859-866 (2015).
- Orner, C. A., Geary, M. B., Hammert, W. C., O'Keefe, R. J., Loiselle, A. E. Low-dose and short-duration Matrix Metalloproteinase 9 Inhibition does not affect adhesion formation during murine flexor tendon healing. Plast Reconstr Surg. , (2016).
- Loiselle, A. E., et al. Remodeling of murine intrasynovial tendon adhesions following injury: MMP and neotendon gene expression. J Orthop Res. 27, 833-840 (2009).
- Tsubone, T., et al. Effect of TGF-beta inducible early gene deficiency on flexor tendon healing. J Orthop Res. 24, 569-575 (2006).
- Beason, D. P., Kuntz, A. F., Hsu, J. E., Miller, K. S., Soslowsky, L. J. Development and evaluation of multiple tendon injury models in the mouse. J Biomech. 45, 1550-1553 (2012).
- David, M. A., et al. Tendon repair is compromised in a high fat diet-induced mouse model of obesity and type 2 diabetes. PloS one. 9, e91234 (2014).
- Wong, J. K., et al. The cellular biology of flexor tendon adhesion formation: an old problem in a new paradigm. Am J Pathol. 175, 1938-1951 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon