Method Article
Flexor murino Lesión del tendón y Cirugía de reparación
En este artículo
Resumen
Los tendones flexores de la mano se lesionan con frecuencia, dando lugar a alteración de la función de la mano. Sin embargo, la respuesta de curación de la cicatriz de tejido no está bien caracterizado. Un modelo murino de la curación del tendón flexor se demuestra aquí. Este modelo se puede mejorar la comprensión global del proceso de curación y evaluar enfoques terapéuticos para mejorar la curación.
Resumen
Tendon conecta el músculo esquelético y el hueso, lo que facilita el movimiento de casi todo el cuerpo. En la mano, tendones flexores (FTS) permiten la flexión de los dedos y la función de la mano en general. Las lesiones en el FTS son comunes, y la curación satisfactoria a menudo se ven mermadas por el exceso de tejido cicatrizal y adherencias entre el tendón y el tejido circundante. Sin embargo, poco se sabe acerca de los componentes moleculares y celulares de la reparación FT. Para ello, un modelo murino de reparación FT que recapitula muchos aspectos de la cicatrización en seres humanos, incluyendo alteración de la amplitud de movimiento y la disminución de las propiedades mecánicas, se ha desarrollado y descrito previamente. A continuación se proporciona una demostración en profundidad de este procedimiento quirúrgico, que implica la transección y la posterior reparación del tendón flexor largo de los dedos (FDL) en la pata trasera murino. Esta técnica se puede utilizar para llevar a cabo el análisis de linaje de diferentes tipos de células, evaluar los efectos de la ganancia o pérdida de genes de función, y para probar la eficacia de las intervenciones farmacológicas en el proceso de curación. Sin embargo, hay dos limitaciones principales para este modelo: i) el tendón FDL en la porción media de la pata trasera murino, donde se producen la transección y reparación, no está rodeado por una vaina sinovial. Por lo tanto, este modelo no tiene en cuenta la contribución potencial de la funda para el proceso de formación de la cicatriz. ii) Para proteger la integridad de la zona de reparación, el FT es liberado en la unión miotendinosa, disminuyendo las fuerzas mecánicas del tendón, probablemente contribuyendo a un aumento de la formación de cicatrices. Aislamiento de células suficientes de tejido de granulación de la FT durante el proceso de curación para el análisis de citometría de flujo ha demostrado ser un desafío; centrifugación citología para concentrar estas células es un método alternativo utilizado, y permite la generación de preparaciones de células en el que puede llevarse a cabo el etiquetado de inmunofluorescencia. Con este método, la cuantificación de células o proteínas de interés durante la curación FT se hace posible.
Introducción
Los tendones flexores de la mano de obra en concierto con los músculos flexores del antebrazo y vainas digitales para permitir la flexión de los dedos y agarrar la función de la mano. Los tendones flexores corren a lo largo de la cara palmar de la mano; esta ubicación relativamente superficial a menudo resulta en lesiones de los tendones flexores durante un traumatismo en la mano. Los tendones se curan a través de una respuesta del tejido de la cicatriz en lugar de la regeneración de tejido del tendón normal de 1. Aunque este tejido cicatricial proporciona continuidad en el tendón, la función se reduce drásticamente con respecto al tendón sano. Materiales compuestos de tejido del tendón-cicatriz se caracterizan por propiedades mecánicas reducidas 1, lo que hace que los tendones reparados más propensos a romperse. Además, el tejido de cicatriz carece de la organización de la estructura de fibra de colágeno de tendón nativo, dando como resultado un aumento en el tamaño del tendón y a granel. Dadas las limitaciones anatómicas de la unidad de tendón-vaina, incluso un modesto incremento en el tamaño tendón puede drásticamente rojoUCE la función de deslizamiento del tendón, y por lo tanto rango dígitos de movimiento y la función de la mano.
Antes de las lesiones del 1960 a los tendones flexores, en particular los de la Zona II de la mano, no fueron reparados de forma rutinaria debido a las graves complicaciones en la cicatrización que surgieron con estas reparaciones 2. Esta zona de la mano se conoce como 'tierra de nadie' 3. Sin embargo, las mejoras en las técnicas quirúrgicas, los patrones de sutura y los protocolos de rehabilitación de terapia física han mejorado dramáticamente los resultados de la reparación del tendón flexor 2. A pesar de estos avances, hasta el 40% de las reparaciones resultado la formación de una adherencia suficiente para impedir la función de la mano 4. Por lo tanto, se requiere un enfoque biológico para mejorar la cicatrización. Por desgracia, se sabe muy poco sobre el proceso de curación del tendón a nivel celular y molecular. Por lo tanto, el objetivo fue desarrollar un modelo murino que se podría utilizar para mejorar la understandin fundamentalg de los componentes celulares y moleculares de la curación del tendón flexor y la respuesta la formación de cicatrices, como un medio para identificar nuevas dianas terapéuticas, para mejorar la curación.
modelos animales de mayor tamaño han sido fundamentales para fomentar la comprensión del proceso de curación del tendón flexor. Canina y de conejo estudios han demostrado tanto la capacidad de curación intrínseca y extrínseca de tendones flexores 5,6, la importancia de movimiento pasivo controlado temprano en la minimización de la formación de adherencias con relación a la inmovilización 7, así como los efectos de diferentes patrones de sutura en el proceso de curación 8 , 9. Además, el modelo canino ha sido útil en el ensayo de enfoques de ingeniería de tejidos de la traducción para mejorar la cicatrización 10. Sin embargo, hay varias ventajas importantes en el uso de un modelo murino con respecto a un modelo animal grande, incluyendo el costo relativo, la disponibilidad de reactivos específicos murinos, y la facilidad de generar KNOC mundialk-outs o construcciones de deleción / sobreexpresión específicos de tejido. Por otra parte, las similitudes funcionales entre humanos y ratones con respecto a los tendones flexores 11 indican la utilidad potencial en el desarrollo de un modelo murino.
Desarrollo de un modelo murino de la transección del tendón flexor y reparación imita muchos aspectos de la curación clínica, incluyendo la formación de tejido cicatricial abundante y propiedades mecánicas reducidas. El modelo descrito aquí no es un verdadero recapitulación de la práctica clínica debido a la transección de la FDL en la unión miotendinosa el fin de proteger el sitio de reparación. Además, este modelo no tiene en cuenta la contribución de las células de la vaina sinovial de la respuesta de curación, ya que no hay vaina sinovial que cubre la porción media del tendón donde se produce la reparación. A pesar de estas limitaciones, este modelo tiene la ventaja de rango de generación de adherencias que limita el movimiento, el cual aún no se ha demostrado en modelos murinos que más closEly aproximar el escenario clínico. Este modelo ha sido utilizado para evaluar los modelos de ratón knock-out 12,13, y para probar diferentes enfoques farmacológicos para mejorar la cicatrización 14-17. Análisis histológicos de este modelo, mediante inmunohistoquímica e hibridación in situ, puede proporcionar importantes conocimientos en la localización de genes y proteínas clave durante la curación. Sin embargo, la histología proporciona sólo un análisis espacial de la sección transversal y no permite la cuantificación en todo el tejido. La citometría de flujo representa un enfoque más cuantitativo, pero sólo un número muy limitado de células puede ser aislado a partir del tejido del tendón de la curación en el modelo de ratón, y este número se reduce aún más durante la fijación, permeabilización, y etapas de lavado. Teniendo esto en cuenta a, citometría de flujo se convierte en un enfoque inviable debido a la cantidad de animales que se requeriría. Un método alternativo es necesario para preservar la mayor parte de esta pequeña población de células con el finpara caracterizar mejor el medio de curación. El método utilizado para lograr esto, se muestra aquí, implica la concentración de las células aisladas mediante centrifugación citología en un portaobjetos de vidrio, seguido por inmunocitoquímica. En el presente estudio EdU (5-etinil-2'deoxyuridine, un análogo de la timidina) se utilizó incorporación y posterior etiquetado para determinar el estado de proliferación relativa de células en el sitio de curación. Este enfoque se puede aplicar para probar la eficacia de los tratamientos farmacológicos en la proliferación celular, el gen knock-out o sobreexpresión, o para identificar y cuantificar diferentes poblaciones de células.
Protocolo
El Comité Universitario de Investigación Animal de la Universidad de Rochester aprobó todos los experimentos con animales. Diez-12 semanas de edad C57BL / 6J se utilizaron.
1. Preparación de los animales para la cirugía del tendón flexor (~ 15 min)
- instrumentos quirúrgicos autoclave para esterilizar, usan guantes estériles en todo, y mantienen un campo quirúrgico estéril.
- Anestesiar al ratón a través de inyección intraperitoneal (ip) con un volumen de ketamina (80 mg / kg) y xilazina (10 mg / kg) que corresponde al peso corporal. Confirmar profundidad de la sedación a través de la ausencia de reflejo dedo del pie-pellizco.
- Administrar analgesia preventiva (buprenorfina, 0,05 hasta 0,1 mg / kg) por vía subcutánea. Aplique una pomada oftálmica para evitar que los ojos se sequen.
- Preparar el sitio quirúrgico por el recorte de la piel en toda la extremidad posterior. Esterilizar la piel mediante lavado secuencialmente con yodo de povidona, seguido de 70% de etanol, y de nuevo con yodo povidona.
2. Flexor murino Lesión del tendón y Cirugía de reparación (~ 10 min)
- Encuentra el tendón flexor largo de los dedos (FDL), visto superficialmente en la cara medial de la pantorrilla. El uso de un bisturí, hacer un pequeño 0,5-1 cm incisión en la piel con micro-tijeras para exponer el tendón.
- El uso de fórceps para separar el tendón FDL del tejido circundante y rastrear hasta la unión miotendinosa. Cortar el tendón en este cruce con tijeras de primavera para liberarlo, teniendo cuidado de evitar la arteria tibial posterior.
- Cierre la piel con suturas de nylon 5-0.
Nota: La transección y reparación (pasos 2.4) FDL deben llevarse a cabo utilizando un microscopio estereoscópico. - Hacer una incisión de 3 mm sobre la cara posterolateral de la pata trasera usando primavera micro-tijeras. retraer con suavidad el tejido blando circundante y el músculo con una pinza, asegurándose de minimizar el daño tisular, e identificar el tendón FDL.
- levante suavemente el tendón FDL y seccionar por completo el uso de micro-tijeras. Suturar los extremos del tendón FDL juntos en un patrón Kessler modificada con 8-0 suturas, evitar el secado de la tendón humedeciendo periódicamente con solución salina.
- Reemplazar el tejido blando y el músculo sobre el tendón, a continuación, cerrar la incisión con suturas de nylon 5-0.
- Coloque los ratones en un portaobjetos conjunto más caliente de 37 ° C, para mantener la temperatura corporal hasta que se recupere de la anestesia.
- Monitorear los ratones después de la operación para detectar signos de deterioro o infección, incluyendo el aumento de la vocalización y el pelo erizado. Inyectar buprenorfina (50 l / ratón) como analgésico cada 12 h hasta que los ratones ya no muestran signos de dolor o angustia.
- Permitir que los ratones se curen por un período de 10 días después de la cirugía antes de continuar con los pasos siguientes.
Nota: Las células se pueden cosechar en cualquier punto de tiempo posterior a la cirugía. Aquí, 10 días son elegidos para estos experimentos representativos dada la relativamente alta celularidad del tejido en este momento.
3. Labeling del ciclo de las células (~ 10 min)
- Preparar EdU (5-etinil-2'deoxyuridine) solución (10 mg / ml en solución salina tamponada con fosfato estéril [PBS] + 1% dimetil sulfóxido [DMSO] para aumentar la solubilidad).
- Inyectar ratones con 100 l EdU (50 mg / kg) mediante inyección ip 24 hr antes del sacrificio.
4. Las células de cosecha para Citología centrifugación (2,5 h, ~ 30 min manos a tiempo)
- Preparar 3 mg / ml de colagenasa I en PBS.
- La eutanasia del ratón a través de asfixia con dióxido de carbono a una velocidad de flujo de no más de 3 L / min, y llevar a cabo la dislocación cervical como una medida secundaria.
- Localizar el tendón reparado utilizando paso 2.4 anterior, y aislar tejido del tendón por el corte aproximadamente 2 mm a cada lado de la zona de la lesión con micro-tijeras.
- tejido de carne picada con el escalpelo en una placa de Petri con 1 ml de 3 mg / ml de colagenasa, a continuación, pasar la mezcla a través de una aguja de 18 G varias veces para romper el tejido. Recoger mezcla en un tubo de centrífuga de 1.5 ml.
- Digerir tejido del tendón durante 1 hora a 37 ° C con agitación.
- tejido de la vuelta hacia abajo (300 xg durante 5 min), colagenasa aspirado, a continuación, volver a suspender las células / tejido con albúmina de suero bovino 500 l 3% (BSA) en PBS pipeteando arriba y abajo varias veces.
- suspensión de células de filtro a través de un filtro de células de 70 micras para eliminar los residuos y grandes trozos de tendón, y dejar de lado en una incubadora a 37ºC.
- Coloque el tejido del tendón en otro tubo de centrífuga de 1,5 ml, y refrescar con 1 ml de solución de colagenasa, la pipeta hacia arriba y hacia abajo para mezclar.
- Incubar el tejido otra hora a 37 ° C con agitación.
- Girar el tejido del tendón digerida (300 xg durante 5 min), a continuación, volver a suspender en 500 l de 3% de BSA en PBS pipeteando arriba y abajo varias veces.
- Filtrar la suspensión celular a través de un filtro de células de 70 micras, se combinan con la suspensión aislado en 4.3.3, a continuación, contar las células con un hemocitómetro.
- Lavar las células una vez más con 3% de BSA en PBS, a continuación, volver a suspender a 3-6x 10 4/100 l.
- Coloque un embudo de citología a un portaobjetos con carga positiva y bloqueo en el soporte de diapositivas. Inserte todo el aparato en una centrífuga de citología y añadir la suspensión de células 100 l al embudo. Centrifugar a 300 xg durante 5 min para dispersar las células en el portaobjetos.
5. La inmunocitoquímica para detectar Edu (2 h, ~ 45 min manos a tiempo)
Nota: Todos los pasos de incubación se deben realizar en la oscuridad para limitar photobleaching de fluoróforos.
- células de círculo con un lápiz barrera hidrófoba para minimizar solución necesaria para las siguientes etapas, a continuación, fijar inmediatamente con 150 l 3% de paraformaldehído en PBS 15 min a temperatura ambiente (RT).
- Lavar dos veces durante 5 minutos con 150 l 3% de BSA en PBS.
- células permeabilizar con 0,5% Triton X-100 en PBS 20 min a TA.
- Repita el paso de lavado como en 5.1.1.
- Preparar EdU bu reacciónail acuerdo con las instrucciones del kit de no más de 30 minutos antes de su uso.
- Añadir cóctel de 150 l a cada diapositiva, incubar 30 min a TA.
- Repita el paso de lavado como en 5.1.1.
- Incubar con 150 l contratinción nuclear Hoechst33342 diluido 1: 2000 en PBS 30 min a TA.
- Lavar dos veces por 5 min con 150 l de 1x PBS.
- Añadir 1-2 gotas de medio a las células de montaje anti-fade, luego poco a poco cubreobjetos inferior para evitar burbujas.
- Permitir medio de montaje para curar toda la noche en la oscuridad a temperatura ambiente.
- Utilizar esmalte de uñas transparente para sellar el cubreobjetos al portaobjetos.
- Las diapositivas de imágenes en un aumento de 40X utilizando un microscopio de fluorescencia equipado con filtros de excitación / emisión capaces de detectar DAPI (Hoeschst33342), y Texas Red (Alexa Fluor 594).
Resultados
El flexor largo de los dedos (FDL) muscular, situado en la pantorrilla, actúa para flexionar los dedos de la pata trasera del ratón a través del tendón flexor (esbozado en azul en la Figura 1A, y se muestra histológicamente en la Figura 2A), que se extiende proximalmente desde el miotendinosa unión y termina en las falanges distales. En este modelo de cicatrización del tendón flexor, el tendón FDL se secciona y se repara en la parte media del pie, proximal a la bifurcación en la que los dígitos de la pata posterior (flechas rojas, Figura 1A). Para evitar la rotura de la reparación, lo cual impediría el análisis experimental, se corta el tendón (y el músculo adyacente), o en libertad, en la unión miotendinosa (flecha amarilla en la Figura 1B, la liberación se muestra en la Figura 1C). Si bien este paso no es representativo de la situación clínica, es fundamental para proteger la reparación por la disminución de la tensión en el lugar de la lesión. Figura 2Des un ejemplo histológico de una reparación del tendón flexor rotura, en comparación con una reparación exitosa muestra en la Figura 2C. En este último, las pantallas de tejido de granulación aumentaron en gran medida la celularidad en comparación con el tendón no lesionada (Figura 2B), y esta población de células pueden ser analizados adicionalmente por medio de centrifugación citología en un portaobjetos seguido por inmunocitoquímica. La figura 3 describe el procedimiento experimental usado para evaluar el estado de proliferación de las células recogidas de la curación de tendones 10 días post-reparación a través de EdU incorporación en el ADN recién sintetizado. Por lo tanto, el etiquetado EdU muestra sólo aquellas células que proliferaron activamente durante el período de 24 horas después de la pulso EdU en ratones vivos, como se ve en la Figura 4. Una evaluación cuantitativa de la proliferación en el tejido de granulación del tendón de la curación se puede determinar entonces por el punto de recuento de toda la preparación de células. De esta manera, una línea de base de proliferación se puede establecer en cada momento, y cualquier cambio debido a las intervenciones genéticas o farmacológicas puede ser evaluada.
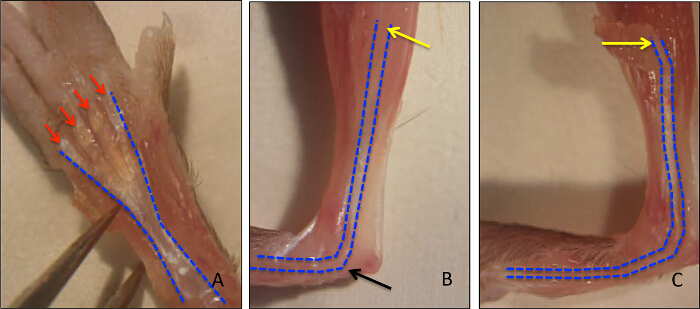
Figura 1 :. murino de la pata trasera Anatomía e Identificación del tendón flexor Longo. El músculo flexor largo (FDL) flexiona los dígitos en la pata posterior del ratón y corre a lo largo de la cara palmar de la pata trasera (FDL resume en azul) donde bifurca en los dígitos (flechas rojas) (Figura 1A). Proximal, el tendón FDL se ejecuta a través del túnel del tarso (flecha negro), hasta la pantorrilla, que termina en la unión miotendinosa (flecha amarilla) (Figura 1B). La liberación del tendón en la unión miotendinosa para evitar la ruptura se muestra en la Figura 1C. Por favor, haga clic aquí para ver una versión más grande de esta figura.
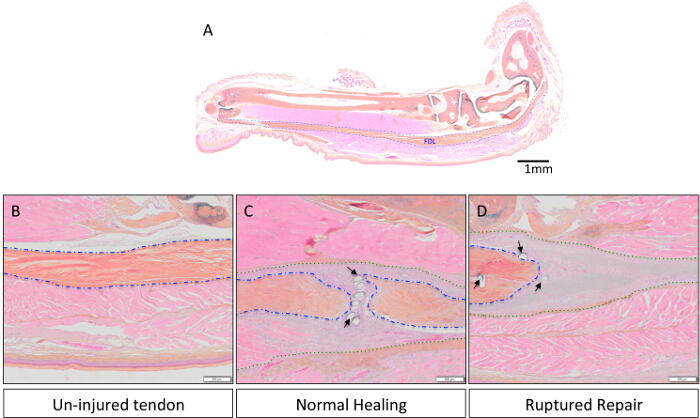
Figura 2:. Representativos imágenes histológicas de heridas-Un, curación normal y Reparaciones Ruptura del tendón flexor La anatomía del tendón FDL en la pata trasera murino se muestra en la Figura 2A. La barra de escala representa 1 mm. En las figuras 2B-D, el tendón se magnifica a 8X para comparar tejido del tendón no lesionada (Figura 2B) para una reparación intacta y ruptura (Figuras 2C y 2D, respectivamente). Enteros muestras de la pata trasera se fijaron en formalina tamponada neutra, incrustado en parafina, se cortaron en secciones de 3 m, y se tiñeron con azul Alcian / hematoxilina / Naranja G como se ha descrito previamente 13. tendón nativo se resume en azul, compuesta tendón / tejido de granulación se describe en verde, y las flechas negras indican las suturas. Las barras de escala representan 200 micras. Parrendar clic aquí para ver una versión más grande de esta figura.
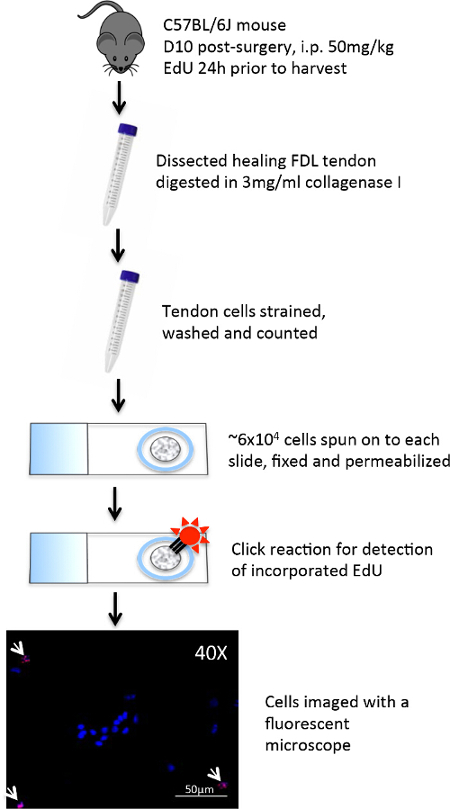
Figura 3: Procedimiento experimental para Realizar EdU Click-it Química en preparaciones celulares En el día 10 después de la cirugía de la curación de tendones FDL fueron disecados de las patas traseras del ratón.. Los tendones se picaron digirieron entonces durante dos horas en colagenasa I para disociar las células. La suspensión celular fue filtrada para eliminar los desechos, y ~ 6 x 10 4 células se centrifugaron en una monocapa en portaobjetos de vidrio cargados positivamente utilizando una centrífuga de la citología. Las células se rodearon con un lápiz barrera hidrofóbica y después se fijaron inmediatamente con paraformaldehído. Después de la permeabilización con Triton X-100, las células se trataron con un cóctel de detección EdU, y una reacción de química obligados Alexa Fluor 594 a EdU incorporado. Hoechst 33342 se usó como una mancha nuclear, y las células wer e analizadas en 10-40x con un microscopio de fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
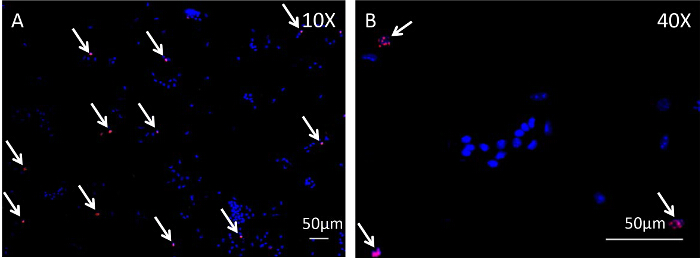
Figura 4:. Análisis inmunocitoquímica de células marcadas con EdU Ciclismo Durante los tendones del tendón flexor Curación Curación FDL se recolectaban en las patas traseras de los ratones 10 días después de la cirugía y se digirió con colagenasa para obtener una suspensión celular. La centrifugación se utiliza para dispersar estas células en una monocapa en portaobjetos, seguido por inmunocitoquímica a la imagen EdU incorporación. Figura 4A y la Figura 4B son imágenes tomadas a 10X y 40X, respectivamente, de las células siguientes análisis inmunocitoquímico. tinción nuclear Hoechst 33342 es azul, y las células que han incorporado a Edu salpicada de rojo. Las barras de escala representan 50 micras.href = "https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/54433/54433fig4large.jpg" target = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El procedimiento quirúrgico para un modelo murino de la transección completa y la reparación del tendón flexor largo de los dedos se presenta en este estudio. Además, se demostró una nueva aplicación de la concentración de las poblaciones de células pequeñas con centrífuga citología, lo que permite el análisis inmunocitoquímico cuantitativa del entorno celular durante la cicatrización del tendón flexor. Este modelo de reparación del tendón flexor demuestra una respuesta de curación reproducible, que se puede utilizar para evaluar los cambios en el proceso de curación usando modelos knockout o con una intervención farmacológica. Después de la cirugía, una reacción inflamatoria comienza dentro de las 24 horas, durante el cual las células son reclutados al sitio de la lesión y un callo de tejido fibroso comienza a formarse. Una fase proliferativa sigue a las cuatro días, que implica en gran medida el aumento de celularidad y abundante deposición de matriz extracelular desorganizado en el sitio de la reparación, lo que lleva a la formación de adherencias entre 14-21 días. La remodelación tisular continues hasta el día 35, en el que se restaura la continuidad del tiempo y organización del tendón flexor, y celularidad se reduce 18.
Actualmente, hay varios modelos murinos de reparación del tendón flexor, además de la que se presenta aquí. Tsubone et al., Han descrito un modelo in vitro de la curación del tendón flexor 19. Si bien este modelo puede evaluar los cambios en la expresión de genes con el tiempo, no puede tener en cuenta el reclutamiento de células extrínsecas o cambios en el medio inflamatorio / citoquina que se produce in vivo. In vivo, dos modelos de transección parcial se han desarrollado utilizando incisional o excisional defectos 20,21. Más recientemente, Wong et al., Caracterizado un modelo de la zona II de la lesión del tendón flexor en un modelo murino 22. Este es un avance importante, ya que permite la contribución de células de la vaina sinovial derivado de los procesos de sanación que se definan. Sin embargo, no cuantificable cambios en la función de deslizamiento se han descrito el uso de este modelo. Cada modelo tiene sus propias ventajas y limitaciones que deben ser considerados, incluyendo la facilidad técnica, relevancia clínica y la anatomía. Una limitación principal del modelo descrito aquí es que el tendón de la curación se puede romper antes de la evaluación, éste no podrá utilizarse para el análisis adicional. La recolección de células suficientes se hace inviable en estas circunstancias, y cualquier análisis histoquímico no es viable, como un tendón roto no sigue el proceso de curación estándar descrito anteriormente. Al soltar el tendón FDL proximalmente para disminuir la carga sobre el tendón de la curación, por tanto, es un paso crítico para la prevención, a pesar del hecho de que no es clínicamente relevante. La realización de la cirugía unilateral también reduce la tasa de ruptura. Otra limitación es la incapacidad para realizar un seguimiento de la contribución de las células de la vaina peri-tendinosas, como la vaina sinovial no rodea el segmento de FDL tendón que se ha lesionado en este modelo.
jove_content "> Una función importante de este modelo de reparación de tendón flexor es que permite la evaluación de las células en el sitio de curación. Inmunofluorescencia / inmunohistoquímica (IHC) es una técnica biológica común que puede ser utilizado para caracterizar estas células. Mientras IHC es especialmente adecuado para la determinación de la información espacial, es en gran medida un método cualitativo. los cambios en el tejido o la composición de células en toda la profundidad del tejido pueden perderse, y la cuantificación de las poblaciones es difícil. citometría de flujo representa un enfoque ideal para definir, cuantificar y potencialmente aislar células poblaciones durante la cicatrización. Sin embargo, los números muy bajos de células de aislamiento y la digestión del tejido del tendón curación de este modelo rendimientos para el análisis de citometría de flujo (1-2 x 10 5 en promedio de cada ratón), y la fijación / permeabilización de los pasos para la detección de marcadores intracelulares reduce este número más. el uso de centrifugación citología para concentrar las células aisladas, seguida de immunocytocheMistry, proporciona una manera de caracterizar estas pequeñas poblaciones de células. Una ventaja significativa de esta técnica es que no hay necesidad de muestras de la piscina junto para obtener suficientes células; Por lo tanto, cada ratón representa una muestra individual para el análisis. Una consideración importante en la generación de estas preparaciones de células es el mantenimiento de la coherencia en el tejido recogido para su análisis. músculo circundante y la fascia se pueden adherir al tejido de granulación y deben ser disecado cuidadosamente de distancia. Dado que este método implica un procesamiento mínimo de las células antes de la fijación en portaobjetos, conserva la mayoría de las células aisladas para su posterior análisis. De esta manera, prácticamente la totalidad de la población de células que componen el tejido de adhesión en el sitio de reparación se puede evaluar cuantitativamente a través de inmunocitoquímica. En el presente estudio, EdU incorporación por las células en proliferación se utiliza para demostrar la aplicación de esta técnica de citología, sin embargo, puede también ser utilizado para más complejo y en profundidad caracterización of las poblaciones de células heterogéneas implicados en la curación del tendón flexor. Las futuras aplicaciones de esta técnica pueden llevar a más en profundidad la caracterización de las poblaciones celulares que participan en la curación del tendón, ya que permite la determinación de co-localización de marcadores celulares en las células asociadas con el tejido de granulación en el tendón de curación.Divulgaciones
The authors declare that they have no competing financial interests
Agradecimientos
Este trabajo fue parcialmente apoyado por la Sociedad Americana de Cirugía de la Mano y el Premio Piloto NIH / NIAMS 1K01AR068386-01 (AEL) y NIAMS / NIH P30AR061307.
Materiales
| Name | Company | Catalog Number | Comments |
| Surgical preparation | |||
| C57BL/6J mice | Jackson Laboratories | 000664 | |
| Ketamine | Hospira | NDC# 0409-2051-05 | |
| Xylazine | Lloyd Inc. | NDC# 61311-482-10 | |
| Buprenorphine | Par Pharmaceutical Inc. | NDC# 42023-179-10 | |
| 0.9% sodium chloride irrigation | Hospira | NDC# 0409-6138-03 | For preparation of ketamine/xylazine and buprenorphine solutions |
| 1 ml syringe | BD | 309659 | |
| 30 G needle | BD | 305106 | |
| Povidone-Iodine solution | Aplicare | 82-226 | |
| 70% ethanol | |||
| Puralube vet opthalmic ointment | Dechra Veterinary Products | NDC# 17033-211-38 | |
| Name | Company | Catalog Number | Comments |
| Surgical tools | |||
| Portable balance 200 g | Ohaus | SP202 | |
| Spring scissors | Fine Science Tools | 15124-12 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Needle holders | Fine Science Tools | 91201-13 | |
| Micro spring scissors | Fine Science Tools | 15003-08 | |
| Micro needle holders | Fine Science Tools | 12061-02 | |
| 5-0 nylon sutures | Ethicon | 668G | |
| 8-0 microsurgery nylon sutures | Ethicon | 2808G | |
| Lab-Line histology slide warmer | Barnstead International | 26025 | |
| Name | Company | Catalog Number | Comments |
| Cytospin method | |||
| Collagenase Type I, lyophilized | Life Technologies | 1700-017 | |
| Bovine Serum Albumin | Cell Signaling Technologies | 9998S | |
| 1x PBS | Thermo Fisher | 10010-023 | |
| Cytology funnels | Fisher HealthCare | 10-354 | |
| HistoBond+ microscope slides | VWR | 16005-110 | |
| Cytospin 2 centrifuge | Shandon | SH-CYTO2 | |
| Name | Company | Catalog Number | Comments |
| Immunocytochemistry | |||
| Slide staining tray with black lid | IHC World | M920-2 | |
| Click-iT Plus EdU Imaging Kit | Life Technologies | C10639 | Includes EdU and Hoeschst 33342 |
| Immedge hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| ProLong Diamond mounting medium | Thermo Fisher | P36970 | |
| Glass coverslips 24 x 50 mm #1.5 | |||
| Clear nail polish |
Referencias
- Lin, T. Biomechanics of tendon inury and repair. J Biomech. 37, 865-877 (2004).
- Strickland, J. W. Development of flexor tendon surgery: twenty-five years of progress. J Hand Surg [Am]. 25, 214-235 (2000).
- Bunnell, S. Repair of tendons in the fingers and description of two new instruments. Surg Gynecol Obstet. 26, 103-110 (1918).
- Aydin, A., et al. Single-stage flexor tendoplasty in the treatment of flexor tendon injuries. Acta Orthop Traumatol Turc. 38, 54-59 (2004).
- Gelberman, R. H., Steinberg, D., Amiel, D., Akeson, W. Fibroblast chemotaxis after tendon repair. J Hand Surg Am. 16, 686-693 (1991).
- Lundborg, G., Rank, F. Experimental intrinsic healing of flexor tendons based upon synovial fluid nutrition. J Hand Surg Am. 3, 21-31 (1978).
- Aoki, M., Kubota, H., Pruitt, D. L., Manske, P. R. Biomechanical and histologic characteristics of canine flexor tendon repair using early postoperative mobilization. J Hand Surg Am. 22, 107-114 (1997).
- Kim, H. M., et al. Technical and biological modifications for enhanced flexor tendon repair. J Hand Surg Am. 35, 1031-1037 (2010).
- Aoki, M., Manske, P. R., Pruitt, D. L., Kubota, H., Larson, B. J. Work of flexion after flexor tendon repair according to the placement of sutures. Clin Orthop Relat Res. , 205-210 (1995).
- Zhao, C., et al. Award for Outstanding Orthopaedic Research: Engineering flexor tendon repair with lubricant, cells, and cytokines in a canine model. Clin Orthop Relat Res. 472, 2569-2578 (2014).
- Wong, J., Bennett, W., Ferguson, M. W., McGrouther, D. A. Microscopic and histological examination of the mouse hindpaw digit and flexor tendon arrangement with 3D reconstruction. J Anat. 209, 533-545 (2006).
- Katzel, E. B., et al. Impact of Smad3 loss of function on scarring and adhesion formation during tendon healing. J. Orthop. Res. 29, 684-693 (2011).
- Loiselle, A. E., et al. Bone marrow-derived matrix metalloproteinase-9 is associated with fibrous adhesion formation after murine flexor tendon injury. PloS one. 7, e40602 (2012).
- Lee, D. J., et al. Parathyroid hormone 1-34 enhances extracellular matrix deposition and organization during flexor tendon repair. J Orthop Res. 33, 17-24 (2015).
- Geary, M. B., et al. Systemic EP4 Inhibition Increases Adhesion Formation in a Murine Model of Flexor Tendon Repair. PloS one. 10, e0136351 (2015).
- Loiselle, A. E., et al. Development of antisense oligonucleotide (ASO) technology against Tgf-beta signaling to prevent scarring during flexor tendon repair. J Orthop Res. 33, 859-866 (2015).
- Orner, C. A., Geary, M. B., Hammert, W. C., O'Keefe, R. J., Loiselle, A. E. Low-dose and short-duration Matrix Metalloproteinase 9 Inhibition does not affect adhesion formation during murine flexor tendon healing. Plast Reconstr Surg. , (2016).
- Loiselle, A. E., et al. Remodeling of murine intrasynovial tendon adhesions following injury: MMP and neotendon gene expression. J Orthop Res. 27, 833-840 (2009).
- Tsubone, T., et al. Effect of TGF-beta inducible early gene deficiency on flexor tendon healing. J Orthop Res. 24, 569-575 (2006).
- Beason, D. P., Kuntz, A. F., Hsu, J. E., Miller, K. S., Soslowsky, L. J. Development and evaluation of multiple tendon injury models in the mouse. J Biomech. 45, 1550-1553 (2012).
- David, M. A., et al. Tendon repair is compromised in a high fat diet-induced mouse model of obesity and type 2 diabetes. PloS one. 9, e91234 (2014).
- Wong, J. K., et al. The cellular biology of flexor tendon adhesion formation: an old problem in a new paradigm. Am J Pathol. 175, 1938-1951 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados