Method Article
光血栓法を用いた外接莢梗塞モデル
要約
この原稿は、莢梗塞のモデリング技術が記載されています。ここでは、手術前のターゲット・マッピング後の光の低強度で変性された光血栓技術を利用しました。この技術を使用して、我々は永続的な運動障害を持つ外接莢梗塞モデルを作成しました。
要約
Recent increase in the prevalence rate of white matter stroke demands specific research in the field. However, the lack of a pertinent animal model for white matter stroke has hampered research investigations. Here, we describe a novel method for creating a circumscribed capsular infarct that minimizes damage to neighboring gray matter structures. We used pre-surgery neural tracing with adeno-associated virus-green fluorescent protein (AAV-GFP) to identify somatotopic organization of the forelimb area within the internal capsule. The adjustment of light intensity based on different optical properties of gray and white matter contributes to selective destruction of white matter with relative preservation of gray matter. Accurate positioning of optical-neural interface enables destruction of entire forelimb area in the internal capsule, which leads to a marked and persistent motor deficit. Thus, this technique produces highly replicable capsular infarct lesions with a persistent motor deficit. The model will be helpful not only to study white matter stroke (WMS) at the behavioral, circuit, and cellular levels, but also to assess its usefulness for development of new therapeutic and rehabilitative interventions.
概要
最近まで、「灰白質ストローク(GMS)のモデルは、「排他的脳卒中の病態生理を理解するために、新しい治療法の開発を導くために使用されています。すべてのストローク1,2の25% -しかし、15を構成している高齢者における皮質下白質に影響を与えるストロークの増加罹患率がありました。多くの研究は、白質ストローク(WMS)モデルを使用したいくつかの研究がある一方で、GMSモデルを使用に関するストロークを行われています。げっ歯類における白質は、ヒトまたは霊長類における白質よりも実質的に小さいです。これにより、選択白質3に標的領域にアクセスして破壊することはより困難です。さらに、全く効率的なツールを選択的に標的白質の計画範囲を破壊するためにこれまでに開発されていません。したがって、白質ストロークの研究のための適切なモデルの欠如がありました。
動物目rokeモデルは、多くの場合、新たなリハビリテーションや治療法の開発のための運動回復の進行を監視するために使用されます。人間のストローク4,5で実証解剖学的な変化と調和の長期神経学的欠損を示す動物モデルを利用することが理想的です。この点において、梗塞lesioning以下の運動障害や脳の広い関与の急速な回復は、脳卒中の研究を追求して現実的ではないかもしれません。前嚢梗塞モデルは内部のカプセル6-9にエンドセリン-1(ET-1)の内頸動脈または前部脈絡膜動脈と拡散の閉塞によってなされてきました。それにもかかわらず、動脈閉塞は、動脈の注意深い解剖が必要ですが、それは永続的な行動欠陥なしに、内部カプセルを含む梗塞病変の広い面積を、生成されます。また、ET-1は完全に内包後脚を破壊するために拡散していなかった、したがってより少ないとマークまたはBEHを持続しますavioral赤字。
光血栓梗塞モデルは広く皮質梗塞病変および皮質下構造10の様々なタイプを生成するために使用されています。技術は、小血管および梗塞病変の発生10で血小板凝集につながる焦点照明に続く静脈内投与が含まれます。ほとんどWMS病変5,11を生成するために使用されていないのに対し、光血栓技術が広く、GMS病変を作成するために使用されてきました。この技術については、ローズベンガル染料および光照射の組み合わせは、対応する機能障害を引き起こし、ターゲット構造の破壊に有用であることが実証されています。それは梗塞病変の大きさを決定するので、光血栓技術の重要な要素は、光照射です。灰白質および白質に異なる影響で光照射の結果、光の散乱が白ミリアンペアで4倍以上高くなっているので、灰白質12と比較してtter。光強度が十分に低い放射照度(<1140ミリワット/ mm 2)とがある場合したがって、1は光血栓病変が白質( すなわち 、内部カプセル)に範囲に影響を与えるように拡張機能を制限することができます。例えば、より高いエネルギーの光は、グレーと白の両方の問題に梗塞を誘導することができる、まだ低いエネルギーの光のみが白質に光血栓を誘発する可能性があります。また、光エネルギーの普及率は非常に限られていました。光エネルギーの約99%は、光13のソースから1ミリメートルを超えて失われました。したがって、より低いエネルギーの光が隣接灰白質の最小限の侵略と白質にのみ光血栓を誘発し、正確に標的にすることを期待されています。
ここでは、げっ歯類における内部カプセルの前肢の領域に梗塞病変を作成するための新規な方法を説明します。私たちは、内部CAに前肢領域の識別方法を説明しますpsule、調整、光の配信、および梗塞病変の生成を含む光照射の技術、。我々はまた、莢膜モデルの完全性を評価するために使用される行動試験を記載します。
プロトコル
すべての手順は、光州科学技術院(GIST)の機関のガイドラインに従って行われた、すべての手順は、GISTで施設内動物管理使用委員会によって承認されました。
1.事前lesioning手順
- AAV-GFPを使用した内部カプセル内前肢地域の同定
- ハウスとSDラット(〜400グラム、11から13週間)を処理制度や国のガイドラインに準拠したこと。
- 適切な滅菌(蒸気またはプラズマ滅菌器)を使用して、すべての手術器具および電極を滅菌します。殺菌、乾燥のために30分間、30分の設定として121℃の蒸気滅菌器を使用してください。
- 筋肉内注射を介してケタミン塩酸塩の混合物(100mg / kg)およびキシラジン(7ミリグラム/キログラム)で動物を麻酔。足のピンチによって麻酔の深さを確認してください。下の加熱パッドを経由して37.5±0.5℃の体温を維持動物の体。
- 耳のバーと口ホルダーを使用して、定位フレームに動物を置きます。
- クリーンと70%アルコールとポビドンヨード溶液で手術部位を消毒します。手術中の痛みを軽減することを意図し頭蓋切開領域には、頭皮の下に2%塩酸リドカインを浸潤します。
- 目の乾燥を防ぐために獣医眼軟膏を適用します。手術部位への動物の上に滅菌ドレープを配置します。無菌状態ですべての手続きを維持しています。
- メスを用いて2センチメートルの正中線頭蓋骨切開を行い、ワイヤリトラクターとの二国間の皮膚を撤回。綿棒及び30%過酸化水素で頭蓋骨を乾燥させます。
- (2.5±正中線から:ML、ブレグマから2.5 AP)およびウイルス注入のためのマイクロcurretteで道をクリアする運動皮質の前肢領域の上にハンドピースのドリルを用いて穴を開けます。
- の氷と負荷1μlの上AAV-GFP(2×10 12ウイルス分子/ ml)を解凍10μlのシリンジ内のウイルス。定位フレームに注射器を置きます。
- 既製の穴に針を移動し、硬膜深く針1ミリメートルを下げます。
- 高精度マイクロポンプを使用して(0.1マイクロリットル/分)、ゆっくりとウイルスを注入し、ウイルスが外に拡散することを可能にするために、追加の10分間の場所に針を残します。
- 生理食塩水による洗浄で手術部位を洗浄した後、3-0ナイロン縫合糸で傷口を確保。定位フレームからラットを解放し、回復室に転送します。術後疼痛管理のための筋肉内注射を介してケトプロフェン(2ミリグラム/キログラム)を管理します。
- 加熱パッド付き体温(37℃)を維持し、必要に応じて皮下注射を介して筋肉内注射し、2%塩酸リドカインを経由して(0.1%、1ミリリットル)第二世代セフェムクラスの抗生物質を投与します。それは維持するのに十分な意識を取り戻したまで無人の動物を放置しないでください胸骨横臥位。完全復旧までのシングル家動物。
- 3週間の回復、深くフード内の筋肉内注射を介してケタミン塩酸塩(300 mgの/ kg)を過剰投与によりラットを麻酔 - 2を以下に示します。つま先ピンチ応答、パルス、および呼吸の欠如によって動物の死を確認してください。フードにラット仰向けに置きます。
- 胸腔を開くには 'Y'字型の切開により腹腔を開きます。しっかりと止血剤と下行大動脈をクランプし、血液の排水のためのラットの心臓の右心房を破裂。 30分(10ml /分)のために4%パラホルムアルデヒドに続く5分(10ml /分)、冷1%パラホルムアルデヒドで心臓の左心室に灌流を開始します。
- ハサミを使用して、カーカスから、ラットの頭を削除します。鼻に首から正中切開を行い、頭蓋骨が露出するようにはさみや骨鉗子を使用して、首の筋肉を取り除きます。静かに脳から頭蓋骨とデュラスを解剖します。
- 脳を抽出し、一晩、4%パラホルムアルデヒドを充填した50ミリリットルコニカルチューブにラットの脳を置きます。次の日は、1×PBSで3回脳を洗浄し、30%ショ糖溶液に入れてください。
- 脳が完全に30%スクロース溶液の底に沈む後、cryotomeで-20℃で10月化合物とcryomoldで脳を置きます。 40ミクロンの厚さと200μmの間隔で前頭面で脳をスライス。
- スライド法14を用いて、GFPの免疫組織化学染色を行います。 4℃で一晩脳切片に:一次抗体(抗緑色蛍光タンパク質、ウサギIgG画分の200 1)を適用します。 2 番目に日のTween-20(PBST)溶液を、1%リン酸緩衝生理食塩水で3回洗浄し、二次抗体を適用する:1時間(1ヤギ抗ウサギIgG(H + L)の500)。 1%のPBSTで3回スライドを洗浄します。脳切片上のカバーガラスを置きます。
- 蛍光顕微鏡(励起波長を使用して470nmで、発光波長525nmで、倍率5倍)、内部のカプセル内のAAV-GFP形質導入された軸索を観察します。形質導入された軸索の定位座標を決定するために、ラット脳アトラス15で形質導入された軸索の位置を比較
- 莢膜梗塞モデル化するための適切な光強度の調整を事前にlesioning
- 光ニューラルインタフェースの構築
- 切削ドリルを使用して、内部スタイレットと27ゲージの脊椎針の適切な長さ(4センチ)カット。
注:カッティング脊椎針の先端を圧縮して潰してもよいです。スタイレットを除去し、脊髄針の破砕部分を除去し、脊髄針の内側の口径を維持するために、脊髄針の先端を磨きます。 - 片側パッチコードの光ファイバ(62.5μmのコアと125ミクロン)のジャケットの適切な長さ(10センチメートル)を取り除きます。
- unjacked光学Fiのを挿入しますberの金属管(外径17ミリメートル:3.8ミリメートル、内径:3.3ミリメートル、長さ)に、次に繊維の周りにクランプされ、。金属管は、光ファイバや脊髄針のハブとの間の空間を充填すると便利です。二回押さえて金属管の1/2下を固定します。
- 光ファイバ上に熱硬化性エポキシ樹脂を適用し、脊髄針に光ファイバを挿入します。ハブ内の空きスペースに追加のエポキシ樹脂を適用します。安定した固定のために100℃で20分間、エポキシ樹脂を硬化させます。
- 脊髄針の外に突出する光ファイバを切断し、ダイヤモンドラッピング(研磨)のシートを使用して、脊髄針の先端に光ファイバを磨きます。
- 緑色レーザシステムのカプラにパッチコードのFC / PCコネクタ部品を接続して、デジタル光パワーとエネルギーメーターを用いた光ファイバの先端から光強度を測定します。
- 切削ドリルを使用して、内部スタイレットと27ゲージの脊椎針の適切な長さ(4センチ)カット。
- 光ニューラルインタフェースの構築
2. Photothrom内部のカプセル内botic梗塞Lesioning
- 適切な滅菌(蒸気またはプラズマ滅菌器)を使用して、すべての手術器具および電極を滅菌します。殺菌、乾燥のために30分間、30分の設定として121℃の蒸気滅菌器を使用してください。
- 動物を麻酔(〜400グラム、11から13週間)の筋肉内注射を介して塩酸ケタミン(100mg / kg)およびキシラジン(7ミリグラム/キログラム)の混合物。足のピンチによって麻酔の深さを確認してください。動物の体の下に加熱パッドを経由して37.5±0.5℃の体温を維持。
- 耳のバーと口ホルダーを使用して、定位フレームに動物を置きます。
- クリーンと70%アルコールとポビドンヨード溶液で手術部位を消毒します。手術中の痛みを軽減することを意図し頭蓋切開領域には、頭皮の下に2%塩酸リドカインを浸潤します。目の乾燥を防ぐために獣医眼軟膏を適用します。
- ANの上に滅菌ドレープを適用します。imalとは、手術部位を露出させます。無菌状態ですべての手続きを維持しています。
- 2センチメートルの正中線頭蓋骨切開を行い、ワイヤリトラクターとの二国間の皮膚を撤回。綿のスワップおよび過酸化水素で頭蓋骨を乾燥させます。
- ブレグマとラムダが同じレベルで整列されるまで、ノーズクランプの高さを調整します。重要なステップ:この位置合わせが正しく、主実験で内部カプセルに梗塞病変を行うのように、より深い構造にアプローチすることが重要です。
- 光血栓を誘発するためにドリルを使って穴(3.0±正中線から:;:; MLブレグマから-2.04 AP直径2mm)を作成します。
- ポーランドと光インターフェイスの光ファイバ先端を清掃してください。曲げず定位フレームにONIを修正しました。 ONIの先端をチェックして、光インタフェースの挿入前と後に明らかにそれを一掃。
- opticaの挿入に先立って、光ファイバの先端からのレーザ強度を測定ラット脳の標的部位へのLインタフェース。光ファイバの先端に、手術前の手順によって確認されるように、3.5 mWのにレーザー強度を調整します。
- 内部カプセルの標的領域にドリルスルーホール(手術前の段階から確認-7.8 mm)をONIを挿入します。
- 光血栓中に37.5±0.5℃の体温を維持します。下半身の温度が梗塞の予想範囲を生成しないかもしれません。尾静脈からローズベンガル(2ミリリットル/キログラム)を注入します。
- ローズベンガル注射後90秒1分間の532nmのグリーンレーザをオンにします。照射後、静かに脳からONIを削除します。手術部位を洗浄した後、傷は3-0ナイロン縫合糸で傷口を確保確保。定位フレームからラットを解放し、回復室に転送します。
- 偽手術群(SOG)の場合は、代わりにローズベンガルの生理食塩水の注入(0.2ミリリットル/ 100グラム)を除いて、同一の病変作りの手順を実行します。
- 手術後の加熱パッドで、体温(37℃)を維持し、筋肉内注射を介して抗生物質(第2世代セファロスポリン、0.1%、1ミリリットル)を管理。それは胸骨横臥位を維持するのに十分な意識を取り戻したまで無人の動物を放置しないでください。完全に回復するまで、他の動物によって占有ケージに手術後の動物を返さないでください。
注:予備実験5ミリワット、1ミリワットから最適な光強度を見つけるために、同じ手順で行い、手順は異なる状態で病変の十分な範囲を取得するために必要とされ得ます。
莢膜梗塞Lesioning 3.評価
- 行動試験と動物のグループ化
- ウィショーらによって記載されているように、単一のペレット到達タスクを実行します。14ストロークモデル化した後、1週間毎日前肢の運動障害を評価します。単一のペレットに達するのタスクを実行します1cm幅のスリットと前壁の真ん中の前に食品の棚に明確なプレキシグラス(30×15×35センチメートルの高さ)を使用した食品制限動物では(SPRT)(対照体重の90%)。
- 好適な前肢の斜め反対側の食品棚にペレットを配置します。 3週間のセッションあたり20ペレットを管理します。
注:SPRTsの成功数は、動物が食物ペレットを把握し、それを落とすことなく、口の中にそれを置くているリーチとして定義されています。 - 以下の式で定義される成功達するの百分率としてスコアを計算します。
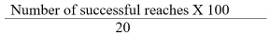
注:偽手術群(SOG)、緩やかに回復グループ(MRG)、および不十分な回収・グループ(PRG):私たちは3つのグループに動物を分けます。もし脳卒中後SPRTスコア> 50%、我々は、実質的な病変の存在を示すMRG、としてラットを分類するが、TAのない完全な破壊目標確認。脳卒中後SPRTスコアが<50%プレストロークSPRTスコアと比較している場合、我々は目標に完全lesioningを示しPRG、としてグループを分類します。
- 梗塞LesioningのNeurohistological確認
- 前述のように4%パラホルムアルデヒドで心臓灌流を行います。脳が完全に30%ショ糖溶液に沈む後、10μmの厚さとミクロトームまたはcryotome 4を用いて、200μmの間隔で冠状切片を行います。
- H&E、ニッスル、ルクソールファーストブルーPAS、ニューロフィラメントタンパク質、Lまたはグリア線維酸性タンパク質染色および組織学的所見を観察で染色は、染色を観察する対象領域内部のカプセルの全体幅をカバーすることができ、最適な光強度を決定します4,17。
- ImageJソフトウェアを使用して、脳のスライド上の内部カプセルの光血栓梗塞領域の体積を測定。
- 梗塞領域の体積を測定するには、「ImageJの「ソフトウェアを起動します。 ( 'イメージ」→「スタック」→「イメージスタックに')を積層するファイルを開く」スタックへのイメージ」を選択します。編集ファイル名を選択し、スケールを編集する(→「スケールを設定します ''分析 ')'スケールを設定します」。
- 「プラグイン」で、選択した画像の容量や面積を計算するために「スタックを測定します」。 「スライス間隔」に2つの画像の距離間隔を挿入します。すべての画像のROI(関心領域)の描画を行い、「測定」をクリックします。
注:ソフトウェア「ImageJの」は、自動的に各画像およびそれらの全体積の面積や体積を計算します。
結果
ここに提示された方法は、永続的な運動障害で外接莢梗塞を作成することを意図しています。従って、正確に手術前の段階において内蔵カプセル内の標的を決定することが重要です。内部のカプセル内の錐体繊維の体部位マッピングは、現在までに決済されていません。正しく内部のカプセル内の標的を同定するために、前肢領域が描写されなければなりません。運動皮質の前肢領域にAAV-GFP注射を内包(図1)においてピラミッド繊維の軸索を追跡することができる。例えば、ビオチン化デキストランアミン(BDA)のような他の神経トレーサーを、同様に使用することができます目的。内部のカプセル内の標的の定位座標を内包する運動皮質の前肢領域に由来の軸索突起を追跡することによって明らかにすることができます。

2週間AAV-GFPの注射後の内部カプセルに前肢エリアの 図1 の識別。運動皮質の前肢のエリアから発信GFPで形質導入した軸索の繊維は視床(矢印)の腹外側核に示されており、内部カプセル(矢じり)の尾の部分。点線は、内部カプセルの輪郭を示し、数字はブレグマからの距離を参照してください。カバ、海馬; CPU、尾状核被殻; VL、腹外側核; ICは、内部のカプセル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
最適な光強度は、動物の系統、体重および種類との直径に応じて異なっていてもよいです光ファイバ。したがって、最適な光強度がメイン梗塞lesioning実験の前に別々に決定されるべきです。損傷の程度は、隣接する灰白質の構造(図2)を破壊することなく内部のカプセルの全体幅をカバーするまで、光血栓の手順を用いて、光強度を徐々に増大させることができる。最適な光強度は、組織学的程度を比較することによって確認することができます梗塞病変と場所の。
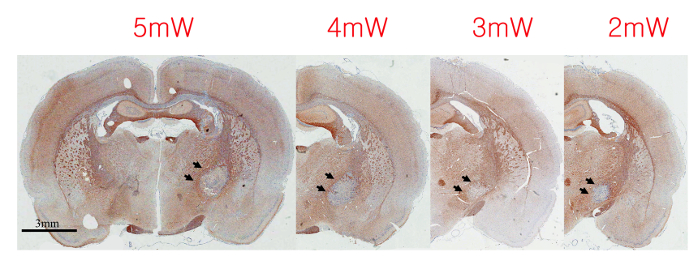
光血栓Lesioning後5 mWの2週間に2ミリワットからレーザー光の強度を変化させるアクロス梗塞病変の 図2 程度。最適な光強度は、この実験設定で3mWとし、4ミリワットの間にあると考えられています。矢印は、梗塞病変を示しています。/53281/53281fig2large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
我々は、光ファイバは、薄い金属管(脊髄針)に含まれているONIを使用することを好みます。光ファイバは、光ファイバ路に沿って付加的な神経損傷が発生する可能性がある繊維の側から最小の光散乱を生成することができます。光ファイバの収納がより深い目標光ファイバの曲げを防止するために、ならびに定位フレーム(図3)にONIを取り付けることも有利で す。

オプティカル・神経インタフェースの 図3. 建設(ONI)。脊髄針の(a)の切断。光ファイバのストリップ(B)。 (C&D)固定金属管が上に挿入されています脊髄針のハブに光ファイバを固定する光ファイバと窮屈を剥奪。 (E)エポキシ添加光ファイバは、脊椎針に挿入されます。 (F)エポキシ20分間100℃で硬化させます。 (G)光ファイバは、脊髄針の先端に切断されます。 (h)は、光ファイバを研磨します。 (ⅰ)光強度は、光ファイバの先端から測定される。 この図の拡大版をご覧になるにはこちらをクリックしてください。
光血栓の手順では、運動障害で〜70%の成功で再現性の病変と場所を生成します。典型的な莢膜梗塞病変が莢繊維(図4A)の腹背両面の寸法を包含している。また、梗塞病変が原因莢繊維内部に増加し、光散乱の内部カプセルの前後軸に沿って延びています(図4B)内部カプセルの下に位置する光路は、白質の繊維で構成されています。;従って、それは、多くの場合、増加した光強度の照射によって損傷を受けます。連続切片と染色は梗塞のボリューム全体と程度を確認するために必要とされます。梗塞容積は0.63±0.37ミリメートル3でした 。莢繊維の破壊を評価するために、神経フィラメントおよびルクソールファーストブルーPAS汚れが役に立ちます。

3週間光血栓後の莢梗塞の 図4. 微視的外観。3週間光血栓後の莢梗塞の微視的な外観。ラット脳における冠状断面のA)脳スライス。アローヘッドは、視床に、内部カプセルまでの光ファイバを含む針の道を示しています。冠状脳スライスのB)シリアルニッスル染色showi内部のカプセル内の梗塞病変の全体の範囲をngの。矢頭は、梗塞病変を示す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
モデルの成功は、タスクに到達する単一のペレットを用いて行動試験によって評価することができます。梗塞lesioning次の1週間後の行動のパフォーマンスは毎日単一ペレット到達トレーニング(図5)にもかかわらず、SPRTの持続的かつ顕著な障害を伴う正確なlesioningを、確認するために良いガイドです。モーター赤字はPRGに示されると、神経障害は、観測の3ヶ月の期間中持続しました。偽手術群は、操作後SPRT性能の有意な減少を示しませんでした。
/ "/ 53281 / 53281fig5.jpgをアップロード>
莢膜Infart 4,20 の後にスコアに達するシングルペレット5.変更図 。実験グループ(PRGとMRG)が大幅に出品偽手術群(SOG)と比較して、梗塞lesioning直後のスコアを減少させました。 PRGは、時間をかけて持続的な運動障害を示すのに対し、MRGは、SPRT性能の緩やかな回復を示します。オペアンプ、光血栓梗塞lesioning。 PRG、貧弱な回復基; MRG、緩やかな回復グループ。統計的有意性は、分散の反復測定分析を用いて決定しました。 MRG対+ SOG。 * PRG対SOG。データは、平均±SEMである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ここで提示莢梗塞モデルは、前肢の機能の著しいと持続的な運動障害を持つ対象となる病変を示しています。皮質下の莢ストロークの前のモデルは、運動障害と迅速なリカバリ処理の6,8,9の不十分な度合いを示しました。この意味で、このモデルは、長期的な機能障害を呈する臨床莢梗塞例に似ています。
外接莢梗塞モデルの開発において最も重要なステップは次のとおりです:1)が正しく内部カプセル内に機能を無効にすることを目的と身体部分の体部位表現を識別するために、 2)近隣の灰白質構造の最小限の侵略と内部カプセルの幅全体を破壊することができ、緑色レーザーの最適な強度を識別するために、 3)正確にターゲット構造の光ファイバを配置します。提示された技術は、外接を誘導することができるが、高複製率(> 70%)とD莢梗塞モデルは、内部カプセルの幅全体をカバーする破壊の完全性のターゲティングおよび程度の小さな差は、異なる運動障害を説明することができます。
皮質脊髄路は、体部位、組織15の論争にもかかわらず、ヒトにおける内部のカプセルで後肢の前半に位 置しています。これとは対照的に、同等の分類またはげっ歯類の内部カプセルの体部位局在性の詳細な解明がなされていません。体部位局在性に関する知識の欠如は、多くの場合、莢梗塞モデル間で異なる運動の成果と内部カプセル内に梗塞lesioningの間違ったターゲットにつながります。しかし、我々は可能性が高い前肢の運動線維のパスを表す内部カプセルの尾部にGFP形質導入軸索を、同定しました。また、このエリアdemonstratのlesioning前肢到達技能のマークされ、永続的な赤字を編。したがって、我々は莢梗塞モデルの妥当性を向上させるために定位lesioningための内部カプセルの尾の部分をお勧めします。
ONIの動物系統、体重、光源と種類が梗塞の異なるサイズを生成することができるので、光強度の事前調整はストロークモデルにおける梗塞病変の均一な広がりを生成するために必須です。満足梗塞病変は最小限の光強度で達成されるまでそのため、同じ株および体重で実験動物に異なる光強度を用いた予備実験が行われるべきです。
隣接構造への最小の損傷に前肢の領域に対応する莢繊維(前後および背腹程度)の全体幅を破壊することができる強い光強度は、最適な光強度であると考えられます。 forelim内部カプセルのb領域は上方視床と下方視索によって制限されます。したがって、ONIの挿入の深さは、上位および下位の隣接構造の同時保存して、背腹方向にICの全範囲を破壊するために正確である必要があります。 ONIの不正確な配置は、内部のカプセル内の残りの錐体繊維のシナプス可塑性の結果として、運動障害の迅速な回復につながるICの不完全な破壊をもたらします。シリアル組織学的検査では、永続的な運動障害の誘導において最も交絡因子はPLIC 4,16の幅全体を破壊する故障につながるONIの不正確な位置決めでした。そのため、細心の注意が正しいターゲットに到達するために支払われるべきです。最近、Blasiのらは、持続的な純粋な運動障害は、後方内部カプセルに梗塞病変を作ることによって製造することができることを報告しエンドセリン-1(ET-1)17を使用して。しかし、ET-1は、ET-1の拡散により隣接する灰白質の構造を破壊することがあります。
行動試験は、内部のカプセルに梗塞病変の形成を評価するための研究室ですぐに利用できるベンチマークです。しかし、1週間梗塞lesioning後のモータ性能の評価は中程度と貧しい回復グループに動物を分割することをお勧めします。貧しい回復は<50%の回収率と定義したのに対し、緩やかな回復は、前lesioningのスコアと比較して> 50%のパフォーマンススコアの増加と定義しました。前肢モータ行動試験の中で、タスクに到達する単一のペレットは、脳卒中により誘導されるモータ公演14の定量的および定性的測定の両方のための最も敏感な試験の一つです。同時に、このような食品を把握し、検索など、前肢の使用の分析を提供しながら作業を定量的に到達し、成功を測定しますペレット。到達運動の定性分析は、本物の機能回復や補償20を区別することによって、脳卒中の回復の品質を区別するためにも有用です。ここでは、簡単にSPRTの定量的測定を説明しました。しかし、フレーム毎の分析に基づいて撮影およびスコアリングを使用して定性分析を、さらに詳細な分析のために推奨されます。
ここで紹介する技術は、外接莢梗塞モデルの誘導に限定する必要はありません。技術は、脳梁、前交連と神経構造間の接続繊維などの白質の他の領域での梗塞病変の誘発にも適用することができます。白質の光学特性に基づいて、小さなONIと光血栓技術の組み合わせは、隣接構造物への最小限のダメージで標的構造を破壊する可能性があります。例えば、ラクナ梗塞を簡単に生成することができますモーター、認知、およびメモリ機能に関連する皮質下構造を標的とすることによって、D。ターゲット構造が大きい場合、ONI異なる標的と傾斜軌道の複数の挿入は、病変の所望の程度を生成するために必要とされ得ます。
この手法にはいくつかの制限があります。技術はPLICとその後の回復に梗塞lesioningの結果を証明するのに十分です。白質の光血栓破壊が少し人間WMS異なるためしかし、このモデルは、人間のWMSの完全なスペクトルを反映するものではありません。したがって、神経生物学的またはMRI画像所見は光血栓lesioningの初期段階で異なる特徴を示すことができます。したがって、このモデルは適切にモデルの利点と欠点をトレードオフするために使用されるべきです。それは非常に正確な手順を必要とするため、技術的には、すべての手術は、このモデルでマークされ、永続的な運動障害を生成することができません。 Specifically、訓練を受けた経験豊富な手が、このモデルの生成に高い再現性を生成するために必要とされます。
結論として、光血栓技術、光強度を最適化し、正しい標的の併用は、外接莢膜梗塞モデルを生成するために有用な技術です。このモデルは、行動、回路、および細胞レベルでのWMSを勉強するだけでなく、新たな治療とリハビリテーション介入の有用性を評価するためにだけではなく、参考になります。
開示事項
The authors have nothing to disclose.
謝辞
この作品は、医療システム工学研究所(iMSE)&GISTからGIST-カリフォルニア工科大学共同基金(K04592)からの助成金によっておよび未来創造科学部が資金を提供し、韓国のNRFを通して基礎科学研究開発プログラムによってサポートされていました(NRF-2013R1A2A2A01067890)。
資料
| Name | Company | Catalog Number | Comments |
| DC Temperature controller | WORLD PRECISION INSTRUMENTS, INC. | ATC1000 | |
| Digital Stereotaxic Instruments | STOELTING CO. | 51900 | |
| Electrical Stimulator | CyberMedic Corp. | EMGFES 2000 | |
| Epoxy | Precision Fiber Products, INC. | PFP-353ND1 | Mix Ratio: 10(A):1(B-hardener) by weight Curing Schedule: 1 min @150 °C 2 ~ 5 min @120 °C 5 ~ 10 min @100 °C 15 ~ 30 min @80 °C |
| Fiber Optic Scribe | THORLABS, INC | S90R | |
| Fiber patch cable | KOREA OPTRON Corp. | Outer diameter: 3 mm Ø200 µm 0.39 NA FC/PC-FC/PC 1 m | |
| Laser Power Supply | CHANGCHUN NEW INDUSTRIES OPTOELECTRONICS TECH. CO., LTD. | MGL-FN-532nm-200mW-14010196 | |
| Crimp ring | DAWOOTECH CO.,LTD. | Length: 19 mm Inner diameter: 3 mm Outer diameter: 3.8 mm Material: SUS | |
| Micro4-micro syringe pump controller | WORLD PRECISION INSTRUMENTS, INC | 95100 | |
| Optical Power Meter | THOLABS, INC | PM100D | |
| Diamond lapping (polishing) sheet | THORLABS, INC | LF3D | Grit : 3 µm |
| Diamond lapping (polishing) sheet | THORLABS, INC | LF6D | Grit : 6 µm |
| Rose Bengal | SIGMA-ALDRICH CO. LLC. | 330000 | |
| Needle for spinal anesthesia with pencil point tip (Spinal needle) | B.BRAUN MELSUNGEN AG | 4502027 | Size: 27 G Length: 88 mm Needle: 0.40 mm |
| Waterproof sandpaper | DEERFOS CO.,LTD | CC261 | Grit : 1,000 µm |
| Nanofil 10 µl syringe | WORLD PRECISION INSTRUMENTS, INC | NANOFIL | |
| Nanofil 33 G BVLD needle | WORLD PRECISION INSTRUMENTS, INC | NF33BV-2 | |
| AAV-GFP virus | UNC Vector Core | AAV2-CamKIIa-eYFP | 2 x 1012 virus molecules/ml |
| Anti-Green Fluorescent Protein, Rabbit IgG fraction | Life Technologies, INC | A11122 | primary antibody (1:200) |
| Goat Anti-Rabbit IgG (H + L) | Life Technologies, INC | A11034 | secondary antibody (1:500) |
| Ceftezole | GUJU Pharma CO.,LTD. | A27802741 | 0.1%, 1 ml |
| Lidocain hydrochloride injection | JEIL PHARMACEUTICAL CO.,LTD. | A04900271 | 2%, 1 ml |
| Hand Piece Drill | Seshin | ||
| Digital optical power and energy meter | THORLABS, INC | PM100D | |
| Ketoprofen | UNIBIOTech |
参考文献
- Roger, V. L., et al. Heart disease and stroke statistics--2012 update: a report from the American Heart Association. Circulation. 125, 2-220 (2012).
- Debette, S., Markus, H. S. The clinical importance of white matter hyperintensities on brain magnetic resonance imaging: systematic review and meta-analysis. Bmj. 341, 3666(2010).
- Zhang, K., Sejnowski, T. A universal scaling law between gray matter and white matter of cerebral cortex. PNAS. 97 (10), 5621-5626 (2000).
- Kim, H. S., et al. A rat model of photothrombotic capsular infarct with a marked motor deficit: a behavioral, histologic, and microPET study. J Cereb Blood Flow Metab. 34 (4), 683-689 (2014).
- Kleim, J. A., Boychuk, J. A., Adkins, D. L. Rat models of upper extremity impairment in stroke. ILAR J. 48 (4), 374-384 (2007).
- Frost, S. B., Barbay, S., Mumert, M. L., Stowe, A. M., Nudo, R. J. An animal model of capsular infarct: endothelin-1 injections in the rat. Behav Brain Res. 169 (2), 206-211 (2006).
- He, Z., et al. Definition of the anterior choroidal artery territory in rats using intraluminal occluding technique. J Neurol Sci. 182 (1), 16-28 (2000).
- Tanaka, Y., et al. Experimental model of lacunar infarction in the gyrencephalic brain of the miniature pig: neurological assessment and histological, immunohistochemical, and physiological evaluation of dynamic corticospinal tract deformation. Stroke. 39 (1), 205-212 (2008).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Watson, B. D., Dietrich, W. D., Busto, R., Wachtel, M. S., Ginsberg, M. D. Induction of reproducible brain infarction by photochemically initiated thrombosis. Ann Neurol. 17 (5), 497-504 (1985).
- Kuroiwa, T., et al. Development of a rat model of photothrombotic ischemia and infarction within the caudoputamen. Stroke. 40 (1), 248-253 (2009).
- Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Handbook of biomedical optics. 83, CRC Press. Boca Raton, Fl. (2011).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Whishaw, I. Q., Whishaw, P., Gorny, B. The structure of skilled forelimb reaching in the rat: a movement rating scale. J Vis Exp. (18), e816(2008).
- Jang, S. H. A review of corticospinal tract location at corona radiata and posterior limb of the internal capsule in human brain. NeuroRehabilitation. 24 (3), 279-283 (2009).
- Kim, D., et al. Longitudinal changes in resting-state brain activity in a capsular infarct model. J Cereb Blood Flow Metab. 35 (1), 11-119 (2014).
- Blasi, F., Whalen, M. J., Ayata, C. Lasting pure-motor deficits after focal posterior internal capsule white-matter infarcts in rats. J Cereb Blood Flow Metab. 35 (6), 977-984 (2015).
- Metz, G. A., Antonow-Schlorke, I., Witte, O. W. Motor improvements after focal cortical ischemia in adult rats are mediated by compensatory mechanisms. Behavioural brain research. 162 (1), 71-82 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved