Method Article
דוגמנות מוגבלת Capsular אוטם בעזרת טכניקת Photothrombotic
In This Article
Summary
כתב יד זה מתאר טכניקת דוגמנות של אוטם קופסית. כאן השתמשנו בטכניקת photothrombotic שונה עם בעצימות נמוכות של אור לאחר מיפוי היעד מראש ניתוח. באמצעות טכניקה זו, יצרנו מודל אוטם קופסית מתוחם עם לקויות מוטוריות מתמיד.
Abstract
Recent increase in the prevalence rate of white matter stroke demands specific research in the field. However, the lack of a pertinent animal model for white matter stroke has hampered research investigations. Here, we describe a novel method for creating a circumscribed capsular infarct that minimizes damage to neighboring gray matter structures. We used pre-surgery neural tracing with adeno-associated virus-green fluorescent protein (AAV-GFP) to identify somatotopic organization of the forelimb area within the internal capsule. The adjustment of light intensity based on different optical properties of gray and white matter contributes to selective destruction of white matter with relative preservation of gray matter. Accurate positioning of optical-neural interface enables destruction of entire forelimb area in the internal capsule, which leads to a marked and persistent motor deficit. Thus, this technique produces highly replicable capsular infarct lesions with a persistent motor deficit. The model will be helpful not only to study white matter stroke (WMS) at the behavioral, circuit, and cellular levels, but also to assess its usefulness for development of new therapeutic and rehabilitative interventions.
Introduction
עד לא מזמן, "מודלים שבץ החומר האפור (GMS)" שימשו אך ורק כדי להבין את פתופיזיולוגיה של שבץ כדי להנחות את הפיתוח של טיפולים חדשים. עם זאת, חלה שכיחות גוברת של שבץ משפיעת חומר לבן קורטיקליים אצל אנשי קשישים, המהווים כ -15 - 25% מכל מקרי השבץ 1,2. מחקרים רבים נערכו שבץ לגבי שימוש במודלי GMS, ואילו ישנם כמה מחקרים שהשתמשו שבץ חומר לבן מודלים (WMS). חומר לבן במכרסמים פחות משמעותי בחומר הלבן בבני אדם או יונקים. כתוצאה מכך, זה יותר קשה לגשת באופן סלקטיבי ולהרוס אזורי היעד בחומר הלבן 3. בנוסף, אין כלים יעילים פותחו עד כה להרוס את ההיקף המתוכנן סלקטיבי של חומר לבן ממוקד. לכן, חל חוסר המודלים המתאימים ללימוד של משייכות חומר לבנות.
בעלי החיים stמודלי רוק משמשים לעתים קרובות כדי לעקוב אחר ההתקדמות של התאוששות מנוע לפיתוח שיקומי חדשים ושיטות טיפוליות. הוא אידיאלי כדי לנצל במודל חיה שמספק חסר נוירולוגים לטווח ארוך שתואמו את השינויים אנטומיים הפגינו שבץ אדם 4,5. בהקשר זה, התאוששות מהירה של הגירעון המנוע ומעורבות רחבה של lesioning האוטם הבא המוח לא יכולה להיות מציאותית במרדף של מחקר שבץ. מודלים אוטמי קופסית קודמים נעשו על ידי החסימה של עורק התרדמה הפנימית או עורקי כורואידלית קדמיים ואת דיפוזיה של 1 אנדותלין (ET-1) לתוך הקפסולה הפנימית 6-9. עם זאת, חסימה בעורק דורשת דיסקציה זהירה של עורקים, אבל זה מייצר שטח נרחב של נגע אוטם, כולל הקפסולה הפנימית, ללא גירעונות התנהגותי מתמשכים. יתר על כן, ET-1 לא היה מתפזר להרוס את האיבר האחורי לחלוטין של הקפסולה הפנימית, ולכן פחות מסומן או מתמידים ביהגירעון avioral.
מודל אוטם photothrombotic כבר בשימוש נרחב כדי ליצור סוגים שונים של נגעים אוטמים בקליפה ומבנים קורטיקליים 10. הטכניקה לכלול עירוי לוריד ואחריו תאורת מוקד, אשר מובילה הצטברות של טסיות דם בתוך כלי הדם הקטנים דור הנגעים אוטמים 10. טכניקת Photothrombotic כבר נעשתה שימוש נרחב כדי ליצור נגעי GMS, ואילו מעט המשמשת לייצור נגעי WMS 5,11. עבור טכניקה זו, שילוב של קרינה לצבוע ואור רוז בנגל הודגם להיות שימושי להרס מבנה היעד, גרימת מקביל גירעונות תפקודיים. הרכיב המרכזי של טכניקת photothrombotic הוא הקרנת אור, משום שהיא קובעת את גודל נגעים אוטמים. תוצאות הקרנת אור אפקטים שונים על חומר אפור ואת חומר לבן, בגלל פיזור האור הוא יותר מ -4 פעמים גבוהות ב ma הלבןtter לעומת חומר אפור 12; בהתאם לכך, אם עוצמת האור יש irradiance נמוכה מספיק (<1,140 mW / מ"מ 2), אפשר להגביל את הרחבה אשר הנגע photothrombotic להשפיע על המידה בחומר הלבן (כלומר., כמוסה פנימית). לדוגמא, לאור האנרגיה גבוהה יכול לגרום אוטמים בשני חומר אפור-לבן, עדיין אור האנרגיה נמוך יותר עשוי לגרום photothrombosis רק בחומר לבן. יתר על כן, חדירת אנרגית אור הייתה מוגבלת מאוד. כ -99% של אנרגית אור אבדו מעבר 1 מ"מ מהמקור של 13 אור. לכן, צפוי כי ממוקד ומדויק, אור אנרגיה נמוכה יותר גורם photothrombosis רק בחומר הלבן עם הסגת גבול מינימלי של החומר האפור השכנה.
כאן אנו מתארים שיטה חדשנית ליצירת נגעים האוטם באזור forelimb של הקפסולה הפנימית במכרסמים. אנו מתארים את שיטת זיהוי של אזור forelimb ב ca הפנימיpsule, הטכנולוגיה של הקרנת אור, כולל ההתאמה והאספקה של אור, ואת הדור של נגע אוטם. כמו כן, אנו מתארים בדיקות התנהגותיות להשתמש כדי להעריך את השלמות של המודלים קופסית.
Protocol
כל הנהלים בוצעו על פי ההנחיות המוסדיות של Gwangju מכון למדע והטכנולוגיה (GIST), וכל ההליכים אושרו על ידי הטיפול בבעלי החיים המוסדי הוועדה השתמשתי ב GIST.
1. שלבים טרום lesioning
- זיהוי של פינת Forelimb הקפסולה הפנימית באמצעות-GFP AAV
- בית ולטפל חולדות ספראג Dawley (~ 400 גרם, 11 - 13 שבועות) בהתאם להנחיות מוסדיות ולאומיות.
- לעקר את כל הכלים כירורגיים אלקטרודות באמצעות מעקר מתאים (קיטור או מעקר פלזמה). השתמש מעקר קיטור ב 121 מעלות צלזיוס כפי הגדרה של 30 דקות עבור עיקור ו -30 דקות עבור יבש.
- להרדים את החיה עם תערובת של קטמין הידרוכלוריד (100 מ"ג / ק"ג) ו xylazine (7 מ"ג / ק"ג) באמצעות זריקה תוך שרירית. בדוק את עומק ההרדמה על ידי צביטת כפה. שמירה על טמפרטורת הגוף על 37.5 ± 0.5 מעלות צלזיוס באמצעות כרית חימום מתחתהגוף של החיה.
- מניחים את חיה בתוך מסגרת stereotactic באמצעות אוזן בר ובעל פה.
- לנקות ולחטא את האתר כירורגית עם 70% אלכוהול בתמיסת יוד povidone. חדור 2% לידוקאין הידרוכלוריד תחת הקרקפת באזור חתך גולגולת שנועד להפחית את הכאב במהלך הניתוח.
- החל משח וטרינר עיניים כדי למנוע התייבשות של העיניים. מניח וילון סטרילי על החיה לאתרים האופרטיביים. לשמור על כל ההליכים בתנאים סטריליים.
- בצע חתך גולגולת קו אמצע של 2 סנטימטר בעזרת אזמל לחזור בו העור בילטרלי עם כתיבת תיל. לייבש את הגולגולת עם צמר גפן ואת מי חמצן 30%.
- עושים חור באמצעות מקדח פיסת יד מעל האזור forelimb של הקורטקס המוטורי (AP: 2.5 מ גבחת, ML: ± 2.5 מ קו האמצע) ונקה את דרכי עם-currette מיקרו-הזרקה וירוס.
- ההפשרה AAV-GFP (2 x 10 12 מולקולות וירוס / מ"ל) על קרח עומס 1 μl שלוירוס בתוך מזרק 10 μl. יש להכניס את המזרק על מסגרת stereotactic.
- להזיז את המחט אל החור שהוכן מראש ולהפחית את מ"מ מחט 1 עמוק לתוך הדורה.
- להזריק את הווירוס לאט (0.1 μl / min) באמצעות micropump דיוק גבוה ולהשאיר את המחט במקום במשך 10 דקות נוספות כדי לאפשר לנגיף מפוזר החוצה.
- לאחר ניקוי האתר הפעיל עם השקיה מלוחה, לאבטח את הפצע עם תפר ניילון 3-0; לשחרר את העכברוש ממסגרת stereotactic ולהעביר אותו אל חדר התאוששות. נהל ketoprofen (2 מ"ג / ק"ג) באמצעות זריקה תוך שרירית לשליטה בכאב לאחר הניתוח.
- שמירה על טמפרטורת הגוף (37 מעלות צלזיוס) עם כרית חימום ולנהל אנטיביוטיקה דור שני cephems ממדרגה (0.1%, 1 מ"ל) באמצעות זריקה תוך שרירית ו hydrochloride לידוקאין 2% באמצעות זריקה תת עורית לפי הצורך. אל תשאירו חיה ללא השגחה עד שהוא שב להכרתו מספיק כדי לשמורשכיבה sternal. בית יחיד החיה עד להחלמה מלאה.
- בעקבות 2 - התאוששות בשבוע 3, עמוק להרדים את עכברוש עם מנת יתר של קטמין הידרוכלוריד (300 מ"ג / ק"ג) באמצעות זריקה תוך שרירית בשכונה. אשר את מותו של בעלי חיים על ידי חוסר צובט בוהן בתגובה, דופק ונשימה. מניחים את פרקדן עכברוש למכסה המנוע.
- פתח את חלל הבטן דרך חתך 'בצורת Y'כדי לפתוח את בית החזה. בחוזקה מהדק את אבי העורקים יורד עם hemostat ו לקרוע את העלייה הימנית של הלב חולדה לניקוז דם. ליזום זלוף לתוך החדר השמאלי של הלב עם paraformaldehyde 1% קרים למשך 5 דקות (10 mL / min) ואחריו paraformaldehyde 4% למשך 30 דקות (10 mL / min).
- הסר את ראש החולדה מן הפגר באמצעות מספריים. ביצוע חתך קו אמצע מהצוואר אל האף ולהסיר את שרירי הצוואר באמצעות מספריים או rongeur כך גולגולת חשופה. בעדינות לנתח את עצמות הגולגולת דיראס החוצה מהמוח.
- חלץ את המוח ולמקם המוח עכברוש צינור חרוטי 50 מ"ל מלא paraformaldehyde 4% בין לילה. למחרת, לשטוף את המוח עם פעמים 1x PBS 3 ולמקם אותו פתרון 30% סוכרוז.
- לאחר המוח שוקע לחלוטין לתחתית של תמיסת סוכרוז 30%, במקום את המוח cryomold עם המתחם OCT ב -20 מעלות צלזיוס cryotome. פורסים את המוח במישור העטרה בעובי של 40 מיקרון ו מרווח של 200 מיקרומטר.
- בצע מכתים אימונוהיסטוכימיה GFP בשיטת שקופית 14. החל נוגדן ראשוני (1: 200 של חלבון פלואורסצנטי אנטי-ירוק, חלק IgG ארנב) פרוסות המוח לילה ב 4 מעלות צלזיוס. ב -2 nd יום, לשטוף עם 1% בופר פוספט עם Tween-20 (PBST) פתרון 3 פעמים ולהחיל את נוגדנים משני (1: 500 של IgG נגד ארנב עיזים (H + L)) במשך שעה 1. יש לשטוף את השקופית עם 1% PBST 3 פעמים. מניחים את הזכוכית המכסה על פרוסת המוח.
- באמצעות מיקרוסקופ פלואורסצנטי (גל עירור470 ננומטר, פליטת גל 525 ננומטר, הגדלה 5X), לקיים את AAV-GFP אקסונים transduced הקפסולה הפנימית. השווה את מיקומם של אקסונים transduced עם מוח החולדה אטלס 15 כדי לקבוע את הקואורדינטות stereotactic של אקסונים transduced
- מתאימה טרום lesioning התאמת עוצמת האור עבור Capsular אוטם דוגמנות
- בניית הממשק העצבי האופטי
- חותכים באורך המתאים (4 ס"מ) של מחט השדרה 27 מד עם stylet בתוך באמצעות מקדח חיתוך.
הערה: חיתוך עשוי לדחוס ולרסק את קצה מחט השדרה; להסיר את stylet ולהבריק את קצה מחט השדרה כדי להסיר את החלק השחוק של מחט השדרה ולשמור על הקליבר הפנימי של מחט השדרה. - רצועת אורך המתאים (10 ס"מ) של הז'קט של סיבים אופטיים (125 מיקרומטר עם ליבה 62.5 מיקרומטר) של תיקון כבל צד אחד.
- הכנס את fi האופטי unjackedבער לתוך צינור המתכת (קוטר חיצוני: 3.8 מ"מ, קוטר פנימי: 3.3 מ"מ ואורך: 17 מ"מ), אשר לאחר מכן הוא הדק סביב הסיב. צינור המתכת כדאי למלא את החלל בין הסיב האופטי ואת הרכזת של מחט השדרה. הצמד את התחתון 1/2 של צינור מתכת עם פרסר פעמיים.
- החל אפוקסי החום לריפוי על הסיב האופטי וכנס הסיב האופטי לתוך מחט השדרה. החלת אפוקסי נוסף בחלל הריק ב- hub. לרפא אפוקסי במשך 20 דקות ב 100 מעלות צלזיוס במשך קיבוע יציב.
- קליב הסיב האופטי שבולט מתוך מחט השדרה ולהבריק את הסיב האופטי על קצה מחט השדרה באמצעות לחיכה יהלום (ליטוש) סדינים.
- חבר את חלק מחבר FC / PC של תיקון כבל כדי מצמד של מערכת לייזר ירוק ולמדוד את עוצמת האור מהקצה של סיבים אופטיים באמצעות כוח מד האנרגיה דיגיטלי אופטי.
- חותכים באורך המתאים (4 ס"מ) של מחט השדרה 27 מד עם stylet בתוך באמצעות מקדח חיתוך.
- בניית הממשק העצבי האופטי
2. Photothrombotic האוטם Lesioning הקפסולה הפנימית
- לעקר את כל הכלים כירורגיים אלקטרודות באמצעות מעקר מתאים (קיטור או מעקר פלזמה). השתמש מעקר קיטור ב 121 מעלות צלזיוס כפי הגדרה של 30 דקות עבור עיקור ו -30 דקות עבור יבש.
- להרדים את החיה (~ 400 גרם, 11 - 13 שבועות) בתערובת של קטמין הידרוכלוריד (100 מ"ג / ק"ג) ו xylazine (7 מ"ג / ק"ג) באמצעות זריקה תוך שרירית. בדוק את עומק ההרדמה על ידי צביטת כפה. שמירה על טמפרטורת הגוף על 37.5 ± 0.5 מעלות צלזיוס באמצעות כרית חימום מתחת לגוף של החיה.
- מניחים את חיה בתוך מסגרת stereotactic באמצעות אוזן בר ובעל פה.
- לנקות ולחטא את האתר כירורגית עם 70% אלכוהול בתמיסת יוד povidone. חדור 2% לידוקאין הידרוכלוריד תחת הקרקפת באזור חתך גולגולת שנועד להפחית את הכאב במהלך הניתוח. החל משח וטרינר עיניים כדי למנוע התייבשות של העיניים.
- החל וילון סטרילי מעל הרצועהimal ולחשוף באתרים האופרטיביים. לשמור על כל ההליכים בתנאים סטריליים.
- בצע חתך גולגולת קו אמצע של 2 סנטימטר ו לחזור בו העור בילטרלי עם כתיבת תיל. לייבש את הגולגולת עם חילופי כותנה מי חמצן.
- התאם את גובה מלחציים האף עד גבחת ו למבדה מיושרים באותו רמה. שלב קריטי: יישור זה קריטי להתקרב מבנה עמוק כראוי, כגון בביצוע נגע אוטם הקפסולה הפנימית בניסוי הראשי.
- עושים חור (בקוטר 2 מ"מ; AP: -2.04 מן גבחת; ML: ± 3.0 מ קו האמצע) באמצעות מקדח לגרום photothrombosis.
- פולני ולנקות את קצה הסיב האופטי של הממשק האופטי. תקן את ONI למסגרת stereotaxic מבלי לכופף. בדוק את קצה ONI ולנגב את זה בבירור לפני ואחרי הכניסה של הממשק האופטי.
- מדוד את עוצמת הלייזר מקצה הסיב האופטי לפני הכנסת של אופטיקהממשק l לאתר היעד של המוח עכברוש. התאם את עוצמת הלייזר 3.5 mW, כפי שאושרו על ידי צעדים טרום הניתוח, על קצה של סיבים אופטיים.
- הכנס את ONI לאזור היעד של הקפסולה הפנימית (-7.8 מ"מ אשר משלב טרום ניתוח) דרך חור הקידוח.
- שמירה על טמפרטורת הגוף על 37.5 ± 0.5 מעלות צלזיוס במהלך photothrombosis. עליה בטמפרטורת גוף תחתונה עלולה לא להשיג את היקף הניצול הצפוי של אוטם. להזריק רוז בנגל (2 מ"ל / ק"ג) דרך וריד הזנב.
- הפעל 532 הלייזר הירוק ננומטר במשך 90 שניות 1 דקות לאחר ההזרקה בנגל רוז. לאחר ההקרנה, בעדינות להסיר את ONI מהמוח. לאחר ניקוי האתר הפעיל, לאבטח את הפצע לאבטח את הפצע עם תפר ניילון 3-0; לשחרר את העכברוש ממסגרת stereotactic ולהעביר אותו אל חדר התאוששות.
- עבור קבוצת דמה מופעלת (SOG), לבצע הליך קבלת נגע זהה, למעט הזרקה מי מלח (0.2 מיליליטר / 100 גרם) במקום רוז-בנגל.
- שמירה על טמפרטורת הגוף (37 מעלות צלזיוס) עם כרית חימום לאחר הניתוח ולנהל אנטיביוטיקה (צפלוספורין הדור השני, 0.1%, 1 מ"ל) באמצעות זריקה תוך שרירית. אין להשאיר את החיה ללא השגחה עד שהוא שב להכרתו מספיק כדי לשמור שכיבה sternal. אל תחזרו לאחר ניתוח חיות לכלוב שנכבש על ידי בעלי חיים אחרים עד התאושש לחלוטין.
הערה: ניסוי ראשוני בוצע הנהלים הזהים כדי למצוא את עוצמת האור האופטימלית בין 1 mW עד 5 mW ואת ההליך עשוי להידרש לרכוש במידה המספקת של נגע במצב שונה.
הערכת 3. Capsular אוטם Lesioning
- בדיקה התנהגותית קיבוץ בעלי חיים
- בצע אחת גלול להגיע משימות כפי שתואר על ידי Whishaw et al. 14 כדי להעריך את הגירעון המנוע של forelimb כל יום במשך שבוע 1 לאחר דוגמנות השבץ. לבצע משימה לכת גלולה אחת(SPRT) אצל בעלי חיים-מוגבל מזון (90% ממשקל הגוף מלאה) באמצעות פרספקס ברור (30 x 15 x 35 ס"מ גובה) עם שסע 1 ס"מ רוחב ו מדף מזון בחלק הקדמי של באמצע הקיר הקדמי.
- מניח גלול על מדף המזון הנגדי באלכסון אל forelimb המועדף. נהלת 20 כדורים בכל הפעלה למשך 3 שבועות.
הערה: מספר מוצלח של SPRTs מוגדר להישג שבו החיה ותופסת גלולת מזון ומכניסה אותו לתוך הפה מבלי להפיל אותו. - חשבתי את הציון כאחוז בדרגים מוצלחים, אשר מוגדר על פי הנוסחא הבאה:
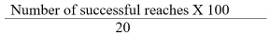
הערה: אנו מחלקי חיות ל -3 קבוצות: קבוצת מופעל הדמה (SOG), קבוצת התאוששות מתונה (MRG), וקבוצת התאוששות עלובה (PRG). אם ציון SPRT שלאחר שבץ> 50%, נסווג את החולדות כמו MRG, אשר מעיד על קיומו של נגע משמעותי אך לא הרס מוחלט של ת"אr קבל. אם תוצאת SPRT פעימות פוסט היא <50% לעומת תוצאת SPRT מראש הפעימות, נסווג את הקבוצה PRG, אשר מציינת lesioning מלא ביעד.
- אישור Neurohistological של האוטם Lesioning
- בצע זלוף לב עם paraformaldehyde 4% כפי שתואר לעיל. לאחר המוח שוקע לגמרי הפתרון סוכרוז 30%, לבצע חתך העטרה בעובי של 10 מיקרון ו מרווח של 200 מיקרומטר באמצעות microtome או cryotome 4.
- הכתם עם H & E, Nissl, מהיר Luxol כחול-PAS, neurofilament-L חלבון או מכתים חלבון fibrillary חומצה גלייה ולבחון את הממצאים היסטולוגית כדי לקבוע את עוצמת האור האופטימלי שיכול לכסות את רוחב כולו של הקפסולה הפנימית באזור היעד להתבונן מכתים 4,17.
- באמצעות תוכנה ImageJ, למדוד את עוצמת הקול של אזור האוטם photothrombotic של הקפסולה הפנימית בשקופיות המוח.
- כדי למדוד את היקף השטח אוטם, להפעיל את התוכנה 'ImageJ'. כדי לפתוח את הקבצים להערם, בחר 'תמונה למקבצים' ( 'תמונה' → → "סטאקס '' תמונה למקבצים '). שם הקובץ ערוך ובחר "בחר את קנה המידה '(' לנתח '→' בחר את קנה המידה ') לערוך מידה.
- ב 'תוספים', בחר 'מדוד סטאקס' כדי לחשב נפח או שטח של תמונות. הכנס את מרווח מרחק של 2 תמונות לתוך 'Slice ריווח'. כן ציור של ROI (אזור של עניין) של כל התמונות ולחצו על 'מדוד'.
הערה: התוכנה 'ImageJ' מחשב באופן אוטומטי את שטח ונפח של כל תמונה וסרטון הנפח הכולל של אותם.
תוצאות
השיטה המוצגת כאן נועדה ליצור אוטם קופסית מתוחם עם גירעון מנוע מתמשך. לכן, חשוב לקבוע את המטרה בדייקנות בתוך הקפסולה הפנימית בשלב טרום הניתוח. מיפוי somatotopic של סיבי פירמידליים הקפסולה הפנימית לא הוסדר עד כה. כדי לזהות את המטרה בדייקנות בתוך הקפסולה הפנימית, באזור forelimb חייב להיות תחום. זריקה של AAV-GFP לאזור forelimb של הקורטקס המוטורי יכול להתחקות אחר אקסונים של סיבי פירמידליים הקפסולה הפנימית (איור 1). קליעים נותבים עצביים אחרים, כגון אמין dextran biotinylated (BDA), ניתן להשתמש באותו מַטָרָה. קואורדינטות stereotactic של היעד בתוך הקפסולה הפנימית ניתן הובהרו על ידי התחקות תחזיות axonal שמקורן באזור forelimb של הקורטקס המוטורי הקפסולה הפנימית.
r.within-page = "1"> 
איור 1. זיהוי של פינת Forelimb ב פנימי קפסולת 2 שבועות לאחר הזרקה של AAV-GFP. סיבים אקסונלית-transduced GFP שמקורם מאזור forelimb של הקורטקס המוטורי מוצגים בגרעין ventrolateral של התלמוס (חיצים) ו חלק הזנב של הקפסולה הפנימית (ראש החץ). הקו המקווקו מציין את קווי המתאר של הקפסולה הפנימית, והמספרים מתייחסים המרחקים מן גבחת. היפו, ההיפוקמפוס; מעבדים, putamen caudate; VL, גרעין ventrolateral; IC, כמוסה פנימית. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
עוצמת האור האופטימלית עשויה להיות שונה בהתאם למשקל לכאבה גוף של החיה ועל סוגים ובקטרים של סיבים אופטיים. לכן, עוצמת האור האופטימלית צריכה להיקבע בנפרד לפני ניסוי lesioning האוטם הראשי. באמצעות הליך photothrombotic, עוצמת האור ניתן להגדיל בהדרגה עד היקף הנגע מכסה את הרוחב כולו של הקפסולה הפנימית מבלי להרוס את מבני חומר אפורים השכנים (איור 2). עוצמת האור האופטימלית יכול להיות מאומתת על ידי ההשוואה במידה היסטולוגית הנגע והמיקומים האוטמים.
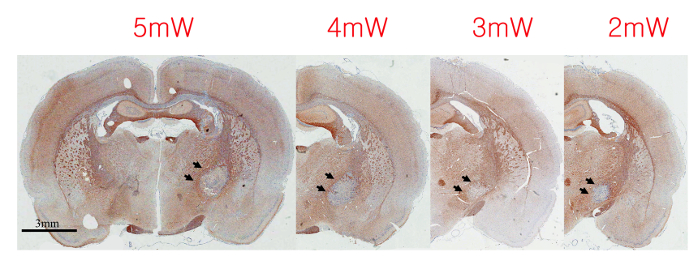
איור 2. היקף הנגעים האוטם מעבר אינטנסיביות שונות של אור לייזר מ 2 mW עד 5 mW 2 שבועות לאחר Photothrombotic Lesioning. עוצמת האור האופטימלי נחשב בין 3 mW ו -4 mW בהגדרה זו ניסיוני. החצים מצביעים על הנגע האוטם./53281/53281fig2large.jpg "Target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
אנחנו מעדיפים להשתמש ONI שבה הסיב האופטי הכלול צינור מתכת דק (מחט שדרה). הסיב האופטי עשוי לייצר פיזור אור מינימלית מהצד של סיבים, אשר עשוי להניב נזק עצבי נוסף לאורך בדרכי סיב אופטי. והחסימה של הסיב האופטי היא גם יתרון למנוע הכיפוף של הסיב האופטי מטרות עמוקות, כמו גם לצרף את ONI למסגרת stereotactic (איור 3).

איור 3. בניית הממשק האופטי-העצבי (האונים). (א) חיתוך של מחט השדרה. (ב) בנוכחות אחרת של הסיבים האופטיים. (C & D) צינור מתכת העיגון מוכנס עלסיב אופטי הפשיט וצפוף כדי לאבטח את הסיב האופטי אל הרכזת של מחט השדרה. (ה) סיבים אופטיים מוסף אפוקסי מוכנס לתוך מחט השדרה. (ו) אפוקסי הוא התקשה ב 100 מעלות צלזיוס למשך 20 דקות. (ז) הסיב האופטי הוא בקע על קצה מחט השדרה. (ח) הסיב האופטי הוא מלוטש. (i) עוצמת האור נמדד מהקצה של סיבים אופטיים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
הליך photothrombotic יפיק נגעים לשחזור ומיקומים בהצלחה ~ 70% ב לקויות מוטוריות. נגע אוטם קופסית אופייני כולל את ממד ventrodorsal של סיבי קופסית (איור 4 א). יתר על כן, הנגע האוטם משתרע לאורך ציר anteroposterior של הקפסולה הפנימית בגלל פיזור אור גדל בתוך הסיב קופסית. (איור 4) המערכת האופטית הממוקמת מתחת הכמוסה הפנימית מורכבת של סיבי חומר לבנים; וכך, הוא פגום לעתים קרובות על ידי הקרנה של עוצמת אור גדלה. מדורים מכתימים סידוריים נדרשים לאשר את הנפח והיקף של אוטם כולו. ההיקף האוטם היה 0.63 ± 0.37 מ"מ 3. כדי להעריך את חורבן קופסית סיבים, neurofilament וכתמים כחולים-PAS מהר Luxol מועילים.

איור 4. מראה מיקרוסקופית של 3 שבועות Capsular אוטם לאחר Photothrombosis. מראה מיקרוסקופית של אוטם קופסית 3 שבועות לאחר photothrombosis. א) פרוס מוח סעיף עטרה במוח החולדה. ראש חץ המצביע על חלקת מחט המכיל סיב אופטי בתלמוס עד כמוסה פנימית. B) מכתים סידורי Nissl של showi פרוסות המוח העטרה ng במידה השלמה של נגע אוטם הקפסולה הפנימית. ראשי חץ מציינים את הנגע האוטם. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
ההצלחה של המודלים ניתן להעריך על ידי בדיקות התנהגותיות באמצעות גלולה אחת להגיע משימה. המופע התנהגותיים לאחר שבוע 1 בעקבות lesioning האוטם הוא מדריך טוב כדי לאשר lesioning המדויק, אשר מלווה את ירידת הערך המתמשכת ניכרת של SPRT למרות גלולה אחת מדי יום אימוני לכת (איור 5). לאחר גירעון המנוע מוצג PRG, גירעון הנוירולוגיות מתמיד במשך 3 חודשי תקופה של התבוננות. קבוצה שאם מופעלים לא הראתה הירידה המשמעותית של ביצועי SPRT לאחר ניתוח.
להעלות / 53281 / 53281fig5.jpg "/>
איור 5. שינויים יחיד גלולה Reaching בציונים לאחר Capsular Infart 4,20. בקבוצת הניסוי (PRG ו MRG) הציגה ירידה משמעותית ציונים מייד לאחר האוטם lesioning בהשוואה לקבוצת מופעל הדמה (SOG). MRG מפגין התאוששות הדרגתית של הופעות SPRT, ואילו PRG מפגין לקויות מוטוריות מתמשכות לאורך זמן. אופ, lesioning האוטם photothrombotic; PRG, קבוצת התאוששות עניה; MRG, קבוצת התאוששות מתונה. מובהקות סטטיסטיות נקבעו באמצעות ניתוח מדד חוזר ונשנה של סטיות. + SOG לעומת MRG; * SOG לעומת PRG. נתונים הם אמצעי ± SEM. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
המודל האוטם קופסית המוצג כאן מדגים נגע ממוקד עם לקויות מוטוריות ניכרות ומתמשכות בתפקוד forelimb. דגמים קודמים של שבץ קופסית קורטיקליים הוכיחו תואר מספק של לקויות מוטוריות ו 6,8,9 תהליך ההחלמה מהיר. במובן זה, המודל הזה דומה במקרים אוטמי קופסית הקליניים אשר תערוכת ליקוי תפקודי לטווח ארוך.
השלבים הקריטיים ביותר בפיתוח מודל אוטם קופסית מתוחם הם: 1) לזהות את ייצוג somatotopic נכון של חלק הגוף נועד לבטל את הפונקציה בתוך הקפסולה הפנימית; 2) כדי לזהות את העוצמת האופטימלית של הליזר הירוק, אשר יכול להרוס את רוחב היריעה כולה של הקפסולה הפנימית עם הסגת גבול מינימאלי של שכנת מבני חומר אפורים; ו -3) למקם את הסיב האופטי מדויק במבנה היעד. למרות הטכניקות שהוצגו יכולות לגרום circumscribeמודל אוטם ד קופסית עם קצב שכפול גבוה (> 70%), הבדלים קטנים המיקוד ומידת השלמות להשמדה סוקרים את כל המגוון השלם של הקפסולה הפנימית עשויים להסביר גירעונות מנוע שונים.
בדרכי corticospinal ממוקמות במחצית הקדמית של האיבר האחורי של הקפסולה הפנימית בבני אדם למרות המחלוקת של ארגון somatotopic 15. לעומת זאת, לא חל כל סיווג שווה או הבהרות והסברים מדוקדקים של ארגון somatotopic של הקפסולה הפנימית במכרסמים. חוסר הידע לגבי ארגון somatotopic מוביל לעתים קרובות מטרות שגויות של lesioning האוטם בתוך הקפסולה הפנימית עם תוצאות מנוע שונות בין דגמים אוטמים קופסית. עם זאת, זיהינו את האקסונים-transduced GFP בחלק הזנב של הקפסולה הפנימית, אשר צפוי לייצג את הנתיב של סיבי מנוע forelimb. יתר על כן, lesioning של demonstrat בתחום זהאד גירעון מסומן ומתמשך של מיומנות לכת forelimb. לכן, אנו ממליצים על חלק הזנב של הקפסולה הפנימית עבור lesioning stereotactic כדי לשפר את תקפות מודל האוטם קופסית.
התאמה מראש של עוצמת אור היא חובה לייצר במידה אחידה של נגע אוטם במודלים שבצו כי זן חיה, משקל גוף, המקור וסוגי לאור ONI עלול ליצור בגדלים של אוטם שונים. לכן, ניסויים ראשוניים באמצעות בעוצמות אור שונות בחיות מעבדה עם המשקל לכאבה אותו הגוף צריכים להתנהל עד הנגע האוטם השביע הרצון מושג עם עוצמת אור מינימאלית.
עוצמת אור חזקה שיכול להרוס את רוחב היריעה כולה של הסיבים קופסית (קדמי, אחורי והיקף dorsoventral) מתאימה לאזור forelimb עם ניזק מינימאלי המבנים הסמוכים נחשבת את עוצמת האור האופטימלית. forelimב שטח של הקפסולה הפנימית מוקף התלמוס superiorly ואת דרכי הראייה inferiorly. לכן, את עומק החדרת ONI צריך להיות מדויק כדי להרוס את ההיקף השלם של IC בכיוון dorsoventral, עם שימור סימולטני של המבנים הסמוכים העליונים ונחותים. מיקום מדויק של אוני תוצאה הוא הרס חלקי של IC, אשר מוביל להחלמה מהירה של גירעון המנוע כתוצאה של הפלסטיות הסינפטית של סיבי פירמידה שנותרו הקפסולה הפנימית. בבדיקות היסטולוגיות סדרו, הגורם המבלבל ביותר האינדוקציה של גירעון מנוע עיקש היה המיצוב הנכון של ONI, מה שמוביל לכישלון להרוס את הרוחב כולו של PLIC 4,16. לכן, תשומת לב קפדנית צריך להיות משולם כדי להגיע ליעד הנכון. לאחרונה, Blasi et al. דיווח כי גירעון טהור מנוע קיימא יכול להיות מיוצר על ידי ביצוע נגע אוטם בכמוסה פנימית אחוריתאנדותלין -1 אלקטרוני (ET-1) 17. עם זאת, ET-1 יכולים להרוס את מבנה החומר האפור השכנה על ידי דיפוזיה של ET-1.
בדיקות התנהגות היא אמת מידה זמינה מיידי במעבדה כדי להעריך את היווצרות נגע אוטם הקפסולה הפנימית. עם זאת, הערכה של ביצועי המנוע שבוע לאחר lesioning האוטם מומלץ לחלק את החיות לקבוצות התאוששות מתונה ועניים. התאוששות מתונה הוגדרה כעליית תוצאת ההופעה של> 50% לעומת התוצאה לפני lesioning, ואילו התאוששות עניה הוגדרה התאוששות של <50%. בין בדיקות התנהגותיות מנוע forelimb, גלולה אחת להגיע המשימה היא אחד המבחנים הרגישים ביותר עבור שתי המדידות כמותיים ואיכותיים של הופעות המנוע כתוצאה משבץ מוחי 14. המשימה כמותית מודדת את ההצלחה להגיע תוך מתן בו זמנית ניתוח שימוש forelimb, כגון אחיזה ושולפי מזוןגְלוּלָה. הניתוח האיכותי של תנועת הלכת הוא גם מועיל כדי לבדל את האיכות למחלימים משבצים ע"י הבחנת התאוששות תפקודית אמיתית או פיצוי 20. כאן תיארנו למדידה כמותית בקצרה של SPRT; עם זאת, ניתוח איכותני באמצעות צילומי ניקוד על בסיס ניתוח מסגרת לפי מסגרת מומלץ לניתוח מפורט נוסף.
הטכניקות שהוצגו כאן לא צריכים להיות מוגבלות האינדוקציה של דוגמנות אוטם קופסית מצומצמת. הטכניקה עשויה להיות מיושמת על האינדוקציה של נגע אוטם באזורים אחרים של חומר לבן, כגון כפיס המוח, commissures הקדמי וסיבי חיבור בין מבנים עצביים. השילוב של טכניקה אוני photothrombotic זעיר מבוסס על התכונות האופטיות של החומר הלבן הוא עלול להרוס את המבנים ממוקד עם נזק מינימלי למבנים סמוכים. לדוגמא, אוטמי אַגמִימִי ניתן בקלות לייצרד על ידי מיקוד מבנים קורטיקליים הקשורים מוטוריים, קוגניטיביים, ופונקציות זיכרון. כאשר מבנה היעד הוא גדול, הוספות מרובות של אוני מסלולי מיקוד ואת הזווית שונים עשויות להידרש לייצר במידה הרצויה של נגעים.
ישנן מספר מגבלות בטכניקה זו. הטכניקה היא מספקת כדי להמחיש את התוצאה של lesioning האוטם את PLIC והתאוששות לאחר מכן. עם זאת, מודל זה אינו משקף את מלוא הספקטרום של WMS אדם בשל הרס photothrombotic של חומר לבן שונה במקצת WMS אדם. כתוצאה מכך, ממצאי הדמיה הנוירוביולוגי או MRI עשויים להפגין תכונות שונות בשלב המוקדם של lesioning photothrombotic. לכן, המודל הזה צריך לשמש כראוי לסחור את היתרונות והחסרונות של המודל. מבחינה טכנית, לא כל הניתוחים יכולים לייצר את גירעון המנוע הניכר וקבוע במודל זה, מכיוון שהיא דורשת נהלים מאוד מדויקים. Specifically, ידות מיומנות ומנוסות נדרשות לייצר את השחזור הגבוה בדור של דגם זה.
לסיכום, השימוש בשילוב של טכניקה photothrombotic, אופטימיזציה של עוצמת אור, ומיקוד נכון הוא טכניקה יעילה כדי לייצר מודל אוטם קופסית מצומצם. מודל זה יהיה מועיל לא רק ללמוד WMS בבית, המעגל התנהגותי, ורמות הסלולר אלא גם להעריך את התועלת של התערבויות טיפוליות ושיקומיות חדשות.
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי מענק מטעם המכון להנדסת מערכת רפואית (IMSE) & גיסט-Caltech הקרן שיתופית (K04592) מ גיסט ועל ידי תכנית המחקר למדע הבסיסי דרך NRF של קוריאה ממומנת על ידי משרד המדע, ICT ותכנון לעתיד (NRF-2013R1A2A2A01067890).
Materials
| Name | Company | Catalog Number | Comments |
| DC Temperature controller | WORLD PRECISION INSTRUMENTS, INC. | ATC1000 | |
| Digital Stereotaxic Instruments | STOELTING CO. | 51900 | |
| Electrical Stimulator | CyberMedic Corp. | EMGFES 2000 | |
| Epoxy | Precision Fiber Products, INC. | PFP-353ND1 | Mix Ratio: 10(A):1(B-hardener) by weight Curing Schedule: 1 min @150 °C 2 ~ 5 min @120 °C 5 ~ 10 min @100 °C 15 ~ 30 min @80 °C |
| Fiber Optic Scribe | THORLABS, INC | S90R | |
| Fiber patch cable | KOREA OPTRON Corp. | Outer diameter: 3 mm Ø200 µm 0.39 NA FC/PC-FC/PC 1 m | |
| Laser Power Supply | CHANGCHUN NEW INDUSTRIES OPTOELECTRONICS TECH. CO., LTD. | MGL-FN-532nm-200mW-14010196 | |
| Crimp ring | DAWOOTECH CO.,LTD. | Length: 19 mm Inner diameter: 3 mm Outer diameter: 3.8 mm Material: SUS | |
| Micro4-micro syringe pump controller | WORLD PRECISION INSTRUMENTS, INC | 95100 | |
| Optical Power Meter | THOLABS, INC | PM100D | |
| Diamond lapping (polishing) sheet | THORLABS, INC | LF3D | Grit : 3 µm |
| Diamond lapping (polishing) sheet | THORLABS, INC | LF6D | Grit : 6 µm |
| Rose Bengal | SIGMA-ALDRICH CO. LLC. | 330000 | |
| Needle for spinal anesthesia with pencil point tip (Spinal needle) | B.BRAUN MELSUNGEN AG | 4502027 | Size: 27 G Length: 88 mm Needle: 0.40 mm |
| Waterproof sandpaper | DEERFOS CO.,LTD | CC261 | Grit : 1,000 µm |
| Nanofil 10 µl syringe | WORLD PRECISION INSTRUMENTS, INC | NANOFIL | |
| Nanofil 33 G BVLD needle | WORLD PRECISION INSTRUMENTS, INC | NF33BV-2 | |
| AAV-GFP virus | UNC Vector Core | AAV2-CamKIIa-eYFP | 2 x 1012 virus molecules/ml |
| Anti-Green Fluorescent Protein, Rabbit IgG fraction | Life Technologies, INC | A11122 | primary antibody (1:200) |
| Goat Anti-Rabbit IgG (H + L) | Life Technologies, INC | A11034 | secondary antibody (1:500) |
| Ceftezole | GUJU Pharma CO.,LTD. | A27802741 | 0.1%, 1 ml |
| Lidocain hydrochloride injection | JEIL PHARMACEUTICAL CO.,LTD. | A04900271 | 2%, 1 ml |
| Hand Piece Drill | Seshin | ||
| Digital optical power and energy meter | THORLABS, INC | PM100D | |
| Ketoprofen | UNIBIOTech |
References
- Roger, V. L., et al. Heart disease and stroke statistics--2012 update: a report from the American Heart Association. Circulation. 125, 2-220 (2012).
- Debette, S., Markus, H. S. The clinical importance of white matter hyperintensities on brain magnetic resonance imaging: systematic review and meta-analysis. Bmj. 341, 3666(2010).
- Zhang, K., Sejnowski, T. A universal scaling law between gray matter and white matter of cerebral cortex. PNAS. 97 (10), 5621-5626 (2000).
- Kim, H. S., et al. A rat model of photothrombotic capsular infarct with a marked motor deficit: a behavioral, histologic, and microPET study. J Cereb Blood Flow Metab. 34 (4), 683-689 (2014).
- Kleim, J. A., Boychuk, J. A., Adkins, D. L. Rat models of upper extremity impairment in stroke. ILAR J. 48 (4), 374-384 (2007).
- Frost, S. B., Barbay, S., Mumert, M. L., Stowe, A. M., Nudo, R. J. An animal model of capsular infarct: endothelin-1 injections in the rat. Behav Brain Res. 169 (2), 206-211 (2006).
- He, Z., et al. Definition of the anterior choroidal artery territory in rats using intraluminal occluding technique. J Neurol Sci. 182 (1), 16-28 (2000).
- Tanaka, Y., et al. Experimental model of lacunar infarction in the gyrencephalic brain of the miniature pig: neurological assessment and histological, immunohistochemical, and physiological evaluation of dynamic corticospinal tract deformation. Stroke. 39 (1), 205-212 (2008).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Watson, B. D., Dietrich, W. D., Busto, R., Wachtel, M. S., Ginsberg, M. D. Induction of reproducible brain infarction by photochemically initiated thrombosis. Ann Neurol. 17 (5), 497-504 (1985).
- Kuroiwa, T., et al. Development of a rat model of photothrombotic ischemia and infarction within the caudoputamen. Stroke. 40 (1), 248-253 (2009).
- Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Handbook of biomedical optics. 83, CRC Press. Boca Raton, Fl. (2011).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Whishaw, I. Q., Whishaw, P., Gorny, B. The structure of skilled forelimb reaching in the rat: a movement rating scale. J Vis Exp. (18), e816(2008).
- Jang, S. H. A review of corticospinal tract location at corona radiata and posterior limb of the internal capsule in human brain. NeuroRehabilitation. 24 (3), 279-283 (2009).
- Kim, D., et al. Longitudinal changes in resting-state brain activity in a capsular infarct model. J Cereb Blood Flow Metab. 35 (1), 11-119 (2014).
- Blasi, F., Whalen, M. J., Ayata, C. Lasting pure-motor deficits after focal posterior internal capsule white-matter infarcts in rats. J Cereb Blood Flow Metab. 35 (6), 977-984 (2015).
- Metz, G. A., Antonow-Schlorke, I., Witte, O. W. Motor improvements after focal cortical ischemia in adult rats are mediated by compensatory mechanisms. Behavioural brain research. 162 (1), 71-82 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved