Method Article
ヒト乳癌組織および細胞株からマンモスフェア形成アッセイ
要約
Floating mammosphere assays can investigate the subset of stem-like breast cancer cells that survive in suspension conditions and show enhanced tumorigenesis when implanted into mice. This protocol provides a convenient in vitro measure of sphere-forming ability, a proxy for in vivo tumorigenesis, while facilitating analysis of the stem-associated transcriptional landscape.
要約
より分化した子孫を生じることながら健康な組織に似ては、多くの血液および固形の悪性腫瘍は、現在、自己再生幹様癌細胞のサブセットで、階層的に組織化されると考えられている。非幹腫瘍の大きさと比較して強化された化学療法および放射線抵抗性を有することが、乳癌、これらの癌幹細胞を標的と理解とは、重要な研究分野となっている。マンモスフェアアッセイはまた、広く遡及sphere-を同定する能力について用いられるようになっている:CD44、CD24、およびALDH活性を含むマーカーは、将来に向かって、免疫不全マウスに移植したときに増強された腫瘍形成性を示す細胞を単離するために蛍光活性化細胞選別(FACS)を用いて評価することができる単一の幹細胞様のクローンから発生セルを形成する。ここでは、適切な細胞株または一次患者サンプルからマンモスフィアの培養、彼らの継代、及び球体Fを推定する計算のためのアプローチを概説orming効率(SFE)。まず、適切な計画とマンモスフェア実験の解釈の重要な考慮事項と落とし穴を議論する。
概要
幹様がん幹細胞が率いる腫瘍細胞系列の存在が大幅に腫瘍の不均一性の我々の理解に追加されました。腫瘍におけるいくつかの表現型の多様性は遺伝的に異なるクローンのクローンの成長から生じませんが、かなりのコンポーネントは、エピジェネティックな違いに起因すると表示されます。癌細胞は、特定の遺伝子の活性化または抑制を経由して幹、前駆、および分化した状態の間で(時には可逆的に)遷移することができる表現のプログラム1から3。これは、現在調節因子を提供する隣接癌、間質、または免疫細胞の傍分泌シグナル伝達と関連して、その結果自己分泌シグナル伝達を細胞内で発現された遺伝子発現プログラムを反映して、細胞内因性または外因性の要因を反映して、そのようなの程度microenviromental条件よい低酸素症2,4,5。
革新的な系統は、アプローチをトレースするが、それらのインビボニッチ6で推定される癌幹細胞を研究する当社の能力進めています- 8、球形成アッセイは、少なくとも使用されるアッセイ条件下では、幹細胞のように振る舞うように乳癌細胞」の可能性を推定するための普及した、便利なアプローチのまま。これは、しばしば膜マーカーCD44およびCD24 9、及び酵素ALDH(アルデヒドデヒドロゲナーゼ)10の活性レベルの発現によって精製癌幹細胞について遡及的な方法は、よりmesenchymal-上皮に対応するために提案されたマーカーと一緒に使用され様がん幹細胞をそれぞれ11。球形成のアプローチは、最初の上皮成長因子(EGF)12を添加して非接着、無血清条件下で単一クローン由来の推定幹細胞の増殖を可能にする、ニューロスフィアアッセイとして開発された、後で有用正常および癌に適用される乳房組織。
球体形成創始細胞の同一性、及び球塊を構成する混合細胞型は、mammo-、または他の球形成アッセイから作ることができる推論に関連している。 G0期で休むと考えられて長期静止骨善意幹細胞は、 生体内で活性化を有利に働く要因の正確な組み合わせは発生しません。マンモスフェアアッセイは、代わりに有糸分裂に構えたり、すでに13を分割するいずれかの細胞の成長を可能にします。これらの前駆細胞ではなく、真に静止細胞が、アッセイにおいて使用されるEGFおよび塩基性線維芽細胞増殖因子(bFGF)マイトジェンで増殖する細胞段階であってもよい。それにもかかわらず、それらは活性化された幹細胞に関連するシグナル伝達経路14の範囲を含む。また、それらの形成の速度は、マウス異種移植片2,15,16の中で限界希釈アッセイにおけるそれらの効力により測定し、それらから採取された組織の腫瘍形成に関連する</ SUP>。
ここでは、単一細胞を単離し、ヒト乳癌細胞株および乳房腫瘍の臨床試料の両方からの一次マンモスフィアを生成するための詳細なプロトコルを提供する。我々はまた、自己再生を評価するために主要なマンモスフィアの連続継代を実行する方法を説明し、どのように異なる播種密度間での比較は( 図1のスキームを参照)を可能にする効率を形成する球を計算する。
プロトコル
以下の手順では、倫理的にインペリアル·カレッジ、ロンドンによって承認されている。
ヒト乳癌細胞株からの一次マンモスフィアの1世代
注:無菌培養フードの下で、次の手順を実行します。
- マンモスフェアメディア2mMのL-グルタミン、100 U / mlペニシリン、100 U / mlストレプトマイシンを補充したDMEM / F12を含む準備する。 、10ng / mlの組換えヒト塩基性線維芽細胞増殖因子(bFGF; R&D Systems社)及び1×B27サプリメント、20ng / mlの組換えヒト上皮細胞増殖因子(シグマEGF)を添加することによって使用直前に完全培地を調製する。
- 接着性のMCF-7またはMDA-MB-231細胞(または任意の乳癌細胞株; 70〜80%コンフルエンス)を含むフラスコから培地を吸引除去は、1×PBSで2回洗浄し、細胞をトリプシン処理。
- 5分間室温で200×gで遠心分離細胞。マンモスフェアメディア1-5 mlの上清と再懸濁細胞をデカントします。ピペット40μmのセルストレーナーキャップフィルタ上下に、必要に使用した場合、単一細胞懸濁液を得た。単一細胞懸濁液が形成された(ない場合は、3回まで細胞懸濁液を注射器25 G針を使用)していることを確認するために血球計数器を使用してください。
- FACS経由必要な分離株のCD44 + CD24-細胞のサブセットは、抗CD24-フィコエリトリン(PE)および抗CD44フルオレセインイソチオシアネート(FITC)モノクローナル抗体9を使用している場合。また、磁気活性化細胞ソーティング抗CD44及び製造者の指示に従って、抗CD24ビオチン結合されたマイクロビーズとの(MACS)システムを使用してこのような集団を単離。 LDカラムを使用して、LSカラムを用いて正の選択、および負の選択を行い、17フローサイトメトリーにより、すべての単離された細胞の表現型を確認する。
- トリパンブルーを用いて1mlあたり生存細胞の数を計算します。
注:細胞生存率はhemocy上のグリッド内のセルの総数で割った生存細胞の数として計算される光度計。パンブルーを取る細胞は非生存と考えられている。以下の手順を正確に生存細胞の割合を決定するために使用される。- PBS中トリパンブルーの0.4%溶液を調製する。細胞の1ミリリットルのパンブルーストック溶液0.1ミリリットルを追加します。血球計数器をロードし、低倍率で顕微鏡下ですぐに調べる。総細胞数及び青色染色細胞の数を数える。
生存細胞= [1.00 - (青色細胞の数÷全細胞の数)]×100。 - 培養物1mlあたりの生存細胞数を計算するには、以下の式を使用します。希釈係数を補正することを忘れないでください。
10 4×1.1 =細胞/ mlの文化×生細胞の数
- PBS中トリパンブルーの0.4%溶液を調製する。細胞の1ミリリットルのパンブルーストック溶液0.1ミリリットルを追加します。血球計数器をロードし、低倍率で顕微鏡下ですぐに調べる。総細胞数及び青色染色細胞の数を数える。
- 6ウェルの超低付着性プレートの各ウェルに完全なマンモスフェア培地2ml中の細胞の予め決定された量を再懸濁する。播種密度は、通常、ウェル当たり500-4,000細胞/ cm 2の細胞である。必要に応じてLOを使うワットアタッチメント24ウェルプレートは、培地の0.5mlの同じ濃度で細胞を播種した。
注:私たちは、対象となる各細胞株について播種密度と文化の時間の最適化をお勧めします。 - 特に最初の5日間の増殖期の間に、プレートを乱すことなく(細胞株およびマンモスフィアのサイズに応じて)5~10日間、37℃、5%CO 2での超低接着6穴プレートをインキュベート。
ヒト乳癌臨床サンプルからの一次マンモスフィアの2世代
注:ヒト乳癌組織は、乳房腫瘍を除去するための手術を受けた患者から得ることができる。 100 U / mlペニシリンおよび100 U / mlのストレプトマイシンを含む培地50mlの滅菌チューブ中で24時間まで氷上店組織。無菌培養フードの下に、次の手順を実行します。
- メディアの少容量で100ミリメートル組織ペトリ皿にサンプルを転送します。 Remov無菌のはさみ、scapelとピンセットを使用して電子脂肪組織。
- DMEM / F12 2-3 mlを加え大きな片がなくなるまで、無菌scapelやカミソリの刃で1ミリメートル3枚にサンプルをミンチ。
- タンパク質分解酵素(3,000 U / mlコラゲナーゼ1,000 U / mlのヒアルロニダーゼ)を含む予め温めておいた10ミリリットルDMEM中で組織片を再懸濁し、すべての組織断片が消化されるまで、ロータリーシェーカーで37℃でインキュベートする。通常、完全な消化は1-3時間かかる。腫瘍の病理学的な文字によると消化時間を調整します。 (例えば、乳腺癌はより壊れやすく、短い消化時間を必要と粘液癌に比べて消化することが通常困難です)。血球計数器の下に20μlのサスペンションを観察することによって消化ごとに1/2時間の程度を評価。
- 断片はその後、5分間沈降室TEMで10分間200×gで15ミリリットルコニカルポリプロピレンチューブと遠心分離機で上清を転送できるようにする温度。マンモスフェアメディア5mlの - 慎重に1上清および再懸濁細胞をオフにデカント。
- 単一細胞懸濁液を得て、メッキする細胞株について上記のステップ1.1から1.4に従ってください。必要に応じて25〜Gの細胞が損傷した細胞を制限するために2回の最大シリンジ渡します。
3.マンモスフェア効率(%)計算の形成
- 培養期間の後、40倍の倍率で顕微鏡下でマンモスフィア(より大きい40μm)の直径を数える。光学顕微鏡にデジタルカメラを使用してデジタル画像5ランダムフィールドおよび取得ソフトウェアを使用して、マンモスフィアのサイズを決定する。任意の画像解析ソフトウェアを使用してください。
- マンモスフェアは、以下の式を使用して効率(MFE%)を形成する計算する:
MFE(%)=(ウェル当たりマンモスフィアの#)/(ウェル当たり播種した細胞の#)×100
自己再生の評価のためのマンモスフィアの4連続継代
- ピペット15ミリリットルチューブに各ウェルからマンモスフィアを含む培地。 PBSでウェルを洗浄し、収集したメディアに追加する。室温で10分間、115×gで遠心する。
- 上清を捨て、予め温めておいた0.5%トリプシン/ 0.2%EDTAを500μlにペレットを再懸濁。 2-3分間インキュベートする。
- トリプシンを中和するためにFCSの500を添加する。 5分間500×gで遠心分離する。 、マンモスフィアメディアの100μlの上清と再懸濁ペレットを廃棄ピペッティング球を脱凝集する。
- 血球計で細胞をカウントし、細胞を単一細胞懸濁液にするかどうかを判断。 25 Gを通過しない場合は、単一細胞を得るために3回まで注射器。主要生成に使用したのと同じ密度で新しい超低接着6ウェルプレートに細胞を播種する。
- 5-10日後、>40μmの球をカウントし、前に報告された式を使って球形成効率を計算。
結果
異なるサンプルまたは異なる処理を施したものは播種初期セルに対して正規化した後に形成マンモスフィア>40μmの数が変化してもよい。三重で成長し、各治療のためにマンモスフェア形成効率(MFE)を計算します。これは、異なる播種密度を用いた実験を比較することを可能にする。データは、最高の理想的な陽性および陰性対照を、棒グラフに表示し、三つ組のウェルで標準偏差を表示している。一貫して60〜80%コンフルエンスの間に非接着性プレートに付着細胞を移す。慎重な細胞計数は正確に治療の効果を定量化することが不可欠である。この重要なステップはよく同じ処理とは別に、複数の懸濁液を調製することにより、検索結果に寄与している変動率を推定します。測定される細胞濃度が同じウェルと著しく異なる場合には、( 図2)を計数アプローチを精製考える。
:FOクラス= "jove_content"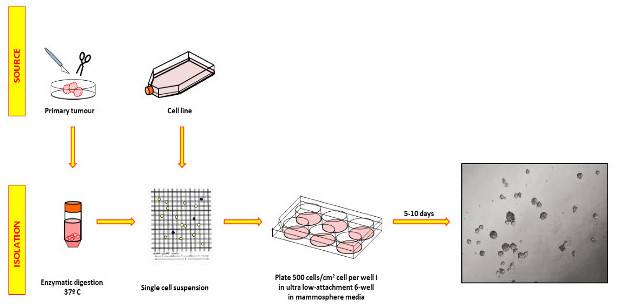
図1:原発性乳癌及び細胞株試料の処理は、マンモスフェア培養物を得るために、サンプルは、酵素的に消化され、単一の細胞として、検証、および成長因子無血清マンモスフェア培地中で非接着性プレート上にプレーティングする。プレートは、球の融合を回避するために、増殖期中に処理すべきではありません。右の写真は、5日後に撮影した代表的なMCF-7球を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:正上皮エストロゲンから形成されたマンモスフィアの代表的な結果(MCF-7)、および間葉三重negatiVEの(MDA-MB-231)細胞株。最小細胞融合/凝集は、MCF-7、500細胞/ cm 2で、ここで、低密度めっきにより得、1,000細胞/ cm 2 MDA-MB-231のためにした。
ディスカッション
プライマリとセカンダリのマンモスフィアの成功評価は、マンモスフィアは、最小限の球凝集に、単一のクローンから形成する十分に低い密度でメッキされる細胞に依存しています。しかし低すぎる密度で、数が少なすぎるマンモスフィアは、統計学的治療の効果を区別するために形成することができる。播種密度は、彼らは彼らの球の形成効率が大幅に変化することができるので、使用される各細胞株について最適化する必要があります(低E-カドヘリンを発現するものが少なく安定しており、短期のマンモスフェア培養18を形成することができる)。この最適化段階は、単一細胞のクローン成長からほとんどのプライマリとセカンダリの球形成の結果を確認する必要があります。ウェルごとに1つの細胞をプレーティングすることは、完全にクローンマンモスフェア形成を確実にする唯一の方法であり、新たに得られた試料13の自己再生/分化率を定量化するために推奨することができる。しかし、このアプローチは、複雑な要因に苦しんでいる:マンモスフェアが形成1%の効率は、96ウェルプレートあたり単一マンモスフェアが得られると、効率が懸濁された細胞間のシグナリングパラクリン成長因子の非存在下で形成されているより少ないマンモスフィアを過小評価することができる。最後に、継代後の二球の頻度は、自己再生のレベルを推定することができ、真にがん幹細胞特性を有する細胞を選択した場合、一次球の形成よりも二次のより高い効率が期待されるべきである。再凝集は、二球及び細胞型に適切な非常に低い細胞密度を導出するに向かって最適化されるべき特定の問題である。
> 40μmの成長するマンモスフィアのにかかる時間も変化し、臨床サンプルからマンモスフィアは、球の成長速度に応じて、5-12日の間にカウントする必要があるかもしれません。球体の凝集、融着が必然的にメディアの周りの細胞の固有の移動に起因し発生するが、このプロセスは、実質的に元によって増強されるようである増殖期の間にプレート19を移動させるperimentersは、したがって、何かが回避される。
大きな球体は、日常この仮定は慎重に扱われるべきであるより高い長期の複製能を有する幹細胞に由来すると考えられている。大きな球は、前駆細胞の増殖能力を反映し、増殖因子に対する応答、または凝集または融合の産物であり得る。両方の細胞型の合成周波数は依然として元の組織の腫瘍形成能を反映することができるが、両方の幹細胞およびそれらのトランジット増幅娘細胞は、マンモスフィア20を生じさせることが可能である。
マンモスフェアアッセイは、それらのインビボニッチ中の癌幹細胞の形成および動作の複雑性を捕捉する障害によって制限される。真にインビトロおよびインビボ自己再生およびプロスペクティブ単離さ乳癌幹細胞の分化、マンモに長期を評価する球アッセイは、したがって、理想的に系統のトレースと異種移植実験と併せて行われるべきである。系譜トレースが正確にがん幹細胞サブセットを反映したマーカーに依存しているが、これらは「骨の善意」がん幹細胞の動的な形成に寄与、生体内の状態を保持から大きな恩恵を受ける。まだヒト免疫および間質部品21を欠いている間免疫不全マウスにおける異種移植実験で腫瘍形成を評価することはまた、マンモスフェアアッセイから欠落している多くのニッチなコンポーネントを提供します。もっと技術的に厳しいが、これらの技術は、乳癌幹細胞の特性と腫瘍形成のより完全かつ有益なビューのために試みるべきである。
マンモスフェアアッセイは、有益で便利なツールを提供し、それは慎重に行われ、上記の制限を考慮提供:確かに、生体内コンディの我々の知識としてがん幹細胞の進歩によって経験ン、マンモスフェアアッセイは、分子と環境因子の増加範囲を組み込むことができる。上記で概説したアプローチを用いて、球形成率は、異種移植片2,15,16における腫瘍イニシエーション·レートに対応し、球の自己再生は、より攻撃的な乳癌の22の増加と化学療法23などの後の幹細胞の増加介入を行う。一方、球体自体が発現差および幹細胞遺伝子発現のアーキテクチャに関与する新規因子を研究する際の価値ある資源を提供することができる。
開示事項
The authors declare that there is no conflict of interest that could be perceived as prejudicing the impartiality of this article.
謝辞
この作品はヒラリークラフトと卿ダグラスマイヤーズに特別な言及にインペリアルBRC、ヘルスリサーチ研究所、およびアクション対がんによってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Lonza | CC-3151 | |
| 2 mM L-glutamine | Sigma Aldrich | G8540 | |
| 100 U/ml Penicillin & Streptomycin | Sigma Aldrich | P4083 | |
| 20 ng/ml Recombinant human epidermal growth factor (EGF) | Sigma Aldrich | E9644 | |
| 20 ng/ml Recombinant human basic fibroblast growth factor (bFGF) | R&D systems | 233-FB-025 | |
| 1x B27 supplement | Invitrogen | 17504-044 | |
| Phosphate buffered saline (PBS) | Thermo Scientific | 12399902 | |
| 0.5% trypsin/0.2% EDTA | Sigma Aldrich | 59418C | |
| Fetal calf serum | First Link UK | 02-00-850 | |
| Trypan blue | Sigma Aldrich | 93595 | |
| Low attachment 6-well plates | Corning | CLS3814 | |
| Collagenase type 1A | Sigma Aldrich | C9891 | |
| Hyaluronidase | Sigma Aldrich | H3506 | |
| Sterile razor blades | Fisher Scientific | 12443170 | |
| Sterile scalpel | Fisher Scientific | 11758353 | |
| Sterile micro-dissecting scissors | Sigma Aldrich | S3146 |
参考文献
- Iliopoulos, D., Hirsch, H. a., Struhl, K. An epigenetic switch involving NF-kappaB, Lin28, Let-7 MicroRNA, and IL6. Cell. 139 (4), 693-706 (2009).
- Iliopoulos, D., Hirsch, H. a., Wang, G., Struhl, K. Inducible formation of breast cancer stem cells and their dynamic equilibrium with non-stem cancer cells via IL6 secretion. Proc Natl Acad Sci U S A. 108 (4), 1397-1402 (2011).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell stem cell. 10 (6), 717-728 (2012).
- Rosen, J. M., Jordan, C. T. The increasing complexity of the cancer stem cell paradigm. Science. 324 (5935), 1670-1673 (2009).
- Rokavec, M., Wu, W., Luo, J. -. L. IL6-mediated suppression of miR-200c directs constitutive activation of inflammatory signaling circuit driving transformation and tumorigenesis. Mol Cell. 45 (6), 777-789 (2012).
- Chen, J., Li, Y., et al. A restricted cell population propagates glioblastoma growth after chemotherapy. Nature. 488 (7412), 522-526 (2012).
- Driessens, G., Beck, B., Caauwe, A., Simons, B. D., Blanpain, C. Defining the mode of tumour growth by clonal analysis. Nature. 488 (7412), 527-530 (2012).
- Schepers, A. G., Snippert, H. J., et al. Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas. Science. 337 (6095), 730-735 (2012).
- Sheridan, C., Kishimoto, H., et al. CD44+/CD24- breast cancer cells exhibit enhanced invasive properties: an early step necessary for metastasis. Breast cancer research: BCR. 8 (5), R59 (2006).
- Ginestier, C., Hur, M. H., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell stem cell. 1 (5), 555-567 (2007).
- Liu, S., Cong, Y., et al. Breast Cancer Stem Cells Transition between Epithelial and Mesenchymal States Reflective of their Normal Counterparts. Stem cell reports. 2 (1), 78-91 (2014).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: a critical review of sphere-formation as an assay for stem cells. Cell stem cell. 8 (5), 486-498 (2011).
- Dontu, G., Abdallah, W. M., et al. In vitro propagation and transcriptional profiling of human mammary stem / progenitor cells. Genes Dev. , 1253-1270 (2003).
- Ponti, D., Costa, A., et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties. Cancer Res. 65 (13), 5506-5011 (2005).
- Grimshaw, M. J., Cooper, L., et al. Mammosphere culture of metastatic breast cancer cells enriches for tumorigenic breast cancer cells. Breast Cancer Res. 10 (3), R52 (2008).
- Pham, P. V., Phan, N. L. C., et al. Differentiation of breast cancer stem cells by knockdown of CD44: promising differentiation therapy. J Transl Med. 9 (1), 209 (2011).
- Manuel Iglesias, J., Beloqui, I., et al. Mammosphere formation in breast carcinoma cell lines depends upon expression of E-cadherin. PloS one. 8 (10), e77281 (2013).
- Coles-Takabe, B. L. K., Brain, I., et al. Don’t look: growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Stingl, J. Detection and analysis of mammary gland stem cells. J Pathol. 217 (2), 229-241 (2009).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell stem cell. 14 (3), 275-291 (2014).
- Al-Hajj, M., Clarke, M. F. Self-renewal and solid tumor stem cells. Oncogene. 23 (43), 7274-7282 (2004).
- Yu, F., Yao, H., et al. let-7 regulates self renewal and tumorigenicity of breast cancer cells. Cell. 131 (6), 1109-1123 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved