Method Article
神経細胞の金ナノロッド補助光刺激
要約
This protocol outlines how to use the transient heating associated with the optical absorption of gold nanorods to stimulate differentiation and intracellular calcium activity in neuronal cells. These results potentially open up new applications in neural prostheses and fundamental studies in neuroscience.
要約
Recent studies have demonstrated that nerves can be stimulated in a variety of ways by the transient heating associated with the absorption of infrared light by water in neuronal tissue. This technique holds great potential for replacing or complementing standard stimulation techniques, due to the potential for increased localization of the stimulus and minimization of mechanical contact with the tissue. However, optical approaches are limited by the inability of visible light to penetrate deep into tissues. Moreover, thermal modelling suggests that cumulative heating effects might be potentially hazardous when multiple stimulus sites or high laser repetition rates are used. The protocol outlined below describes an enhanced approach to the infrared stimulation of neuronal cells. The underlying mechanism is based on the transient heating associated with the optical absorption of gold nanorods, which can cause triggering of neuronal cell differentiation and increased levels of intracellular calcium activity. These results demonstrate that nanoparticle absorbers can enhance and/or replace the process of infrared neural stimulation based on water absorption, with potential for future applications in neural prostheses and cell therapies.
概要
最近の研究では、水(> 1400 nmの波長)で赤外光の吸収に関連する過渡的な加熱が神経組織1及び2心筋細胞の細胞内カルシウムトランジェントに活動電位を誘導するために使用され得ることを実証した。赤外光の使用は、潜在的な細かい空間分解能、組織と直接接触の欠如、刺激アーチファクトの最小化、および必要性の除去に遺伝的に、神経補綴物における用途のために大きな関心を調達している刺激前に細胞を修正する(光遺伝学で必要に応じて)1。これらの利点の全てにもかかわらず、最近開発されたサーマルモデルは、標的組織/細胞は、複数の刺激部位および/ または高繰返し率は3,4使用されている累積的加熱効果によって影響を受ける可能性があることを示唆した。
これらの課題に対応するため、研究者らは、外因absorを使用する可能性を認識している神経刺激のための繊維が組織内のより局所的な加熱効果を生成する。 Huang らは、遠隔高周波磁場5をHEK 293細胞中で温度感受性TRPV1チャネルを活性化するために、超常磁性フェライトナノ粒子を使用してこの原理を実証した。この技術は、より深い浸透(磁場が組織と比較的弱く対話)を可能にすることができるが、応答は、ほんの数秒の周期ではなく、バイオニックデバイス5に必要なミリ秒の期間にわたって記録した。同様に、ファラらは、インビトロにおいて黒色微粒子ラット皮質ニューロンの電気刺激を実証した。これらは、潜在的により速い反復率6を可能μJの範囲でμsでエネルギーの数百のオーダーのパルス持続時間を使用して刺激における細胞レベルの精度を示した。
外因性の吸収剤の使用はまた、誘導するために適用されているin vitroでの形態学的変化。 Ciofani らは、超音波7により励起された圧電窒化ホウ素ナノチューブを用いた神経細胞の伸長で約40%の増加を示した。同様に、PC12細胞におけるエンドサイトーシスされた酸化鉄ナノ粒子は、鉄酸化物8の細胞接着分子の活性化を、用量依存的に神経分化を促進することが報告されている。
最近では、神経刺激を支援するための外因性吸収材への関心も、金ナノ粒子(金NPS)を使用することに焦点を当ててきた。 AuのNPは、効率的に、プラズモンピークのレーザ光 を吸収すると熱9の形で周囲の環境へと放散する能力を有する。 10 -利用可能な粒子形状のすべての中で、金ナノロッド(金のNR)の光吸収が便利に(NIR、750-1,400の間の波長近赤外線)生体組織の治療の窓に一致する。また、続きで神経刺激のextは、金のNRの使用は比較的良好な生体適合性と表面機能オプション11の広い範囲を提供します。最近の研究は、分化刺激効果は、NG108-15神経細胞12中のAuのNRの連続レーザ曝露後に誘導できることを示した。同様に、細胞内カルシウムトランジェントは、可変周波数およびパルスで変調されたレーザ照射13を長後のAuのNRで培養した神経細胞で記録した。細胞膜の脱分極はまた、らせん神経節ニューロン14の初代培養中のAuのNRの近赤外レーザー照射後に記録した。照射された金のNRとのin vivoでのアプリケーションの最初のは、つい最近実証されている。オムらは彼らのプラズモンピーク時金のNRを露出し、複合神経活動電位(CNAPS)の振幅の6倍に増加し、ラットの坐骨神経における刺激閾値で3倍の減少を記録した。 ENhanced応答はNRプラズモンピーク15の励起に起因する局所的な加熱効果に起因するものであった。
本論文では、金のNRを用いて培養しNG108-15神経細胞におけるレーザー刺激の効果を調査するためのプロトコルが指定されている。これらのメソッドは、標準的な生物学的技術および材料を用いてインビトロで細胞集団を照射する、シンプルでありながら強力な方法を提供します。プロトコルは、安全な操作で再現性のアライメントを可能にするファイバ結合レーザダイオード(LD)に基づいている。 AuのNRサンプル調製およびレーザー照射方法は、さらに、特定の合成および培養プロトコールはそれぞれ、よく知られている場合に、異なる粒子形状および神経細胞培養物に拡張することができる。
プロトコル
1.金のNRの準備
注:金のNRはレシピ16の数によって合成、または商業ベンダーから購入することができます。
- UV-Vis分光法を介して、0.5ナノメートルの解像度で300から1000nmまでの吸収値を記録することによって、金NR溶液の初期光学密度(OD)を測定する。利用可能なキュベットで使用される溶液の体積を変化させる。
- 適切な技術17( 例えば、UV-Vis分光法、単一粒子誘導結合プラズマ質量分析法、透過型電子顕微鏡)による最初のNPモル濃度を評価するか、ベンダーによって提供される濃度値を使用する。
- 最良の再現性についてはOD = 1に到達するために、初期のAu NRサンプルを希釈する5 mlのストック溶液を調製し、試験した試料のすべてについてODを一定に保つ。希釈溶媒の組成のための商業ベンダーのプロトコルに従ってください。よくわからなければ、脱イオン水を使用しています。
- 二回15分間のAu NR溶液1mlを7800×gで遠心分離した溶液からの任意の化学的過剰を除去する。遠心分離サイクルは、力と時間( 例えば 20分で5600×g)が18に変化することができる。
- 上清を除去し、脱イオン水でのNRを再懸濁。再懸濁粒子が溶液中で凝集体を形成するかもしれないので、最良の結果を持っているために毎日それらを準備。また、1週間以上、もはや用の冷蔵庫で保管してください。凍結しないでください。
- 細胞培養条件下で使用する前に、5分間のAu NR液を超音波処理した後、(UV照射強度以上400mWのがmに∙-2 254nmで)30分間、UV光で滅菌する。
2. NG108-15神経細胞ラインの文化と分化
- 細胞培養培地は、無菌のダルベッコ改変イーグル培地(DMEM)を500mlの10%(w / v)のウシ胎児血清(FCS)、L-グルタミン(w / vの)1%、1%の準備(w / v)のペニシリン/ストレプトマイシンおよび0.5%(w / v)のアンホテリシンB
注:サプリメントは、-20℃で保存し、等分し、必要な日に培地に添加することができる。細胞培養培地は、1ヶ月の最大のために無菌状態で冷蔵することができる。 - 細胞分化培地は、1%を含む滅菌DMEMを50mlを調製L-グルタミン、1%(w / v)のペニシリン/ストレプトマイシンおよび0.5%(w / v)のアンホテリシンB(w / v)の
- (37℃、5%CO 2)で加湿雰囲気のインキュベーター中でポリスチレン製のT75フラスコに細胞培養培地10ml中NG108-15神経細胞を成長させる。通常は、3〜4日で準備ができて、各フラスコに1.5〜2×10 5細胞を播種。 2日毎に細胞培養培地を変える。
注:遺伝的ドリフトまたは変動を防ぐために、実験のために通路21より古い細胞を使用しないでください。 - 培養液中の場合には70〜80%コンフルエント、暖かい新鮮な細胞培養培地に培地を変更します。機械的に優しく石油公社によって細胞を切り離す王コンフルエントのフラスコの底に。トリプシンを使用しないでください。
- 遠心分離機600×gで5分間、細胞懸濁液と温かい細胞分化培地2mlで再懸濁細胞ペレット。
- 種子細胞分化培地200μlで組織培養ポリスチレン96ウェルプレート中で2×10 4細胞/ cm 2。 5%CO 2/37℃で1日の実験をインキュベートする。
- 3.2×10 9の間で-4.2×1 0 10日2上のAu NR液の粒子/ mlを追加し、さらに24時間のためにそれをインキュベートする。対照実験用粒子を追加しないでください。
注:別の対照として、高分化型のピーク吸収波長のAu NPは、比較目的の14のために使用することができる。より一貫性の細胞の挙動については、一定の細胞密度を維持し、細胞播種前のウェル表面を変更しないでください。
3.神経突起伸長強化
- カップルシングルモード光ファイバ(開口数= 0.13)を有するレーザとファイバコネクタ(FCコネクタが便利で一般に入手可能である)でそれを終了する。標準的な電力計で出力レーザパワーを測定する。最も効果的な結果を得るために、NRののプラズモン共鳴ピークのレーザーのピーク波長に一致する。
- NRのインキュベーション後の3日目に、ウェルにFCコネクタを修正。異なるレーザパワーのために、連続波で1分間RTでサンプルとコントロールを照射する。培養は、5%CO 2/37℃で3追加日間進行できるようにします。 3つの独立した測定値の最低レーザー照射を繰り返します。
注:異なる照射時間とパルス周波数は、用途に応じて、選択することができる。 - (W∙cm -2で)ビーム径とレーザ放射の観点からレーザーを特徴付ける。
- 標準のシングルモードファイバの場合は、NA = N∙罪θを使用するnが使用されている媒体の屈折率であり、θは 、ファイバを出る光の円錐の半角である( 図1Aを参照)。 rはビーム半径である三角法で、r =日焼けθ∙d及びdからの繊維とサンプルとの間の距離である。 FCコネクタは、したがって、距離dにおけるサンプル= 2.70±0.20ミリメートルを照らす、ウェルの直径と一致する。ライトは、r =日焼け(SIN-1(NA / n)を )を与える、水に繊維を抜けた(n = 1.33)dは ∙。
- 後者の式を使用して、ターゲットにレーザービーム半径、対応するビーム面積と平均レーザー放射照度(ビーム面積で割ったレーザパワー)を計算する( 図1Bの例のグラフを参照)。これらの値は、照射された領域での平均放射照度を表す。
- エラー伝播の一般理論と測定のためのエラーを評価します。
注:距離between FCコネクタおよびサンプルは、適切なソフトウェア(ImageJの)を使用して、画像の実験装置と後処理の写真により測定することができる。
- 5日目に、実験から細胞分化培地を除去し、3.7%10分間(v / v)のホルムアルデヒド溶液で試料を固定し、その後0.1%20分間(v / v)のトリトンX-100で細胞を透過。
- 結合部位は、未反応のタンパク質をブロックするために60分間サンプルに3%(w / v)のウシ血清アルブミン(BSA)を加える。 4℃で(PBS中5μg/ mlのBSAの1%を補足した)抗βIIIチューブリン一晩のための試料にラベルを付けます。
- PBS中の1%BSAで0.4〜2μg/ mlの濃度を使用して( 例えば、TRITC結合抗マウスIgG抗体)は、適切な二次抗体を用いて、暗所で90分間、細胞をインキュベートする。 10分間DAPI(0.1 / mlの中で脱イオン水)で細胞核にラベルを付けます。
(注)抗体共役および濃度MIGhtは、会社のプロトコルに従って変化する。各染色段階後5分間二回PBSで洗浄サンプル。
- 少なくとも20×対物レンズを使用して落射蛍光または共焦点顕微鏡による画像サンプル。顕微鏡を選択して、二次抗体に応じてフィルタリングします。 DAPIフィルターを選択(λEX = 358 nmのを、λEMは 488 nmの=)を細胞核を可視化する。
- 評価することにより、画像を分析した:i)最大の神経突起の長さ(レコード細胞体の最初に神経突起の先端からの長さ)と、ii)神経細胞あたりの神経突起の数()は、細胞当たりの神経突起のすべてを総括およびiii)神経突起を有する細胞のパーセンテージ(陽性に染色された核を有する細胞の総数)19によってβIIIチューブリンを発現する細胞の総数を分割する。
4.細胞内Ca 2+イメージングをレーザ誘起
- 無水ジメチルスルホキシド(DMSO)10ml中の溶質2gを溶解することによりプルロニックF-127の20%(w / v)のストック溶液を調製する。溶解性を増加させるために、約20分間40℃でプルロニックF-127の溶液を加熱する。 RTで保存した場合、事前に準備をします。
- NRインキュベーション後3日目に、平衡塩類溶液(BSS; 135ミリモルのNaCl、4.5のKCl、1.5のCaCl 2、0.5のMgCl 2、5.6 mMグルコース、および10mM HEPES、pH7.4)で調製し、5でそれを補ったDMSO中のFluo-4 AMおよび0.1%のμM(w / v)のプルロニックF-127の溶液。
注:BSS溶液を予め調製し、1ヶ月の最大冷蔵することができる。実験の日にサプリメント(のFluo-4 AMとプルロニックF-127)を追加します。 - 細胞分化培地を除去し、補足しBSSソリューションと交換してください。倒立共焦点顕微鏡で最良の結果を得るためには、ウェルのマイクロスライドで細胞を培養する。
- 負荷のFluo-4 AMとNG108-15細胞5%CO 2/37℃、暗所で30分間インキュベートした。インキュベーション時間の後、すべての細胞外のアンロードされた蛍光団を削除するには、BSSで二回のサンプルを洗う。
- カップルレーザーシングルモード光ファイバとし、標準的な技術を用いて、先端を切断する。 ( すなわち先端が顕微鏡検査の際に繊維軸に垂直と平らにしてください)高品質な表面を確保するために、光学顕微鏡下で生じた先端を観察します。
- 標準的な電力計で出力レーザパワーを測定する。光ファイバホルダに光送出ファイバを挿入し、マイクロポジショナーにそれを貼り付けます。光ファイバの準備とポジショニングの詳細については、Brown ら 20を参照してください。
注意:( たとえば、他のラボのユーザーに迷光の露出を防ぐ、取り扱い時にレーザー安全ゴーグルを着用し、レーザー光を直視しないでください)レーザパワーの測定中にレーザーの安全のための一般的なルールに従ってください<。/ LI>
- 標準的な電力計で出力レーザパワーを測定する。光ファイバホルダに光送出ファイバを挿入し、マイクロポジショナーにそれを貼り付けます。光ファイバの準備とポジショニングの詳細については、Brown ら 20を参照してください。
- 光変調を監視するために携帯用のレーザーにオシロスコープを接続します。可変周波数(0.5〜2ヘルツ)とパルス長(20〜100ミリ秒)でバイナリ信号を使用してください。 Paviolo ら 13に示す設定に従って、顕微鏡用トランジスタ-トランジスタロジック(TTL)などの変調信号を用いてレーザ入力を接続する。
- 倒立共焦点顕微鏡下で細胞を置き、250±50ミクロン離れて透過照明モードでの標的細胞からの光送出ファイバを配置。この距離では、ターゲットでのビーム半径を計算するために3.3.1で提示の式を使用しています。
- 内部化のFluo-4 AM色素を励起するアルゴンイオンレーザー(488 nm)を使用します(λEX = 494nmで、λEMは 516ナノメートル=)とエンドサイトーシスのNRの励起のための同期化されたLDを。時系列スキャンを収集することにより、少なくとも40倍の対物レンズを用いて試料および対照のRTでの撮像を行う256×256ピクセル/少なくとも4ヘルツの周波数で往復モードのフレームの解像度を持つ。任意のアルゴンイオンレーザー干渉(ベースラインノイズ)を識別するための、LD励起せずに記録を行う。
- 適応的に加重処罰最小二乗アルゴリズム21を使用してデータから背景を削除します。時間の関数として誘発されたCa 2+の変化をプロットします。レベルのベースラインノイズ(3σ)の標準偏差の3倍を閾値化することにより画像後処理ソフトウェアを使用して蛍光強度の過渡的なピークを分析する。
結果
ここで説明するプロトコル1,2、および3を用いて、分化刺激効果は、AuのNPと共に培養NG108-15神経細胞で観察されたレーザー後(金NRは、ポリ(スチレンスルホン酸)のAuのNRおよびシリカ被覆金のNRをコーティングさ) 1.25と7.5 Wとのエクスポージャー·cm -2で。 rhodamineB標識金のNRの共焦点画像は、粒子が、インキュベーション12の1日目から内部移行したことを示した。局在化は主に摂取の好ましい機構は、細胞体膜12を介してであったことを示し、細胞質で観察された。 NG108-15神経細胞に分化誘導後に検出された主な形態学的変化は、増殖の停止、βIIIチューブリンタンパク質の発現と最大長さと数22の条件で分析した神経突起の伸長であった。
のNRを用いて培養した試料は、レーザirradiにおける神経突起の長さの増加を示したここで測定ンスレベル(1.25と7.5 Wの間·cm -2で)。 (NPをなしで培養し、同じレーザパワーで照射した細胞)コントロールサンプルの長さに有意な変化を示さなかった。 7.5 W·cm -2で、金のNRと共に培養NG108-15の最終的な神経突起の長さの照射線量を使用すると、非レーザー照射試料よりもおよそ36%高いた(p <0.01)であった。この動作は、具体的のNRの表面化学にリンクされていませんでした。これらの値は、単独で-15 NG108によって開発され、レーザー露光した(p <0.05)12の同じ値にさらされる神経突起よりも約20%大きかった。これらの結果は、超音波照射7圧電ナノチューブを用いて培養し、照射PC12神経細胞上の以前に発表された研究に沿ったものである。
金のNRない対照実験はまた、神経突起と数neとニューロンの割合の観点から780nmの光のいくつかの刺激効果を示したニューロンあたりurites。この刺激は、低いレーザパワー(1.25 W∙cm -2で)最も高いレーザーエネルギー(7.5 W∙cm -2で)12時以降の減少とでより効果的であった。いずれのレーザー照射なしでのNPに起因する適度な刺激(ポリ(スチレンスルホネート)がコーティングさとシリカ被覆のみ)は、神経突起12を持つニューロンの割合で検出された。これらの結果は、金ナノ粒子は、インビトロ 23,24 におけるニューロン活性を増加させることができることが最近発表さ所見と一致している。 図2を参照には、単独で培養し、分化NG108-15神経細胞( 図2A)または金のNRとの落射蛍光画像の例( 図2Bを示しています)と、図に示す異なるレーザパワー()を照射した。
光生成された細胞内Ca 2+放出の可能性がプロトコール1、2に従ってパルスNIR光を用いて評価し、した前記カルシウムイオンは、有糸分裂、筋収縮および突起伸長25,26などの異なる細胞活性において重要な役割を果たしている。刺激に応答して、Ca 2+の増加は 、特定の細胞機能の活性化、調節または終了に至る、振動すると減少する。最近のCa 2+トランジェントはまた、心筋細胞におけるIRレーザー露光の結果として観察されている。 IR曝露は自発的なのCa 2+トランジェント2より低い振幅と高速なリカバリ時間を示した後に、その作業では、Ca 2+の応答が誘発。 図3は NG108-15神経細胞のFluo-4 AMを負荷し、で画像化の例を示してい共焦点顕微鏡。のFluo-4 AMは細胞質全体でインジケータのほぼ均一な分布をもたらす、非破壊的な方法で細胞膜に入ることが観察された。わずかな核や細胞質の細胞小器官の染色が検出されました。前述したように、NRは細胞内には12に配置されることが期待された。 JがCM∙0.07の間NG108-15単独の神経細胞やAuのNRおよびポリ(スチレンスルホン酸)を用いて培養コーティングさ-金NRは、レーザー放射照度にその後暴露した-2と370 Jの範囲で変調されたレーザの周波数で、cm -2での ∙ 0.5〜2ヘルツの。
図4は、応答の振幅が時間の関数としてマッピングされた方法の代表的な例を示している。放射露光( 図4A - C)に変化したCa 2+応答の振幅ではなく観察されたが、一貫してレーザパルス( 図4C)13によってトリガされる。最も可能性の高い説明が不完全なのCa 2+ロード2または神経細胞中のNRの内在化の異なる効率に起因する細胞内Ca 2+ストアの一過性の枯渇した。 NRははculturで使用されなかった場合には電子(対照実験、 図4D)、780 nmの光の刺激効果も観察された。しかし、これはより低い蛍光振幅ピーク及び(分析された試料のわずか16%において検出される)の活性化のより低い確率を生成した。全体的に、NRレーザー誘導性の細胞活性化の48%の確率で達成されたとにより780nmの光に対するバックグラウンド事象にもかかわらず、NR処理細胞の曝露は、より低いレーザエネルギーおよび応答13のより高いピークがより高い刺激効率を示した。実際には、カルシウム応答は0.33 J∙cm -2のNR処理細胞におけるピークに見出された。これは、熱抑制13に起因するものであった。実験中、ブレブ形成、または細胞膜破壊の任意の他の形態の証拠は19 W∙cmの比較的高い電力密度で細胞の光破壊を報告するHuang らの結果と一致して、検出されなかった-2 4に適用2分7。NR処理細胞における自発的な活動は、レーザー露光せずに記録されなかった。

図1:光ファイバ実験(A)と、平均レーザー放射照度領域のレーザー光に対するレーザーパワーの関数としては0.4mmで、図2(B)に等しい。ビームパラメータは、(A)繊維(θ)、ビーム半径(r)と光ファイバと、サンプル(d)の間の距離を出る光の最大円錐の半角。
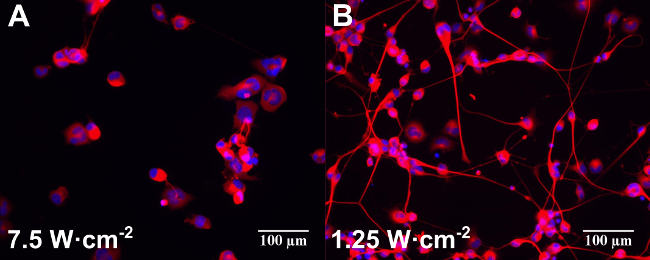
図2:単独で培養した分化したNG108-15神経細胞(A)の落射蛍光画像の例、または金のNR(B)とし、(図に示す)は、異なるレーザパワーを照射する。サンプルは私だったレーザー照射の前に一日ncubated。細胞を固定し、三日レーザー照射後の抗β-IIIチューブリン(赤)およびDAPI(青色)のために標識した。スケールバーは100μmである。

図3:FLUO4-AMのCa 2+インジケーターを搭載し、分化NG108-15神経細胞の例は、イメージが40X油浸対物レンズとの倒立共焦点顕微鏡を用いて撮影した。
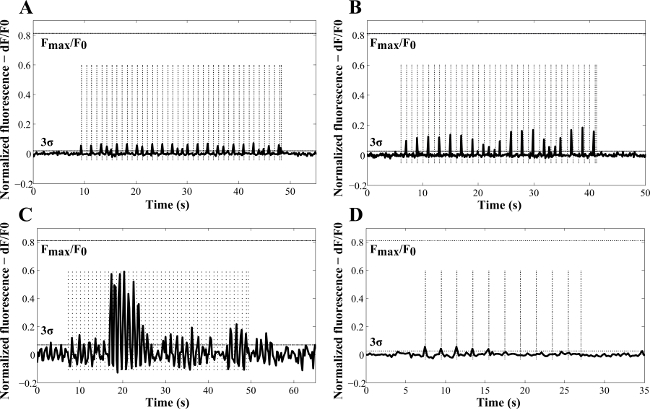
図4(A)は、ポリ(スチレンスルホン酸)-AuのNRは、(B、C)で3日間、無血清条件下で培養されたNG108-15神経細胞における時間の関数としてのレーザー誘発Ca 2+の変化の代表例NRはせずに金のNR、及び(D)(対照試料)。これらの結果であった100ミリ秒(A、C、D)と、50ミリ秒(B)のレーザパルスを用いて得られる。 ( - C A)および0.5 Hzの(D)の実験(縦の破線)に使用される周波数は1Hzであった。計算された放射エクスポージャーはcm -2で(A)、34.7 Jが∙Jが∙69.4だったcm -2で(B)、0.37 J∙cm -2で(C)と138.87 J∙cm -2で(D)。 F MAX / F 0は、イオノマイシンでキャリブレーションからNG108 -15神経細胞で検出された最大蛍光増加、(許可13を得て複製)を示している。
ディスカッション
このプレゼンテーションで概説プロトコルは文化に、差別化と光学的に外因性の吸収を使用して神経細胞を刺激する方法を説明します。 NR特性( 例えば、寸法、形状、プラズモン共鳴波長および表面化学)及び( 等波長、パルス長、繰り返し率、等)、レーザー刺激パラメータは、異なる実験的なニーズに合うように変えることができる。細胞の挙動に対する効果は、標準的な生物学的アッセイおよび材料を用いてモニターすることができる。全体的なアプローチは、 インビトロで細胞集団を照射するためのシンプルかつ強力な、方法を提供し、一次細胞、組織試料およびインビボ研究に拡張することができる。
金のNRの生物学的用途のために使用することが満たす必要がある主な要件は、安定性(化学的および物理的の両方)および生体適合性である。後者により、カチオン性界面活性剤(一般的に存在するため、特に重要である金の表面上のLY CTAB)。 CTABは、インビトロ28およびインビボ29の両方で細胞毒性を誘導することが知られており、一般NR-形状形成30を駆動するための合成プロセスの間に使用される。安定性および生体適合性は、多くの場合( 例えば 、ポリエチレングリコール、シリカ)31金NR表面上に追加のコーティングを堆積させることによって改善される。組織学的分析は、多くの場合、組織実験7,8,12,15の間に行われている間、生体適合性を評価するために、別のアッセイは、インビトロで ( 例えば、生/死、MTS、MTTなど)を使用することができる。
ナノ材料で作業するときに直面するもう1つの課題は、正しくそれらのモル濃度を測定するのが困難なことである。形状、大きさ、及び化学的性質の点でのNPの巨大な様々な粒子のみ特定のクラスのための適切な技術は、現在利用可能にする。たとえば、標準の動的光scattメソッドをeringすることはNPが球状と散乱光等方的に17を持っていることを前提としています。したがって、測定された濃度と実際の1の間の不一致中のAuのNR結果にこの方法を適用する。投与濃度は正確に(薬物送達用途のための例 )プロセスの有効性を最大化し、ナノ材料17の毒性を最小限にするために制御する必要がナノ医療の分野に関連する場合NP濃度の問題は、特に問題である。ここで報告された研究では、使用される光学濃度は、細胞生存率および粒子数の点で良好な結果を与えた。
それらの固有の吸収特性にはAu NPは、多くの場合、レーザ源と組み合わせて使用される。露光中に、吸収及び散乱がNPの表面で発生する可能性が二つの主なプロセスである。多くの場合、レーザー波長はプラズモン共鳴波長と一致する場合、吸収NP面での刺激的な伝導電子、散乱に優先するものとします。これらは、その平衡位置から離れると、共振コヒーレント振動の局在表面プラズモン共鳴(LSPR)と呼ば作成する電子ガスを形成する。エネルギーは、その後、周囲環境32へと急速に放散される熱のようなNPの結晶格子に転送される。熱はNR LSPRの励起後に観察された主な効果であるので、レーザー露光した後、細胞生存率を監視することが望ましい。
これは、神経突起伸長と細胞内Ca 2+経路上の観察された効果は、LSPRの励起から生じる過渡的な加熱によるものであったという仮説が立てられている。この仮説は、フェライトのNP 5の磁気曝露後の温度感受性TRPV1チャンネルの活性化と一致している。このプロセスはまた、観測感熱TRPV4チャンネルナンプラーと一致しているY赤外線神経刺激33において重要な役割。分子レベルでは、それは最近、TRPV4だけチャネル34とホスホイノシチド-4,5- -biphosphate(PIP 2)の相互作用の後に感熱性であることが示されている。したがって、NR励起後に生じる過渡的な加熱が加速し、及び/又はTRPV4チャネルの開口を誘導するのに役立つ可能性がある。この仮説は、Ca 2+を使用して、将来のCa 2+の実験により確認することができる- PIP 2枯渇超える血清培地および/ または分子を制御する。
異なるグループには、生理的温度範囲にわたって小さな温度勾配は、ニューロンの成長円錐のような他の応答25を案内またはヒト胚腎臓細胞35内の電流の脱分極を誘導するために使用され得ることを実証した。龍と共同研究者らは、一次聴覚神経細胞のカルトにおける電気信号活性の有意な増加を記録しLSPRでのNRのレーザー照射後のシリカ被覆金のNRと測定しまし。レーザ照射粒子によって生成加熱は、パッチクランプ法14を用いて測定した。より最近では、オムら連続してラット坐骨神経15の神経束のシース付近で灌流したとき3.4×10 9のAuのNRのレーザー露光した後CNAPSの振幅の増加を記録した。
これは、780nmで36無視できることが知られているように、実験中に観察された780nmのレーザダイオードの刺激効果は、水の吸収により発生する熱にリンクされなかった。以前に公表された結果はまた、 インビボ 37,38 における神経組織に780nmの光の刺激効果を報告している。in vitro試験は、プロセス39中の反応性酸素種の関与を実証した。しかし、詳細なメカニズムはこれによりNIR刺激遺伝子transcriptioに影響を与えるNおよび他の細胞の活動は、現在未解決である。現在のデータは、ミトコンドリアにおける発色団内の光子吸収(780 nmでのエネルギーのほぼ50%は、シトクロムcオキシダーゼによって吸収される場合があります)37,39-41、カルシウムに対する膜透過性の変化を含む刺激で異なる効果、の相互作用を示唆している細胞における37炎症活性の阻害37。
この原稿に示す結果は、ナノ粒子の吸収剤は、神経細胞の光刺激における将来のアプリケーションのための偉大な約束を保持することを示している。主な利点は、組織内に(治療ウインドウを)深く浸透するNIR光の能力にある。これらの結果は、ナノ粒子吸収剤増強および/または水の吸収に基づいて赤外線神経刺激のプロセスを置き換えることができることを示している。神経補綴における将来の応用のためには、異なる表面functionalizatを調査することは興味深いであろう多くの光刺激アプリケーションのための主なターゲットである神経細胞の軸索、の化学親和性を有するイオン。
開示事項
The authors have no competing interests to disclose.
謝辞
著者は、部分的に撮影中に彼女の助けのためにシェフィールドさんとJaimeeメインの大学でこの研究を主催したための旅行資金援助と教授ジョン·ヘイコック用NanoVenturesオーストラリアを承認したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Au NR | Sigma Aldrich | 716812 | |
| NG108-15 | Sigma Aldrich | 8811230 | |
| DMEM | Sigma Aldrich | D6546 | |
| FCS | Life Technologies | 10100147 | |
| L-glutamine | Sigma Aldrich | G7513 | |
| Penicillin/streptomycin | Life Technologies | 15140122 | |
| Amphotericin B | Life Technologies | 15290018 | |
| Formaldehyde | Sigma Aldrich | F8775 | |
| Triton X-100 | BDH | T8532 | |
| BSA | Sigma Aldrich | A2058 | |
| Anti-βIII-tubulin | Promega | G7121 | |
| TRITC-conjugated anti-mouse IgG antibody | Sigma Aldrich | T5393 | |
| DAPI | Invitrogen | D1306 | |
| Fluo-4 AM | Invitrogen | F14201 | |
| DMSO | Sigma Aldrich | 472301 | |
| Pluronic F-127 | Invitrogen | P6867 | |
| UV-Vis spectrometer | Varian Medical Systems Inc. | Cary 50 Bio | |
| Mini centrifuge | Eppendorf | Mini Spin | |
| Sonic bath | Unisonics Australia | FPX 10D | |
| Cell culture incubator | Kendro | Hera Cell 150 | |
| Cell culture centrifuge | Hettich | Rotofix 32A | |
| Laser diode | Optotech | 780 nm single mode fibre - coupled LD | |
| Optical fiber | Thorlabs | 780 HP | |
| Power meter | Coherent | Laser Check | |
| ImageJ | http://rsb.info.nih.gov/ij/index.html | ||
| Epifluorescent microscope | Axon Instruments | ImageX-press 5000A | |
| μ-slide well | Ibidi | 80826 | |
| Inverted confocal microscope | Carl Zeiss Microscopy Ltd. | LSM 510 meta-confocal microscope | |
| Oscilloscope | Tektronix | TDS210 |
参考文献
- Richter, C. P., Matic, A. I., Wells, J. D., Jansen, E. D., Walsh, J. T. Neural stimulation with optical radiation. Laser. Photonics Rev. 5 (1), 68-80 (2011).
- Dittami, G. M., Rajguru, S. M., Lasher, R. A., Hitchcock, R. W., Rabbitt, R. D. Intracellular calcium transients evoked by pulsed infrared radiation in neonatal cardiomyocytes. J. Physiol. 589 (6), 1295-1306 (2011).
- Thompson, A. C., Wade, S. A., Brown, W. G. A., Stoddart, P. R. Modeling of light absorption in tissue during infrared neural stimulation. J. Biomed. Opt. 17 (7), 075002-075002 (2012).
- Thompson, A. C., Wade, S. A., Cadusch, P. J., Brown, W. G., Stoddart, P. R. Modeling of the temporal effects of heating during infrared neural stimulation. J. Biomed. Opt. 18 (3), 035004 (2013).
- Huang, H., Delikanli, S., Zeng, H., Ferkey, D. M., Pralle, A. Remote control of ion channels and neurons through magnetic-field heating of nanoparticles. Nat. Nanotechnol. 5 (8), 602-606 (2010).
- Farah, N., et al. Holographically patterned activation using photo-absorber induced neural-thermal stimulation. J. Neural. Eng. 10 (5), (2013).
- Ciofani, G., et al. Enhancement of neurite outgrowth in neuronal-like cells following boron nitride nanotube-mediated stimulation. ACS Nano. 4 (10), 6267-6277 (2010).
- Kim, J. A., et al. Enhancement of neurite outgrowth in PC12 cells by iron oxide nanoparticles. Biomaterials. 32 (11), 2871-2877 (2011).
- Myroshnychenko, V., et al. Modelling the optical response of gold nanoparticles. Chem. Soc. Rev. 37 (9), 1792-1805 (2008).
- Choi, W. I., Sahu, A., Kim, Y. H., Tae, G. Photothermal cancer therapy and imaging based on gold nanorods. Ann. Biomed. Eng. 40 (2), 534-546 (2011).
- Zhan, Q., Qian, J., Li, X., He, S. A study of mesoporous silica-encapsulated gold nanorods as enhanced light scattering probes for cancer cell imaging. Nanotechnology. 21 (5), 055704 (2010).
- Paviolo, C., et al. Laser exposure of gold nanorods can increase neuronal cell outgrowth. Biotechnol. Bioeng. 110 (8), 2277-2291 (2013).
- Paviolo, C., Haycock, J. W., Cadusch, P. J., McArthur, S. L., Stoddart, P. R. Laser exposure of gold nanorods can induce intracellular calcium transients. J. Biophotonics. 7 (10), 761-765 (2014).
- Yong, J., et al. Gold-nanorod-assisted near-infrared stimulation of primary auditory neurons. Adv. Healthcare Mater. , (2014).
- Eom, K., et al. Enhanced infrared neural stimulation using localized surface plasmon resonance of gold nanorods. Small. , (2014).
- Juste, J., Pastoriza-Santos, I., Liz-Marzán, L. M., Mulvaney, P. Gold nanorods: Synthesis, characterization and applications. Coordination Chemistry Reviews. (17-18), 1870-1901 (2005).
- Shang, J., Gao, X. Nanoparticle counting: towards accurate determination of the molar concentration. Chem. Soc. Rev. 43 (21), 7267-7278 (2014).
- Sharma, V., Park, K., Srinivasarao, M. Shape separation of gold nanorods using centrifugation. Proc. Natl. Acad. Sci. 106 (13), 4981-4985 (2009).
- Kaewkhaw, R., Scutt, A. M., Haycock, J. W. Anatomical site influences the differentiation of adipose-derived stem cells for schwann-cell phenotype and function. Glia. 59 (5), 734-749 (2011).
- Brown, W. G. A., Needham, K., Nayagam, B. A., Stoddart, P. R. Whole cell patch clamp for investigating the mechanisms of infrared neural stimulation. JoVE. (77), (2013).
- Cadusch, P. J., Hlaing, M. M., Wade, S. A., McArthur, S. L., Stoddart, P. R. Improved methods for fluorescence background subtraction from Raman spectra. J. Raman Spectrosc. 44 (11), 1587-1595 (2013).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Jung, S., et al. Intracellular gold nanoparticles increase neuronal excitability and aggravate seizure activity in the mouse brain. PLoS ONE. 9 (3), e91360 (2014).
- Salinas, K., Kereselidze, Z., DeLuna, F., Peralta, X., Santamaria, F. Transient extracellular application of gold nanostars increases hippocampal neuronal activity. J. Nanobiotechnology. 12 (1), 31 (2014).
- Ebbesen, C. L., Bruus, H. Analysis of laser-induced heating in optical neuronal guidance. J. Neurosci. Meth. 209 (1), 168-177 (2012).
- Iwanaga, S., et al. Location-dependent photogeneration of calcium waves in HeLa cells. Cell Biochem. Biophys. 45 (2), 167-176 (2006).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Determination of the minimum temperature required for selective photothermal destruction of cancer cells with the use of immunotargeted gold nanoparticles. Photochem. Photobiol. 82 (2), 412-417 (2006).
- Connor, E. E., Mwamuka, J., Gole, A., Murphy, C. J., Wyatt, M. D. Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity. Small. 1 (3), 325-327 (2005).
- Isomaa, B., Reuter, J., Djupsund, B. M. The subacute and chronic toxicity of cetyltrimethylammonium bromide (CTAB), a cationic surfactant, in the rat. Arch. Toxicol. 35 (2), 91-96 (1976).
- Juste, J., Pastoriza-Santos, I., Liz-Marzán, L., Mulvaney, P. Gold nanorods: synthesis, characterization and applications. Coord. Chem. Rev. 249 (17-18), 1870-1901 (2005).
- Dreaden, E. C., Alkilany, A. M., Huang, X., Murphy, C. J., El-Sayed, M. A. The golden age: gold nanoparticles for biomedicine. Chem. Soc. Rev. 41 (7), 2740-2779 (2012).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Plasmonic photothermal therapy (PPTT) using gold nanoparticles. Lasers Med. Sci. 23 (3), 217-228 (2008).
- Albert, E. S., et al. TRPV4 channels mediate the infrared laser-evoked response in sensory neurons. J. Neurophysiol. 107 (12), 3227-3234 (2012).
- Garcia-Elias, A., et al. Phosphatidylinositol-4,5-biphosphate-dependent rearrangement of TRPV4 cytosolic tails enables channel activation by physiological stimuli. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9553-9558 (2013).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. -. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nat. Commun. 3 (736), (2012).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Müller, G. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J. Biomed. Opt. 4 (1), 36-46 (1999).
- Byrnes, K. R., et al. Light promotes regeneration and functional recovery and alters the immune response after spinal cord injury. Lasers Surg. Med. 36 (3), 171-185 (2005).
- Wu, X., et al. 810 nm wavelength light: an effective therapy for transected or contused rat spinal cord. Lasers Surg. Med. 41 (1), 36-41 (2009).
- Grossman, N., Schneid, N., Reuveni, H., Halevy, S., Lubart, R. 780 nm low power diode laser irradiation stimulates proliferation of keratinocyte cultures: involvement of reactive oxygen species. Lasers Surg. Med. 22 (4), 212-218 (1998).
- Wong-Riley, M. T. T., et al. Photobiomodulation directly benefits primary neurons functionally inactivated by toxins - Role of cytochrome c oxidase. J. Biol. Chem. 280 (6), 4761-4771 (2005).
- Beauvoit, B., Kitai, T., Chance, B. Contribution of the mitochondrial compartment to the optical properties pf the rat liver: a theoretical and practical approach. Biophys. J. 67 (6), 2501-2510 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved