Method Article
Oro nanorod-assistito stimolazione ottica di cellule neuronali
In questo articolo
Riepilogo
This protocol outlines how to use the transient heating associated with the optical absorption of gold nanorods to stimulate differentiation and intracellular calcium activity in neuronal cells. These results potentially open up new applications in neural prostheses and fundamental studies in neuroscience.
Abstract
Recent studies have demonstrated that nerves can be stimulated in a variety of ways by the transient heating associated with the absorption of infrared light by water in neuronal tissue. This technique holds great potential for replacing or complementing standard stimulation techniques, due to the potential for increased localization of the stimulus and minimization of mechanical contact with the tissue. However, optical approaches are limited by the inability of visible light to penetrate deep into tissues. Moreover, thermal modelling suggests that cumulative heating effects might be potentially hazardous when multiple stimulus sites or high laser repetition rates are used. The protocol outlined below describes an enhanced approach to the infrared stimulation of neuronal cells. The underlying mechanism is based on the transient heating associated with the optical absorption of gold nanorods, which can cause triggering of neuronal cell differentiation and increased levels of intracellular calcium activity. These results demonstrate that nanoparticle absorbers can enhance and/or replace the process of infrared neural stimulation based on water absorption, with potential for future applications in neural prostheses and cell therapies.
Introduzione
Recenti studi hanno dimostrato che il riscaldamento transitoria associata con l'assorbimento di luce infrarossa da acqua (lunghezza d'onda> 1.400 nm) può essere utilizzato per indurre potenziali di azione nel tessuto nervoso 1 e transienti di calcio intracellulare in cardiomiociti 2. L'uso di luce infrarossa ha suscitato notevole interesse per applicazioni in protesi neurali, a causa della potenziale risoluzione spaziale più fine, di un contatto diretto con il tessuto, la minimizzazione degli artefatti di stimolazione, e la rimozione della necessità di modificare geneticamente le cellule prima della stimolazione ( come richiesto in optogenetics) 1. Nonostante tutti questi vantaggi, modelli termici recentemente sviluppati suggerito che i destinatari dei tessuti / cellule possono essere influenzati da effetti di riscaldamento cumulativi, quando più siti di stimolo e / o alti tassi di ripetizione sono utilizzati 3,4.
In risposta a queste sfide, i ricercatori hanno riconosciuto il potenziale di utilizzare absor estrinsecabri per la stimolazione del nervo a produrre effetti di riscaldamento più localizzati nel tessuto. Huang et al. Ha dimostrato questo principio usando nanoparticelle di ferrite superparamagnetiche per attivare da remoto i canali TRPV1 sensibili alla temperatura in HEK 293 cellule con una radio-frequenza di campo magnetico 5. Sebbene questa tecnica può consentire una penetrazione più profonda (campi magnetici relativamente interagiscono debolmente con tessuto), le risposte sono state registrate solo su periodi di secondi, piuttosto che le durate di millisecondi richiesti dispositivi bionici 5. Allo stesso modo, Farah et al. Stimolazione elettrica dimostrato di neuroni corticali di ratto con neri micro particelle in vitro. Hanno mostrato di precisione a livello di cella nella stimolazione con durate di impulso dell'ordine di centinaia di ms ed energie nella gamma di μJ, potenzialmente permette tassi di ripetizione più veloce 6.
L'uso di assorbitori estrinseci è stata applicata anche per indurrecambiamenti morfologici in vitro. Ciofani et al. Hanno evidenziato un aumento del ~ 40% nella crescita neuronale utilizzando piezoelettrici boro nitruro nanotubi eccitato da ultrasuoni 7. Analogamente, ferro endocitosi nanoparticelle di ossido in cellule PC12 sono stati riportati per migliorare la differenziazione dei neuriti in modo dose-dipendente, causa l'attivazione di molecole di adesione delle cellule con l'ossido di ferro 8.
Recentemente, l'interesse assorbitori estrinseci per assistere stimolazione neurale è anche concentrato sull'uso di nanoparticelle di oro (Au NP). Au NP hanno la capacità di assorbire efficacemente luce laser al picco plasmonica e dissiparlo nell'ambiente circostante nella forma di calore 9. Tra tutte le forme di particelle disponibili, l'assorbimento ottico di nanotubi d'oro (Au NR) corrisponde comodamente la finestra terapeutica di tessuti biologici (vicino infrarosso - NIR, lunghezza d'onda tra 750-1,400 nm) 10. Inoltre, nel context di stimolazione neurale, l'uso di Au NR offre biocompatibilità relativamente favorevole e una vasta gamma di opzioni di funzionalizzazione superficiale 11. Recenti studi hanno dimostrato che un effetto stimolante sulla differenziazione può essere indotta dopo esposizione laser continue di Au NR in NG108-15 cellule neuronali 12. Allo stesso modo, transienti intracellulari di calcio sono stati registrati in cellule neuronali coltivate con Au NRs dopo irradiazione laser modulato con frequenze variabili e lunghezze di impulso 13. Membrana cellulare depolarizzazione si è registrato anche dopo l'illuminazione laser NIR di Au NRs in colture primarie di neuroni gangliari spirale 14. La prima applicazione in vivo con irradiato Au NR è stata dimostrata solo di recente. EOM e collaboratori esposti Au NRs al loro picco plasmonica e hanno registrato un aumento di sei volte in ampiezza dei potenziali d'azione del nervo composto (CNaPS) e una diminuzione di tre volte nella soglia di stimolazione in ratti nervi sciatico. L'enrisposta ampliate è stato attribuito a effetti di riscaldamento locali derivanti dalla eccitazione del NR picco plasmonica 15.
Nel presente lavoro, vengono specificati protocolli per studiare gli effetti della stimolazione laser a NG108-15 cellule neuronali coltivate con Au NR. Questi metodi forniscono una semplice, ma potente, modo di irradiare popolazioni cellulari in vitro usando tecniche biologiche standard e materiali. Il protocollo si basa su un diodo laser accoppiato in fibra (LD) che permette un funzionamento sicuro e ripetibile allineamento. La preparazione del campione e laser metodi di irraggiamento Au NR possono essere ulteriormente estesi a diverse forme di particelle e colture cellulari neuronali, a condizione che si conoscono, rispettivamente, i protocolli di sintesi e di cultura specifica.
Protocollo
1. Au NR Preparazione
Nota: Au NR può essere sintetizzato da un numero di ricette 16, o acquistati da fornitori commerciali.
- Misurare la densità ottica iniziale (OD) della soluzione Au NR tramite spettroscopia UV-Vis, registrando i valori di assorbimento da 300 nm a 1000 nm con una risoluzione di 0,5-2 nm. Variare il volume della soluzione da usare con la cuvetta disponibili.
- Valutare la concentrazione iniziale NP molare con una tecnica 17 Ideale (ad esempio la spettroscopia UV-Vis, singola particella ICP-MS, microscopia elettronica a trasmissione) o utilizzare i valori di concentrazione forniti dal venditore.
- Preparare una soluzione madre 5 ml diluendo il campione iniziale Au NR raggiungere un OD = 1. Per una migliore ripetibilità, mantenere costante OD per tutti i campioni testati. Seguire protocollo del fornitore commerciale per la composizione del solvente di diluizione. Se non sei sicuro, Usare acqua deionizzata.
- Centrifugare 1 ml della soluzione Au NR due volte per 15 minuti a 7800 xg per rimuovere qualsiasi eccesso chimico dalla soluzione. Cicli di centrifugazione può variare in vigore e nel tempo (ad esempio, 20 min a 5.600 × g) 18.
- Rimuovere il surnatante e risospendere le NRs in acqua deionizzata. Come particelle risospeso potrebbero formare aggregati in soluzione, prepararli giorno per avere i migliori risultati. In alternativa, conservare in frigorifero per non più di 1 settimana. Non congelare.
- Prima di utilizzare in condizioni di coltura cellulare, sonicare la soluzione Au NR per 5 minuti e poi sterilizzare con la luce UV per 30 minuti (intensità di radiazione UV non meno di 400 mW ∙ m -2 a 254 nm).
2. NG108-15 cellule neuronali Linea Cultura e differenziazione
- Per mezzo di coltura cellulare, preparare 500 ml di mezzo sterile modificato di Dulbecco Eagle (DMEM) contenente 10% (w / v) di siero fetale bovino (FCS), 1% (w / v) L-glutammina, 1%(W / v) di penicillina / streptomicina e 0,5% (w / v) anfotericina B.
Nota: Gli integratori possono essere aliquotati, conservati a -20 ° C e aggiunti ai media il giorno desiderato. Mezzo di coltura cellulare può essere refrigerato in condizioni sterili per un massimo di 1 mese. - Per il mezzo differenziazione cellulare, preparare 50 ml di DMEM sterile contenente 1% (w / v) L-glutammina, 1% (w / v) di penicillina / streptomicina e 0,5% (w / v) anfotericina B.
- Grow NG108-15 cellule neuronali in 10 ml di mezzo di coltura cellulare in fiasche T75 in polistirolo in un incubatore con un'atmosfera umidificata (5% CO 2 a 37 ° C). Normalmente, sementi 1,5-2 x 10 5 cellule in ogni contenitore per essere pronto in 3-4 giorni. Cambiare mezzo di coltura cellulare ogni due giorni.
Nota: per evitare derive genetiche o di variazione, non usare le cellule di età superiore a 21 passaggio per gli esperimenti. - Quando 70-80% confluenti nella cultura, cambia il mezzo con mezzo di caldo coltura cellulare fresca. Meccanicamente staccare le cellule delicatamente Knocre il fondo del pallone confluenti. Non usare tripsina.
- Centrifugare la sospensione cellulare per 5 minuti a 600 xg e risospendere il pellet cellulare in 2 ml di mezzo caldo differenziazione cellulare.
- Seed 2 × 10 4 cellule / cm 2 in una piastra di coltura tissutale polistirene ben 96 con 200 ml di terreno di differenziamento cellulare. Incubare l'esperimento per 1 giorno al 5% di CO 2/37 ° C.
- Aggiungi tra 3,2 × 10 9 -4.2 × 1 0 10 particelle / ml di soluzione Au NR il giorno 2 ed incubare per ulteriori 24 ore. Non aggiungere le particelle per gli esperimenti di controllo.
Nota: Come controllo alternativo, Au NP con un picco d'onda di assorbimento ben differenziati possono essere utilizzati ai fini del confronto 14. Per un comportamento cellulare più coerente, mantenere la densità costante di cella e non modificare la superficie ben prima della semina delle cellule.
3. crescita dei neuriti Enhancement
- Coppiail laser con una fibra ottica monomodale (apertura numerica = 0.13) e terminare con un connettore in fibra (connettori FC sono convenienti e comunemente disponibili). Misurare la potenza del laser di uscita con un misuratore di potenza standard. Per ottenere risultati ottimali, abbinare il picco di lunghezza d'onda del laser al picco di risonanza plasmonica di NR.
- Il giorno 3 dopo incubazione NR, fissare il connettore FC al pozzo. Irradiare campioni ed i controlli a temperatura ambiente per 1 minuto in onda continua, per le diverse potenze laser. Lasciare che la cultura di procedere per 3 giorni aggiuntivi in 5% CO 2/37 ° C. Ripetere la radiazione laser per un minimo di 3 misurazioni indipendenti.
Nota: differenti tempi di irradiazione e possono essere selezionati frequenze impulsi, a seconda dell'applicazione. - Caratterizzano il laser in termini di diametro del raggio e di irraggiamento laser (W ∙ cm -2).
- Per una singola fibra modalità standard, utilizzare NA = n ∙ sin θ,dove n è l'indice di rifrazione del mezzo in uso e θ è la metà-angolo del cono di luce uscenti dalla fibra (vedere Figura 1A). Da trigonometria, r = tan θ ∙ d, dove r è il raggio del fascio e d è la distanza tra la fibra e il campione. Il connettore FC corrisponde al diametro del pozzo, quindi illuminando il campione ad una distanza d = 2,70 ± 0,20 mm. Luce esce la fibra in acqua (n = 1.33), dando r = tan (sin-1 (NA / n)) ∙ d.
- Utilizzando quest'ultima equazione, calcolare il raggio del fascio laser, l'area corrispondente trave e l'irradianza media del laser (potenza del laser divisa per l'area del fascio) sul bersaglio (si veda il grafico esempio nella Figura 1B). Questi valori rappresentano l'irraggiamento medio sopra l'area illuminata.
- Valutare gli errori per le misure con la teoria generale di propagazione degli errori.
Nota: La distanza bra il connettore FC e il campione possono essere misurati con fotografie del dispositivo sperimentale e post-elaborazione delle immagini utilizzando il software appropriato (per esempio ImageJ).
- Al giorno 5, rimuovere terreno di differenziamento cellulare dagli esperimenti e fissare i campioni con 3,7% (v / v) di formaldeide per 10 minuti, poi permeabilize le cellule con 0,1% (v / v) Triton X-100 per 20 min.
- Aggiungere 3% (w / v) di albumina di siero bovino (BSA) per i campioni per 60 min per bloccare siti di legame della proteina non reagito. Etichettare i campioni per il pernottamento anti-βIII-tubulina (5 mg / ml in PBS integrato con 1% di BSA) a 4 ° C.
- Incubare le cellule per 90 minuti al buio con un anticorpo secondario appropriato (topo anti-anticorpo es TRITC-coniugato IgG) utilizzando una concentrazione di 0,4-2 mg / ml in 1% BSA in PBS. Etichettare i nuclei delle cellule con DAPI (0,1 mg / ml in acqua deionizzata) per 10 minuti.
Nota: coniugazione di anticorpi e concentrazione migHT variano secondo il protocollo aziendale. Lavare i campioni con PBS due volte per 5 minuti dopo ogni fase di colorazione.
- Campioni Immagine di epifluorescenza o microscopia confocale utilizzando almeno un 20 × obiettivo. Scegli il microscopio filtri di conseguenza per l'anticorpo secondario. Selezionare un filtro DAPI (λ = 358 nm EX; λ = EM 488 nm) per visualizzare i nuclei delle cellule.
- Analizzare le immagini valutando: i) la lunghezza massima dei neuriti (registrare la lunghezza dalla punta del neurite all'inizio del corpo cellulare), ii) il numero di neuriti per cellula neuronale (riassumere tutti i neuriti per cella) e iii) la percentuale di cellule con neuriti (dividere il numero totale di cellule che esprimono βIII-tubulina per il numero totale di cellule con un nucleo tinto positivamente) 19.
4. laser-indotta intracellulare Ca 2+ Imaging
- Preparare un 20% (w / v) di soluzione stock di Pluronic F-127 sciogliendo 2 g di soluto in 10 ml di dimetilsolfossido anidro (DMSO). Riscaldare la soluzione di Pluronic F-127 a 40 ° C per circa 20 minuti per aumentare la solubilità. Preparare in anticipo se conservato a temperatura ambiente.
- Il giorno 3 dopo NR incubazione, preparare una soluzione salina bilanciata (BSS; 135 mM NaCl, 4,5 mM KCl, CaCl 1,5 mm 2, MgCl 0,5 mm 2, 5.6 mM glucosio, e HEPES 10 mM, pH 7.4) e integrato con 5 pM di Fluo-4 sono nella DMSO e 0,1% (w / v) di soluzione Pluronic F-127.
Nota: soluzione BSS può essere preparata in anticipo e refrigerato per un massimo di 1 mese. Aggiungere i supplementi (Fluo-4 AM ed Pluronic F-127), il giorno dell'esperimento. - Rimuovere terreno di differenziamento cellulare e sostituirlo con la soluzione BSS integrata. Per ottenere i migliori risultati con un microscopio confocale invertito, incubare le cellule in un micro-pozzetto.
- Carica NG108-15 cellule con Fluo-04:00per 30 minuti al buio a 5% di CO 2/37 ° C. Dopo il tempo di incubazione, lavare campioni due volte con BSS per rimuovere eventuali fluoroforo scarico extracellulare.
- Coppia il laser con una fibra ottica monomodale e fende la punta utilizzando tecniche standard. Osservare la punta risultante sotto un microscopio ottico, per assicurare una superficie di alta qualità (cioè la punta deve essere perpendicolare all'asse della fibra e piatto su controllo microscopia).
- Misurare la potenza del laser di uscita con un misuratore di potenza standard. Inserire la fibra di consegna luce in un supporto in fibra ottica e applicarla ad un micropositioner. Fare riferimento a Brown et al. 20 per maggiori dettagli sulla preparazione fibra ottica e il posizionamento.
Attenzione: Seguire le regole generali per la sicurezza laser durante la misurazione della potenza del laser (per esempio non guardare direttamente il raggio laser, indossare occhiali di sicurezza laser durante la manipolazione, evitare l'esposizione alla luce diffusa ad altri utenti del laboratorio) <./ Li>
- Misurare la potenza del laser di uscita con un misuratore di potenza standard. Inserire la fibra di consegna luce in un supporto in fibra ottica e applicarla ad un micropositioner. Fare riferimento a Brown et al. 20 per maggiori dettagli sulla preparazione fibra ottica e il posizionamento.
- Collegare un oscilloscopio per il laser portatile per monitorare la modulazione ottica. Utilizzare un segnale binario con frequenze variabili (0,5-2 Hz) e lunghezze di impulso (20-100 msec). Collegare il laser utilizzando il segnale di modulazione come logica transistor-transistor (TTL) ingresso per microscopio, in seguito alla configurazione mostrata in Paviolo et al. 13.
- Collocare le cellule con un microscopio confocale invertito e posizionare la fibra consegna luce 250 ± 50 micron dalla cellula bersaglio in modalità di trasmissione di illuminazione. A questa distanza, utilizzare le equazioni presentati in 3.3.1 per calcolare il raggio del fascio sul bersaglio.
- Utilizzare un laser ad argon-ion (488 nm) per eccitare l'interiorizzato Fluo-04:00 dye (λ = 494 nm EX; λ PN = 516 nm) e la LD sincronizzato per l'eccitazione delle NRs endocitosi. Eseguire la immagini a RT di campioni e controlli utilizzando almeno un obiettivo 40 × raccogliendo scansioni time-seriescon 256 × 256 pixel / risoluzione fotogramma in modalità di andata e ritorno con una frequenza di almeno 4 Hz. Eseguire una registrazione senza alcuna eccitazione LD per identificare qualsiasi interferenza laser argon-ion (rumore di fondo).
- Rimuovere lo sfondo dei dati utilizzando adattivo ponderati penalizzati minimi quadrati algoritmi 21. Tracciare le indotte Ca 2+ variazioni in funzione del tempo. Analizzare i picchi transitori di intensità di fluorescenza utilizzando immagine software di post-elaborazione per soglia ad un livello tre volte la deviazione standard del rumore di fondo (3σ).
Risultati
Utilizzando protocolli 1, 2, e 3 qui descritte, un effetto stimolante sulla differenziazione è stata osservata in NG108-15 cellule neuronali coltivate con NP Au (Au NR, poli (styrenesulfonate) Rivestiti Au NRs e silice rivestite Au NR) dopo laser esposizioni tra 1,25 e 7,5 W · cm -2. Immagini confocale di rhodamineB marcato Au NRs dimostrato che le particelle sono stati internalizzati dal giorno 1 di incubazione 12. La localizzazione è stata osservata prevalentemente nel citoplasma cellulare, indicando che il meccanismo preferito di assorbimento attraverso la membrana era corpo cellulare 12. I principali cambiamenti morfologici rilevati dopo indurre la differenziazione in cellule neuronali NG108-15 erano l'arresto della proliferazione, l'espressione della proteina βIII-tubulina e la conseguenza di neuriti, che sono state analizzate in termini di lunghezza massima e il numero 22.
I campioni coltivati con NR hanno mostrato un aumento di lunghezza dei neuriti al laser irradiANCE livelli misurati qui (tra 1,25 e 7,5 W · cm -2). I campioni di controllo (colture cellulari senza NP e irradiati con la stessa potenza del laser) hanno mostrato alcun cambiamento significativo di lunghezza. Utilizzando una dose di irradiazione di 7,5 W · cm -2, la lunghezza dei neuriti finale NG108-15 coltura con Au NR era maggiore di circa 36% (p <0.01) rispetto ai campioni non laser irradiati. Questo comportamento non è stato specificamente legato alla chimica di superficie delle NR. Questi valori erano quasi il 20% maggiore di neuriti sviluppati da NG108 -15 sola ed esposti allo stesso valore di esposizione laser (p <0.05) 12. Questi risultati sono in linea con gli studi precedentemente pubblicati su PC12 cellule neuronali in coltura con nanotubi piezoelettrici e irradiati con radiazioni ultrasuoni 7.
Esperimenti di controllo senza Au NRs anche mostrato alcuni effetti stimolatori della luce 780 nm in termini di percentuale di neuroni con neuriti e il numero di NEurites per neurone. Questa stimolazione è stato più efficace a potenze laser inferiori (1,25 W ∙ cm -2) con conseguente riduzione al l'energia laser più alto (7,5 W ∙ cm -2) 12. Una stimolazione moderata causato dalle NP senza irradiazione laser (poly (styrenesulfonate) Rivestiti e silice rivestite solo) è stato rilevato nella percentuale di neuroni con neuriti 12. Questi risultati sono in linea con le osservazioni recentemente pubblicati che le nanoparticelle d'oro possono aumentare l'attività neuronale in vitro 23,24. La figura 2 mostra un esempio di immagini epifluorescenza di cellule neuronali differenziate NG108-15 coltivate da solo (Figura 2a) o con Au NR (Figura 2B ) ed irradiati con differenti potenze laser (indicati in figura).
Il potenziale per il rilascio intracellulare photo-generated Ca 2+ è stata valutata utilizzando la luce pulsata NIR secondo protocolli 1, 2, e4. ioni calcio svolgono un ruolo importante in diverse attività cellulari, come la mitosi, la contrazione muscolare e l'estensione dei neuriti 25,26. In risposta ad uno stimolo, Ca 2+ aumenta, oscilla e diminuisce, portando all'attivazione, la modulazione o cessazione di una funzione specifica cella. Recentemente, Ca 2+ transitori sono anche state osservate a seguito di esposizione laser IR in cardiomiociti. In questo lavoro, il Ca 2+ risposte evocate dopo l'esposizione IR esposto ampiezze inferiori e tempi di recupero più veloce del spontanee Ca 2+ transitori 2. La figura 3 mostra un esempio di NG108-15 cellule neuronali caricati con Fluo-04:00 e ripreso con una microscopio confocale. Fluo-4:00 è stato osservato per entrare nella membrana cellulare in maniera non distruttiva, risultante in una distribuzione generalmente uniforme dell'indicatore attraverso il citoplasma della cellula. È stato rilevato solo lievi organello colorazione nucleare o citoplasmatica. Come precedentemente indicato, NR dovevano essere situato intracellulare 12. NG108-15 sole cellule neuronali o coltivate con Au NRs e poli (styrenesulfonate) Rivestiti-Au NRs sono stati esposti in seguito a irradianze laser tra 0,07 J ∙ cm -2 e 370 J ∙ cm -2, con la frequenza laser modulato in gamma di 0,5-2 Hz.
La figura 4 mostra esempi rappresentativi di come l'ampiezza delle risposte è stato mappato in funzione del tempo. L'ampiezza del Ca 2+ risposta varia con l'esposizione radiante (Figura 4A - C) e non era osservato essere costantemente attivato da impulsi laser (Figura 4C) 13. Le più probabili spiegazioni erano la deplezione transiente di Ca2 + intracellulare negozi attribuiti al incompleta Ca 2+ carico 2 o la diversa efficienza NR internalizzazione nelle cellule neuronali. Quando NR non sono stati utilizzati in culture (esperimenti di controllo, la figura 4D), è stato anche osservato un effetto stimolante della luce 780 nm. Tuttavia, questo prodotto inferiori picchi di ampiezza fluorescenza e minore probabilità di attivazione (rilevata in solo il 16% dei campioni analizzati). Nel complesso, una probabilità del 48% di attivazione cellulare indotta da laser NR è stato raggiunto e nonostante gli eventi di fondo dovuta alla luce 780 nm, l'esposizione di cellule NR-trattate dimostrato maggiore efficienza stimolazione con minore energia laser e picchi elevati di risposta 13. Infatti, la risposta di calcio è risultato picco a 0,33 J ∙ cm -2 nelle cellule NR-trattate. Questo è stato attribuito all'inibizione termico 13. Durante gli esperimenti, prove di blebbing o qualsiasi altra forma di perturbazione membrana cellulare è stato rilevato, il che è coerente con i risultati di Huang et al. Hanno riportato che fotodistruzione cellulare con una densità di potenza relativamente elevata di 19 W ∙ cm -2 richiesto 4 min 27. Nessuna attività spontanea nelle cellule NR-trattati è stato registrato senza esposizione laser.

Figura 1: Fibra ottica sperimentale setup (A) e irradianze laser media in funzione della potenza del laser per un fascio laser di superficie uguale a 0,4 mm 2 (B). Parametri del fascio sono (A): metà-angolo del cono massima di luce uscenti dalla fibra (θ), il raggio del fascio (r) e la distanza tra la fibra ottica e il campione (d).
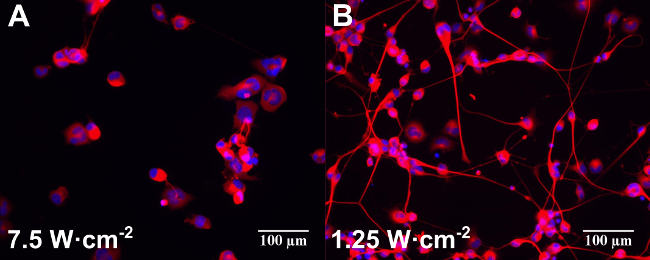
Figura 2: Esempi di immagini epifluorescenza di cellule neuronali differenziate NG108-15 coltivate da solo (A) o con Au NR (B) e irradiati con diverse potenze laser (indicate in figura). I campioni sono stati incubated per un giorno prima dell'irraggiamento laser. Le cellule sono state fissate e etichettati per anti-β-tubulina III (rosso) e DAPI (blu) tre giorni dopo l'irradiazione laser. Barre di scala sono 100 micron.

Figura 3: Esempio di differenziati NG108-15 cellule neuronali caricate con indicatore Fluo4-AM Ca 2+ L'immagine è stata scattata con un microscopio confocale invertito con un obiettivo ad immersione in olio 40X..
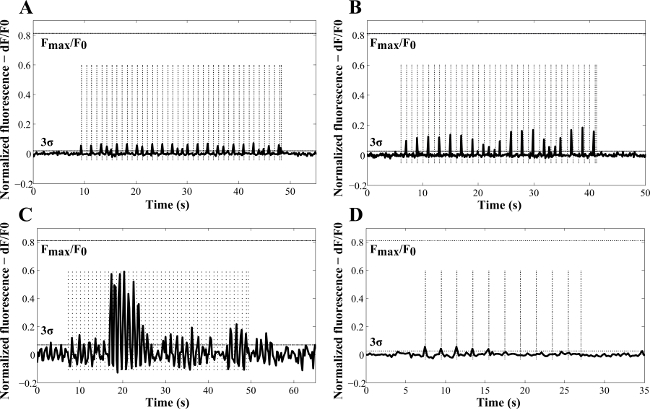
Figura 4: Esempi rappresentativi di indotta laser Ca 2+ variazioni in funzione del tempo in NG108-15 cellule neuronali coltivate in condizioni prive di siero per tre giorni con (A) poli (styrenesulfonate) -au NR, (B, C) Au NR, e (D) senza NR (campione di controllo). Questi risultati sono statiottenuto con impulsi laser di 100 msec (A, C, D) e 50 msec (B). Le frequenze usate per gli esperimenti (linee verticali tratteggiate) erano 1 Hz (A - C) e 0,5 Hz (D). Le esposizioni radianti calcolati erano 69.4 J ∙ cm -2 (A), il 34,7 J ∙ cm -2 (B), 0.37 J ∙ cm -2 (C) e 138,87 J ∙ cm -2 (D). F max / F 0 indica l'aumento massimo di fluorescenza rilevato in NG108 -15 cellule neuronali, dalla calibrazione con ionomicina (riprodotto con il permesso 13).
Discussione
I protocolli descritti in questa presentazione descrivono come la cultura, differenziare e otticamente stimolare le cellule neuronali utilizzando assorbitori estrinseci. Le caratteristiche NR (ad esempio le dimensioni, la forma, risonanza plasmonica di lunghezza d'onda e chimica di superficie) ei parametri di stimolazione laser (come la lunghezza d'onda, la lunghezza di impulso, frequenza di ripetizione, ecc) possono essere variate per soddisfare diverse esigenze sperimentali. Gli effetti sul comportamento delle cellule possono essere monitorati tramite saggi biologici standard e materiali. Nel complesso l'approccio fornisce un semplice, ma potente, modo di irradiare popolazioni di cellule in vitro e potrebbe essere esteso a pile, di campioni di tessuto e studi in vivo.
I principali requisiti che Au NR devono soddisfare per essere utilizzati per applicazioni biologiche sono la stabilità (sia chimica e fisica) e biocompatibilità. Quest'ultima è particolarmente critica, a causa della presenza di un tensioattivo cationico (comunely CTAB) sulla superficie del Au. CTAB è noto per indurre citotossicità in vitro sia in vivo 28 e 29 ed è comunemente utilizzata durante il processo di sintesi per guidare la formazione NR-figura 30. Stabilità e biocompatibilità sono spesso migliorati depositando ulteriori rivestimenti sulla superficie Au NR (per esempio polietilenglicole, silice) 31. Per valutare la biocompatibilità, saggi differenti possono essere utilizzati in vitro (es vivo / morto, MTS, MTT, ecc) mentre l'analisi istologica viene spesso eseguita durante gli esperimenti tessuto 7,8,12,15.
Un'altra sfida da affrontare quando si lavora con nanomateriali è la difficoltà di determinare correttamente la loro concentrazione molare. L'enorme varietà di NP in termini di forma, dimensione, e le proprietà chimiche rende le tecniche attualmente disponibili adatto solo alcune classi di particelle. Ad esempio, la Scatt luce dinamica di serieMetodo rendo presuppone che NP hanno una forma sferica e dispersione della luce isotropa 17. Pertanto, l'applicazione di questo metodo per risultati Au NRS in discrepanze tra la concentrazione misurata e quella reale. Il problema della concentrazione NP è particolarmente problematico se relative al campo nanomedicina, dove la concentrazione somministrata deve essere controllato con precisione al fine di massimizzare l'efficacia del processo (ad esempio per applicazioni drug delivery) e minimizzare la tossicità dei nanomateriali 17. Negli studi riportati qui, la densità ottica utilizzata ha dato buoni risultati in termini di vitalità cellulare e numero di particelle.
A causa delle loro proprietà di assorbimento intrinseche, Au NP sono spesso usati in combinazione con una sorgente laser. Durante l'esposizione, l'assorbimento e la dispersione sono i due principali processi che possono verificarsi sulla superficie delle nanoparticelle. Se la lunghezza d'onda del laser corrisponde alla lunghezza d'onda di risonanza plasmonica, assorbimento spessoprevale su dispersione, emozionanti gli elettroni di conduzione in superficie NP. Queste formano un gas di elettroni che si allontana dalla sua posizione di equilibrio e crea una oscillazione coerente risonanza chiamato la risonanza plasmonica superficiale localizzata (LSPR). L'energia viene quindi trasferita al reticolo cristallino NP come calore, che viene successivamente dissipata rapidamente nell'ambiente circostante 32. Poiché il calore è il principale effetto osservato dopo l'eccitazione del NR LSPR, è opportuno monitorare la vitalità cellulare dopo l'esposizione laser.
E 'stato ipotizzato che gli effetti osservati sulla crescita dei neuriti e intracellulare Ca 2+ percorso erano dovuti al riscaldamento transitorio derivante dalla eccitazione del LSPR. Questa ipotesi è in linea con l'attivazione del canale TRPV1 termosensibile dopo esposizione magnetico NP ferrite 5. Questo processo è anche coerente con le osservazioni che i canali TRPV4 termosensibili play un ruolo importante in infrarossi stimolazione nervosa 33. A livello molecolare, è stato recentemente dimostrato che TRPV4 è termosensibile solo dopo l'interazione di phosphoinositide -4,5 -biphosphate (PIP 2) con il canale 34. Pertanto, è possibile che il riscaldamento transitorio insorto dopo NR eccitazione potrebbe servire per accelerare e / o indurre l'apertura dei canali TRPV4. Questa ipotesi può essere confermata da future Ca 2+ esperimenti utilizzando Ca 2+ - media liberi e / o controlli molecolari sul PIP 2 esaurimento.
Diversi gruppi hanno inoltre dimostrato che i piccoli gradienti di temperatura nella gamma di temperatura fisiologica possono essere utilizzati per indurre altre risposte, come cono di crescita neuronale guida 25 o depolarizzante correnti in cellule renali embrionali umane 35. Yong e collaboratori hanno registrato un significativo aumento dell'attività segnale elettrico in primaria cult neuroni uditivirato con silice rivestite Au NRs dopo irradiazione laser dei NRs al LSPR. Il riscaldamento prodotto dalle particelle irradiate laser è stata misurata utilizzando tecniche di patch-clamp 14. Più recentemente, Eom et al. Registrato un aumento dell'ampiezza di CNaPS dopo esposizione laser di 3,4 × 10 9 Au NR quando continuamente perfuso in prossimità della guaina del fascio nervoso di un ratto nervo sciatico 15.
L'effetto stimolante del diodo laser 780 nm osservato durante gli esperimenti non era legato a calore generato dall'assorbimento di acqua, in quanto questo è noto per essere trascurabile a 780 nm 36. Risultati precedentemente pubblicati hanno riportato effetti stimolatori di 780 nm luce sul tessuto neuronale in vivo 37,38. Studi in vitro hanno dimostrato il coinvolgimento di specie reattive dell'ossigeno nel processo 39. Tuttavia, i meccanismi dettagliati per il quale la stimolazione NIR colpisce gene transcription e altre attività cellulari sono attualmente irrisolti. Dati attuale suggerisce l'interazione di effetti diversi nella stimolazione, tra l'assorbimento di fotoni all'interno cromofori nei mitocondri (quasi il 50% dell'energia a 780 nm può essere assorbito dal citocromo c ossidasi) 37,39-41, cambiamenti nella permeabilità della membrana al calcio 37 e inibizione dell'attività infiammatoria nelle cellule 37.
I risultati presentati in questo manoscritto dimostrano che assorbitori di nanoparticelle molto promettenti per le applicazioni future in ottica stimolazione delle cellule neuronali. Il vantaggio principale risiede nella capacità di NIR luce di penetrare in profondità nei tessuti (finestra terapeutica). Questi risultati mostrano anche che assorbitori nanoparticelle possono migliorare e / o sostituire il processo di infrarossi stimolazione neurale basato su assorbimento di acqua. Per le applicazioni future in protesi neurali, sarebbe interessante indagare diversi functionalizat superficieioni con affinità chimica per assoni neuronali, che sono i principali obiettivi per molte applicazioni di stimolazione ottica.
Divulgazioni
The authors have no competing interests to disclose.
Riconoscimenti
Gli autori vorrebbero riconoscere NanoVentures Australia per sostegno finanziario di viaggio e il Prof. John Haycock per aver ospitato in parte questa ricerca presso l'Università di Sheffield e la signora Jaimee Mayne per il suo aiuto durante le riprese.
Materiali
| Name | Company | Catalog Number | Comments |
| Au NR | Sigma Aldrich | 716812 | |
| NG108-15 | Sigma Aldrich | 8811230 | |
| DMEM | Sigma Aldrich | D6546 | |
| FCS | Life Technologies | 10100147 | |
| L-glutamine | Sigma Aldrich | G7513 | |
| Penicillin/streptomycin | Life Technologies | 15140122 | |
| Amphotericin B | Life Technologies | 15290018 | |
| Formaldehyde | Sigma Aldrich | F8775 | |
| Triton X-100 | BDH | T8532 | |
| BSA | Sigma Aldrich | A2058 | |
| Anti-βIII-tubulin | Promega | G7121 | |
| TRITC-conjugated anti-mouse IgG antibody | Sigma Aldrich | T5393 | |
| DAPI | Invitrogen | D1306 | |
| Fluo-4 AM | Invitrogen | F14201 | |
| DMSO | Sigma Aldrich | 472301 | |
| Pluronic F-127 | Invitrogen | P6867 | |
| UV-Vis spectrometer | Varian Medical Systems Inc. | Cary 50 Bio | |
| Mini centrifuge | Eppendorf | Mini Spin | |
| Sonic bath | Unisonics Australia | FPX 10D | |
| Cell culture incubator | Kendro | Hera Cell 150 | |
| Cell culture centrifuge | Hettich | Rotofix 32A | |
| Laser diode | Optotech | 780 nm single mode fibre - coupled LD | |
| Optical fiber | Thorlabs | 780 HP | |
| Power meter | Coherent | Laser Check | |
| ImageJ | http://rsb.info.nih.gov/ij/index.html | ||
| Epifluorescent microscope | Axon Instruments | ImageX-press 5000A | |
| μ-slide well | Ibidi | 80826 | |
| Inverted confocal microscope | Carl Zeiss Microscopy Ltd. | LSM 510 meta-confocal microscope | |
| Oscilloscope | Tektronix | TDS210 |
Riferimenti
- Richter, C. P., Matic, A. I., Wells, J. D., Jansen, E. D., Walsh, J. T. Neural stimulation with optical radiation. Laser. Photonics Rev. 5 (1), 68-80 (2011).
- Dittami, G. M., Rajguru, S. M., Lasher, R. A., Hitchcock, R. W., Rabbitt, R. D. Intracellular calcium transients evoked by pulsed infrared radiation in neonatal cardiomyocytes. J. Physiol. 589 (6), 1295-1306 (2011).
- Thompson, A. C., Wade, S. A., Brown, W. G. A., Stoddart, P. R. Modeling of light absorption in tissue during infrared neural stimulation. J. Biomed. Opt. 17 (7), 075002-075002 (2012).
- Thompson, A. C., Wade, S. A., Cadusch, P. J., Brown, W. G., Stoddart, P. R. Modeling of the temporal effects of heating during infrared neural stimulation. J. Biomed. Opt. 18 (3), 035004 (2013).
- Huang, H., Delikanli, S., Zeng, H., Ferkey, D. M., Pralle, A. Remote control of ion channels and neurons through magnetic-field heating of nanoparticles. Nat. Nanotechnol. 5 (8), 602-606 (2010).
- Farah, N., et al. Holographically patterned activation using photo-absorber induced neural-thermal stimulation. J. Neural. Eng. 10 (5), (2013).
- Ciofani, G., et al. Enhancement of neurite outgrowth in neuronal-like cells following boron nitride nanotube-mediated stimulation. ACS Nano. 4 (10), 6267-6277 (2010).
- Kim, J. A., et al. Enhancement of neurite outgrowth in PC12 cells by iron oxide nanoparticles. Biomaterials. 32 (11), 2871-2877 (2011).
- Myroshnychenko, V., et al. Modelling the optical response of gold nanoparticles. Chem. Soc. Rev. 37 (9), 1792-1805 (2008).
- Choi, W. I., Sahu, A., Kim, Y. H., Tae, G. Photothermal cancer therapy and imaging based on gold nanorods. Ann. Biomed. Eng. 40 (2), 534-546 (2011).
- Zhan, Q., Qian, J., Li, X., He, S. A study of mesoporous silica-encapsulated gold nanorods as enhanced light scattering probes for cancer cell imaging. Nanotechnology. 21 (5), 055704 (2010).
- Paviolo, C., et al. Laser exposure of gold nanorods can increase neuronal cell outgrowth. Biotechnol. Bioeng. 110 (8), 2277-2291 (2013).
- Paviolo, C., Haycock, J. W., Cadusch, P. J., McArthur, S. L., Stoddart, P. R. Laser exposure of gold nanorods can induce intracellular calcium transients. J. Biophotonics. 7 (10), 761-765 (2014).
- Yong, J., et al. Gold-nanorod-assisted near-infrared stimulation of primary auditory neurons. Adv. Healthcare Mater. , (2014).
- Eom, K., et al. Enhanced infrared neural stimulation using localized surface plasmon resonance of gold nanorods. Small. , (2014).
- Juste, J., Pastoriza-Santos, I., Liz-Marzán, L. M., Mulvaney, P. Gold nanorods: Synthesis, characterization and applications. Coordination Chemistry Reviews. (17-18), 1870-1901 (2005).
- Shang, J., Gao, X. Nanoparticle counting: towards accurate determination of the molar concentration. Chem. Soc. Rev. 43 (21), 7267-7278 (2014).
- Sharma, V., Park, K., Srinivasarao, M. Shape separation of gold nanorods using centrifugation. Proc. Natl. Acad. Sci. 106 (13), 4981-4985 (2009).
- Kaewkhaw, R., Scutt, A. M., Haycock, J. W. Anatomical site influences the differentiation of adipose-derived stem cells for schwann-cell phenotype and function. Glia. 59 (5), 734-749 (2011).
- Brown, W. G. A., Needham, K., Nayagam, B. A., Stoddart, P. R. Whole cell patch clamp for investigating the mechanisms of infrared neural stimulation. JoVE. (77), (2013).
- Cadusch, P. J., Hlaing, M. M., Wade, S. A., McArthur, S. L., Stoddart, P. R. Improved methods for fluorescence background subtraction from Raman spectra. J. Raman Spectrosc. 44 (11), 1587-1595 (2013).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Jung, S., et al. Intracellular gold nanoparticles increase neuronal excitability and aggravate seizure activity in the mouse brain. PLoS ONE. 9 (3), e91360 (2014).
- Salinas, K., Kereselidze, Z., DeLuna, F., Peralta, X., Santamaria, F. Transient extracellular application of gold nanostars increases hippocampal neuronal activity. J. Nanobiotechnology. 12 (1), 31 (2014).
- Ebbesen, C. L., Bruus, H. Analysis of laser-induced heating in optical neuronal guidance. J. Neurosci. Meth. 209 (1), 168-177 (2012).
- Iwanaga, S., et al. Location-dependent photogeneration of calcium waves in HeLa cells. Cell Biochem. Biophys. 45 (2), 167-176 (2006).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Determination of the minimum temperature required for selective photothermal destruction of cancer cells with the use of immunotargeted gold nanoparticles. Photochem. Photobiol. 82 (2), 412-417 (2006).
- Connor, E. E., Mwamuka, J., Gole, A., Murphy, C. J., Wyatt, M. D. Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity. Small. 1 (3), 325-327 (2005).
- Isomaa, B., Reuter, J., Djupsund, B. M. The subacute and chronic toxicity of cetyltrimethylammonium bromide (CTAB), a cationic surfactant, in the rat. Arch. Toxicol. 35 (2), 91-96 (1976).
- Juste, J., Pastoriza-Santos, I., Liz-Marzán, L., Mulvaney, P. Gold nanorods: synthesis, characterization and applications. Coord. Chem. Rev. 249 (17-18), 1870-1901 (2005).
- Dreaden, E. C., Alkilany, A. M., Huang, X., Murphy, C. J., El-Sayed, M. A. The golden age: gold nanoparticles for biomedicine. Chem. Soc. Rev. 41 (7), 2740-2779 (2012).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Plasmonic photothermal therapy (PPTT) using gold nanoparticles. Lasers Med. Sci. 23 (3), 217-228 (2008).
- Albert, E. S., et al. TRPV4 channels mediate the infrared laser-evoked response in sensory neurons. J. Neurophysiol. 107 (12), 3227-3234 (2012).
- Garcia-Elias, A., et al. Phosphatidylinositol-4,5-biphosphate-dependent rearrangement of TRPV4 cytosolic tails enables channel activation by physiological stimuli. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9553-9558 (2013).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. -. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nat. Commun. 3 (736), (2012).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Müller, G. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J. Biomed. Opt. 4 (1), 36-46 (1999).
- Byrnes, K. R., et al. Light promotes regeneration and functional recovery and alters the immune response after spinal cord injury. Lasers Surg. Med. 36 (3), 171-185 (2005).
- Wu, X., et al. 810 nm wavelength light: an effective therapy for transected or contused rat spinal cord. Lasers Surg. Med. 41 (1), 36-41 (2009).
- Grossman, N., Schneid, N., Reuveni, H., Halevy, S., Lubart, R. 780 nm low power diode laser irradiation stimulates proliferation of keratinocyte cultures: involvement of reactive oxygen species. Lasers Surg. Med. 22 (4), 212-218 (1998).
- Wong-Riley, M. T. T., et al. Photobiomodulation directly benefits primary neurons functionally inactivated by toxins - Role of cytochrome c oxidase. J. Biol. Chem. 280 (6), 4761-4771 (2005).
- Beauvoit, B., Kitai, T., Chance, B. Contribution of the mitochondrial compartment to the optical properties pf the rat liver: a theoretical and practical approach. Biophys. J. 67 (6), 2501-2510 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon