Method Article
Gold-Nanostäbchenunterstützte optische Stimulation von Nervenzellen
In diesem Artikel
Zusammenfassung
This protocol outlines how to use the transient heating associated with the optical absorption of gold nanorods to stimulate differentiation and intracellular calcium activity in neuronal cells. These results potentially open up new applications in neural prostheses and fundamental studies in neuroscience.
Zusammenfassung
Recent studies have demonstrated that nerves can be stimulated in a variety of ways by the transient heating associated with the absorption of infrared light by water in neuronal tissue. This technique holds great potential for replacing or complementing standard stimulation techniques, due to the potential for increased localization of the stimulus and minimization of mechanical contact with the tissue. However, optical approaches are limited by the inability of visible light to penetrate deep into tissues. Moreover, thermal modelling suggests that cumulative heating effects might be potentially hazardous when multiple stimulus sites or high laser repetition rates are used. The protocol outlined below describes an enhanced approach to the infrared stimulation of neuronal cells. The underlying mechanism is based on the transient heating associated with the optical absorption of gold nanorods, which can cause triggering of neuronal cell differentiation and increased levels of intracellular calcium activity. These results demonstrate that nanoparticle absorbers can enhance and/or replace the process of infrared neural stimulation based on water absorption, with potential for future applications in neural prostheses and cell therapies.
Einleitung
Jüngste Studien haben gezeigt, daß die Übergangserwärmung mit der Absorption von Infrarotlicht durch Wasser (Wellenlänge> 1.400 nm) verbunden sind, können verwendet werden, um Aktionspotentiale in Nervengewebe 1 und intrazellulären Calciumtransienten in Kardiomyozyten 2 induzieren. Die Verwendung von Infrarotlicht hat großes Interesse für Anwendungen in der Neuroprothesen angehoben, aufgrund der potentiellen feinere räumliche Auflösung, Fehlen eines direkten Kontaktes mit dem Gewebe, Minimierung der Stimulationsartefakte und das Entfernen der Notwendigkeit, genetisch die Zellen vor der Stimulation verändern ( wie in Optogenetik erforderlich) 1. Trotz all dieser Vorteile, schlug kürzlich entwickelte thermische Modelle, dass die Zielgewebe / Zellen können durch kumulative Wärmeeffekte, wenn mehrere Konjunktur Websites und / oder hohen Repetitionsraten verwendet 3,4 berührt.
Als Antwort auf diese Herausforderungen haben die Forscher das Potenzial, extrinsische absor zugelassenesglieder zur Nervenstimulation, mehr lokalisierte Erwärmungseffekte im Gewebe zu produzieren. Huang et al. Gezeigt, dieses Prinzip durch Verwendung superpara Ferritnanopartikel die temperaturempfindliche TRPV1 Kanäle in HEK 293 Zellen, die mit einem Hochfrequenz-Magnetfeld 5 Ferne zu aktivieren. Obwohl diese Technik für ein tieferes Eindringen zu ermöglichen (Magnetfelder in Wechselwirkung relativ schwach mit Gewebe) wurden die Reaktionen nur über einen Zeitraum von Sekunden aufgezeichnet, anstatt Millisekundendauer in bionische Vorrichtungen 5 erforderlich. Ähnlich Farah et al. Zeigten elektrische Stimulation kortikale Neuronen der Ratte mit schwarzen Mikropartikel in vitro. Sie zeigten zellgenau in Stimulation mit Pulsdauern in der Größenordnung von Hunderten von & mgr; s und Energien im Bereich von & mgr; J, potenziell ermöglicht eine schnellere Wiederholraten 6.
Die Verwendung von extrinsischen Absorber wurde auch angewendet, um zu induzierenmorphologische Veränderungen in vitro. Ciofani et al. Zeigten eine Zunahme ~ 40% in neuronalen Zell Auswuchs mit piezoelektrischen Bornitrid-Nanoröhren durch Ultraschall 7 erregt. Ähnlich endozytosiert Eisenoxidnanopartikel in PC12-Zellen wurde berichtet, Neuriten Differenzierung in einer dosisabhängigen Art und Weise zu erweitern, die durch die Aktivierung von Zelladhäsionsmolekülen mit dem Eisenoxid 8.
Vor kurzem hat das Interesse an der äußeren Absorber auf neuronale Stimulation unterstützen auch die Verwendung von Gold-Nanopartikeln (Au-NPs) konzentriert. Gold-Nanopartikel haben die Fähigkeit, Laserlicht effizient absorbieren an der Plasmonen Spitze und sie in die Umgebung in Form von Wärme 9 zerstreuen. Unter allen verfügbaren Partikelformen, die optische Absorption des Gold-Nanostäbchen (Au NRs) bequem passt das therapeutische Fenster von biologischen Geweben (Nahinfrarot - NIR- Wellenlänge zwischen 750-1,400 nm) 10. Darüber hinaus wird in der Fortsetzungext neuronaler Stimulation, die Verwendung von Au NRs bietet relativ günstige Biokompatibilität und eine breite Palette von Oberflächenfunktionalisierung Optionen 11. Jüngste Studien haben gezeigt, dass eine stimulierende Wirkung auf die Differenzierung nach der kontinuierlichen Laserbelichtungen Au NRs in NG108-15 neuronalen Zellen 12 induziert werden. In ähnlicher Weise wurden die intrazelluläre Calcium Transienten in neuronalen Zellen mit Au NRs nach der Laserbestrahlung mit variablen Frequenzen und impulsmoduliert Weiten 13 kultiviert aufgezeichnet. Zellmembran Depolarisation wurde auch nach NIR Laserbeleuchtung Au NRs in primären Kulturen von Spiralganglienneuronen 14 aufgezeichnet. Die erste in vivo-Anwendung mit bestrahlten Au NRs wurde erst kürzlich unter Beweis gestellt. EOM und Mitarbeiter ausgesetzt Au NRs an deren Plasmonenspitze und erfasst eine sechsfache Erhöhung in der Amplitude der Verbindung Nervenaktionspotentiale (Cnaps) und eine dreifache Verringerung der Reizschwelle in Rattenischiasnerven. Die enhanced Reaktion wurde die lokale Erwärmungseffekte von der Erregung des NR plasmonic Peak 15 resultierende zurückzuführen.
In der vorliegenden Arbeit werden die Protokolle für die Untersuchung der Auswirkungen von Laserstimulation in NG108-15 neuronalen Zellen mit Au NRs kultiviert angegeben. Diese Methoden bieten eine einfache, aber leistungsstarke Möglichkeit, Zellpopulationen in vitro Bestrahlung mit Standard-biologischen Techniken und Materialien. Das Protokoll basiert auf einem fasergekoppelten Laserdiode (LD), der einen sicheren Betrieb und reproduzierbare Ausrichtung ermöglicht. Die Au-NR Probenvorbereitung und Laserbestrahlungsverfahren kann weiter auf verschiedene Partikelformen und neuronalen Zellkulturen ausgedehnt werden, vorausgesetzt, dass die gezielte Synthese und Kultur Protokolle bekannt sind.
Protokoll
1. Au NRs Vorbereitung
Anmerkung: Au NRs kann durch eine Reihe von Rezepturen 16 synthetisiert oder von kommerziellen Anbietern erhältlich.
- Die anfängliche optische Dichte (OD) der Au NR Lösung mittels UV-Vis-Spektroskopie, durch Aufnahme der Absorptionswerte von 300 nm bis 1.000 nm mit einer Auflösung von 0,5-2 nm. Vary das Volumen der Lösung, um mit den verfügbaren Küvetten verwendet werden.
- Bewerten Sie die erste NP molare Konzentration mit einer geeigneten Technik 17 (zB UV-Vis-Spektroskopie, Einzelpartikel induktiv gekoppelte Plasma-Massenspektrometrie, Transmissionselektronenmikroskopie) oder verwenden Sie die Konzentrationswerte von dem Verkäufer zur Verfügung gestellt.
- Bereiten Sie eine 5 ml-Stammlösung durch die anfängliche Au NR Probe Verdünnung auf eine OD erreicht = 1. Für die beste Wiederholgenauigkeit, halten Sie die OD Konstante für alle getesteten Proben. Folgen Sie der kommerziellen Anbieters Protokoll für die Zusammensetzung des Verdünnungslösungsmittel. Falls Sie nicht sicherVerwenden Sie deionisiertes Wasser.
- Zentrifuge 1 ml der Au NR Lösung zweimal für 15 Minuten bei 7800 · g, jede chemische Überschuss aus der Lösung zu entfernen. Zentrifugation-Zyklen in Kraft und Zeit (zB 20 Minuten bei 5600 × g) 18 variieren.
- Entfernen Sie die Überstände und resuspendieren die NRs in VE-Wasser. Als Wieder Schwebeteilchen können Aggregate in Lösung, bereiten sie täglich, um die besten Ergebnisse zu erzielen. Alternativ lagern in einem Kühlschrank nicht länger als 1 Woche. Nicht einfrieren.
- Bevor Sie unter Zellkulturbedingungen, beschallen die Au NR-Lösung für 5 Minuten und dann mit UV-Licht sterilisiert werden für 30 Minuten (UV-Strahlung Intensität nicht weniger als 400 mW ∙ m -2 bei 254 nm).
2. NG108-15 Neuronal-Zelllinie, Kultur und Differenzierung
- Aus dem Zellkulturmedium, bereiten 500 ml steriler Dulbecco modifiziertem Eagle-Medium (DMEM), das 10% (w / v) fötalem Kälberserum (FCS), 1% (w / v) L-Glutamin, 1%(W / v) Penicillin / Streptomycin und 0,5% (w / v) Amphotericin B.
Hinweis: Ergänzungen können aliquotiert bei -20 ° C gelagert und in den Medien am Tag erforderlich. Zellkulturmedium kann in einem sterilen Zustand für höchstens 1 Monat im Kühlschrank gelagert werden. - Für die Zelldifferenzierungsmedium, bereiten 50 ml steriles DMEM, enthaltend 1% (w / v) L-Glutamin, 1% (w / v) Penicillin / Streptomycin und 0,5% (w / v) Amphotericin B.
- Wachsen NG108-15 neuronalen Zellen in 10 ml Zellkulturmedium in T75-Flaschen von Polystyrol in einem Brutschrank mit befeuchteter Atmosphäre (5% CO 2 bei 37 ° C). Normalerweise Saatgut 1,5-2 x 10 5 Zellen in jedem Kolben bereit zu sein, in 3-4 Werktagen. Ändern Zellkulturmedium alle zwei Tage.
Hinweis: Um die genetische Drift oder Abweichung zu vermeiden, verwenden Sie keine Zellen, die älter als Durchgang 21 für Experimente. - Bei 70-80% konfluent in Kultur, ändern Sie die Medium mit warmen frisches Zellkulturmedium. Mechanisch lösen die Zellen durch vorsichtiges KnocKönig der Boden der konfluenten Flasche. Verwenden Sie keine Trypsin.
- Zentrifuge die Zellsuspension für 5 min bei 600 × g und resuspendieren das Zellpellet in 2 ml warmem Zelldifferenzierungsmedium.
- Seed 2 × 10 4 Zellen / cm 2 in einem Gewebekulturpolystyrol Platte mit 96 Vertiefungen mit 200 ul Zelldifferenzierungsmedium. Inkubation des Experiments 1 Tag bei 5% CO 2/37 ° C.
- Fügen Sie zwischen 3,2 × 10 9 -4,2 × 1 0 10 Teilchen / ml Au NR Lösung am Tag 2 und inkubieren sie für weitere 24 Stunden. Die Partikel für den Kontrollexperimenten nicht hinzufügen.
Hinweis: Als Alternative Steuerung kann mit Gold-Nanopartikeln mit einem gut differenzierten Spitzenabsorptionswellenlänge zu Vergleichszwecken 14 verwendet werden. Für eine einheitliche Zellverhalten, halten Sie die Zelldichte konstant und nicht die gut Oberfläche vor der Zellaussaat ändern.
3. Neuritenwachstum Enhancement
- Paarder Laser mit einem optischen Monomode-Faser (numerische Apertur = 0,13) und enden mit einem Faserverbinder (FC-Anschlüsse sind praktisch und allgemein verfügbar ist). Messen Sie die Ausgangslaserleistung mit einem Standard-Leistungsmesser. Um die besten Ergebnisse zu erzielen, passen Sie die Peak-Wellenlänge des Lasers auf die Plasmonresonanzspitze der NRs.
- Am Tag 3 nach NR Inkubation, fixieren Sie die FC-Stecker an den Brunnen. Bestrahlen Proben und Kontrollen bei RT für 1 min im Dauerstrich, für unterschiedliche Laserleistungen. Ermöglichen die Kultur für 3 weitere Tage bei 5% CO 2/37 ° C ablaufen. Wiederholen der Laserbestrahlung für ein Minimum von 3 unabhängigen Messungen.
Anmerkung: Verschiedene Bestrahlungszeiten und Impulsfrequenzen können ausgewählt werden, abhängig von der Anwendung. - Charakterisieren Sie den Laser in Bezug auf die Strahldurchmesser und Laserbestrahlungsstärke (W ∙ cm -2).
- Bei einer Standard-Singlemode-Faser, verwenden NA = n ∙ sin θ,wobei n der Brechungsindex des Mediums, in Gebrauch und θ ist der Halbwinkel des Konus von Licht aus der Faser austretenden (siehe 1A). Von Trigonometrie r = tan θ ∙ d, wobei r der Radius des Laserstrahls ist und d der Abstand zwischen der Faser und der Probe. Die FC-Stecker auf den Durchmesser des Bohrlochs daher Beleuchten der Probe in einem Abstand d = 2,70 ± 0,20 mm. Licht tritt aus der Faser in Wasser (n = 1,33), so dass r = tan (sin-1 (NA / n)) ∙ d.
- Verwendung der letzteren Gleichung errechnen Laserstrahlradius, die entsprechende Strahlfläche und die mittlere Laserbestrahlungsstärke (Laserleistung geteilt durch Strahlfläche) am Ziel (siehe Beispiel Diagramm in 1B). Diese Werte stellen den Durchschnitt Bestrahlungsstärke auf der beleuchteten Fläche.
- Bewerten der Fehler bei den Messungen mit der allgemeinen Theorie der Fehlerausbreitung.
Hinweis: Der Abstand bwischen der FC-Stecker und die Probe kann durch Fotografien der Versuchsanordnung und Nachverarbeitung des Bildes mit einer geeigneten Software (zB ImageJ) gemessen werden.
- An Tag 5, entfernen Zelldifferenzierungsmedium aus den Versuchen und fixieren die Proben mit 3,7% (v / v) Formaldehyd-Lösung für 10 min, dann permeabilisiert die Zellen mit 0,1% (v / v) Triton X-100 für 20 min.
- Hinzufügen von 3% (w / v) Rinderserumalbumin (BSA) zu den Proben für 60 min, um das nichtumgesetzte Proteinbindungsstellen zu blockieren. Beschriften der Proben für Anti βIII -Tubulin über Nacht (5 ug / ml in PBS, ergänzt mit 1% BSA) bei 4 ° C.
- Die Zellen für 90 min im Dunkeln inkubieren mit einem geeigneten sekundären Antikörper (zB TRITC-konjugiertem Anti-Maus-IgG-Antikörper) mit einer Konzentration von 0,4-2 ug / ml in 1% BSA in PBS. Kennzeichnen die Zellkerne mit DAPI (0,1 & mgr; g / ml in deionisiertem Wasser) für 10 min.
Hinweis: Antikörper-Konjugation und Konzentration might variieren je nach Firmenprotokoll. Wash Proben zweimal mit PBS für 5 Minuten nach jeder Färbung Bühne.
- Bildproben durch Epifluoreszenz oder konfokaler Mikroskopie unter Verwendung von mindestens einem 20 × -Objektiv. Wähle das Mikroskop filtert entsprechend an den sekundären Antikörper. Wählen Sie eine DAPI-Filter (λ EX = 358 nm; λ EM = 488 nm), um die Zellkerne zu visualisieren.
- Analysieren Sie die Bilder von der Bewertung: i) die maximale Neuritenlänge (Rekord die Länge von der Spitze des Neuriten an den Anfang des Zellkörpers), ii) die Anzahl der Neuriten pro neuronalen Zell (Fassend alle Neuriten pro Zelle) und iii) der Anteil der Zellen mit Neuriten (teilen die Gesamtzahl der Zellen βIII-Tubulin exprimieren durch die Gesamtzahl von Zellen mit einem positiv gefärbten Kern) 19.
4. Laser-induzierter intrazellulärer Ca 2+ Imaging
- Vorbereiten einer 20% (w / v) Stammlösung von Pluronic F-127 durch Lösen von 2 g des gelösten Stoffes in 10 ml wasserfreiem Dimethylsulfoxid (DMSO). Erhitzt man die Lösung von Pluronic F-127 bei 40 ° C für ungefähr 20 min, um die Löslichkeit zu erhöhen. Bereiten Sie im Voraus, wenn bei RT gelagert.
- Am Tag 3 nach NR Inkubation, bereiten eine ausgeglichene Salzlösung (BSS, 135 mM NaCl, 4,5 mM KCl, 1,5 mM CaCl 2, 0,5 mM MgCl 2, 5,6 mM Glucose und 10 mM HEPES, pH 7,4) und ergänzt es mit 5 uM Fluo-4.00 in DMSO und 0,1% (w / v) Pluronic F-127-Lösung.
Anmerkung: BSS Lösung kann vorher hergestellt und für höchstens 1 Monat im Kühlschrank gelagert werden. Hinzufügen der Ergänzungs (Fluo-4 Uhr und Pluronic F-127), am Tag des Experiments. - Entfernen Zelldifferenzierungsmedium und ersetzen Sie es mit dem BSS-Lösung ergänzt. Um die besten Ergebnisse mit einem invertierten konfokalen Mikroskop zu erhalten, Inkubation der Zellen in einem Mikroobjektträgers.
- Last NG108-15-Zellen mit Fluo-04.00für 30 min im Dunkeln bei 5% CO 2/37 ° C. Nach der Inkubationszeit waschen Proben zweimal mit BSS jede extrazellulärem unbelastetem Fluorophor zu entfernen.
- Koppeln der Laser mit einer Einmoden-Lichtleitfaser und spalten die Spitze unter Verwendung von Standardtechniken. Beachten Sie die resultierende Spitze unter einem optischen Mikroskop, um eine hochwertige Oberfläche gewährleisten (dh die Spitze sollte senkrecht zur Faserachse und flach auf Mikroskopie Inspektion).
- Messen Sie die Ausgangslaserleistung mit einem Standard-Leistungsmesser. Legen Sie die Lichtabgabe Faser in eine optische Faser Halter und befestigen Sie es an einen Mikropositionierer. Siehe Brown et al. 20 für weitere Informationen über Glasfaser Vorbereitung und Positionierung.
Achtung: Beachten Sie die allgemeinen Regeln für die Lasersicherheit während der Messung der Laserleistung (zB schauen Sie nicht direkt in den Laserstrahl, Laserschutzbrillen tragen bei der Handhabung, verhindert Streulicht Exposition gegenüber anderen Labor-Benutzer) <./ Li>
- Messen Sie die Ausgangslaserleistung mit einem Standard-Leistungsmesser. Legen Sie die Lichtabgabe Faser in eine optische Faser Halter und befestigen Sie es an einen Mikropositionierer. Siehe Brown et al. 20 für weitere Informationen über Glasfaser Vorbereitung und Positionierung.
- Schließen Sie ein Oszilloskop an den tragbaren Laser, um die optische Modulation zu überwachen. Verwenden Sie ein binäres Signal mit variabler Frequenz (0,5-2 Hz) und Pulslängen (20-100 ms). Verbinden des Lasers unter Verwendung des Modulationssignals als Transistor-Transistor-Logik (TTL) Eingang für das Mikroskop, im Anschluss an die in Paviolo et al. 13 gezeigten Aufbau.
- Zeigen die Zellen unter einem umgekehrten Konfokalmikroskop und Positionieren des Lichtzuführungsfaser 250 ± 50 & mgr; m entfernt von der Zielzelle im Transmissionsbeleuchtungsmodus. In dieser Entfernung mit Hilfe der Gleichungen präsentiert in 3.3.1, um die Strahlradius auf das Ziel zu berechnen.
- Verwenden eines Argon-Ionenlaser (488 nm), um den internalisierten Fluo-4.00 Farbstoff anzuregen (λ ex = 494 nm; λ EM = 516 nm) und der Synchron LD für die Anregung der Endozytose NRs. Führen die Abbildung bei RT von Proben und Kontrollen unter Verwendung von mindestens einem 40 × -Objektiv durch Sammeln von Zeitreihen Scansmit 256 x 256 Pixel / Rahmen Auflösung in Roundtrip-Modus mit einer Frequenz von mindestens 4 Hz. Führen einer Aufzeichnung ohne LD Anregungs jede Argon-Ionen-Laser-Interferenz (Grundrauschen) zu identifizieren.
- Entfernen Sie den Hintergrund aus den Daten mit Hilfe adaptiv gewichtet bestraft Least-Squares-Algorithmus 21. Zeichnen Sie die induzierte Ca 2+ Änderungen als eine Funktion der Zeit. Analysieren Sie die Signalspitzen in der Fluoreszenzintensität mit Bildnachbearbeitungssoftware durch Schwellen auf einem Niveau, das Dreifache der Standardabweichung der Grundrauschen (3σ).
Ergebnisse
Durch die Verwendung von hier beschriebenen Protokolle 1, 2 und 3 wurde eine stimulierende Wirkung auf die Differenzierung neuronaler NG108-15 Zellen mit Gold-Nanopartikeln kultiviert beobachtet (Au NRs, Poly (styrolsulfonat) beschichteten Au NRs und Siliciumdioxid-beschichteten Gold-NRs) nach der Laser Expositionen zwischen 1,25 und 7,5 W · cm -2. Konfokale Bilder von rhodamineB markierten Au NRs gezeigt, dass die Teilchen wurden von Tag 1 der Inkubation 12 internalisiert. Die Lokalisierung wurde vorwiegend im Zytoplasma der Zelle beobachtet, was zeigt, dass der bevorzugte Mechanismus der Aufnahme war über die Zellkörpermembran 12. Die wichtigsten morphologischen Veränderungen nach der Induktion der Differenzierung in NG108-15 neuronalen Zellen nachgewiesen wurden, waren die Festnahme der Proliferation, der Ausdruck der βIII-Tubulin-Protein und das Auswachsen von Neuriten, die in Bezug auf die maximale Länge und die Anzahl 22 analysiert wurden.
Proben mit NRs kultiviert zeigte eine Neuritenlänge Anstieg am Laser irradirungs Ebenen hier gemessen (zwischen 1,25 und 7,5 W · cm -2). Kontrollproben (Zellen ohne NPs kultiviert und der Bestrahlung mit der gleichen Laserleistung) zeigten keine signifikante Längenänderung. Verwendung einer Bestrahlungsdosis von 7,5 W · cm -2, die endgültige Neuritenlänge der NG108-15 mit Au NRs kultiviert war etwa 36% höher (p <0,01) als die nicht laser-bestrahlten Proben. Dieses Verhalten war nicht spezifisch an die Oberflächenchemie der NRs verbunden. Diese Werte waren fast 20% größer als die von NG108 entwickelt -15 allein und auf den gleichen Wert der Laserbelichtung (p <0,05) 12 ausgesetzt Neuriten. Diese Ergebnisse stehen im Einklang mit früher veröffentlichten Studien über PC12 neuronalen Zellen mit piezoelektrischen Nanotubes mit Ultraschallstrahlung 7 kultiviert und bestrahlt.
Kontrollexperimente ohne Au NRs zeigte auch einige stimulierende Wirkung des 780 nm Licht in Prozent der Neuronen mit Neuriten und die Anzahl der neurites pro Neuron. Diese Stimulation war wirksamer bei niedrigeren Laserleistungen (1,25 W ∙ cm -2) mit einem anschließenden Rückgang auf höchstem Laserenergie (7,5 W ∙ cm -2) 12. Eine mäßige Stimulierung durch den NPs ohne Laserbestrahlung verursacht (Poly (styrolsulfonat) beschichteten und mit Kieselsäure beschichtete nur) wurde in dem Prozentsatz der Neuronen mit Neuriten 12 erfasst. Diese Ergebnisse sind in Übereinstimmung mit kürzlich veröffentlichten Beobachtungen, dass Gold-Nanopartikel können neuronale Aktivität in vitro 23,24 erhöhen, Fig. 2 zeigt ein Beispiel für Epifluoreszenz Bilder von differenzierten neuronalen NG108-15 Zellen alleine kultiviert (2A) oder mit Au NRs (2B ) und mit unterschiedlichen Laserleistungen (in der Figur angegeben) bestrahlt.
Das Potenzial für die foto-erzeugten intrazellulären Ca 2+ -Freisetzung wurde mit gepulsten NIR-Licht in Übereinstimmung mit den Protokollen 1, 2 beurteilt, und4. Calciumionen spielen eine wichtige Rolle in verschiedenen Zellaktivitäten, wie beispielsweise die Mitose, Muskelkontraktion und die Neuritenextension 25,26. In Reaktion auf einen Reiz, Ca 2+ zunimmt, schwingt, und verringert, was zur Aktivierung, Modulation oder die Beendigung einer bestimmten Zellfunktion. Kürzlich wurden Ca 2+ Transienten auch als Folge von IR-Laserbelichtung in Kardiomyozyten beobachtet. In dieser Arbeit, evoziert der Ca 2+ Antworten nach IR Exposition zeigten geringere Amplituden und schnellere Recovery-Zeiten, als die spontane Ca2 + Transienten 2, Fig. 3 zeigt ein Beispiel für NG108-15 neuronalen Zellen mit Fluo-4.00 geladen und mit einem bebilderten konfokalen Mikroskop. Fluo-4.00 wurde beobachtet, um die Zellmembran in einer nicht-störenden Weise gelangen können, was in einer im Wesentlichen gleichmäßige Verteilung des Indikators in das Cytoplasma der Zelle. Nur geringe Kern oder cytoplasmatische Organelle Färbung wurde erkannt. Wie zuvor angedeutetWurden NRs erwartet intrazellulär 12 angeordnet sein. NG108-15 neuronalen Zellen allein oder mit Au NRs und Poly (styrolsulfonat) kultiviert -beschichteten-Au NRs wurden danach mit Laserbestrahlungen ausgesetzt zwischen 0,07 J ∙ cm -2 und 370 J ∙ cm -2, mit der Laserfrequenz im Bereich modulierten von 0,5-2 Hz.
Abbildung 4 zeigt repräsentative Beispiele, wie die Amplitude der Antworten wurde als Funktion der Zeit abgebildet. Die Amplitude des Ca 2+ Antwort mit der Bestrahlung (4A - C) variiert, und wurde nicht beobachtet, konsequent von den Laserpulsen (4C) 13 ausgelöst werden. Die wahrscheinlichste Erklärung waren die vorübergehende Erschöpfung der intrazellulären Ca 2+ speichert unvollständigen Ca 2+ Lade 2 oder der unterschiedlichen Effizienz der NR Internalisierung in den neuronalen Zellen zurückzuführen. Wenn NRs nicht in cultur verwendete (Kontrollversuche, 4D) wurde eine stimulierende Wirkung des 780-nm-Licht beobachtet. Jedoch wurden in diesem Zusammenhang unteren Fluoreszenzamplitudenspitzen und geringere Wahrscheinlichkeit der Aktivierung (nur bei 16% der untersuchten Proben gefunden). Insgesamt eine 48% Wahrscheinlichkeit des NR Laser-induzierte Zellaktivierung wurde erreicht und trotz der Untergrundereignisse aufgrund der 780-nm-Licht, Belichtung des NR-behandelten Zellen zeigten höhere Stimulationseffizienz mit geringeren Laserenergie und höhere Gipfel der Antwort 13. In der Tat, die Calcium-Reaktion auf Peak bei 0,33 J ∙ cm -2 in der NR-behandelte Zellen gefunden wurde. Dieser wurde einer thermischen Inhibierung 13 zurückzuführen. Während der Experimente wurden keine Beweise für blebbing oder jeder anderen Form der Zellmembran Störung detektiert, was konsistent mit den Ergebnissen von Huang et al., Die zelluläre Photozerstörung mit einer relativ hohen Leistungsdichte von 19 W ∙ cm angegeben -2 4 angewendet min 27. Keine Spontanaktivität in den NR-behandelten Zellen wurde ohne Laserbelichtung aufgezeichnet.

Abbildung 1: Glasfaser Versuchsaufbau (A) und die mittlere Laserbestrahlungsstärken in Abhängigkeit von der Laserleistung für einen Laserstrahl der Fläche ist gleich 0,4 mm 2 (B). Strahlparameter sind: (A) der Halbwinkel der maximalen Lichtkonus aus der Faser austretenden (θ), der Strahlradius (r) und des Abstandes zwischen der optischen Faser und der Probe (d).
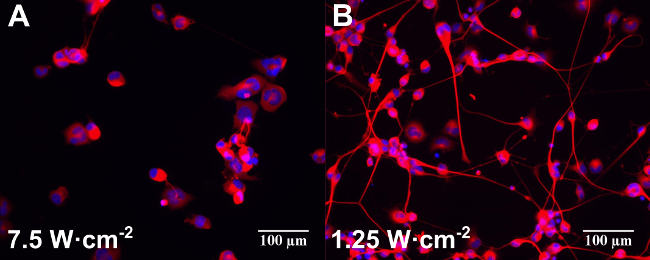
Abbildung 2: Beispiele für Epifluoreszenz Bilder von differenzierten neuronalen Zellen NG108-15 allein (A) kultiviert oder mit Au NRs (B) und mit unterschiedlichen Laserleistungen (in der Figur angegeben) bestrahlt. Die Proben wurden ieinen Tag vor der Laserbestrahlung ncubated. Die Zellen wurden fixiert und für die anti-β-III-Tubulin (rot) und DAPI (blau) drei Tage nach der Laserbestrahlung markiert. Maßstabsbalken sind 100 um.

Abbildung 3: Beispiel differenzierter NG108-15 neuronalen Zellen mit Fluo4-AM Ca 2+ Anzeige geladen Das Bild wurde unter Verwendung eines invertierten konfokalen Mikroskop mit einem 40x Ölimmersionsobjektiv aufgenommen..
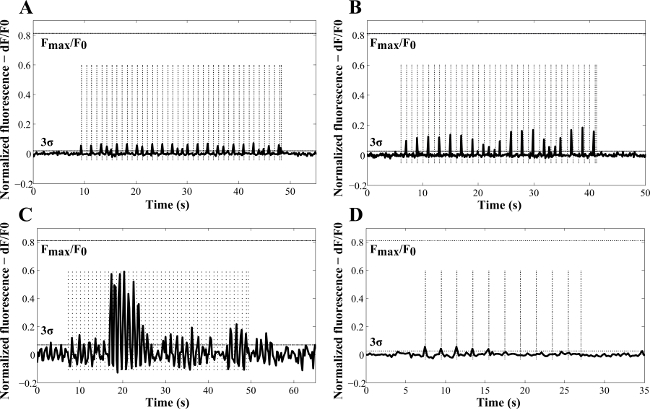
Abbildung 4: Repräsentative Beispiele für laserinduzierte Ca 2+ Änderungen als eine Funktion der Zeit in NG108-15 neuronalen Zellen in einem serumfreien Bedingungen für drei Tage kultiviert (A) Poly (styrolsulfonat) -Au NRs, (B, C) Au NRs, und (D) ohne NRs (Kontrollprobe). Diese Ergebnisse warenmit Laserpulsen von 100 msec (A, C, D) und 50 ms (B) erhalten. Die für die Versuche (gestrichelte vertikale Linien) verwendeten Frequenzen waren 1 Hz (A - C) und 0,5 Hz (D). Die berechneten Strahlungsrisiken waren 69,4 J ∙ cm -2 (A), ∙ 34,7 J cm -2 (B), 0,37 J ∙ cm -2 (C) und 138,87 J ∙ cm -2 (D). F max / F 0 die in NG108 -15 neuronalen Zellen erkannt maximale Fluoreszenzanstieg, aus Kalibrierung mit Ionomycin (mit Genehmigung 13 wiedergegeben).
Diskussion
Die in dieser Präsentation beschriebenen Protokolle beschreiben, wie Kultur, zu differenzieren und optisch zu stimulieren Nervenzellen mit extrinsischen Absorber. Die NR Eigenschaften (zB Abmessungen, die Form, Plasmonresonanzwellenlänge und die Oberflächenchemie) und die Laserstimulationsparameter (wie zum Beispiel Wellenlänge, Impulsdauer, Wiederholungsrate usw.) können variiert werden, um verschiedene experimentelle Bedürfnisse angepasst werden. Die Auswirkungen auf das Zellverhalten können mit Standard-biologischen Assays und Materialien überwacht werden. Insgesamt ist der Ansatz bietet eine einfache, aber leistungsfähige, Weg, um Zellpopulationen in vitro zu bestrahlen und könnte zu primären Zellen, Gewebeproben und in vivo Studien erweitert werden.
Die wichtigsten Anforderungen, die Au NRs müssen genügen, um für biologische Anwendungen verwendet werden, sind Stabilität (sowohl chemische und physikalische) und Biokompatibilität. Letzteres ist insbesondere dann kritisch, wegen der Anwesenheit eines kationischen Tensids (commonly CTAB) auf der Oberfläche der Au. CTAB ist bekannt, Zytotoxizität in vitro 28 und 29 in vivo zu induzieren, und es wird üblicherweise bei der Synthese verwendet, um die NR-förmiger Formation 30 anzutreiben. Stabilität und Biokompatibilität werden oft durch Aufbringen zusätzlicher Beschichtungen auf dem Au NR Oberfläche (zB Polyethylenglycol, Siliciumdioxid) 31 verbessert. Um die Biokompatibilität zu bewerten, können verschiedene Tests in vitro verwendet werden (zB Live / Dead, MTS, MTT, etc.), während die histologische Analyse wird oft während der Gewebe Experimente 7,8,12,15 geführt.
Eine weitere Herausforderung zu stellen, wenn Sie mit Nanomaterialien ist die Schwierigkeit der korrekten Bestimmung ihrer molaren Konzentration. Die Vielzahl von Nanopartikeln in Bezug auf Form, Größe und chemische Eigenschaften macht die Techniken derzeit nur für bestimmte Klassen von Teilchen geeignet. Zum Beispiel kann die Standard-dynamische Licht scattEring Methode geht davon aus, dass NPs eine sphärische Form und streuen das Licht isotrop 17. Daher Anwendung dieser Methode zu Au NRs ergibt Abweichungen zwischen der gemessenen Konzentration und die reale. Die Frage der NP-Konzentration ist besonders problematisch, wenn an die Nanobereich, wobei das verabreichte Konzentration muss präzise um die Wirksamkeit des Verfahrens (zB für die Arzneimittelabgabe-Anwendungen) zu maximieren und die Toxizität der Nanomaterialien 17 zu minimieren kontrolliert werden müssen. In den Studien, die hier berichtet, die optische Dichte verwendet, gute Ergebnisse in Bezug auf die Lebensfähigkeit der Zellen und die Partikelzahl.
Aufgrund ihrer intrinsischen Absorptionseigenschaften, Gold-Nanopartikel werden oft in Kombination mit einer Laserquelle verwendet. Während der Belichtung, Absorption und Streuung sind die beiden Hauptverfahren wahrscheinlich an der Oberfläche der Nanopartikel erfolgen. Wenn die Laserwellenlänge entspricht der Plasmon-Resonanz-Wellenlänge, Absorption oftVorrang vor Streuung, spannend die Leitungselektronen an der Oberfläche NP. Diese bilden ein Elektronengas, das sich von seiner Gleichgewichtsposition bewegt und erzeugt eine Resonanz kohärenten Schwingung genannte lokalisierte Oberflächenplasmonenresonanz (LSPR). Die Energie wird dann zu der NP-Kristallgitter als Wärme, die danach schnell in die Umgebung 32 abgeführt wird übertragen. Da Wärme ist die nach der Erregung des NR LSPR beobachtete Haupteffekt ist es ratsam, die Lebensfähigkeit der Zelle, nachdem die Laserbelichtung zu überwachen.
Es wurde vermutet, dass die beobachteten Effekte auf das Neuritenwachstum und die intrazelluläre Ca 2+ Wegs aufgrund der transienten Erwärmung aus Anregung des LSPR waren. Diese Hypothese ist in Übereinstimmung mit der Aktivierung des temperaturempfindlichen TRPV1 Kanal nach magnetischer Einwirkung von Ferrit NPs 5. Dieser Prozess ist auch im Einklang mit Beobachtungen, die thermisch empfindliche TRPV4 Kanäle play eine wichtige Rolle bei der Infrarot-Nervenstimulation 33. Auf molekularer Ebene wurde kürzlich gezeigt, dass TRPV4 ist thermo erst nach dem Zusammenwirken der Phosphoinositid -4,5 -biphosphate (PIP 2) mit dem Kanal 34. Daher ist es möglich, dass die transienten Erwärmung, die nach Anregung NR könnte dazu dienen, zu beschleunigen und / oder zu veranlassen das Öffnen der TRPV4 Kanälen. Freiem Medium und / oder Molekular Kontrollen des PIP 2 Verarmungs - diese Hypothese durch zukünftige Ca 2+ Experimente unter Verwendung Ca 2+ bestätigt werden.
Verschiedene Gruppen haben auch gezeigt, dass kleine Temperaturgradienten über den physiologischen Temperaturbereich kann verwendet werden, um andere Reaktionen, wie neuronale Wachstumskegel Führung 25 oder depolarisierenden Ströme in humane embryonale Nierenzellen 35 zu induzieren. Yong und Mitarbeiter einen deutlichen Anstieg der elektrischen Signal-Aktivität in primären auditorischen Neuronen Kultfiguriert mit Silica-beschichteten Au NRs nach Laserbestrahlung der NRs am LSPR. Die von den laserbestrahlten Partikeln hergestellt Heizung wurde mit Patch-Clamp-Techniken 14 gemessen. In jüngerer Eom et al. Einen Anstieg in der Amplitude des Cnaps nach Laserbelichtung von 3,4 × 10 9 Au NRs wenn kontinuierlich in der Nähe der Hülle der Nervenbündel eines Ischiasnervs der Ratte 15 perfundiert.
Die stimulierende Wirkung der während der Versuche beobachtet, 780 nm Laserdiode wurde nicht gebunden, die durch Wasserabsorption erzeugte Wärme, wie dies bekannt ist, bei 780 nm 36 vernachlässigbar. Früher veröffentlichten Ergebnisse wurden ebenfalls berichtet stimulatorischen Wirkungen von 780 nm Licht auf neuronale Gewebe in vivo 37,38. In vitro-Studien haben die Beteiligung von reaktiven Sauerstoffspezies in dem Prozess 39 gezeigt. Die detaillierten Mechanismen, durch die NIR-Stimulation wirkt sich jedoch Gen transcription und anderen zellulären Aktivitäten liegen noch ungelöst. Aktuelle Daten nahe, die Wechselwirkung der verschiedenen Effekte der Stimulation, einschließlich Absorptions Photon innerhalb Chromophore in den Mitochondrien 37,39-41 (nahezu 50% der Energie bei 780 nm können durch das Cytochrom-c-Oxidase absorbiert werden), Veränderungen in der Membrandurchlässigkeit für Calcium 37 und die Hemmung der Entzündungsaktivität in den Zellen 37.
Die Ergebnisse in diesem Manuskript vorgestellt zeigen, dass Nanopartikel-Absorber sind äußerst viel versprechend für zukünftige Anwendungen in der optischen Stimulation von Nervenzellen. Der große Vorteil liegt in der Fähigkeit der NIR-Licht, um in das Gewebe dringen tief (therapeutisches Fenster). Diese Ergebnisse zeigen auch, dass die Nanopartikel-Absorber können zu verbessern und / oder den Prozess der Infrarot neuronale Stimulation auf Basis von Wasseraufnahme ersetzen. Für zukünftige Anwendungen in der Neuroprothesen, wäre es von Interesse sein, unterschiedliche Oberflächen functionalizat untersuchenIonen mit chemischer Affinität für neuronale Axone, die die Hauptziele für viele optische Stimulationsanwendungen.
Offenlegungen
The authors have no competing interests to disclose.
Danksagungen
Die Autoren möchten NanoVentures Australien Reise finanzielle Unterstützung und Prof. John Haycock, dass sie diese Forschung an der University of Sheffield und Frau Jaimee Mayne teilweise gehostet für ihre Hilfe bei den Dreharbeiten zu bestätigen.
Materialien
| Name | Company | Catalog Number | Comments |
| Au NR | Sigma Aldrich | 716812 | |
| NG108-15 | Sigma Aldrich | 8811230 | |
| DMEM | Sigma Aldrich | D6546 | |
| FCS | Life Technologies | 10100147 | |
| L-glutamine | Sigma Aldrich | G7513 | |
| Penicillin/streptomycin | Life Technologies | 15140122 | |
| Amphotericin B | Life Technologies | 15290018 | |
| Formaldehyde | Sigma Aldrich | F8775 | |
| Triton X-100 | BDH | T8532 | |
| BSA | Sigma Aldrich | A2058 | |
| Anti-βIII-tubulin | Promega | G7121 | |
| TRITC-conjugated anti-mouse IgG antibody | Sigma Aldrich | T5393 | |
| DAPI | Invitrogen | D1306 | |
| Fluo-4 AM | Invitrogen | F14201 | |
| DMSO | Sigma Aldrich | 472301 | |
| Pluronic F-127 | Invitrogen | P6867 | |
| UV-Vis spectrometer | Varian Medical Systems Inc. | Cary 50 Bio | |
| Mini centrifuge | Eppendorf | Mini Spin | |
| Sonic bath | Unisonics Australia | FPX 10D | |
| Cell culture incubator | Kendro | Hera Cell 150 | |
| Cell culture centrifuge | Hettich | Rotofix 32A | |
| Laser diode | Optotech | 780 nm single mode fibre - coupled LD | |
| Optical fiber | Thorlabs | 780 HP | |
| Power meter | Coherent | Laser Check | |
| ImageJ | http://rsb.info.nih.gov/ij/index.html | ||
| Epifluorescent microscope | Axon Instruments | ImageX-press 5000A | |
| μ-slide well | Ibidi | 80826 | |
| Inverted confocal microscope | Carl Zeiss Microscopy Ltd. | LSM 510 meta-confocal microscope | |
| Oscilloscope | Tektronix | TDS210 |
Referenzen
- Richter, C. P., Matic, A. I., Wells, J. D., Jansen, E. D., Walsh, J. T. Neural stimulation with optical radiation. Laser. Photonics Rev. 5 (1), 68-80 (2011).
- Dittami, G. M., Rajguru, S. M., Lasher, R. A., Hitchcock, R. W., Rabbitt, R. D. Intracellular calcium transients evoked by pulsed infrared radiation in neonatal cardiomyocytes. J. Physiol. 589 (6), 1295-1306 (2011).
- Thompson, A. C., Wade, S. A., Brown, W. G. A., Stoddart, P. R. Modeling of light absorption in tissue during infrared neural stimulation. J. Biomed. Opt. 17 (7), 075002-075002 (2012).
- Thompson, A. C., Wade, S. A., Cadusch, P. J., Brown, W. G., Stoddart, P. R. Modeling of the temporal effects of heating during infrared neural stimulation. J. Biomed. Opt. 18 (3), 035004 (2013).
- Huang, H., Delikanli, S., Zeng, H., Ferkey, D. M., Pralle, A. Remote control of ion channels and neurons through magnetic-field heating of nanoparticles. Nat. Nanotechnol. 5 (8), 602-606 (2010).
- Farah, N., et al. Holographically patterned activation using photo-absorber induced neural-thermal stimulation. J. Neural. Eng. 10 (5), (2013).
- Ciofani, G., et al. Enhancement of neurite outgrowth in neuronal-like cells following boron nitride nanotube-mediated stimulation. ACS Nano. 4 (10), 6267-6277 (2010).
- Kim, J. A., et al. Enhancement of neurite outgrowth in PC12 cells by iron oxide nanoparticles. Biomaterials. 32 (11), 2871-2877 (2011).
- Myroshnychenko, V., et al. Modelling the optical response of gold nanoparticles. Chem. Soc. Rev. 37 (9), 1792-1805 (2008).
- Choi, W. I., Sahu, A., Kim, Y. H., Tae, G. Photothermal cancer therapy and imaging based on gold nanorods. Ann. Biomed. Eng. 40 (2), 534-546 (2011).
- Zhan, Q., Qian, J., Li, X., He, S. A study of mesoporous silica-encapsulated gold nanorods as enhanced light scattering probes for cancer cell imaging. Nanotechnology. 21 (5), 055704 (2010).
- Paviolo, C., et al. Laser exposure of gold nanorods can increase neuronal cell outgrowth. Biotechnol. Bioeng. 110 (8), 2277-2291 (2013).
- Paviolo, C., Haycock, J. W., Cadusch, P. J., McArthur, S. L., Stoddart, P. R. Laser exposure of gold nanorods can induce intracellular calcium transients. J. Biophotonics. 7 (10), 761-765 (2014).
- Yong, J., et al. Gold-nanorod-assisted near-infrared stimulation of primary auditory neurons. Adv. Healthcare Mater. , (2014).
- Eom, K., et al. Enhanced infrared neural stimulation using localized surface plasmon resonance of gold nanorods. Small. , (2014).
- Juste, J., Pastoriza-Santos, I., Liz-Marzán, L. M., Mulvaney, P. Gold nanorods: Synthesis, characterization and applications. Coordination Chemistry Reviews. (17-18), 1870-1901 (2005).
- Shang, J., Gao, X. Nanoparticle counting: towards accurate determination of the molar concentration. Chem. Soc. Rev. 43 (21), 7267-7278 (2014).
- Sharma, V., Park, K., Srinivasarao, M. Shape separation of gold nanorods using centrifugation. Proc. Natl. Acad. Sci. 106 (13), 4981-4985 (2009).
- Kaewkhaw, R., Scutt, A. M., Haycock, J. W. Anatomical site influences the differentiation of adipose-derived stem cells for schwann-cell phenotype and function. Glia. 59 (5), 734-749 (2011).
- Brown, W. G. A., Needham, K., Nayagam, B. A., Stoddart, P. R. Whole cell patch clamp for investigating the mechanisms of infrared neural stimulation. JoVE. (77), (2013).
- Cadusch, P. J., Hlaing, M. M., Wade, S. A., McArthur, S. L., Stoddart, P. R. Improved methods for fluorescence background subtraction from Raman spectra. J. Raman Spectrosc. 44 (11), 1587-1595 (2013).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Jung, S., et al. Intracellular gold nanoparticles increase neuronal excitability and aggravate seizure activity in the mouse brain. PLoS ONE. 9 (3), e91360 (2014).
- Salinas, K., Kereselidze, Z., DeLuna, F., Peralta, X., Santamaria, F. Transient extracellular application of gold nanostars increases hippocampal neuronal activity. J. Nanobiotechnology. 12 (1), 31 (2014).
- Ebbesen, C. L., Bruus, H. Analysis of laser-induced heating in optical neuronal guidance. J. Neurosci. Meth. 209 (1), 168-177 (2012).
- Iwanaga, S., et al. Location-dependent photogeneration of calcium waves in HeLa cells. Cell Biochem. Biophys. 45 (2), 167-176 (2006).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Determination of the minimum temperature required for selective photothermal destruction of cancer cells with the use of immunotargeted gold nanoparticles. Photochem. Photobiol. 82 (2), 412-417 (2006).
- Connor, E. E., Mwamuka, J., Gole, A., Murphy, C. J., Wyatt, M. D. Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity. Small. 1 (3), 325-327 (2005).
- Isomaa, B., Reuter, J., Djupsund, B. M. The subacute and chronic toxicity of cetyltrimethylammonium bromide (CTAB), a cationic surfactant, in the rat. Arch. Toxicol. 35 (2), 91-96 (1976).
- Juste, J., Pastoriza-Santos, I., Liz-Marzán, L., Mulvaney, P. Gold nanorods: synthesis, characterization and applications. Coord. Chem. Rev. 249 (17-18), 1870-1901 (2005).
- Dreaden, E. C., Alkilany, A. M., Huang, X., Murphy, C. J., El-Sayed, M. A. The golden age: gold nanoparticles for biomedicine. Chem. Soc. Rev. 41 (7), 2740-2779 (2012).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Plasmonic photothermal therapy (PPTT) using gold nanoparticles. Lasers Med. Sci. 23 (3), 217-228 (2008).
- Albert, E. S., et al. TRPV4 channels mediate the infrared laser-evoked response in sensory neurons. J. Neurophysiol. 107 (12), 3227-3234 (2012).
- Garcia-Elias, A., et al. Phosphatidylinositol-4,5-biphosphate-dependent rearrangement of TRPV4 cytosolic tails enables channel activation by physiological stimuli. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9553-9558 (2013).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. -. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nat. Commun. 3 (736), (2012).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Müller, G. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J. Biomed. Opt. 4 (1), 36-46 (1999).
- Byrnes, K. R., et al. Light promotes regeneration and functional recovery and alters the immune response after spinal cord injury. Lasers Surg. Med. 36 (3), 171-185 (2005).
- Wu, X., et al. 810 nm wavelength light: an effective therapy for transected or contused rat spinal cord. Lasers Surg. Med. 41 (1), 36-41 (2009).
- Grossman, N., Schneid, N., Reuveni, H., Halevy, S., Lubart, R. 780 nm low power diode laser irradiation stimulates proliferation of keratinocyte cultures: involvement of reactive oxygen species. Lasers Surg. Med. 22 (4), 212-218 (1998).
- Wong-Riley, M. T. T., et al. Photobiomodulation directly benefits primary neurons functionally inactivated by toxins - Role of cytochrome c oxidase. J. Biol. Chem. 280 (6), 4761-4771 (2005).
- Beauvoit, B., Kitai, T., Chance, B. Contribution of the mitochondrial compartment to the optical properties pf the rat liver: a theoretical and practical approach. Biophys. J. 67 (6), 2501-2510 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten