Method Article
開発の初期段階での切開およびゼブラフィンチ胚のダウンストリーム解析
要約
The zebra finch (Taeniopygiaguttata) is a valuable model organism; however, early stages of zebra finch development have not been extensively studied. The protocol describes how to dissect early embryos for developmental and molecular applications.
要約
キンカチョウ(Taeniopygia滴状 ) が毒性学1、2、行動3、およびメモリを含むと4,5,6の学習、研究の多くの分野でますます重要なモデル生物となっています。配列決定されたゲノムを有する唯一の小鳥のように、キンカチョウは、発達研究に使用するための大きな可能性を秘めている。しかし、キンカチョウ開発の初期段階では十分に研究されていない。キンカチョウの開発における研究の欠如は小さな卵、胚の解剖の難しさに起因することができます。以下の解剖法は、胚発生のすべての段階での形態および遺伝子発現の調査のために可能にする胚組織の損傷を最小限に抑えることができます。これは、明視野の両方を可能にし、胚の品質蛍光イメージングは、例えば、in situハイブリダイゼーション (ISH)、細胞増殖アッセイ、ならびに定量的なレア定量的アッセイのためのRNA抽出のような分子の手順で使用L-リアルタイムPCR(qtRT-PCR)である。 この手法は、研究者がアクセスするために以前に困難であった開発の初期段階を研究することができます。
概要
この技術の全体的な目標は、発生研究の広い範囲で使用するための胚発生の初期段階からのキンカチョウ(Taeniopygia滴状 )の胚を得ることである。キンカチョウが 優勢小鳥のモデル生物となっており、毒性学1,2、行動3、メモリ、および4,5,6、比較神経解剖学7,8を学習し、言語発達9,10など、様々な分野で広く使用されている。配列決定されたゲノムを有する唯一の小鳥のように、キンカチョウは、既知の種の鳥11、12,13の50%以上を表しスズメ目秩序の分子および遺伝学的研究を可能にする。
フィールドの多様な成人および若年キンカチョウの使用にもかかわらず、いくつかの研究では、特に開発の初期段階で、キンカチョウの胚で実行された。これは、その卵aの小さいサイズに起因することができND胚、および鶏( ニワトリ )が以前に優勢なモデルシステムの17,18,19,20,21として使用された研究のためのモデル生物14,15,16としての新しい地位。しかし、非ボーカル学習者として、鶏は、発声学習、遺伝、行動、運動学習10に関わる皮質-大脳基底核回路の開発を発声学習の遺伝的基礎を研究するための適切なモデル系ではありません。
これは、キンカチョウの胚は、はるかに繊細で、より簡単に破損切開および分子処置中のニワトリ胚よりもあることに留意することが重要である。キンカチョウの胚での透過処理の手順を実行する際に特に、大きな注意が必要です。ニワトリ胚に害を与えないであろう強い洗剤や酵素はキンカチョウの胚が損傷することがあります。一般的なケアの観点からは、インキュベーター内での配置の前に小さなカップにキンカチョウの卵を入れることが必要であるローリング時にインキュベーション中に破損するのを防ぐため。
キンカチョウ簡単かつ多産飼育下で一年中繁殖、行動研究に適している、とボーカルの学習者である。これらの特性は、キンカチョウの使用は、開発を統合したモデル生物の必要性、遺伝学、および言語の行動の側面に対処することができます。キンカチョウ22に固有の最近開発されたステージングガイドと組み合わせて、以下に詳述解剖法は、キンカチョウ、ますます便利標準化された発達モデル生物にする。しかし、初期段階の胚を得ることが困難なことができます。このプロトコルは、研究者が簡単に初期胚を取得することができます。キンカチョウでの複雑な行動、または他の小さな開発に対する毒性効果の早期開発と分子の発達の基礎を調査する研究は、スズメ目の鳥は、この解剖の方法論が役立つでしょう。
プロトコル
倫理声明:メソッドはウィリアム&メアリーカレッジの繁殖コロニーから家畜化キンカチョウを行った。すべての手順は、RSPCAのガイドライン23に続き、ウィリアム·アンド·メアリーOLAW(実験動物福祉事務所)動物福祉保証(#のA3713-01)の大学によって承認されたと(#2013から06施設内動物管理使用委員会(IACUC)の承認を持っていた - 02から8721 - dacris)。
1。卵の収集とインキュベーション
- 暗サイクル:午後02時10光にキンカチョウのペアを確立します。食料、水、干し草、および巣箱を自由に指定してください。注意:キンカチョウのための日常のお手入れや繁殖がうまく23を説明してきた。
- 傾斜棚標準ひよこインキュベーターを準備します。注:37.5にて人工インキュベータを維持日常的に培養器の底部に水を添加することによって、湿度95% - - 80°C(+ / 1)。インキュベーターは、2日間平衡化させ使用する前に。
- インキュベーター内で卵を保持するために、少なくとも2.5 cm深い、小さなフィードカップ(5×7.6センチメートル)を選択します。ボトムライン、ペーパータオルの二つの層を有するカップの下縁まだ卵が容易に転動させながらカップは、パディングされるようにする。インキュベーターの傾斜棚にこれらのカップを置きます。注意:あまりにも多くのパディングがローリングを抑制することができ、原因シェル内部に胚の接着に成功したインキュベーションを防ぐであろう。
- 光サイクルの開始後2時間で卵を収集します。注意:これは親のインキュベーションのために与えられたインキュベーション時間のための段階の開発の矛盾を最小限に抑えます。
- 卵の長さに沿った先端部と基部の親指と人差し指で軽く卵を拾う。巣から集め敷設日付と時刻にラベルを付けるために鈍い、柔らかい4Bグラファイト鉛筆を使用してください。注記:より柔らかい4Bの鉛筆が壊れやすい卵の殻を破っ鉛筆のリスクを低減します。
- 各Cで5ラベルの卵 - 1.3.2)1を配置しますインキュベーター内で卵は自由にシェルの内部に胚付着を防止することができるように、ロールアップ。注:カップに5つ以上の卵を配置すると、個々の卵の転がりを防止し、胚の生存率を減少させることができる。
卵から胚の2。取り外し
- 解剖の準備をするには、以下の資料を揃えます。きれいなメスで、細かい傾いて鉗子、および2極細先端鉗子を。 10×10センチの切開のためにきれいな、非吸収性の表面を提供するために、解剖スコープのベースに、紙の重さに配置します。注:卵黄の容易な操作を可能にし、メスで繊細な膜をカットするための最良の面であるため、秤量紙が非常に重要です。
- を50mlポリプロピレンチューブリン酸緩衝生理食塩水(1×PBS)のアリコートを調製し、少なくとも3つの転送ピペットおよび小さな廃バケットを取得する。胚を固定する場合は、4%パラホルムアルデヒド(PFA)のアリコートを調製注意:PFA蒸気は毒性で、D PFAを含むすべてのステップは、露出を最小限にするためにヒュームフード内で行われるべきである。 Flashは胚を凍結した場合、液体窒素を取得し、解剖スコープの近くに保管してください。無菌性は、この解剖プロトコルの問題ではなく、すべての材料が汚れていないことを確認してください。
- キンカチョウステージングガイド22で説明したように所望の段階に必要な時点でインキュベーターから卵を取り出します。注:22 12胚( 図3A)の段階を分析するために、ステージ6の胚( 図4A)22 を分析し、インキュベーションの56時間後に卵を除去するために、インキュベーションの36時間後に卵を削除します。
- 光ファイバー照明ランプを用いて、内部を照明するために、卵を介してその縦軸に沿って光輝き、それを保持することによって卵ロウソク。卵の背後にある光の先を置き、卵黄と発生中の胚を見つけます。
- 卵黄反対側にメスを置き、端から端まで卵に沿って切断かすかな圧力でベース。
- 慎重に親指と人差し指で卵の先端とベースに圧力を加えて卵の内容を削除するか、優しく鉗子で切断とともに卵殻を離れて詮索好きなことで。卵黄を優しくロールアウトするよう直接秤量紙の上に卵を開きます。
- 胚発生を囲むかすかな白い輪のように見えている、接合部の白いゾーンの卵黄を調べ、胚中心に位置するように極細先端鉗子を使用して卵黄を向けます。
注意:卵黄の表面にかすかな白い円が認められていない場合は、細かい鉗子を取り、優しく胚は卵黄の上になるまで、卵黄をロールオーバーする。注意:ステージ1 - 9 22、胚性ディスクは、直径が6mm未満であると卵黄の表面にかすかな、わずかに不透明ディスクとして表示されている-の基準については図1を参照してください。ステージ10歳以上の22のために、血液プールは、改善されたVを許可胚のisibilityが、これは困難な胚を見つけますように、卵黄嚢を穿刺しないように注意してください。
胚体外組織からの胚の3。分離
- 圧力( 図1B)を緩和するために卵黄の端を穿刺し、胚のディスクと一緒に卵黄の直径の長さにわたって単一のカットを行います。胚を含有する卵黄の断面が正常( 図1B)によって分離されるまで、これらの対角線を繰り返し行う。注:この手順は卵黄質量がそのまま残ることを可能にするが、胚中心に切断する際に卵黄の表面に減圧は、より精度を可能にし、胚の構造への損傷を防止する。
- ホールピペットと卵黄のエッジを削除します。注:可能な限り卵黄を削除したが、胚が秤量紙と涙の乾いた表面に付着しないように、少量のままにしておきます。
- ディスペンサーによる胚ディスクを洗う胚の底部に向かって45°の角度で1×PBSをING。隣にはなく、上記の胚のディスク転送ピペットの先端を置きます。付加的な卵黄を除去する必要がある場合は、ペトリ皿に胚を転送する前に、秤量紙の上で外科用メスを有する任意の卵黄を分離する。注意:この方法は、秤量紙の表面から胚を削除します。
- 小さなプラスチック製のペトリ皿に1×PBSの最小容量と一緒にホールピペットを用いて、胚を転送します。直接ではなく、胚、上に、シャーレにより1×PBSを加えて、近くに1×PBSを滴下して胚を洗浄します。洗って除去残留卵黄を、ペトリ皿を傾けて、ホールピペットで廃棄物1×PBSを除去するためのペトリ皿を旋回。
NOTE:1X PBSが除去されると、プラスチック表面が残留1X PBSで滑りやすいので、胚が典型的にペトリ皿の底に付着しない。胚は皿に付着した場合は、より多くの1X PBSを添加することができる。
Tを固定した場合彼は、胚、ステップ3.5および3.6に従ってください。フラッシュ胚を凍結した場合は、すぐに3.8に進みます。 - in situハイブリダイゼーションのための胚を固定した場合は、すぐに胚を沈めるためにペトリ皿に4%PFAを追加。それを平らにするために、胚の上に直接、4%PFAを垂らし;これはカール胚を防ぐことができます。 12時間4℃で4%PFA中で胚を固定します。
- 固定後、100パーセントMeOH中、-20℃で段階的メタノール(MeOH)ソリューション、店舗内の胚を脱水。
- 胚はステージ1の間にある場合- 8 22、胚に付着した卵黄膜を除去します。注:このステップは、固定中または後に行うことができる。彼らは卵黄膜に付着ので、ステージ8 22歳未満の胚を簡単に図2(a)に示すように、キー構造が不明瞭に、可視化されていません。
- グリップ極細ピンセットとの接合部の区域を越えて延びている膜のエッジ。 Carefully残留卵黄顆粒を洗い流すと卵黄膜に胚ディスクの付着を緩めるために、複数回にわたって胚を反転させます。注:これは、胚の構造を損傷するように、胚の中心に手を触れないでください。
- ギャップジャンクションのゾーンと卵黄膜との間で表示されない場合は、ゆっくりと卵黄膜からそれを緩めるために極細先端の鉗子との接合部の区域を傷つける。グリップ極細と卵黄膜は、鉗子を傾け、ゆっくりと離れて胚から引き出します。必要に応じて、ゆっくりと接合部の帯に胚ディスクの周縁部を把持して離れて卵黄膜から胚を引き出します。
- 除去した後に、バイオハザード1廃棄物(バイオセーフティレベル1)中の卵黄膜を捨てる。
- 若い胚のステージ上のISHアッセイを行う場合には、ニワトリ胚24、25のための標準的なホールマウントISHのプロトコルに従いますが、以下の提案を考慮してください。
- ISH手順中の胚への損傷を低減するために、各胚のためのねじキャップで単一の5mlガラスバイアルを使用する。胚が完全に水没していることを確認して、溶液3ml - わずか2でバイアルを埋める。旋回装置に固定されている発泡スチロールラック(またはセキュアバイアルを保持する任意のラック)に5ミリリットルバイアルを配置することによって垂直方向に章動バイアル。注意:この予防措置は、水平ニューテーション時にバイアル瓶の蓋に接触したときに発生する可能性のある、引き裂かれるの胚を防ぐことができます。
- 胚のステージ0の場合は- 6 22、室温で5分間1X PTwは5μg/ mlのプロテイナーゼKで処理する。バックグラウンド染色を減少させるために10 37℃で10分間1X PTwは内μg/ mlのプロテイナーゼKで12 22 -治療胚は7を上演した。
- 12時間、10μg/ mlのプローブ濃度と共にインキュベート、10 22 -段階1中の遺伝子発現の低いレベルを検出するために十分な呈色反応を生成する。古い段階のために、1&#でインキュベート956; 60℃でグラム/ mlのプローブ濃度
- 解剖次のペトリ皿に3ミリリットル1X PBSおよび卵黄顆粒から胚を分離するシャーレを傾け - フラッシュ凍結胚は、すぐに2を追加した場合。液体を除去し、2繰り返す - すべての卵黄を削除するには3回。細かい使用すると、-80℃で保存する前に予め標識マイクロチューブと液体窒素中でフラッシュ凍結に鉗子、移植胚をひっくり返した
4。のEdU細胞増殖アッセイ。定款とゼブラフィンチ胚におけるのEdUの検出。
- 胚または卵黄を検索する光ファイバー照明ランプを用いて卵キャンドル。
- 胚をマイクロインジェクションプロセス中に損傷を受けないことを確実にする卵内の胚又は卵黄の場所にマーク卵の反対側。
- ライン粘土と60ミリメートルのプラスチック皿所望の向きに卵を保持するために、ボウルの形状でそれを金型。マークされたスポットは、あるべきマイクロマニピュレーターを用いてマイクロインジェクション針の挿入を可能にするように方向付け。注:粘土は、マイクロインジェクションの間に、ステップ4.11でのインキュベーションを通して卵を安定します。
- 2ガラスキャピラリーマイクロインジェクション針を引き出します。マークされたスポットで卵に穴を突くために1針を鈍ら。鉱物油とそれをバックロードとマイクロインジェクターに挿入して注入のための第二のマイクロインジェクションの針を準備します。
- マイクロインジェクターで59.8 NLに注射あたりに放出溶液の容量を設定します。
- 10 mMストックのEdU溶液によるマイクロインジェクション針をロードします。
- 卵の空洞にシェルのシェルまたはドロップ部分を粉々にしないように注意しながら、鈍化ガラスキャピラリーでマークされたその場で殻に穴を作成します。オリエント卵穴マイクロインジェクション針が卵黄または胚に空洞を介して直接挿入することができるように、45°の角度になるように。
- マイクロマニピュレーターを用いて、挿入ロード針キャビティへ約1.0センチメートル。
- 直接胚や卵黄にEdUの液の所望の量を注入する。注:EdUを478 nlの最大は、胚の死を生じることなく注入することができる。
- すぐに卵とインキュベーション中の胚の乾燥を防ぐために料理をカバーするためにラップの複数の層で卵と粘土ホルダーをラップします。インキュベーション中アンラップからプラスチックを防ぐために、皿の底にプラスチックラップの端をテープで固定します。注意:プラスチック製のラップは解剖直前に削除する必要があります。
- 所望の段階に到達するまで、新たに増殖している細胞は、37℃でインキュベートすることによって卵のEdUを組み込むことを可能にする。注入後、培養器内の棚を傾けるに卵を返しません。インキュベーターの内側で安定した面のプラスチック包装された粘土並ぶ料理を置きます。
- プラスチック製のラップを外し、前述のプロトコルに従って、胚を解剖。4%PFA中で胚を固定し、上記のように、4℃で12時間インキュベートする。固定後、さらなる分析まで-20℃で新鮮な100%EtOH中で5分間、店舗100%のエタノール(EtOH)で洗浄する。
5。のEdUは、反応プロトコル」をクリックして "
以下のステップは、すべてのガラスバイアル中で行われる。
- 次の連続5分間の洗浄で胚を再水和:
- エタノール、75%エタノールおよび25%滅菌脱イオン25%EtOHおよび75%1X PTwは、100%1X PTW、(SDD)水、50%エタノールと50%のSDDの蒸留水
- 10分ごとに100パーセント1X PTwは中3回洗浄する。
- 水(90μlの)は、SDD 9部に10×緩衝原液(10μL)の1部分を組み合わせることにより、反応緩衝液添加剤(キットの部品F)を希釈します。
- 次を混合することにより、別のチューブ中の反応ミックスを調製する:875μlの1×PBS、20μLのCuSO 4、5μL、アジ、希釈し100μlの反応緩衝添加剤。注:反応混合物の容積は縮小することができる。胚が完全に反応混合物に覆われている場合は、反応が動作します。使用直前に希釈された反応バッファー添加剤(ステップ5.3)を追加します。全ての後続ステップは暗所で行われる。光から保護するために、ホイルで胚をカバーしています。
- アルミホイルでバイアルを覆い、かつニューテーターに取り付けられたスタイロフォームのラックに入れて、2時間室温で垂直にインキュベートする。
- 10分ごとに新鮮な1×PBS中で胚を3回洗浄します。
- 4℃で一晩新鮮な4%PFA中で胚を培養する
- 4℃で新鮮な1×PBS中で10分間ずつ、ストア用に1×PBSで3回洗浄するさらなる分析までホイルで胚をカバーしています。
結果
卵黄膜(A)に取り付けられており、卵黄(B)から胚を分離するための適切な方法を実証しながら、図1に図示のステップは、胚の外観を示している。胚は卵黄膜よりもはるかに軽い接合部のゾーンによって同定することができる。卵黄が切除されるまで、胚自体は区別することがしばしば困難である。胚を卵から切除されると、それを固定することができ、またはフラッシュは、将来の使用のために凍結した。 in situハイブリダイゼーションを解剖胚に予定されている場合は、接合部のゾーンを経由して胚に接着されている卵黄膜を除去する必要がある。この膜は、(C)は解消されると、2の胚の視認性を向上を示している図 、卵黄膜(A、B)を剥離すると、適切な方法。切開および固定後、全体のin situハイブリダイゼーションマウントを図3(A、A '、B、Bに示すように実施した')および図4(A、A'、B、B ')および図5(A、B、C)orthodenticle ホメオボックス2(のOtx2)発生的にメチル水銀の低用量に曝露胚における発現の差を検出する。図5は図背景の欠如を示すセンス·プローブの結果、。対照胚はステージ6 22(A、Aに展開しながら、 図4では、同じ時点で卵から切除されているにもかかわらず、発達メチル水銀(メチル水銀)に曝露胚をステージに5 22(B、B ')を、進行した')。解剖し、 図4に示された胚の群は、巣から採取し、同じ時点でインキュベーターから採取した。いくつかの自然変動が現像中に存在するが、以前の解剖データに基づいて、インキュベータ内の温度変動のみ2.4 ppmのメチル水銀胚develoの原因であるとは考えられないpmentally遅れる。段階における差異は発達メチル水銀に曝露胚における細胞増殖の変化を示す。
解剖前に、EdUのは2日目の卵に注入し、一晩インキュベートさせた。ステージ16〜22の胚の切開および固定後、EdUのは、 図6(A、B、C)に示すように、増殖細胞の検出を可能にする、「クリック」化学を用いて可視化した。それは、発達の進行を妨害する可能性メチル水銀への曝露など、インキュベーター内および解剖中に卵を配置したり、EdUのアッセイを実行するときに慎重に時間点を監視することが重要である。最古の注射は、ステップ1.3で指定されたコレクションの日であった0日目、上で行った。この胚は(ステージ7 22)は、約38時間後に解剖した。生存率であれ噴射量が478 nlの下にあったとして、約90%(対照胚と同じ速度)であった。
この切開法は、高品質のRNA抽出を可能にする。ステージ16は22の胚を解剖した後、RNA抽出は、図7に見られるように、必要な最適化なしで、製造業者のプロトコルに従って行った。卵黄膜の除去は、RNA抽出およびそれ以降のqRT-PCR用途には不要であった。
注:前方および後方領域は、それぞれ、画像の上部と下部にあるように全ての胚の数値は配向されている。

図1。キンカチョウの胚を見つけると解剖の手順は、1月10日22ステージ 。かすかな白いディスクは、(A)は明らかであるまで静かに卵黄を圧延することにより、胚の位置を確認します。一度胚卵黄の中心に位置し、卵黄を最初のカット(1)と後続の切り込み(2)である接合(ZJ)のゾーンを縁卵黄膜の圧力を軽減する段階的(B)に切開し卵黄膜に付着した。スケールバーは1ミリメートルを表しています。
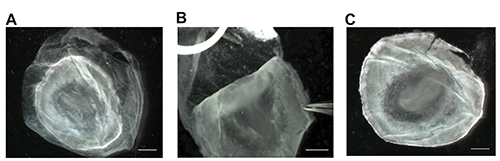
図2。卵黄膜と胚の構造の可視性の除去。卵黄から胚を除去した後、4%PFAを含むペトリ皿内の場所胚。 in situハイブリダイゼーションを行う必要がある場合には、胚性構造体の視認性が不可欠であり、卵黄膜(A)を除去することによって達成することができる。必要に応じてグリップ卵黄膜極細先端ピンセットで、ゆっくりとでは、最も外側のエッジで直接胚を処理することで、離れて胚からそれを剥がす(B)。卵黄膜の除去は、胚性構造体の透明度を増加させ、胚をin situハイブリダイゼーション (C) 中で画像化または処理することができる。スケールバーは1ミリメートルを表しています。 この図の拡大版を表示するには、こちらをクリックしてください。

図3。ホールマウントin situハイブリダイゼーションは 、発達 orthodenticleホメオボックス2(のOtx2)のメチル水銀。発現パターンにさらさキンカチョウ胚で実行が 0.0 ppmのメチル水銀(A、A ')および2.4 ppmのメチル水銀(B、Bに曝露された胚に特徴づけられた')親の食生活を経由。 DOのOtx2のRSAL(A)および腹側(A ')式は、ステージ12〜22の間、中脳および視神経小胞を通して見える。治療群の胚は、同じ時点で解剖したが、背側(B)に示すように、発達遅延しそして、ステージ11 22略語の特徴であるヘッド構造の腹側(B ')ビュー:MB、中脳; OP、眼胞。スケールバーは1ミリメートルを表しています。
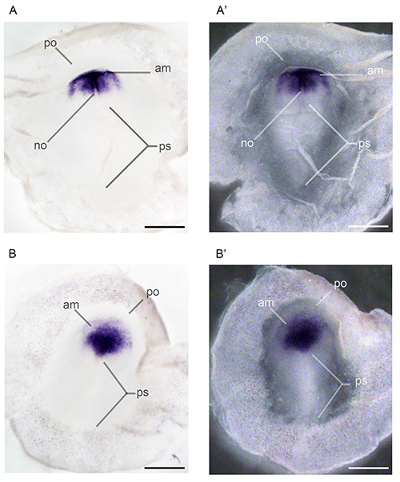
図4。ホールマウント 原位置で ハイブリダイゼーションは、発達メチル水銀にさらさキンカチョウ胚で実行。orthodenticle ホメオボックス2(のOtx2)の発現パターンは、6 22エンブリー段階で特徴づけられた OSは、0.0 ppmのメチル水銀(A、A ')とステージ2.4 ppmのメチル水銀(B、Bにさらさ5 22胚'親の食生活を介して)に暴露した。略語:AM、中胚葉の前縁;いや、脊索、脊索中胚葉; PO、proamnion、前原口; PS、原始線条22。スケールバーは1ミリメートルを表しています。
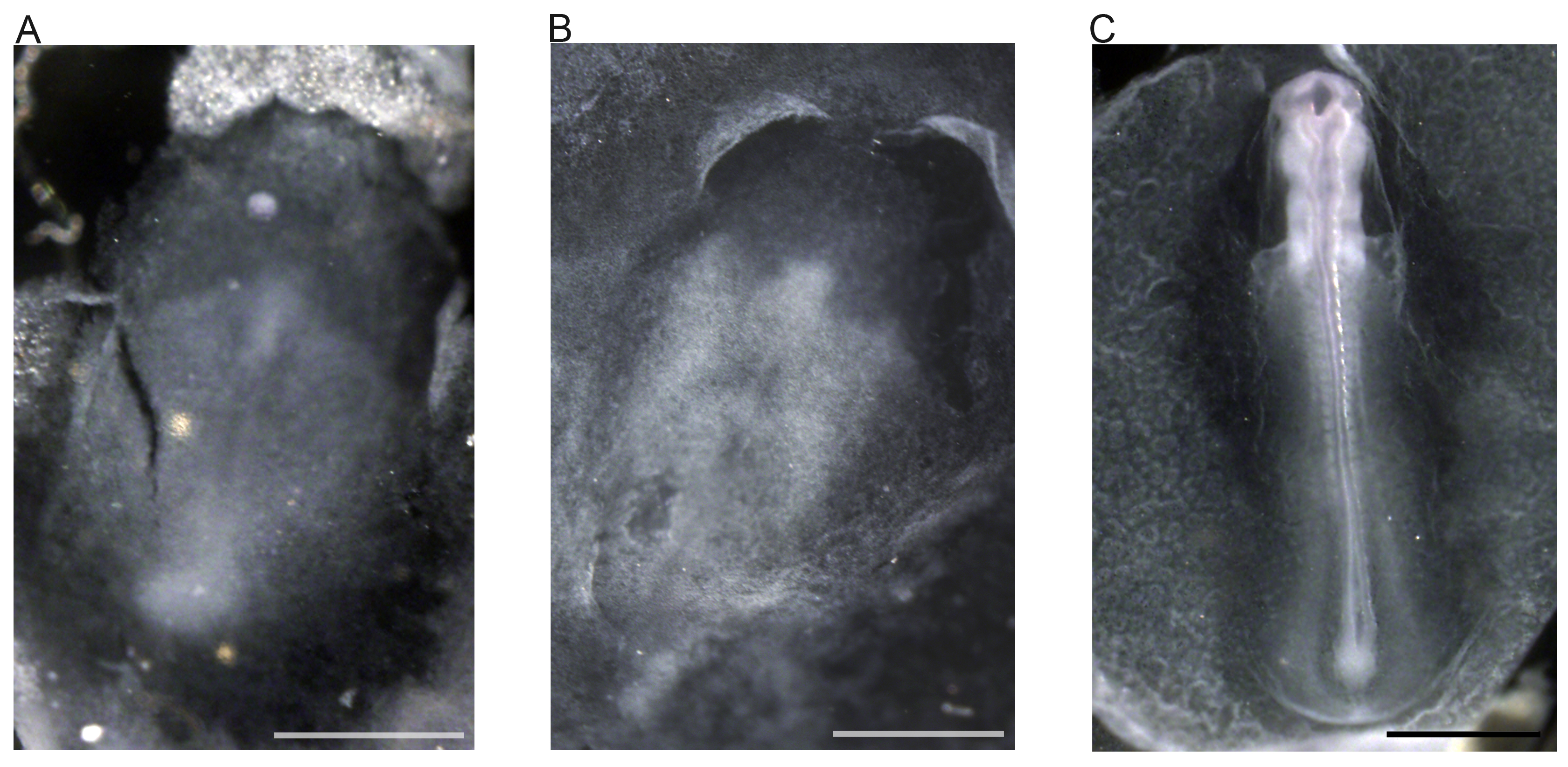
図5。 その場でのホールマウント ハイブリダイゼーションは、センスプローブを用いたキンカチョウ胚で実行。(A)ステージ5 22胚(B)は、初期の段階6 22胚(C)ステージ11 22胚。スケールバーは1ミリメートルを表しています。
6 "SRC =" / files/ftp_upload/51596/51596fig6highres.jpg "/>
図6 EdUの取り込みおよびキンカチョウ胚におけるデ各機能を備えています。EdUの化学はステージ16〜22の胚(A、B、C)で増殖している細胞を検出するために使用された「クリック」。 EdUのチミジン26,27の代わりにDNAに組み込まれ、クリックケミストリー27を用いて検出される。増殖は体節の側縁部と尾芽ではっきりと見える。パネルAは、胚の後部で独占的に発生して増殖を示し、また、個々の増殖性細胞を示す。パネルBは、全胚における増殖位置を示しています。パネルCは、前方領域を示しており、より詳細に高度に増殖性の終脳(TE)を示す。略語:AF、羊水倍; FLB、前肢芽; HLB、後肢芽;ル、レンズ小胞; MS、中脳; MT、後脳; OPC、眼杯; PA、咽頭弓; SM、体節中胚葉; TB、尾芽胚; TE、終脳。スケールバーは1ミリメートルを表しています。 この図の拡大版を表示するには、こちらをクリックしてください。
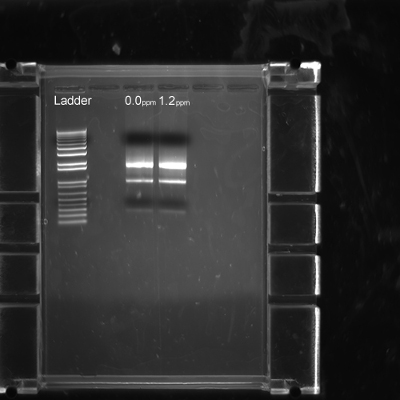
図7。に解剖キンカチョウ胚から抽出したRNAの品質。制御(0.0 ppm)のステップ3.8で説明したように1.2 ppmのメチル水銀胚を解剖し、フラッシュが凍結した。各レーンは、各治療群から2均質化された胚から抽出したRNAを示しています。
ディスカッション
発生学的ステージングガイド22およびゲノムアノテーションの最近の開発は、キンカチョウの発達研究のために望ましいモデル生物にする。しかし、ステージ1で3〜7ミリメートルの範囲キンカチョウ胚のサイズが小さく、脆弱性- 10 22、11、14解剖が困難になります。検索ときれいに卵黄の表面から胚を除去することは困難な場合があります。このプロトコルは、簡単に手順を実行するために十分な詳細を提供します。このプロトコルは、一般的に知られていない重要なステップを示していますが、成功した解剖を確保するために必要である。例えば、スティッキング排除する秤量紙の胚および卵黄シートとの間の小さな層を残すことが不可欠である。
胚の同定および除去の両方が困難であることができる。それが持っているの後に卵黄の表面に胚を特定するトラブルシューティングを行うには、直接、卵黄の上に光を当てる卵から取り出し、胚を見つけるために45°の角度で卵黄を見られて。胚が見つかると、胚を引き裂くしないように注意しながら、紙の重さに卵黄を切った。
構造のより良い視覚化のために、8〜22 -更なるアプリケーションは、解剖学的な違いを画像化を含む場合には、in situハイブリダイゼーション 、又は細胞増殖アッセイでは、段階1で卵黄膜を除去することが重要である。初期段階では卵黄や卵黄膜を除去する際に問題が発生した場合は、胚性脆弱性を減らすために1×PBSでそれを洗う前に、4%PFA中で胚を固定します。説明したように、第1解剖中に卵黄膜を除去することにより、構造体はin situハイブリダイゼーションを行った後に明らかにキンカチョウ胚に表示し、完全な状態である。
のEdUの制限は、胚性致死に478 NLリード以上の投薬量の投与である。しかし、広大な投与量範囲はvaryinができます増殖性細胞タギングのGレベル。
本キットに使用される「クリック」反応は銅(I)触媒による - アルキン - アジド-環化(銅(I)、AAC)です。この特定の反応において、アルキン含有チミジンアナログ分子(のEdU)は活発に分裂する細胞として援用される。 EdUのアルキン基は、DNAのらせん構造から突出しており、遊離アルキン基に結合し、緑色蛍光分子にコンジュゲートアジド分子への曝露によって検出される。緑色蛍光は、胚で新しく増殖している細胞を示している。これらの反応種は、生物において天然には存在しないので、アジドとアルキン基のバイオ直交性は、非特異的染色を阻止する。 DNAは、反応が起こるために変性する必要がないため、また、更なるDNA依存性分析が容易に27を行うことができる。
このメソッドの固有の制限は小型で断片であるキンカチョウ胚のility。慎重に行われていない場合は、15 22損傷胚の構造になることができます-胚の卵黄膜を除去すると、1ステージ。しかしながら、このプロトコルは、研究者は、以前に徹底的に研究されていない構造異常および遺伝子発現を調べるために初期胚の段階を使用できるように、切開法を単純化する。このプロトコルは、研究者は大人の表現型の発生起源を決定することができますセルラー分子アッセイの過多のための道を開く。例えば、遺伝子発現は、種々の環境条件下で発声学習に関与し又は開発28、29,30,31の初期段階で薬理学的治療の後に検査することが可能となる。本論文で実証されていないが、この方法は、潜在的にキンカチョウ組織切片上でin situハイブリダイゼーションなどの放射性のような他の手順を可能にし、エレクトロポレーション/ OV中O 手術 32、33,34。キンカチョウは、文学の広大なボディの中に、重要なモデル生物として確立されていることを考えれば、このような研究は、特に、成人の生理学および行動は言語7、9の開発を発達メカニズムをリンクするための未開発の機会を提供しています。
開示事項
著者らは、開示することは何もありません。
謝辞
著者は彼らの資金源、ウィリアム&メアリーカレッジ、ハワードヒューズ医学研究所学部理科教育プログラムに感謝。グラントスポンサー:NIH(MSS);承認番号:R15NS067566。彼らはまた、動物のケアと支援のためのウィリアム·アンド·メアリー大学、生物学科と教養学部からの支援を認める。
資料
| Name | Company | Catalog Number | Comments |
| Chicken egg incubator | We use a Picture Window Hova-Bator Incubator, Circulated Air Model | ||
| Click-iT EdU Alexa Fluor 488 Imaging kit | Invitrogen | C10337 | Detection of cell proliferation. |
| Dissection microscope | We use Olympus SZ61 | ||
| 7'' Drummond capillary for Nanoject II injector | Drummond | 3-00-203-G/X | |
| Drummond Nanoject II microinjector | Drummond | ||
| Dumont Tweezers #55 | World Precision Instruments | 14099 | |
| Ethanol (EtOH) | |||
| 50 ml Falcon tube (polypropylene) | Fisher Scientific | 06-443-18 | |
| FastPrep Lysis Matrix H tubes | MP biomedicals | 6917-100 | Used for RNA extraction, used to homogenize embryos |
| Fiber optic illuminator lamps (High Intensity Illuminator) | Dolan-Jenner Industries | Fiber-Lite MI-150 | |
| Glass vials with screw cap (DEPC treated) | Fisher Scientific | 03-338A | |
| Microcentrifuge eppe tube (1.5 ml) | Fisher Scientific | 05-408-129 | |
| Mineral oil | Sigma-Aldrich | M-8410 | |
| Modeling Clay | Any brand | ||
| Narshige PB-7 needle puller | Narshige | ||
| Omni Bead Ruptor Homogenizer | OMNI International | 19-010 | Used for RNA extraction |
| 4% Paraformaldehyde (4% PFA): 20 ml 8% PFA (32 g paraformaldehyde, 350 ml sdd H2O, adjust pH to 7.6, 400 ml sdd H2O), 20 ml 2x PBS | Fixation of embryos. Caution, is harmful and do not inhale. | ||
| Phosphate buffered saline (1x PBS): 200 ml 10x PBS, 1,800 ml Barnstead H2O, adjust pH to 7.4 | |||
| Phosphate buffered saline (10x PBS): 800 ml Barnstead, 2.013 g KCL, 80.063 g NaCl, 2.722 g KH2PO4 monobasic, 14.196 g Na2HPO4 dibasic, 200 ml Barnstead H2O, adjust pH to 6.5 | |||
| Phosphate buffered saline with 0.1% Tween-20 (1x PTw): 1,800 ml Barnstead H2O, 200 ml 10x PBS, adjust pH to 7.4, 2 ml Tween-20 | |||
| 35 ml Plastic Petri dish | Fisher Scientific | 08-757-100A | |
| plastic wrap | Any brand | ||
| Prepease RNA Spin Kit | PrepEase, Affymetrix | 78766 1 KT | Used for RNA extraction, used to homogenize embryos |
| Reaction Mix: 875 μl 1xPBS, 100 mM 20 μl CuSO4 (Kit Component E), 5 μl Alexa Fluor 488 azide (Kit Component B), 100 μl diluted reaction buffer additive (Kit Component F) | Invitrogen | C10337 | Detection of cell proliferation. |
| sdd H2O | |||
| Seed cup | We use it as a container when incubating eggs | ||
| Stainless steel scalpel | |||
| Standard nest box | We use Abba Plastic Finch Nestboxes | ||
| 4 ml, Teflon Lined Cap, Glass Vials | Fisher Scientific | 02-912-352 | |
| Transfer pipettes (polyethylene) | Fisher Scientific | 13-711-7M | |
| 4 x 4 weigh paper | Fisher Scientific | 09-898-12B |
参考文献
- Eng, M. L., Elliott, J. E., MacDougall-Shackleton, S. A., Letcher, R. J., Williams, T. D. Early exposure to 2,2',4,4',5-pentabromodiphenyl ether (BDE-99) affects mating behavior of zebra finches. Toxicol Sci. 127, 269-276 (2012).
- Winter, V., Elliott, J. E., Letcher, R. J., Williams, T. D. Validation of an egg-injection method for embryotoxicity studies in a small, model songbird, the zebra finch (Taeniopygia guttata). Chemosphere. 90, 125-131 (2013).
- Maney, D. L., Goodson, J. L. Neurogenomic mechanisms of aggression in songbirds. Adv Genet. 75, 83-119 (2011).
- Kirn, J. R. The relationship of neurogenesis and growth of brain regions to song learning. Brain and Language. 115, 29-44 (2010).
- Fisher, S. E., Scharff, C. FOXP2 as a molecular window into speech and language. Trends in Genetics. 25, 166-167 (2009).
- Tokarev, K., Tiunova, A., Scharff, C., Anokhin, K. Food for Song: Expression of C-Fos and ZENK in the Zebra Finch Song Nuclei during Food Aversion Learning. PLoS One. 6, (2011).
- Vargha-Khadem, F., Gadian, D. G., Copp, A., Mishkin, M. FOXP2 and the neuroanatomy of speech and language. Nat Rev Neurosci. 6, 131-138 (2005).
- Schulz, S. B., Haesler, S., Scharff, C., Rochefort, C. Knockdown of FoxP2 alters spine density in Area X of the zebra finch. Genes, Brain and Behavior. 9, 732-740 (2010).
- Jarvis, E. D., et al. Avian brains and a new understanding of vertebrate brain evolution. Nat Rev Neurosci. 6, 151-159 (2005).
- Brainard, M. S., Doupe, A. J. Translating birdsong: songbirds as a model for basic applied medical research. Annu Rev Neurosci. 36, 489-517 (2013).
- Mayer, U., Watanabe, S., Bischof, H. J. Spatial memory and the avian hippocampus: Research in zebra finches. J Physiol Paris. , (2012).
- Warren, W. C., et al. The genome of a songbird. Nature. 464, 757-762 (2010).
- Agate, R. J., Scott, B., Haripal, B., Lois, C., Nottebohm, F. Transgenic songbirds offer an opportunity to develop a genetic model for vocal learning. Proceedings of the National Academy of Sciences. 106, 17963-17967 (2009).
- Birkhead, T. R., et al. Internal incubation and early hatching in brood parasitic birds. Proceedings of the Royal Society Biological Sciences. 278, 1019-1024 (2011).
- Haesler, S., et al. FoxP2 expression in avian vocal learners and non-learners. J Neurosci. 24, 3164-3175 (2004).
- Godsave, S. F., Lohmann, R., Vloet, R. P. M., Gahr, M. Androgen receptors in the embryonic zebra finch hindbrain suggest a function for maternal androgens in perihatchingsurvival. Journal of Comparative Neurology. 453, 57-70 (2002).
- Stern, C. D. The chick; a great model system becomes even greater. Dev Cell. 8, 9-17 (2005).
- Kuenzel, W. J., Medina, L., Csillag, A., Perkel, D. J., Reiner, A. The avian subpallium: new insights into structural and functional subdivisions occupying the lateral subpallial wall and their embryological origins. Brain Research. 1424, 67-101 (2011).
- Tickle, C. The contribution of chicken embryology to the understanding of vertebrate limb development. Mech Dev. 121, 1019-1029 (2004).
- Vergara, M. N., Canto-Soler, M. V. Rediscovering the chick embryo as a model to study retinal development. Neural Development. 7, (2012).
- Davey, M. G., Tickle, C. The chicken as a model for embryonic development. Cytogenet Genome Research. 117, 231-239 (2007).
- Murray, J. R., Varian-Ramos, C. W., Welch, Z. S., Saha, M. S. Embryological staging of the zebra finch, Taeniopygia guttata. J Morphol. , (2013).
- Hawkins, P., Morton, D. B., Cameron, D., Cuthill, I., Francis, R., Freire, R., Gosler, A., Healy, S., Hudson, A., Inglis, I., Jones, A., Kirkwood, J., Lawton, M., Monaghan, P., Sherwin, C., Townsend, P. Laboratory birds: refinements in husbandry and procedures. Fifth report of BVAAWF/FRAME /RSPCA/UFAW Joint Working Group on Refinement. Lab Anim. , (2001).
- Pearse II, R. V., Esshaki, D., Tabin, C. J., Murray, M. M. Genome-wide expression analysis of intra- and extraarticular connective tissue. Journal of Orthopaedic Research. 27, 427-434 (2009).
- Pizard, A., et al. Whole-mount in situ hybridization and detection of RNAs in vertebrate embryos and isolated organs. Current Protocols in Molecular Biology. 66, (2004).
- Warren, M., Puskarczyk, K., Chapman, S. C. Chick embryo proliferation studies using EdUlabeling. Developmental Dynamics. 238, 944-949 (2009).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA syntesis in vivo. Proceedings of the National Academy of Sciences U S A. 105, 2415-2420 (2008).
- Hoogesteijn, A. L., DeVoogd, T. J., Quimby, F. W., De Caprio, T., Kollias, G. V. Reproductive impairment in zebra finches (Taeinopygia guttata). Environmental Toxicology and Chemistry. 24, 219-223 (2005).
- Winter, V., Williams, T. D., Elliott, J. E. A three-generational study of In ovo exposure to PBDE-99 in the zebra finch. Environmental Toxicology and Chemistry. 32, 562-568 (2013).
- Kitulagodage, M., Buttemer, W. A., Astheimer, L. B. Adverse effects of fipronil on avian reproduction and development: maternal transfer of fipronil to eggs in zebra finch Taeinopygia guttata and in ovo exposure in chickens Gallus domesticus. Ecotoxicology. 20, 653-660 (2011).
- Hallinger, K. K., Zabransky, D. J., Kazmer, K. A., Cristol, D. A. Birdsong differs between mercury-polluted and reference sites. The Auk. 127, 156-161 (2010).
- Chen, C. C., Wada, K., Jarvis, E. D. Radioactive in situ Hybridization for Detecting Diverse Gene Expression Patterns in Tissue. Journal of Visualized Experiments. , (2012).
- Chen, C. C., Balaban, E., Jarvis, E. D. Interspecies Avian Brain Chimeras Reveal That Large Brain Size Differences Are Influenced by Cell–Interdependent Processes. PLoS One. 7, (2012).
- Chen, C. C., Winkler, C. M., Pfenning, A. R., Jarvis, E. D. Molecular profiling of the developing avian telencephalon: Regional timing and brain subdivision continuities. The Journal of Comparative Neurology. 521, 3666-3701 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved