Method Article
تشريح وتحليل المصب من زيبرا فينش الأجنة في المراحل الأولى من التطوير
In This Article
Summary
The zebra finch (Taeniopygiaguttata) is a valuable model organism; however, early stages of zebra finch development have not been extensively studied. The protocol describes how to dissect early embryos for developmental and molecular applications.
Abstract
أصبح فينش حمار وحشي (Taeniopygia الرقشاء) كائن نموذجا متزايد الأهمية في العديد من مجالات البحوث بما في ذلك علم السموم 1، 2، 3 السلوك، والذاكرة والتعلم 4،5،6. كما مطربة فقط مع الجينوم التسلسل، وفينش حمار وحشي لديها امكانات كبيرة لاستخدامها في الدراسات التنموية؛ ومع ذلك، فإن المراحل الأولى من التنمية فينش حمار وحشي لم يتم دراستها جيدا. ويمكن أن يعزى عدم وجود بحوث في مجال التنمية فينش حمار وحشي لصعوبة تشريح البيضة الصغيرة والجنين. طريقة تشريح التالية يقلل من تلف الأنسجة الجنينية، والذي يسمح للتحقيق في التشكل والتعبير الجيني في جميع مراحل التطور الجنيني. هذا يسمح كل من حقل مشرق والتصوير مضان نوعية الأجنة، استخدم في إجراءات الجزيئية مثل الموقع التهجين (ISH)، المقايسات تكاثر الخلايا، واستخراج الحمض النووي الريبي لفحوصات الكمي مثل الجرمية الكمي فيL-PCR الوقت (qtRT-PCR). يسمح هذا الأسلوب المحققين لدراسة المراحل الأولى من التنمية التي كان من الصعب الوصول إليها سابقا.
Introduction
الهدف العام من هذه التقنية هو الحصول على حمار وحشي فينش (Taeniopygia الرقشاء) الأجنة منذ المراحل الأولى من التطور الجنيني للاستخدام في مجموعة واسعة من الدراسات التنموية. أصبحت حمار وحشي فينش السائد نموذج مطربة الحي واستخدمت على نطاق واسع في مجموعة متنوعة من المجالات، بما في ذلك علم السموم 1،2، 3 السلوك والذاكرة والتعلم 4،5،6، 7،8 مقارنة التشريح العصبي، وتطوير اللغة 9،10 . كما مطربة فقط مع الجينوم التسلسل، وحمار وحشي فينش يسمح الدراسة الجزيئية والجينية من أجل Passeriformes، وهو ما يمثل أكثر من 50٪ من أنواع الطيور المعروفة 11، 12،13.
على الرغم من استخدام الكبار والأحداث حمار وحشي فينش في مجموعة متنوعة من المجالات، وقد أجريت دراسات قليلة على الأجنة حمار وحشي فينش، وخصوصا خلال المراحل الأولى من التنمية. ويمكن أن يعزى ذلك إلى صغر حجم بيضها والثانية الأجنة، وضعهم أحدث كنموذج حي 14،15،16 للدراسات التي الدجاج (الداجن جالوس جالوس) كان يستخدم سابقا بمثابة نموذج 17،18،19،20،21 نظام السائد. لكن، وكما المتعلمين غير الصوتية، والدجاج ليست نظاما نموذج مناسب لدراسة الأساس الجيني للتعليم الصوتية، وتطوير التعلم الصوتية، والتوريث، والسلوك، والعقد القاعدية الدوائر-القشرية الحركية المشاركة في التعلم 10.
من المهم أن نلاحظ أن الأجنة حمار وحشي فينش هي أكثر حساسية التالفة بكثير وأكثر سهولة من خلال تشريح افراخ الدجاج والإجراءات الجزيئية. على وجه الخصوص، الأمر يتطلب عناية أكبر عند تنفيذ الخطوات permeabilization على حمار وحشي فينش الأجنة. يمكن المنظفات والإنزيمات القوية التي لن تضر الجنين الفرخ يضر الأجنة فينش حمار وحشي. من حيث الرعاية العامة، فمن الضروري وضع البيض حمار وحشي فينش في أكواب صغيرة قبل وضعه في حاضنةلمنعهم من كسر عندما المتداول خلال الحضانة.
حمار وحشي فينش قابلة للدراسات السلوكية، بسهولة وبغزارة تولد على مدار السنة في الأسر، ويتعلمون الصوتية. هذه الخصائص تسمح باستخدام حمار وحشي فينش لتلبية الحاجة إلى كائن النموذج الذي يجمع بين التنمية، وعلم الوراثة، والجوانب السلوكية للغة. أساليب تشريح مفصل أدناه، جنبا إلى جنب مع دليل التدريج وضعت مؤخرا محددة لحمار وحشي فينش 22، وجعل فينش حمار وحشي ومفيدة على نحو متزايد موحدة نموذج التنموية الحي. ومع ذلك، والحصول على أجنة في مراحل مبكرة يمكن ان تكون شاقة. هذا البروتوكول يسمح للمحققين بسهولة الحصول على الأجنة في مرحلة مبكرة. دراسات التحقيق في التنمية في وقت مبكر والأساس الجزيئي للالتنموية السلوكيات المعقدة في حمار وحشي فينش، أو الآثار السمية على التنمية في الأخرى الصغيرة، وسوف تجد الطيور الجواثم منهجية تشريح هذا مفيد.
Protocol
بيان الأخلاق: أجريت مع أساليب العصافير حمار وحشي المستأنسة من مستعمرة التكاثر في كلية وليام وماري. اتباع جميع الإجراءات المبادئ التوجيهية RSPCA 23 وتمت الموافقة من قبل كلية وليام وماري OLAW (مكتب مختبر رعاية الحيوان) ضمان رعاية الحيوان (# A3713-01)، وكان اللجنة المؤسسية رعاية الحيوان واستخدام (IACUC) موافقة (# 2013-06 -02-8721-dacris).
1. جمع البيض والحضانة
- إنشاء أزواج فينش حمار وحشي على ضوء 14:10: دورة الظلام. توفير الغذاء والماء والقش، وإعلان بالمال وبالشهرة أيضا مربع العش. ملاحظة: الرعاية الروتينية وتربية العصافير لحمار وحشي وقد وصفت جيدا 23.
- إعداد فرخ حاضنة القياسية مع إمالة الرفوف. ملاحظة: الحفاظ على الحاضنة الاصطناعية في 37.5 (+ / - 1) درجة مئوية مع 80-95٪ الرطوبة بإضافة الماء إلى الجزء السفلي من الحاضنة على أساس يومي. تسمح الحاضنة لكي تتوازن لمدة يومينقبل استخدام.
- حدد أكواب تغذية صغيرة (5 × 7.6 سم) 2.5 سم على الأقل العميق لعقد البيض في الحاضنة. خط القاع والحواف السفلي من الكأس مع طبقتين من منشفة ورقية بحيث يتم تعبئة الكأس، في حين لا يزال يسمح للبيض للفة بسهولة. وضع هذه الأكواب على الرفوف إمالة من الحاضنة. ملاحظة: الكثير من الحشو يمكن أن تمنع المتداول، والذي سيمنع الحضانة ناجحة بسبب التصاق الجنينية إلى قذيفة الداخلية.
- جمع البيض في ساعتين بعد بداية دورة ضوء. ملاحظة: هذا يقلل التفاوت في التنمية مرحلة لفترة الحضانة المذكورة بسبب الحضانة الأبوية.
- التقاط البيض بلطف مع الإبهام والسبابة على طرف وقاعدة على طول البيضة. استخدام مملة، 4B قلم رصاص لينة الجرافيت لتسمية تاريخ ضعت والوقت التي تم جمعها من العش. ملاحظة: قلم رصاص 4B يونة يقلل من خطر قلم رصاص كسر قشرة البيضة هشة.
- 1.3.2) ضع 1-5 البيض وصفت في كل جحتى في حاضنة البيض بحيث يمكن لفة بحرية لمنع التصاق الجنين إلى داخل وعاء. ملاحظة: وضع أكثر من 5 بيضات في فنجان قد يمنع المتداول من البيض الفردية والحد من بقاء الأجنة.
2. إزالة الأجنة من البيض
- للتحضير للتشريح، تجميع المواد التالية: مشرط نظيفة، ملقط يميل غرامة، واثنين من غرامة يميل ملقط اضافية. وضع 10 × 10 سم وزن الورق على قاعدة من نطاق تشريح لتوفير سطح نظيف، غير ماصة للتشريح. ملاحظة: ورقة تزن أمر بالغ الأهمية لأنه يسمح التلاعب سهل من صفار البيض والسطح هو أفضل لتقطيع الأغشية دقيق مع مشرط.
- إعداد قسامة من الفوسفات عازلة المالحة (1X PBS) في أنبوب البولي بروبلين 50 مل، والحصول على ما لا يقل عن ثلاثة ماصات نقل ودلو النفايات الصغيرة. إذا تحديد الأجنة، وإعداد قسامة من 4٪ بارافورمالدهيد (PFA) تنبيه: أبخرة سامة PFA، ود جميع الخطوات التي تنطوي PFA ينبغي أن يتم داخل غطاء الدخان للحد من التعرض. إذا فلاش تجميد الأجنة، يجب الحصول النيتروجين السائل وابقائه بالقرب من نطاق تشريح. العقم ليست قضية للتشريح هذا البروتوكول، ولكن تأكد من جميع المواد نظيفة.
- إزالة البيض من الحاضنة عند نقطة الوقت اللازم للمرحلة المطلوبة كما هو موضح في دليل حمار وحشي فينش التدريج 22. ملاحظة: إزالة البيض بعد 36 ساعة من الحضانة إلى المرحلة 6 تشريح الأجنة (الشكل 4A) 22 وإزالة البيض بعد 56 ساعة من الحضانة إلى المرحلة تشريح 12 الأجنة (الشكل 3A) 22.
- باستخدام مصباح إضاءة الألياف البصرية، شمعة البيض بوضعها على طول المحور الرأسي وتألق الضوء من خلال البويضة لإلقاء الضوء على المناطق الداخلية. وضع غيض من الضوء وراء البيض وصفار البيض وتحديد الجنين النامية.
- وضع المشرط على الجانب الآخر صفار البيض وقطع على طول البيضة من طرف إلىقاعدة مع الضغط خافت.
- إزالة محتويات البيضة من خلال تطبيق بعناية الضغط على طرف وقاعدة من البيض مع الإبهام والسبابة، أو عن طريق التحديق بلطف بعيدا قشر البيض على طول قطع بالملقط. فتح البيض مباشرة فوق الورق تزن بحيث صفار تتحرك برفق.
- دراسة صفار البيض للمنطقة من مفرق، الذي يكون مرئيا باعتباره حلقة بيضاء باهتة تطويق التطور الجنيني وتوجيه صفار باستخدام ملقط غرامة اضافية يميل بحيث يقع الجنين في المركز.
ملاحظة: إذا لم يتم ملاحظة وجود دائرة بيضاء باهتة على سطح الصفار، واتخاذ ملقط غرامة وبلطف لفة صفار البيض حتى على الجنين هو على رأس صفار البيض. ملاحظة: للحصول على مراحل 1-9 22، القرص الجنيني هو أقل من 6 ملم في القطر وغير مرئية كما خافت، القرص مبهمة قليلا على سطح الصفار - انظر الشكل 1 لتكون مرجعا. لمراحل 10 و 22 من كبار السن، وحمامات الدم تسمح تحسنت الخامسisibility من الجنين، ولكن الحرص لتجنب ثقب الكيس المحي، وهذا ما يجعل تحديد مكان الجنين صعبة.
3. فصل الأجنة من الأنسجة الجنينية إضافية
- ثقب حواف صفار لتخفيف الضغط (الشكل 1B)، وجعل التخفيضات واحد عبر طول قطرها صفار جنبا إلى جنب مع القرص الجنيني. تكرار إجراء هذه الخطوط القطرية حتى تم فصل قسم من صفار البيض يحتوي على الجنين بنجاح (الشكل 1B). ملاحظة: هذه الخطوة تسمح للصفار الشامل لتبقى سليمة، ولكن انخفاض الضغط على سطح الصفار يسمح لمزيد من الدقة عندما قطع نحو الجنين، ومنع الأضرار التي لحقت الهياكل الجنينية.
- إزالة الحواف من صفار البيض مع ماصة نقل. ملاحظة: إزالة أكبر قدر ممكن صفار، ولكن ترك كمية صغيرة بحيث الجنين لا تلتزم السطح الجاف من الورقة وزن والمسيل للدموع.
- غسل القرص الجنينية التي كتبها dispens1X PBS جي في زاوية 45 درجة نحو الجزء السفلي من الجنين. وضع غيض من ماصة نقل القادمة ليست المذكورة القرص الجنيني. إذا صفار احتياجات إضافية إلى إزالتها، أي فصل صفار مع مشرط على ورقة تزن قبل نقل الجنين الى طبق بيتري. ملاحظة: هذا الأسلوب يزيل الجنين من سطح ورقة تزن.
- نقل الجنين باستخدام ماصة نقل جنبا إلى جنب مع حجم الحد الأدنى من 1X PBS ل، طبق بتري بلاستيكية صغيرة. غسل الجنين عن طريق إضافة المزيد من 1X PBS في طبق بتري ويقطر 1X PBS القريب، ولكن ليس مباشرة على، الجنين. دوامة طبق بيتري لغسل وإزالة صفار المتبقية، وإمالة طبق بيتري، وإزالة النفايات 1X PBS مع ماصة نقل.
ملاحظة: عند إزالة برنامج تلفزيوني 1X، الجنين عادة لا تلتزم الجزء السفلي من طبق بيتري لأن سطح البلاستيك زلقة مع 1X PBS المتبقية. ومع ذلك، يمكن إضافة المزيد من 1X PBS إذا كان الجنين العصي على الطبق.
إذا تثبيت رانه الجنين، اتبع الخطوات 3.5 و 3.6. إذا فلاش تجميد الجنين، انتقل إلى الخطوة 3.8 على الفور. - إذا تحديد الجنين عن التهجين في الموقع، إضافة فورا PFA 4٪ إلى طبق بيتري ليغرق الجنين. بالتنقيط 4٪ PFA مباشرة على الجزء العلوي من الجنين من اجل تمهيدها؛ هذا يمنع الجنين من الشباك. إصلاح الجنين في PFA 4٪ عند 4 درجة مئوية لمدة 12 ساعة.
- بعد التثبيت، يذوى الأجنة في الميثانول متدرج (MeOH) حلول وتخزينها في -20 درجة مئوية في 100٪ MeOH.
- إذا كان الجنين هو بين المراحل 1-8 22، وإزالة الغشاء المحي انضمت إلى الجنين. ملاحظة: هذه الخطوة يمكن أن يتم أثناء أو بعد التثبيت. الأجنة الذين تقل أعمارهم عن 22 مرحلة 8 لا تصور بسهولة لأنها تلتزم الغشاء المحي، والتعتيم الهياكل الرئيسية كما رأينا في الشكل 2A.
- قبضة حافة الغشاء الذي يمتد إلى أبعد من منطقة تقاطع مع ملقط غرامة اضافية. Carefمع ully الوجه الجنين أكثر من عدة مرات ليغسل حبيبات صفار المتبقية وتخفيف تمسك القرص الجنينية إلى الغشاء المحي. ملاحظة: لا تلمس مركز للجنين، حيث سيؤدي ذلك إلى تلف هياكل الجنينية.
- إذا لم يظهر وجود فجوة بين منطقة تقاطع والغشاء المحي، تخدش بلطف منطقة تقاطع مع غرامة اضافية يميل ملقط لتخفيف ذلك من الغشاء المحي. قبضة الغشاء المحي مع غرامة اضافية يميل ملقط وسحب بلطف بعيدا من الجنين. إذا لزم الأمر، وسحب بلطف الجنين بعيدا عن الغشاء المحي من قبل تجتاح الحافة الطرفية من القرص الجنيني في منطقة تقاطع.
- تجاهل الغشاء المحي في 1 واقية النفايات (مستوى السلامة الحيوية 1) بعد الإزالة.
- عند إجراء الفحص ISH على المراحل الجنينية الشباب، واتباع معيار كله بروتوكولات جبل ISH لافراخ الدجاج 24، 25، ولكن النظر في الاقتراحات التالية.
- للحد من الأضرار التي لحقت الأجنة أثناء إجراء ISH، استخدم واحد 5 مل قارورة زجاجية مع غطاء المسمار لكل الجنين. ملء قارورة فقط مع 2-3 مل من محلول، وضمان أن الأجنة وغرقت بالكامل. قارورة Nutate عموديا عن طريق وضع 5 مل قارورة في رف الستايروفوم (أو أي رف من شأنها أن تبقي قارورة آمنة) التي تم تأمينها لnutator. ملاحظة: هذا قائي يمنع الجنين من تمزقها، والذي يمكن أن يحدث عندما يتعلق الأمر في اتصال مع غطاء القارورة خلال الإيماءة الأفقي.
- للأجنة المرحلة 0-6 22، وعلاج مع 5 ميكروغرام / مل K بروتين في 1X PTW لمدة 5 دقائق في درجة حرارة الغرفة. علاج الأجنة نظموا 7-12 22 مع 10 ميكروغرام / مل K بروتين في 1X PTW لمدة 10 دقيقة عند 37 درجة مئوية للحد من تلوين الخلفية.
- لإنتاج رد فعل اللون كافية للكشف عن مستويات منخفضة من التعبير الجيني في مراحل 1 - 10 22، واحتضان مع تركيز 10 ميكروغرام / مل التحقيق لمدة 12 ساعة. لمراحل السن، مع احتضان 1 & #956؛ ز / مل تركيز التحقيق على 60 درجة مئوية.
- إذا كان الجنين تجميد فلاش، بسرعة إضافة 2-3 مل 1X PBS إلى طبق بيتري التالية تشريح والميل طبق بيتري لفصل الجنين من حبيبات الصفار. إزالة السائل وتكرار 2-3 مرات لإزالة كل البيض. باستخدام ملقط غرامة ذات الرؤوس، نقل الأجنة إلى أنبوب microcentrifuge صفت مسبقا وتجميد فلاش في النيتروجين السائل قبل تخزينها في -80 درجة مئوية.
4. EDU خلية انتشار الفحص. التأسيس والكشف عن EDU في زيبرا فينش الأجنة.
- شمعة البيض باستخدام مصباح إضاءة الألياف البصرية لتحديد موقع الجنين أو البيض.
- بمناسبة جانب المعاكس البيض إلى موقع الجنين أو صفار داخل بيضة لضمان عدم تلف الجنين أثناء عملية حقن مكروي.
- خط طبق من البلاستيك 60 ملم مع الصلصال وقولبته في شكل وعاء لاحتواء البيض في الاتجاه المطلوب. يجب أن تكون بقعة ملحوظالموجهة للسماح بإدخال إبرة حقن مكروي باستخدام مياداة مجهرية. ملاحظة: إن الطين استقرار البويضة خلال حقن مكروي وطوال الحضانة في الخطوة 4.11.
- سحب اثنين من الزجاج الشعرية الإبر حقن مكروي. كليلة إبرة واحدة لكزة حفرة داخل البويضة في بقعة ملحوظ. إعداد إبرة حقن مكروي الثاني للحقن بواسطة backloading مع الزيوت المعدنية وإدراجه في microinjector.
- تعيين حجم محلول صدر في حقن ل59.8 NL على microinjector.
- تحميل إبرة حقن مكروي مع 10 ملي الأسهم EDU الحل.
- خلق ثقب في وعاء على الفور ملحوظ مع الزجاج الشعرية اضعافها، مع الحرص على عدم تحطيم قذيفة أو إسقاط قطعة من قذيفة في تجويف البيض. توجيه البويضة بحيث حفرة في زاوية 45 درجة، مما يسمح للإبرة حقن مكروي لإدراجها مباشرة من خلال تجويف لصفار البيض أو الجنين.
- باستخدام مياداة مجهرية، إدراجتحميل إبرة حوالي 1.0 سم في تجويف.
- ضخ المبلغ المطلوب من الحل EDU مباشرة على الجنين النامي أو صفار. ملاحظة: كحد أقصى من 478 NL من EDU يمكن حقنها دون ان تسفر عن وفاة الجنينية.
- التفاف على الفور البيض وحامل الطين مع طبقات متعددة من الاغطية البلاستيكية لتغطية البيض وطبق لمنع جفاف الجنين أثناء الحضانة. الشريط حواف بلاستيكية التفاف على الجزء السفلي من الطبق لمنع إزالة التغليف البلاستيكية من خلال الحضانة. ملاحظة: يجب فقط إزالة التفاف البلاستيك على الفور قبل تشريح.
- تسمح للخلايا المتكاثرة حديثا لإدراج EDU التي يحتضنها البيض عند 37 درجة مئوية حتى يتم الوصول إلى المرحلة المطلوبة. بعد الحقن، لا عودة البيض إلى إمالة الرفوف في الحاضنة. وضع الطين اصطف طبق الملفوفة البلاستيك على سطح مستقر داخل الحاضنة.
- إزالة غلاف بلاستيكي وتشريح الجنين بعد بروتوكول المذكور.إصلاح الجنين في PFA 4٪ واحتضان 12 ساعة في 4 درجات مئوية كما هو موضح أعلاه. بعد التثبيت، ويغسل مع الإيثانول بنسبة 100٪ (ETOH) لمدة 5 دقائق وتخزينها في ETOH الطازجة 100٪ في -20 درجة مئوية حتى مزيد من التحليل.
5. EDU "اضغط على" بروتوكول رد الفعل
يتم تنفيذ كافة الخطوات التالية في قوارير زجاجية.
- ترطيب الأجنة مع المتعاقبة يغسل 5 دقائق من ما يلي:
- ETOH، 75٪ و 25٪ ETOH منزوع الأيونات معقمة المقطر (SDD) الماء، و 50٪ و 50٪ ETOH المياه SDD، 25٪ و 75٪ ETOH 1X PTW، 100٪ 1X PTW
- يغسل ثلاث مرات في 100٪ 1X PTW لمدة 10 دقيقة لكل منهما.
- تمييع عازلة المضافة رد فعل (كيت مكون F) من خلال الجمع بين 1 جزء من حل العازلة 10X الأسهم (10 ميكرولتر) إلى 9 أجزاء SDD المياه (90 ميكرولتر).
- إعداد مزيج رد فعل في أنبوب منفصل عن طريق خلط ما يلي: 875 ميكرولتر 1X PBS، 20 ميكرولتر كبريتات النحاس 4، 5 ميكرولتر أزيد، و 100 ميكرولتر العازلة رد فعل المخفف المضافة.ملاحظة: حجم المزيج رد فعل يمكن تقليصها. فإن رد الفعل تعمل إذا كان الجنين يتم تغطيتها بالكامل في خليط التفاعل. إضافة المخفف المضافة رد فعل العازلة (الخطوة 5.3) مباشرة قبل الاستخدام. يتم تنفيذ جميع الخطوات اللاحقة في الظلام. تغطية الأجنة مع احباط للحماية من ضوء.
- تغطية قارورة مع رقائق الألومنيوم، واحتضان لهم عموديا في درجة حرارة الغرفة لمدة ساعتين عن طريق وضعها في رفوف الستايروفوم تعلق على nutator.
- غسل الأجنة 3 مرات في برنامج تلفزيوني 1X الطازجة لمدة 10 دقيقة لكل منهما.
- احتضان الأجنة الطازجة في PFA 4٪ بين عشية وضحاها في 4 درجات مئوية.
- تغسل 3 مرات في برنامج تلفزيوني 1X لمدة 10 دقيقة كل وتخزينها في برنامج تلفزيوني 1X الطازجة في 4 درجات مئوية. تغطية الأجنة مع احباط حتى مزيد من التحليل.
النتائج
الخطوات تخطيطي في الشكل 1 تشير إلى ظهور الجنين بينما تعلق على الغشاء المحي (A) وشرح الطريقة الصحيحة لفصل الجنين من صفار البيض (B). يمكن التعرف على الجنين من منطقة مفرق، وهي أخف بكثير من الغشاء المحي. الجنين نفسه في كثير من الأحيان من الصعب التمييز حتى يتم قطع صفار بعيدا. مرة واحدة يتم تشريح الجنين من البيضة، ويمكن أن تكون ثابتة أو فلاش المجمدة لاستخدامها في المستقبل. إذا كان التهجين في الموقع ومن المخطط لتشريح الجنين، فمن الضروري إزالة الغشاء المحي التي انضمت إلى الجنين عبر منطقة مفرق الشكل 2 يوضح الرؤية المحسنة من الجنين مرة واحدة تتم إزالة هذا الغشاء (C)، والطريقة الصحيحة لقشر الغشاء المحي (A، B). بعد تشريح والتثبيت، جبل بأكمله في الموقع التهجين أجريت كما رأينا في الشكل 3 (A، A '، B، B') والشكل (4) (A، A'، B، B ') والشكل (5) (A، B، C) للكشف عن الاختلافات في orthodenticle homeobox 2 (Otx2) التعبير في الأجنة تتعرض تنمويا لجرعات منخفضة من ميثيل الزئبق. الشكل 5 يظهر نتائج التحقيق الشعور، وعدم التظاهر من الخلفية. في الشكل 4، على الرغم من تشريح من البيضة في نقطة الوقت نفسه، فإن الجنين يتعرض تنمويا لميثيل الزئبق (ميثيل الزئبق) تقدمت إلى مرحلة 5 22 (B، B ')، في حين أن الجنين السيطرة المتقدمة لاستضافة 6 22 (A، A '). تم جمع مجموعة من الأجنة تشريح ويظهر في الشكل 4 من العش والتي اتخذت من حاضنة في الأوقات نفسها. على الرغم من بعض الاختلاف الطبيعي موجود في التنمية، استنادا إلى بيانات تشريح السابقة، فمن غير المرجح أن التقلبات في درجات الحرارة في الحاضنة لن تؤدي سوى إلى 2.4 جزء في المليون الأجنة ميثيل الزئبق لتكون develo تأخر pmentally. الاختلافات في مراحل توضح التغييرات في تكاثر الخلايا في الأجنة تتعرض تنمويا لميثيل الزئبق.
قبل التشريح، تم حقن EDU في يوم 2 بيضة وسمح لاحتضان بين عشية وضحاها. بعد تشريح وتثبيت للمرحلة 16 22 الجنين، وتصور EDU باستخدام "فوق" الكيمياء، مما يسمح للكشف عن الخلايا المتكاثرة كما رأينا في الشكل 6 (A، B، C). من المهم أن ترصد بدقة نقاط الوقت عند وضع البيض في الحاضنة وخلال تشريح، والتعرض لميثيل الزئبق أو أداء الفحص EDU قد يعطل التقدم التنموي. تم إجراء أقرب حقن في اليوم 0، وهو اليوم من جمع كما هو محدد في الخطوة 1.3. وكان تشريح هذا الجنين في وقت لاحق ما يقرب من 38 ساعة (المرحلة 7 22). تم العثور على معدل البقاء على قيد الحياة إلى أن ما يقرب من 90٪ (بنفس معدل الأجنة السيطرة) طالما كان المبلغ الحقن تحت 478 NL.
"jove_content"> هذه المنهجية تشريح يسمح أيضا لاستخراج الحمض النووي الريبي جودة عالية. بعد تشريح المرحلة 16 22 الأجنة، أجريت عملية استخراج الحمض النووي الريبي وفقا لبروتوكول الشركة المصنعة مع عدم وجود التحسين المطلوبة، كما رأينا في الشكل 7. كان إزالة الغشاء المحي لا لزوم لها لاستخراج الحمض النووي الريبي في وقت لاحق والتطبيقات QRT-PCR.
ملاحظة: يتم توجيه جميع الأرقام الجنين بحيث المناطق الأمامية والخلفية هي في الجزء العلوي والسفلي من الصور، على التوالي.

الشكل 1. إجراء تشريح لتحديد الأجنة وحمار وحشي فينش، مراحل 1-10 22. تحديد موقع الجنين قبل المتداول بلطف صفار البيض حتى القرص الأبيض خافت هو واضح (A). مرة واحدة فييقع الجنين في وسط صفار البيض، يتم تشريح صفار البيض بطريقة تدريجية (B) حيث أول خفض يخفف من الضغط من الغشاء المحي (1) وتخفيضات لاحقة (2) الحدود في منطقة (ZJ) وهو تقاطع انضمت إلى الغشاء المحي. تمثل القضبان نطاق 1 مم.
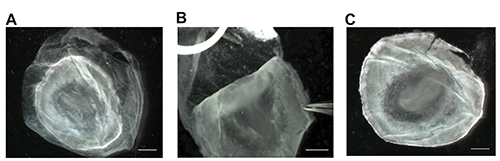
الشكل 2. إزالة الغشاء المحي وضوح الهياكل الجنينية. بعد إزالة الجنين من صفار البيض، ومكان الجنين في طبق بتري تحتوي على 4٪ PFA. إذا كان التهجين في الموقع يحتاج إلى أن يؤديها، والرؤية من الهياكل الجنينية هو أمر ضروري ويمكن تحقيقه عن طريق إزالة الغشاء المحي (A). قبضة الغشاء المحي مع غرامة اضافية يميل ملقط وقشر بلطف بعيدا من الجنين من خلال التعامل مع الجنين مباشرة على حافة الأبعد، إذا لزم الأمر(B). إزالة الغشاء المحي يزيد ضوح الهياكل الجنينية، ويسمح ليمكن تصوير الأجنة أو معالجتها مع الموقع التهجين (C) في. تمثل القضبان نطاق 1 مم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الرقم 3. جبل الجامع في الموقع التهجين التي تجرى على الأجنة فينش حمار وحشي يتعرض تنمويا لميثيل الزئبق. أنماط التعبير من orthodenticle homeobox 2 (Otx2) تميزت في الأجنة تتعرض ل0.0 جزء في المليون ميثيل الزئبق (A، A ') و 2.4 جزء في المليون ميثيل الزئبق (B، B ') عن طريق اتباع نظام غذائي الوالدين. افعلRSAL (A) وبطني (A ') التعبير عن Otx2 مرئيا في جميع أنحاء الدماغ المتوسط والبصرية الحويصلات خلال مرحلة 12 22. تم تشريح الأجنة مجموعة العلاج عند نقطة الوقت نفسه، لكنه تأخر في النمو كما رأينا في الظهرية (B) وبطني (B ') نظرا لهياكل الرأس، والتي هي سمة من مرحلة 11 22 المختصرات:. ميغابايت، الدماغ المتوسط؛ المرجع، الحويصلة البصرية. تمثل القضبان نطاق 1 مم.
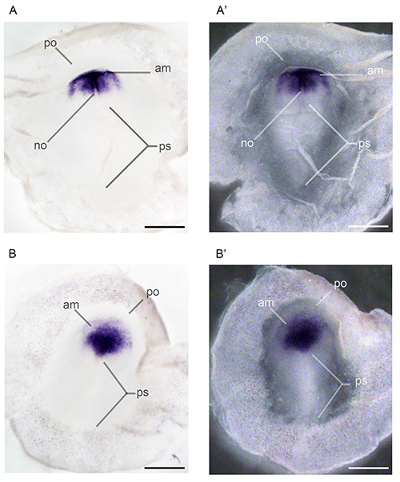
الشكل 4. جبل الجامعة في الموقع إجراء التهجين على الأجنة حمار وحشي فينش يتعرض تنمويا لميثيل الزئبق. أنماط التعبير من orthodenticle homeobox 2 (Otx2) تميزت في المرحلة 6 22 امبري السراج يتعرض ل0.0 جزء في المليون ميثيل الزئبق (A، A ') والمرحلة 5 22 الأجنة تتعرض إلى 2.4 جزء في المليون ميثيل الزئبق (B، B') عن طريق اتباع نظام غذائي الوالدين. الاختصارات: صباحا، الحافة الأمامية من الأديم المتوسط؛ لا، الحبل الظهري، الأديم المتوسط الحبل الظهري؛ بو، مقدم السلى، مسم الأريمة الأمامي؛ ملاحظة، خط بدائية 22. تمثل القضبان نطاق 1 مم.
جبل الرقم 5. الجامع في الموقع إجراء التهجين على حمار وحشي فينش أجنة باستخدام الحس التحقيق. (A) المرحلة 5 22 الجنين. (B) المرحلة المبكرة 6 22 الجنين. (C) المرحلة 11 22 الجنين. تمثل القضبان نطاق 1 مم.
6 "سرك =" / files/ftp_upload/51596/51596fig6highres.jpg "/>
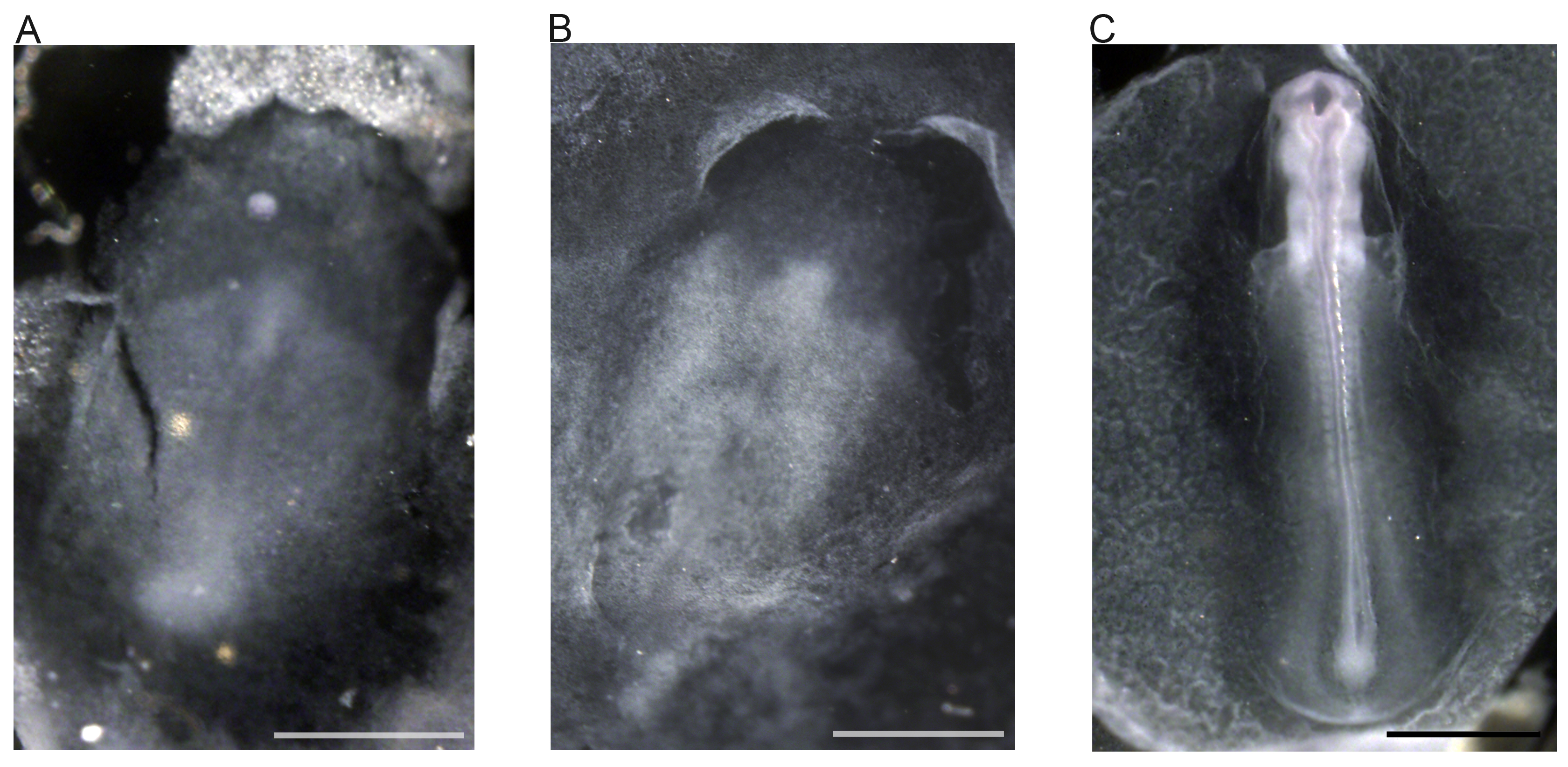
الرقم 6. EDU التأسيس وبحماية المناخ دي في فينش حمار وحشي الأجنة. EDU "فوق" تم استخدام الكيمياء للكشف عن الخلايا المتكاثرة في مرحلة الجنين 16 22 (A، B، C). أدرج EDU في الحمض النووي في مكان ثيميدين 26 و 27 و تم الكشف عن استخدام بنقرة الكيمياء 27. انتشار غير واضحة للعيان في الحواف الجانبية للو somites، وtailbud. لوحة ويظهر انتشار تحدث حصرا في الخلفي من الجنين ويظهر أيضا الخلايا التكاثري الفردية. لوحة B يظهر مواقع التكاثري في الجنين كله. لوحة C يظهر في المنطقة الأمامية، ويظهر لل telencephalon التكاثري للغاية (الشركة المصرية للاتصالات) بمزيد من التفصيل. المختصرات: AF، أضعاف الذي يحيط بالجنين؛ بنك الإجارة الأول، forelimb برعم؛ HLB، hindlimb برعم؛ جنيه، عدسة حويصلة؛ مللي، الدماغ المتوسط؛ طن متري، الدماغ التالي؛ بمسانده، كوب البصرية؛ سنويا، البلعوم القوس؛ كيلومتر، الأديم المتوسط الجسيدة؛ السل، tailbud؛ الشركة المصرية للاتصالات، الدماغ الانتهائي. تمثل القضبان نطاق 1 مم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
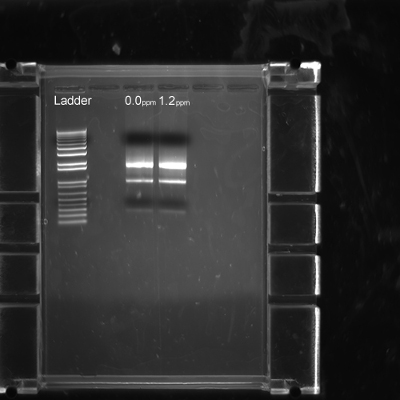
تم تشريح الرقم 7. الجودة من الحمض النووي الريبي المستخرج من تشريح الأجنة حمار وحشي فينش. التحكم (0.0 جزء في المليون) و 1.2 جزء في المليون الأجنة المجمدة ميثيل الزئبق والفلاش كما هو موضح في الخطوة 3.8. يظهر كل حارة الحمض النووي الريبي المستخرج من اثنين من الأجنة المتجانس من كل مجموعة العلاج.
Discussion
التطورات الأخيرة في دليل التدريج الجنينية 22 والجينوم الشرح جعل فينش حمار وحشي كائن النموذج المرغوب فيه للدراسات التنموية. ومع ذلك، فإن صغر الحجم والهشاشة من الأجنة حمار وحشي فينش، والتي تتراوح من 3 إلى 7 ملم في مراحل 1 - 10 22، يمكن أن تجعل من الصعب تشريح 11 و 14. يمكن تحديد موقع وإزالة نظيفة الأجنة من سطح الصفار أن يكون تحديا. يوفر هذا البروتوكول تفاصيل كافية لتنفيذ الإجراء مع سهولة. هذا البروتوكول يوضح الخطوات الحاسمة التي لا تعرف عادة، ولكنها ضرورية لضمان تشريح ناجحة. على سبيل المثال، فمن الضروري أن تترك طبقة صغيرة من صفار بين الجنين ورقة من الورق تزن لمنع الالتصاق.
كل من تحديد وإزالة الجنين يمكن أن يكون صعبا. لاستكشاف وتحديد الجنين على سطح الصفار، وتألق الضوء مباشرة فوق صفار البيض بعد أن لديهأزيلت من البيض، وإلقاء نظرة على صفار في زاوية 45 درجة إلى العثور على الجنين. مرة واحدة ويقع الجنين، وقطع صفار على وزن الورق مع الحرص على عدم المسيل للدموع الجنين.
إذا تشمل المزيد من تطبيقات التصوير الاختلافات التشريحية، التهجين في الموقع، أو المقايسات تكاثر الخلايا، فمن المهم لإزالة الغشاء المحي في مرحلة 1-8 (22) لتصور أفضل للهياكل. إذا تواجه صعوبات عند إزالة صفار البيض أو الغشاء المحي في المراحل المبكرة، وتحديد الجنين في PFA 4٪ قبل غسله في برنامج تلفزيوني 1X للحد من هشاشة الجنينية. الأولى عن طريق إزالة الغشاء المحي أثناء تشريح كما هو موضح، وهياكل واضحة للعيان وسليمة في الأجنة فينش حمار وحشي بعد إجراء عملية التهجين في الموقع.
وجود قيود على EDU هو أن إدارة كميات الجرعة أكثر من 478 NL يؤدي إلى الوفاة الجنينية. ومع ذلك، فإن مجموعة الجرعة العظمى يسمح varyinمستويات غرام من علامات الخلية التكاثري.
و"فوق" رد فعل المستخدمة في هذه المجموعة هو النحاس (I) حفزت-آلكاين أزيد-إضافة حلقية (النحاس (I) AAC). في هذا ردة فعل معينة، يتم تضمينها جزيء ثيميدين التماثلية التي تحتوي على آلكاين (EDU) عن طريق قسمة بنشاط الخلايا. المجموعة آلكاين في EDU يبرز من بنية حلزونية من الحمض النووي، ويتم الكشف عن التعرض لجزيء أزيد مترافق إلى الأخضر، الذي يربط جزيء نيون إلى مجموعة آلكاين الحرة. مضان أخضر يدل على الخلايا المتكاثرة حديثا في الجنين. للالتعامد الحيوي من أزيد والمجموعات آلكاين يمنع تلطيخ غير محددة لأن هذه الأنواع رد الفعل ليست موجودة بشكل طبيعي في الكائنات الحية. أيضا، وذلك لأن الحمض النووي لا بد من التشويه والتحريف من أجل رد الفعل أن تحدث، ويمكن إجراء مزيد من التحليل المعتمدة على الحمض النووي يكون من السهل تنفيذها 27.
بقصور هذا الأسلوب هو الحجم الصغير وفرجility من حمار وحشي فينش الأجنة. إزالة الغشاء المحي من الأجنة مراحل 1 - 15 22 يمكن أن يؤدي إلى هياكل الجنينية مدمرة إذا لم يتم تنفيذ بحذر. ومع ذلك، هذا البروتوكول يبسط طريقة تشريح، مما يسمح للمحققين لاستخدام المراحل الجنينية المبكرة لدراسة التشوهات الهيكلية والتعبير الجيني التي لم يتم دراستها سابقا في العمق. هذا البروتوكول يفتح الطريق أمام مجموعة كبيرة من المقايسات الخلوية الجزيئية التي من شأنها أن تسمح للمحققين لتحديد أصول التنموية من الظواهر الكبار. على سبيل المثال، سيكون من الممكن لدراسة التعبير الجيني المتورطين في التعلم صخبا تحت ظروف بيئية مختلفة أو بعد العلاجات الدوائية في المراحل الأولى من التطوير 28، 29،30،31. وإن لم يكن هو موضح في هذه الورقة، وهذه الطريقة يمكن أن تكون يسمح لإجراءات أخرى مثل المشعة التهجين في الموقع على حمار وحشي فينش أقسام الأنسجة و electroporation / في اوفس 32 عملية جراحية، 33،34. بالنظر إلى أن تم تأسيس فينش حمار وحشي كما كائن نموذجا هاما ضمن هيئة واسعة من المؤلفات، وتوفير مثل هذه الدراسات الفرص غير المستغلة لربط الآليات التنموية مع علم وظائف الأعضاء والسلوك الكبار، ولا سيما تطور اللغة 7 و 9.
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
المؤلفين أشكر مصادر تمويلها، هوارد برنامج التعليم المرحلة الجامعية علوم معهد هيوز الطبي في كلية وليام وماري؛ الراعي المنحة: المعاهد الوطنية للصحة (MSS)؛ عدد المنح: R15NS067566. كما يعترفون بدعم من كلية وليام وماري، قسم الأحياء وكلية الآداب والعلوم للحصول على المساعدة مع رعاية الحيوان.
Materials
| Name | Company | Catalog Number | Comments |
| Chicken egg incubator | We use a Picture Window Hova-Bator Incubator, Circulated Air Model | ||
| Click-iT EdU Alexa Fluor 488 Imaging kit | Invitrogen | C10337 | Detection of cell proliferation. |
| Dissection microscope | We use Olympus SZ61 | ||
| 7'' Drummond capillary for Nanoject II injector | Drummond | 3-00-203-G/X | |
| Drummond Nanoject II microinjector | Drummond | ||
| Dumont Tweezers #55 | World Precision Instruments | 14099 | |
| Ethanol (EtOH) | |||
| 50 ml Falcon tube (polypropylene) | Fisher Scientific | 06-443-18 | |
| FastPrep Lysis Matrix H tubes | MP biomedicals | 6917-100 | Used for RNA extraction, used to homogenize embryos |
| Fiber optic illuminator lamps (High Intensity Illuminator) | Dolan-Jenner Industries | Fiber-Lite MI-150 | |
| Glass vials with screw cap (DEPC treated) | Fisher Scientific | 03-338A | |
| Microcentrifuge eppe tube (1.5 ml) | Fisher Scientific | 05-408-129 | |
| Mineral oil | Sigma-Aldrich | M-8410 | |
| Modeling Clay | Any brand | ||
| Narshige PB-7 needle puller | Narshige | ||
| Omni Bead Ruptor Homogenizer | OMNI International | 19-010 | Used for RNA extraction |
| 4% Paraformaldehyde (4% PFA): 20 ml 8% PFA (32 g paraformaldehyde, 350 ml sdd H2O, adjust pH to 7.6, 400 ml sdd H2O), 20 ml 2x PBS | Fixation of embryos. Caution, is harmful and do not inhale. | ||
| Phosphate buffered saline (1x PBS): 200 ml 10x PBS, 1,800 ml Barnstead H2O, adjust pH to 7.4 | |||
| Phosphate buffered saline (10x PBS): 800 ml Barnstead, 2.013 g KCL, 80.063 g NaCl, 2.722 g KH2PO4 monobasic, 14.196 g Na2HPO4 dibasic, 200 ml Barnstead H2O, adjust pH to 6.5 | |||
| Phosphate buffered saline with 0.1% Tween-20 (1x PTw): 1,800 ml Barnstead H2O, 200 ml 10x PBS, adjust pH to 7.4, 2 ml Tween-20 | |||
| 35 ml Plastic Petri dish | Fisher Scientific | 08-757-100A | |
| plastic wrap | Any brand | ||
| Prepease RNA Spin Kit | PrepEase, Affymetrix | 78766 1 KT | Used for RNA extraction, used to homogenize embryos |
| Reaction Mix: 875 μl 1xPBS, 100 mM 20 μl CuSO4 (Kit Component E), 5 μl Alexa Fluor 488 azide (Kit Component B), 100 μl diluted reaction buffer additive (Kit Component F) | Invitrogen | C10337 | Detection of cell proliferation. |
| sdd H2O | |||
| Seed cup | We use it as a container when incubating eggs | ||
| Stainless steel scalpel | |||
| Standard nest box | We use Abba Plastic Finch Nestboxes | ||
| 4 ml, Teflon Lined Cap, Glass Vials | Fisher Scientific | 02-912-352 | |
| Transfer pipettes (polyethylene) | Fisher Scientific | 13-711-7M | |
| 4 x 4 weigh paper | Fisher Scientific | 09-898-12B |
References
- Eng, M. L., Elliott, J. E., MacDougall-Shackleton, S. A., Letcher, R. J., Williams, T. D. Early exposure to 2,2',4,4',5-pentabromodiphenyl ether (BDE-99) affects mating behavior of zebra finches. Toxicol Sci. 127, 269-276 (2012).
- Winter, V., Elliott, J. E., Letcher, R. J., Williams, T. D. Validation of an egg-injection method for embryotoxicity studies in a small, model songbird, the zebra finch (Taeniopygia guttata). Chemosphere. 90, 125-131 (2013).
- Maney, D. L., Goodson, J. L. Neurogenomic mechanisms of aggression in songbirds. Adv Genet. 75, 83-119 (2011).
- Kirn, J. R. The relationship of neurogenesis and growth of brain regions to song learning. Brain and Language. 115, 29-44 (2010).
- Fisher, S. E., Scharff, C. FOXP2 as a molecular window into speech and language. Trends in Genetics. 25, 166-167 (2009).
- Tokarev, K., Tiunova, A., Scharff, C., Anokhin, K. Food for Song: Expression of C-Fos and ZENK in the Zebra Finch Song Nuclei during Food Aversion Learning. PLoS One. 6, (2011).
- Vargha-Khadem, F., Gadian, D. G., Copp, A., Mishkin, M. FOXP2 and the neuroanatomy of speech and language. Nat Rev Neurosci. 6, 131-138 (2005).
- Schulz, S. B., Haesler, S., Scharff, C., Rochefort, C. Knockdown of FoxP2 alters spine density in Area X of the zebra finch. Genes, Brain and Behavior. 9, 732-740 (2010).
- Jarvis, E. D., et al. Avian brains and a new understanding of vertebrate brain evolution. Nat Rev Neurosci. 6, 151-159 (2005).
- Brainard, M. S., Doupe, A. J. Translating birdsong: songbirds as a model for basic applied medical research. Annu Rev Neurosci. 36, 489-517 (2013).
- Mayer, U., Watanabe, S., Bischof, H. J. Spatial memory and the avian hippocampus: Research in zebra finches. J Physiol Paris. , (2012).
- Warren, W. C., et al. The genome of a songbird. Nature. 464, 757-762 (2010).
- Agate, R. J., Scott, B., Haripal, B., Lois, C., Nottebohm, F. Transgenic songbirds offer an opportunity to develop a genetic model for vocal learning. Proceedings of the National Academy of Sciences. 106, 17963-17967 (2009).
- Birkhead, T. R., et al. Internal incubation and early hatching in brood parasitic birds. Proceedings of the Royal Society Biological Sciences. 278, 1019-1024 (2011).
- Haesler, S., et al. FoxP2 expression in avian vocal learners and non-learners. J Neurosci. 24, 3164-3175 (2004).
- Godsave, S. F., Lohmann, R., Vloet, R. P. M., Gahr, M. Androgen receptors in the embryonic zebra finch hindbrain suggest a function for maternal androgens in perihatchingsurvival. Journal of Comparative Neurology. 453, 57-70 (2002).
- Stern, C. D. The chick; a great model system becomes even greater. Dev Cell. 8, 9-17 (2005).
- Kuenzel, W. J., Medina, L., Csillag, A., Perkel, D. J., Reiner, A. The avian subpallium: new insights into structural and functional subdivisions occupying the lateral subpallial wall and their embryological origins. Brain Research. 1424, 67-101 (2011).
- Tickle, C. The contribution of chicken embryology to the understanding of vertebrate limb development. Mech Dev. 121, 1019-1029 (2004).
- Vergara, M. N., Canto-Soler, M. V. Rediscovering the chick embryo as a model to study retinal development. Neural Development. 7, (2012).
- Davey, M. G., Tickle, C. The chicken as a model for embryonic development. Cytogenet Genome Research. 117, 231-239 (2007).
- Murray, J. R., Varian-Ramos, C. W., Welch, Z. S., Saha, M. S. Embryological staging of the zebra finch, Taeniopygia guttata. J Morphol. , (2013).
- Hawkins, P., Morton, D. B., Cameron, D., Cuthill, I., Francis, R., Freire, R., Gosler, A., Healy, S., Hudson, A., Inglis, I., Jones, A., Kirkwood, J., Lawton, M., Monaghan, P., Sherwin, C., Townsend, P. Laboratory birds: refinements in husbandry and procedures. Fifth report of BVAAWF/FRAME /RSPCA/UFAW Joint Working Group on Refinement. Lab Anim. , (2001).
- Pearse II, R. V., Esshaki, D., Tabin, C. J., Murray, M. M. Genome-wide expression analysis of intra- and extraarticular connective tissue. Journal of Orthopaedic Research. 27, 427-434 (2009).
- Pizard, A., et al. Whole-mount in situ hybridization and detection of RNAs in vertebrate embryos and isolated organs. Current Protocols in Molecular Biology. 66, (2004).
- Warren, M., Puskarczyk, K., Chapman, S. C. Chick embryo proliferation studies using EdUlabeling. Developmental Dynamics. 238, 944-949 (2009).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA syntesis in vivo. Proceedings of the National Academy of Sciences U S A. 105, 2415-2420 (2008).
- Hoogesteijn, A. L., DeVoogd, T. J., Quimby, F. W., De Caprio, T., Kollias, G. V. Reproductive impairment in zebra finches (Taeinopygia guttata). Environmental Toxicology and Chemistry. 24, 219-223 (2005).
- Winter, V., Williams, T. D., Elliott, J. E. A three-generational study of In ovo exposure to PBDE-99 in the zebra finch. Environmental Toxicology and Chemistry. 32, 562-568 (2013).
- Kitulagodage, M., Buttemer, W. A., Astheimer, L. B. Adverse effects of fipronil on avian reproduction and development: maternal transfer of fipronil to eggs in zebra finch Taeinopygia guttata and in ovo exposure in chickens Gallus domesticus. Ecotoxicology. 20, 653-660 (2011).
- Hallinger, K. K., Zabransky, D. J., Kazmer, K. A., Cristol, D. A. Birdsong differs between mercury-polluted and reference sites. The Auk. 127, 156-161 (2010).
- Chen, C. C., Wada, K., Jarvis, E. D. Radioactive in situ Hybridization for Detecting Diverse Gene Expression Patterns in Tissue. Journal of Visualized Experiments. , (2012).
- Chen, C. C., Balaban, E., Jarvis, E. D. Interspecies Avian Brain Chimeras Reveal That Large Brain Size Differences Are Influenced by Cell–Interdependent Processes. PLoS One. 7, (2012).
- Chen, C. C., Winkler, C. M., Pfenning, A. R., Jarvis, E. D. Molecular profiling of the developing avian telencephalon: Regional timing and brain subdivision continuities. The Journal of Comparative Neurology. 521, 3666-3701 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved