Method Article
Dissection et analyse en aval de Zebra Finch embryons aux premiers stades de développement
Dans cet article
Résumé
The zebra finch (Taeniopygiaguttata) is a valuable model organism; however, early stages of zebra finch development have not been extensively studied. The protocol describes how to dissect early embryos for developmental and molecular applications.
Résumé
Le diamant mandarin (Taeniopygia guttata) est devenu un modèle de plus en plus importante organisme dans de nombreux domaines de recherche, y compris la toxicologie 1, 2, 3 comportement et de la mémoire et de l'apprentissage 4,5,6. Comme le seul oiseau chanteur avec un génome séquencé, le diamant mandarin a un grand potentiel pour une utilisation dans les études de développement; Toutefois, les premiers stades de développement de zèbre pinson n'ont pas été bien étudiés. Manque de recherche dans le développement de zèbre pinson peut être attribuée à la difficulté de la dissection du petit œuf et de l'embryon. La méthode de dissection suivante minimise les dommages des tissus embryonnaires, qui autorise des investigations de la morphologie et de l'expression des gènes à tous les stades du développement embryonnaire. Ceci permet à la fois du champ lumineux et une image de fluorescence de la qualité des embryons, l'utilisation dans des procédures moléculaires telles que l'hybridation in situ (ISH), des essais de prolifération cellulaire, et l'extraction de l'ARN pour des dosages quantitatifs tels que rea quantitativel-PCR en temps (qtRT-PCR). Cette technique permet aux chercheurs d'étudier premiers stades de développement qui étaient auparavant difficiles d'accès.
Introduction
L'objectif global de cette technique est d'obtenir Zebra Finch (Taeniopygia guttata) embryons dès les premiers stades de l'embryogenèse pour une utilisation dans un large éventail d'études de développement. Zebra finch devenu prédominant modèle de chanteur organisme et ont largement été utilisé dans une variété de domaines, y compris la toxicologie 1,2, 3 comportement, la mémoire et l'apprentissage 4,5,6, neuroanatomie comparative 7,8, et le développement du langage 9,10 . Comme le seul oiseau chanteur avec un génome séquencé, le diamant mandarin permet étude moléculaire et génétique de l'ordre Passeriformes, qui représente plus de 50% des espèces d'oiseaux connues 11, 12,13.
Malgré l'utilisation d'adulte et juvénile diamant mandarin dans un large éventail de domaines, peu d'études ont été réalisées sur des embryons zèbre pinson, en particulier au cours des premiers stades de développement. Cela peut être attribué à la petite taille de leur œufs une embryons et leur statut plus récent comme un organisme modèle pour les études 14,15,16 où le poulet (Gallus gallus domesticus) a déjà été utilisé comme 17,18,19,20,21 système de modèle prédominant. Cependant, comme les apprenants non vocaux, les poulets ne sont pas un système modèle approprié pour étudier la base génétique de l'apprentissage vocal, le développement de l'apprentissage vocal, héritabilité, le comportement et les circuits des ganglions de la cortico-basale impliqués dans l'apprentissage moteur 10.
Il est important de noter que les embryons zèbre pinsons sont beaucoup plus délicat et plus facilement endommagés que des embryons de poulet pendant la dissection et procédures moléculaires. En particulier, une plus grande prudence est de rigueur lors de l'exécution des mesures de perméabilisation sur zèbre embryons de pinson. Détergents et des enzymes forts qui ne serait pas nuire à un embryon de poulet peuvent endommager zèbre embryons de pinson. En termes de soins généraux, il est nécessaire de mettre zèbre oeufs de pinson dans de petites tasses avant le placement dans un incubateurpour les empêcher de se briser en roulant pendant l'incubation.
Zebra Finch se prêtent à des études comportementales, facilement et abondamment reproduisent toute l'année en captivité, et sont des apprenants vocales. Ces caractéristiques permettent l'utilisation du diamant mandarin pour répondre au besoin d'un organisme modèle qui intègre le développement, la génétique et les aspects comportementaux de la langue. Les dissections méthodes décrites ci-dessous, combinés avec un guide de mise en scène récemment mis au point spécifique de diamant mandarin 22, font le diamant mandarin un modèle de développement standardisé organisme de plus en plus utile. Cependant, l'obtention d'embryons à des stades précoces peut être intimidant. Ce protocole permet aux enquêteurs d'obtenir facilement des embryons à un stade précoce. Les études portant sur le développement précoce et la base moléculaire du développement de comportements complexes en diamant mandarin, ou les effets toxicologiques sur le développement dans d'autres petits, les passereaux trouveront cette méthode de dissection utile.
Protocole
Déclaration d'éthique: Les méthodes ont été menées avec les diamants mandarins domestiques de la colonie de reproduction au Collège de William et Mary. Toutes les procédures suivies directives RSPCA 23 et ont été approuvés par le Collège de William et de Mary OLAW (Office de protection des animaux de laboratoire) Bien-être Assurance animale (# A3713-01) et avait Comité institutionnel de protection et d'utilisation des animaux (IACUC) approbation (# 2013-06 -02-8721-Dacris).
1. Collecte d'oeufs d'incubation et
- Établir zèbre paires de pinson sur un 14h10 cycle lumière sombre. Fournir de la nourriture, de l'eau, du foin, et un nichoir ad libitum. Remarque: les soins de routine et de l'élevage pour les diamants mandarins a été bien décrit 23.
- Préparer un incubateur de poussin standard avec étagères inclinables. Remarque: Maintenir l'incubateur artificiel à 37,5 (+ / - 1) ° C avec 80 à 95% d'humidité par addition d'eau au fond de l'incubateur sur une base quotidienne. Laisser l'incubateur de s'équilibrer pendant deux joursavant de l'utiliser.
- Choisissez de petites tasses d'alimentation (5 x 7,6 cm) d'au moins 2,5 cm de profondeur pour contenir les oeufs dans l'incubateur. Tapisser le fond et les bords inférieurs de la tasse avec deux couches de serviette de papier de sorte que la coupe est complétée, tout en permettant aux œufs de rouler facilement. Placez ces coupes sur les étagères de basculement de l'incubateur. Remarque: Trop de rembourrage peut inhiber de roulement, ce qui empêchera incubation succès en raison de l'adhésion embryonnaire à l'intérieur de la coquille.
- Ramassez les œufs à deux heures après le début du cycle de la lumière. Note: Ceci minimise les écarts dans le développement de la scène pour un temps d'incubation donné raison à l'incubation des parents.
- Ramassez les œufs délicatement avec le pouce et l'index à la pointe et la base sur toute la longueur de l'œuf. Utilisez un crayon terne, mou 4B graphite pour marquer la date prévue et heure de prélèvement du nid. Remarque: Le crayon 4B douce réduit le risque de casser le crayon la coquille fragile.
- 1.3.2) Placer 1 - 5 œufs marqués dans chaque cdans l'incubateur de telle sorte que les œufs peuvent rouler librement pour empêcher l'adhérence embryonnaire à l'intérieur de la coque. Remarque: Placer plus de 5 œufs dans une tasse peut les empêcher de rouler des œufs individuels et réduire la viabilité des embryons.
2. Suppression des embryons de Egg
- Pour se préparer à la dissection, assembler les matériaux suivants: un scalpel propre, fines pinces à bout, et deux fines pointes forceps supplémentaires. Passer de 10 x 10 cm pèsent papier sur la base du microscope à dissection pour fournir une surface propre, non-absorbant pour la dissection. Remarque: Le document peser est cruciale car elle permet une manipulation facile du jaune et est la meilleure surface pour couper les membranes délicates avec un scalpel.
- Préparer une partie aliquote de solution saline tamponnée au phosphate (PBS 1X) dans un tube en polypropylene de 50 ml, et à acquérir au moins trois pipettes de transfert et d'un petit seau à déchets. Si fixant les embryons, préparer une aliquote de 4% de paraformaldéhyde (PFA). Attention: les vapeurs sont toxiques PFA, und toutes les mesures impliquant des PFA doivent être effectuées dans une hotte de minimiser l'exposition. Si le flash congélation des embryons, obtenir de l'azote liquide et le garder près du microscope à dissection. La stérilité n'est pas un problème pour ce protocole de dissection, mais s'assurer que tous les matériaux sont propres.
- Retirez l'œuf de l'incubateur au point nécessaire pour l'étape souhaitée comme décrit dans le diamant mandarin guide de mise en scène 22 fois. Note: Retirer les œufs après 36 heures d'incubation à disséquer étape 6 embryons (figure 4A) 22 et enlever les œufs après 56 heures d'incubation à disséquer étape 12 embryons (figure 3A) 22.
- En utilisant une lampe à fibres optiques éclairage, bougie l'œuf en le tenant le long de son axe vertical et un éclat de lumière à travers l'œuf pour éclairer l'intérieur. Placer l'extrémité de la lumière derrière l'oeuf et de localiser le jaune et le développement de l'embryon.
- Placez le scalpel sur le côté opposé du jaune et couper le long de l'œuf de la tête auxde base avec une légère pression.
- Retirer le contenu de l'œuf en appliquant délicatement la pression sur la pointe et la base de l'œuf avec le pouce et l'index, ou en soulevant doucement à part la coquille le long de la coupe avec des pinces. Ouvrez l'oeuf directement au-dessus du papier peser afin que le jaune roule doucement.
- Examinez le jaune pour la zone blanche de jonction, qui est visible comme un anneau blanc pâle entourant le développement embryonnaire et orienter le jaune à l'aide extra-fine à bout des pinces afin que l'embryon est situé dans le centre.
Remarque: Si un cercle blanc faible sur la surface du jaune n'est pas respecté, prendre les pince fine et rouler doucement sur le jaune jusqu'à ce que l'embryon est au-dessus du jaune. Remarque: Pour les étapes 1-9 22, le disque embryonnaire est inférieure à 6 mm de diamètre et est visible en tant que disque pâle, légèrement opaque sur la surface du jaune - voir la figure 1 à titre de référence. Pour les stades 10 ans et plus 22, le sang s'accumule permettent l'amélioration de visibility de l'embryon, mais prenez soin de ne pas percer le sac jaune, car cela rend la localisation de l'embryon difficile.
3. Séparation de l'embryon de tissu extra-embryonnaire
- Piquer les bords du jaune pour soulager la pression (figure 1B), et faire des coupes simples sur toute la longueur du diamètre de jaune à côté du disque embryonnaire. Répéter rendant ces lignes diagonales jusqu'à ce que la section du jaune d'oeuf contenant l'embryon a été séparé avec succès (Figure 1B). Remarque: Cette étape permet à la masse de jaune d'oeuf de rester intact, mais la pression réduite sur la surface du jaune permet une plus grande précision lors de la découpe autour de l'embryon, la prévention des dommages aux structures embryonnaires.
- Retirer les bords du jaune d'oeuf avec une pipette de transfert. Remarque: Supprimer autant que possible le jaune, mais laisser une petite quantité de sorte que l'embryon n'adhère pas à la surface sèche du papier peser et à la déchirure.
- Laver le disque embryonnaire par dispenstion du PBS 1X à un angle de 45 ° vers le bas de l'embryon. Placez la pointe de la pipette de transfert suivant à pas ci-dessus le disque embryonnaire. Si les besoins de jaune supplémentaires pour être enlevés, séparer tout le jaune avec le scalpel sur le papier avant de peser le transfert de l'embryon à la boîte de Petri. Remarque: Cette méthode supprime l'embryon de la surface du papier de pesée.
- Transférer l'embryon en utilisant une pipette de transfert le long d'un volume minimal de 1 x PBS à une petite antenne, le plastique Petri. Laver l'embryon en ajoutant plus de PBS 1X dans la boîte de Pétri et dégoulinant PBS 1X près, mais pas directement sur l'embryon. Agiter la boîte de Petri à laver et enlever le jaune résiduelle, incliner la boîte de Petri, et éliminer les déchets du PBS 1X avec la pipette de transfert.
NOTE: Lorsque le PBS 1X est retiré, l'embryon généralement n'adhère pas au fond de la boîte de Pétri parce que la surface est glissante plastique avec résiduelle du PBS 1X. Cependant, plus du PBS 1X peut être ajouté si l'embryon se colle au plat.
Si la fixation til embryon, suivez les étapes 3.5 et 3.6. Si le flash congélation de l'embryon, passez à l'étape 3.8 immédiatement. - Si la fixation de l'embryon pour l'hybridation in situ, ajouter immédiatement PFA 4% à la boîte de Petri pour submerger l'embryon. Goutte à goutte 4% PFA directement sur le dessus de l'embryon afin de l'aplatir; ce qui empêche l'embryon de curling. Fixer l'embryon dans 4% PFA à 4 ° C pendant 12 heures.
- Après fixation, déshydratation des embryons dans le méthanol (MeOH) graduée de solutions et conserver à -20 ° C dans 100% de MeOH.
- Si l'embryon est entre les étapes 1-8 22, retirer la membrane vitelline collée à l'embryon. Remarque: Cette étape peut être effectuée pendant ou après la fixation. Les embryons plus jeunes que l'étape 8 22 ne sont pas facilement visualisés parce qu'ils adhèrent à la membrane vitelline, obscurcissant structures clés comme on le voit sur la figure 2A.
- Saisir le bord de la membrane qui s'étend au-delà de la zone de jonction avec des pinces très fines. CarefUlly retourner l'embryon sur plusieurs fois pour laver granules de jaune résiduelles et à desserrer l'adhérence du disque embryonnaire de la membrane vitelline. Remarque: Ne touchez pas le centre de l'embryon, car cela pourrait endommager les structures embryonnaires.
- Si un écart n'apparaît pas entre la zone de jonction et la membrane vitelline, gratter délicatement la zone de jonction avec l'extra-fine à bout des pinces pour la détacher de la membrane vitelline. Saisissez la membrane vitelline avec l'amende supplémentaire incliné pinces et tirez délicatement de l'embryon. Si nécessaire, tirer doucement l'embryon à une distance à partir de la membrane vitelline en saisissant le bord périphérique du disque embryonnaire à la zone de jonction.
- Jeter la membrane vitelline dans biohazard 1 déchets (niveau de biosécurité 1) après le retrait.
- Lors d'un essai de ISH sur les jeunes stades embryonnaires, suivre les protocoles standards de montage ISH entiers pour les embryons de poulet 24, 25, mais prendre en compte les suggestions suivantes.
- Pour réduire les dommages aux embryons durant la procédure d'ISH, utiliser un seul flacon de 5 ml en verre avec un bouchon à vis pour chaque embryon. Ne remplissez flacons avec 2 - 3 ml de solution, veiller à ce que les embryons sont complètement immergés. Flacons nutation verticalement en plaçant flacons de 5 ml dans un rack de polystyrène (ou un rack qui va garder les flacons sécurisé) qui est fixé à un nutator. Remarque: Cette précaution empêche l'embryon de se déchirer, ce qui peut se produire quand il entre en contact avec le couvercle de la fiole pendant nutation horizontal.
- Pour la phase de embryons 0 - 6 22, le traitement avec 5 ug / ml de protéinase K dans 1X PTW pendant 5 min à température ambiante. Traiter les embryons ont organisé 7-12 22 avec 10 ug / ml de protéinase K dans PTW 1X pendant 10 minutes à 37 ° C pour réduire la coloration de fond.
- Pour produire une réaction colorée suffisante pour détecter de faibles niveaux d'expression des gènes dans les étapes 1 à 10 22, incuber avec une concentration de sonde de 10 ug / ml pendant 12 heures. Pour les stades plus âgés, incuber avec 1 & #956; g / ml concentration de la sonde à 60 ° C.
- Si le flash-gel de l'embryon, ajouter rapidement 2 - 3 ml 1X PBS à la boîte de Pétri suivante dissection et incliner la boîte de Pétri pour séparer l'embryon à partir des granules de jaune. Retirer liquide et répéter 2 - 3 fois pour éliminer tout jaune. Utilisation fine pointe de pince, le transfert d'embryons dans un tube à centrifuger pré-étiquetés et gel rapide dans l'azote liquide avant de le ranger à -80 ° C.
4. EdU prolifération cellulaire dosage. Incorporation et détection de EdU dans Zebra Finch embryons.
- Bougie de l'oeuf à l'aide d'une lampe à fibre optique de l'illuminateur pour localiser l'embryon ou du jaune d'oeuf.
- Marquer le côté opposé de l'œuf à l'emplacement de l'embryon ou du jaune d'oeuf à l'intérieur de l'œuf afin de s'assurer que l'embryon ne soit pas endommagé pendant le processus de micro-injection.
- Tapisser un plat de plastique de 60 mm avec la pâte à modeler et de la moisissure dans la forme d'un bol de tenir l'œuf dans l'orientation désirée. L'endroit marqué devrait êtreorientée pour permettre l'insertion de l'aiguille de micro-injection à l'aide du micromanipulateur. Remarque: L'argile va se stabiliser l'œuf pendant la micro-injection et tout au long de l'incubation de l'étape 4.11.
- Tirer deux aiguilles de microinjection capillaires de verre. Émousser une aiguille pour percer un trou dans l'oeuf à l'endroit marqué. Préparer la deuxième aiguille de micro-injection pour l'injection par backloading avec de l'huile minérale et l'insérer dans le micro-injecteur.
- Réglez le volume de la solution dégagée par injection à 59,8 nl sur le micro-injecteur.
- Chargez l'aiguille de microinjection avec la solution mère EdU 10 mM.
- Créer un trou dans la coque à l'endroit marqué avec le capillaire de verre émoussée, en prenant soin de ne pas briser la coquille ou laisser tomber les morceaux de la coque dans la cavité de l'œuf. Orienter l'oeuf de telle sorte que le trou est à un angle de 45 °, ce qui permet l'aiguille de micro-injection pour être inséré directement dans la cavité pour le jaune d'oeuf ou embryon.
- Utilisation du micromanipulateur, insérez lechargé d'environ 1,0 cm de l'aiguille dans la cavité.
- Injecter la quantité souhaitée de la solution EdU directement sur l'embryon en développement ou jaune. Remarque: Un maximum de 478 nl de EdU peut être injecté sans qu'il en résulte la mort embryonnaire.
- Envelopper immédiatement l'œuf et le support d'argile avec de multiples couches de plastique pour recouvrir l'œuf et le plat pour éviter la dessiccation de l'embryon pendant l'incubation. Collez les bords de la pellicule de plastique au fond du plat pour éviter le plastique ne se déroule pendant l'incubation. Remarque: La pellicule de plastique ne doit être retiré immédiatement avant la dissection.
- Laisser les cellules nouvellement proliférantes à intégrer la EdU par incubation de l'œuf à 37 ° C jusqu'à ce que la scène désirée. Après injection, ne pas retourner l'œuf à l'inclinaison des étagères en incubateur. Placez la pâte plat bordé de plastique enroulée sur surface stable à l'intérieur de l'incubateur.
- Retirer la pellicule de plastique et disséquer l'embryon en suivant le protocole ci-dessus.Fixer l'embryon dans 4% de PFA et incuber 12 heures à 4 ° C comme décrit ci-dessus. Après fixation, laver avec de l'éthanol à 100% (EtOH) pendant 5 min et magasin en frais EtOH à 100% à -20 ° C jusqu'à analyse plus approfondie.
5. EdU »Cliquez sur« Protocole de réaction
Les étapes suivantes sont toutes effectuées dans des flacons de verre.
- Réhydrater les embryons avec des lavages successifs de 5 min de ce qui suit:
- EtOH, 75% EtOH et 25% déminéralisée distillée stérile (SDD) de l'eau, 50% d'EtOH et 50% d'eau sdd, 25% EtOH et 75% 1X PTW, 100% 1X Ptw
- Laver trois fois en 100% 1X PTW pendant 10 min chacun.
- Diluer l'additif tampon de réaction (kit de composants F) en combinant une partie de la solution tampon d'actions 10X (10 pi) pour 9 parties d'eau SDD (90 pi).
- Préparer le mélange de réaction dans un tube séparé en mélangeant ce qui suit: 875 ul de PBS 1X, 20 ul de CuSO 4, 5 ul d'azide, 100 ul de tampon dilué additif de réaction.Remarque: Volume du mélange de réaction peut être réduite. La réaction ne fonctionnera que si l'embryon est complètement recouvert dans le mélange réactionnel. Ajouter l'additif tampon de réaction dilué (étape 5.3) immédiatement avant utilisation. Toutes les étapes suivantes sont effectuées dans l'obscurité. Couvrir les embryons avec du papier à l'abri de la lumière.
- Recouvrir les fioles avec une feuille d'aluminium, et incuber à la verticale à la température ambiante pendant deux heures en les plaçant dans un rack en polystyrène attaché à un nutator.
- Laver les embryons 3 fois en eau douce du PBS 1X pendant 10 min chacun.
- Incuber les embryons frais PFA 4% pendant une nuit à 4 ° C.
- Laver 3 fois en PBS 1X pendant 10 min chacun et magasins en frais 1X PBS à 4 ° C. Couvrir les embryons avec du papier jusqu'à ce que d'autres analyses.
Résultats
Les étapes schématisés dans la figure 1 indiquent l'apparition de l'embryon alors qu'il était attaché à la membrane vitelline (A) et de démontrer la bonne méthode pour séparer l'embryon à partir du jaune (B). L'embryon peut être identifiée par la zone de jonction, ce qui est beaucoup plus léger que la membrane vitelline. L'embryon lui-même est souvent difficile de distinguer jusqu'à ce que le jaune est coupé. Une fois que l'embryon est disséquée à partir de l'œuf, il peut être fixé ou éclair congelé pour une utilisation ultérieure. Si une hybridation in situ est prévue pour l'embryon disséqué, il est nécessaire de retirer la membrane vitelline qui est collée à l'embryon par l'intermédiaire de la zone de jonction. Figure 2 illustre l'amélioration de la visibilité de l'embryon, une fois cette membrane est retirée (C), et la bonne façon à peler la membrane vitelline (A, B). Après dissection et de fixation, l'ensemble de montage d'hybridation in situ a été effectuée comme on le voit sur la figure 3 (A, A ', B, B») Et la figure 4 (A, A ', B, B') et la figure 5 (A, B, C) pour détecter des différences dans orthodenticle homeobox 2 (Otx2) expression dans les embryons de développement exposés à de faibles doses de méthylmercure. Figure 5 montre les résultats de la sonde de détection, ce qui démontre le manque de fond. Dans la figure 4, en dépit d'être disséqué de l'œuf au même point dans le temps, l'embryon de développement exposés au méthylmercure (MeHg) a progressé à l'étape 5 22 (B, B '), tandis que l'embryon de contrôle développé à l'étape 6 22 (A, A »). Le groupe d'embryons disséqué et représenté sur la Figure 4 ont été collectées à partir de l'emboîtement et de prise de l'incubateur à la même heure. Bien que certains variation naturelle est présente dans le développement, sur la base de données de dissection précédents, il est peu probable que les fluctuations de température dans l'incubateur ne causent que de 2,4 ppm de méthylmercure embryons soient dévepmentally retardé. Les différences dans les étapes indiquent des changements dans la prolifération des cellules dans des embryons de développement exposées au méthylmercure.
Avant de dissection, Edu a été injecté dans un ovule jour 2 et on laisse incuber pendant la nuit. Après dissection et la fixation de l'étape 16 22 embryon, EdU a été visualisée en utilisant "clic" chimie, permettant la détection de cellules proliférantes comme on le voit sur la figure 6 (A, B, C). Il est important de surveiller attentivement les points de temps en plaçant les œufs dans l'incubateur et pendant les dissections, comme l'exposition au méthylmercure ou d'effectuer le dosage EdU peut perturber la progression du développement. La première injection a été effectuée au jour 0, qui était le jour de la collecte comme spécifié à l'étape 1.3. Cet embryon a été disséqué environ 38 heures plus tard (étape 7 22). Le taux de survie a été trouvée être d'environ 90% (même taux que les embryons témoins) aussi longtemps que la quantité d'injection était sous 478 nl.
Cette méthodologie permet également de dissection pour l'extraction de l'ARN de haute qualité. Après l'étape de dissection 16 22 embryons, une extraction de l'ARN a été réalisée selon le protocole du fabricant sans aucune optimisation nécessaire, comme on le voit sur la figure 7. L'enlèvement de la membrane vitelline n'était pas nécessaire pour l'extraction d'ARN et les applications ultérieures qRT-PCR.
Note: Tous les chiffres de l'embryon sont orientés de sorte que les régions antérieure et postérieure sont en haut et en bas de l'image, respectivement.

Figure 1. Procédure de repérage et la dissection des embryons zèbre pinsons, les étapes 1-10 22. Localiser embryon en roulant doucement le jaune jusqu'à ce que le disque blanc léger est apparente (A). Une fois que l'embryon est situé au centre du jaune d'oeuf, le jaune d'oeuf est disséqué dans un mode pas à pas (B) lorsque la première coupe soulage la pression de la membrane vitelline (1) et les coupes ultérieures (2) la frontière de la zone de jonction (zj), qui est adhérant à la membrane vitelline. Barres d'échelle représentent 1 mm.
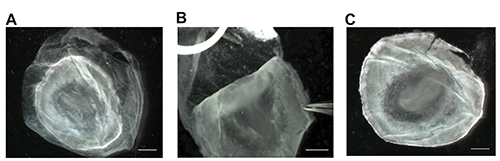
Figure 2. Enlèvement de la membrane vitelline et la visibilité des structures embryonnaires. Après l'élimination de l'embryon à partir du jaune, le lieu embryon dans une boîte de Pétri contenant 4% de PFA. Si une hybridation in situ a besoin d'être effectué, la visibilité des structures embryonnaires est essentielle et peut être obtenue en enlevant la membrane vitelline (A). Saisissez la membrane vitelline très fin, incliné pinces et retirez délicatement loin de l'embryon par manipulation de l'embryon directement au bord extérieur, si nécessaire(B). enlèvement de la membrane vitelline améliore la présence de structures embryonnaires, et permet d'embryons à imager ou traitées avec l'hybridation in situ (C) dans. Barres d'échelle représentent 1 mm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Tout le montage hybridation in situ réalisée sur zèbre embryons de pinson de développement exposés au méthylmercure. Profils d'expression de orthodenticle homéobox 2 (Otx2) ont été caractérisés chez les embryons exposés à 0,0 ppm de méthylmercure (A, A ') et 2,4 ppm de méthylmercure (B, B ») par l'alimentation parentale. Le doRsal (A) et ventral (A ') l'expression de Otx2 est visible à travers les mésencéphale et optiques vésicules lors de l'étape 12 22. Les embryons de groupe de traitement ont été disséqués au même point de temps, mais ont un retard de développement comme on le voit dans la partie dorsale (B) et vue ventrale (B ') de structures de la tête, qui sont caractéristiques de l'étape 11 22 Abréviations:. mb, le mésencéphale; op, vésicule optique. Barres d'échelle représentent 1 mm.
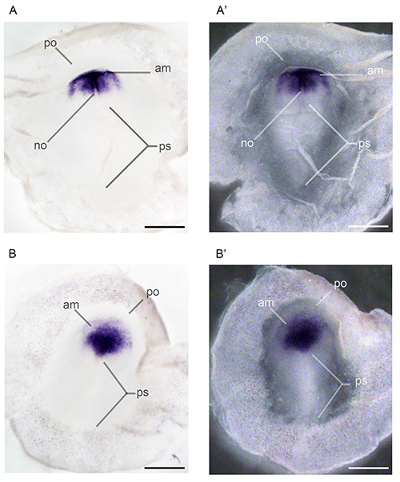
Figure 4. Tout le montage in situ hybridation réalisée sur les embryons zèbre pinson de développement exposés au méthylmercure. profils d'expression de orthodenticle homéobox 2 (Otx2) ont été caractérisés à l'étape 6 22 Embry os exposés à 0,0 ppm de méthylmercure (A, A ') et l'étape 5 22 embryons exposés à 2,4 ppm de méthylmercure (B, B') par l'intermédiaire de régime parental. Abréviations: AM, la marge antérieure du mésoderme; non, notocorde, mésoderme notocorde; po, proamnion, blastopore antérieure; ps, ligne primitive 22. Barres d'échelle représentent 1 mm.
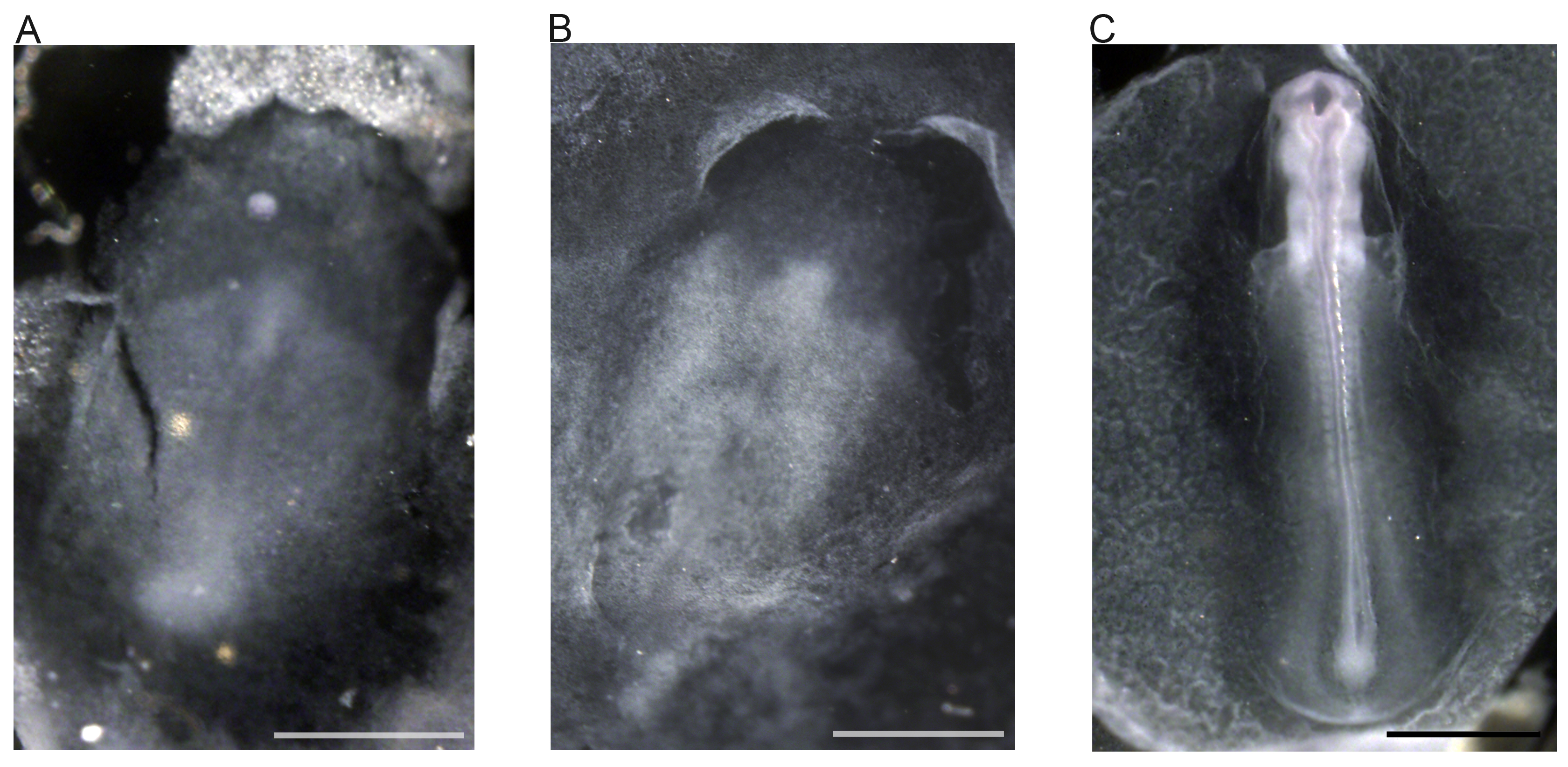
Montage Figure 5. Tout in situ hybridation effectuée sur des embryons de zèbre pinson aide d'une sonde de détection. (A) Etape 5 22 embryon. (B) stade précoce 6 22 embryon. (C) de l'étape 11 22 embryon. Barres d'échelle représentent 1 mm.
6 "src =" / files/ftp_upload/51596/51596fig6highres.jpg "/>
Figure 6. EdU incorporation et de protection dans des embryons de zèbre pinson. EdU "clic" chimie a été utilisé pour détecter les cellules proliférantes dans un stade 16 22 embryon (A, B, C). Edu est incorporé dans l'ADN à la place de la thymidine 26, 27 et est détectée en utilisant click chemistry 27. La prolifération est clairement visible sur les bords latéraux des somites et le bourgeon caudal. Le panneau A montre la prolifération se produit exclusivement dans la partie postérieure de l'embryon et des cellules prolifératives montre également individuels. Groupe B montre les emplacements de prolifération dans l'ensemble embryon. Groupe C montre la région antérieure, et montre le télencéphale hautement proliférante (te) plus en détail. Abréviations: af, pli amniotique; FLB, membres antérieurs bourgeon; hlb, des membres postérieurs bourgeon; le, l'objectif vésicule; ms, mésencéphale; mt, Métencéphale; opc, cupule optique; pa, arc branchial; sm, mésoderme somites; tb, bourgeon caudal; te, télencéphale. Barres d'échelle représentent 1 mm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
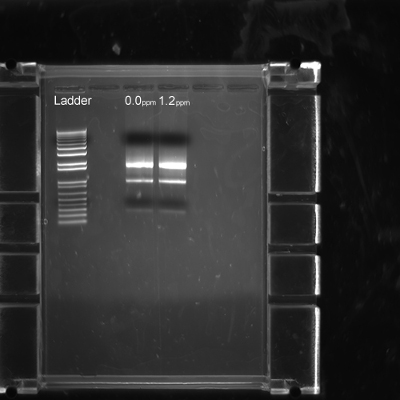
Figure 7. Qualité de l'ARN extrait de disséquées embryons zèbre pinson. Contrôle (0,0 ppm) et 1,2 ppm de méthylmercure embryons ont été disséqués et flash gelé comme décrit dans l'étape 3.8. Chaque couloir montre l'ARN extrait à partir de deux embryons homogénéisées de chaque groupe de traitement.
Discussion
Le développement récent d'un guide de mise en scène embryologique 22 et l'annotation du génome rendre le diamant mandarin, un organisme modèle souhaitable pour les études de développement. Cependant, la petite taille et la fragilité des embryons zèbre pinson, qui vont de 3 à 7 mm dans les stades 1 - 10 22, peuvent faire des dissections difficile 11, 14. Recherche et la suppression proprement embryons de la surface du jaune peut être difficile. Ce protocole fournit des détails suffisants pour effectuer la procédure avec facilité. Ce protocole met en évidence les étapes critiques qui ne sont pas généralement connus, mais qui sont nécessaires pour assurer une dissection succès. Par exemple, il est essentiel de laisser une petite couche de jaune entre l'embryon et la feuille de papier peser pour empêcher de coller.
L'identification et l'élimination de l'embryon peut être difficile. Pour résoudre identifier l'embryon sur la surface du jaune, briller la lumière au dessus de la jaune après qu'il aété retiré de l'œuf, et regarder le jaune à un angle de 45 ° pour trouver l'embryon. Une fois l'embryon se trouve, couper le jaune sur peser papier en prenant soin de ne pas déchirer l'embryon.
Si d'autres applications comprennent l'imagerie des différences anatomiques, hybridation in situ, ou des essais de prolifération cellulaire, il est important d'enlever la membrane vitelline à l'étape 1-8 pour 22 une meilleure visualisation des structures. Si des difficultés lors du retrait du jaune ou de la membrane vitelline à un stade précoce, de fixer l'embryon dans 4% PFA avant de le laver dans du PBS 1X à réduire la fragilité embryonnaire. En enlevant d'abord la membrane vitelline lors de la dissection tel que décrit, les structures sont clairement visibles et intactes zébrée dans des embryons de fringillidés après avoir effectué une hybridation in situ.
Une limitation de l'Education est que l'administration de volumes de dosage sur 478 pistes nl à létalité embryonnaire. Toutefois, la vaste gamme de dosage permet varyinniveaux g de marquage de prolifération cellulaire.
La réaction «clic» utilisé dans ce kit est le cuivre (I)-catalysée-Alcyne-azoture-Cycloaddition (Cu (I) AAC). Dans cette réaction spécifique, une molécule analogues de la thymidine contenant alcyne (EDU) est incorporé en divisant activement les cellules. Le groupe alcyne en EdU saillie à partir de la structure hélicoïdale de l'ADN, et est détecté par exposition à une molécule d'azoture conjugué à une molécule fluorescente verte qui se lie au groupe alcyne libre. La fluorescence verte présente les cellules nouvellement prolifératives de l'embryon. Le bio-orthogonalité de l'azoture et alcyne les empêche la coloration non-spécifique, car ces espèces réactives ne sont pas naturellement présents dans les organismes. En outre, parce que l'ADN n'a pas besoin d'être dénaturé afin que la réaction se produise, une autre analyse de l'ADN-dépendante peut être facilement effectuée 27.
Une limitation inhérente de cette méthode est la petite taille et de fragilité de zèbre embryons de pinson. Retrait de la membrane vitelline d'embryons étapes 1 - 15 22 peut entraîner dans les structures embryonnaires nuisibles s'il n'est pas effectué avec prudence. Cependant, ce protocole simplifie la méthode de dissection, permettant aux enquêteurs d'utiliser premiers stades embryonnaires pour examiner les anomalies structurelles et l'expression des gènes qui n'ont pas été précédemment étudiées en profondeur. Ce protocole ouvre la voie à une multitude de tests cellulaires moléculaire qui permettront aux enquêteurs de déterminer les origines développementales de phénotypes adultes. Par exemple, il sera possible d'examiner l'expression des gènes impliqués dans l'apprentissage vocal dans diverses conditions environnementales ou à la suite des traitements pharmacologiques dans les premiers stades de développement 28, 29,30,31. Bien que non démontrée dans le présent document, cette méthode permet potentiellement d'autres procédures telles que radioactifs hybridation in situ sur des coupes de tissus de pinson de zèbre et l'électroporation / en voo chirurgie 32, 33,34. Étant donné que le diamant mandarin a été établi comme un modèle important organisme dans un vaste corps de la littérature, ces études fournissent des possibilités inexploitées de lier les mécanismes de développement de la physiologie et le comportement des adultes, en particulier le développement de la langue 7, 9.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs remercient leurs sources de financement, Howard Hughes Medical Institute Programme de formation de premier cycle en sciences auprès du College of William and Mary; commanditaire de la subvention: NIH (MSS); Numéro de subvention: R15NS067566. Ils reconnaissent également le soutien du Collège de William et Mary, Département de biologie et du Collège des Arts et des Sciences de l'aide pour les soins aux animaux.
matériels
| Name | Company | Catalog Number | Comments |
| Chicken egg incubator | We use a Picture Window Hova-Bator Incubator, Circulated Air Model | ||
| Click-iT EdU Alexa Fluor 488 Imaging kit | Invitrogen | C10337 | Detection of cell proliferation. |
| Dissection microscope | We use Olympus SZ61 | ||
| 7'' Drummond capillary for Nanoject II injector | Drummond | 3-00-203-G/X | |
| Drummond Nanoject II microinjector | Drummond | ||
| Dumont Tweezers #55 | World Precision Instruments | 14099 | |
| Ethanol (EtOH) | |||
| 50 ml Falcon tube (polypropylene) | Fisher Scientific | 06-443-18 | |
| FastPrep Lysis Matrix H tubes | MP biomedicals | 6917-100 | Used for RNA extraction, used to homogenize embryos |
| Fiber optic illuminator lamps (High Intensity Illuminator) | Dolan-Jenner Industries | Fiber-Lite MI-150 | |
| Glass vials with screw cap (DEPC treated) | Fisher Scientific | 03-338A | |
| Microcentrifuge eppe tube (1.5 ml) | Fisher Scientific | 05-408-129 | |
| Mineral oil | Sigma-Aldrich | M-8410 | |
| Modeling Clay | Any brand | ||
| Narshige PB-7 needle puller | Narshige | ||
| Omni Bead Ruptor Homogenizer | OMNI International | 19-010 | Used for RNA extraction |
| 4% Paraformaldehyde (4% PFA): 20 ml 8% PFA (32 g paraformaldehyde, 350 ml sdd H2O, adjust pH to 7.6, 400 ml sdd H2O), 20 ml 2x PBS | Fixation of embryos. Caution, is harmful and do not inhale. | ||
| Phosphate buffered saline (1x PBS): 200 ml 10x PBS, 1,800 ml Barnstead H2O, adjust pH to 7.4 | |||
| Phosphate buffered saline (10x PBS): 800 ml Barnstead, 2.013 g KCL, 80.063 g NaCl, 2.722 g KH2PO4 monobasic, 14.196 g Na2HPO4 dibasic, 200 ml Barnstead H2O, adjust pH to 6.5 | |||
| Phosphate buffered saline with 0.1% Tween-20 (1x PTw): 1,800 ml Barnstead H2O, 200 ml 10x PBS, adjust pH to 7.4, 2 ml Tween-20 | |||
| 35 ml Plastic Petri dish | Fisher Scientific | 08-757-100A | |
| plastic wrap | Any brand | ||
| Prepease RNA Spin Kit | PrepEase, Affymetrix | 78766 1 KT | Used for RNA extraction, used to homogenize embryos |
| Reaction Mix: 875 μl 1xPBS, 100 mM 20 μl CuSO4 (Kit Component E), 5 μl Alexa Fluor 488 azide (Kit Component B), 100 μl diluted reaction buffer additive (Kit Component F) | Invitrogen | C10337 | Detection of cell proliferation. |
| sdd H2O | |||
| Seed cup | We use it as a container when incubating eggs | ||
| Stainless steel scalpel | |||
| Standard nest box | We use Abba Plastic Finch Nestboxes | ||
| 4 ml, Teflon Lined Cap, Glass Vials | Fisher Scientific | 02-912-352 | |
| Transfer pipettes (polyethylene) | Fisher Scientific | 13-711-7M | |
| 4 x 4 weigh paper | Fisher Scientific | 09-898-12B |
Références
- Eng, M. L., Elliott, J. E., MacDougall-Shackleton, S. A., Letcher, R. J., Williams, T. D. Early exposure to 2,2',4,4',5-pentabromodiphenyl ether (BDE-99) affects mating behavior of zebra finches. Toxicol Sci. 127, 269-276 (2012).
- Winter, V., Elliott, J. E., Letcher, R. J., Williams, T. D. Validation of an egg-injection method for embryotoxicity studies in a small, model songbird, the zebra finch (Taeniopygia guttata). Chemosphere. 90, 125-131 (2013).
- Maney, D. L., Goodson, J. L. Neurogenomic mechanisms of aggression in songbirds. Adv Genet. 75, 83-119 (2011).
- Kirn, J. R. The relationship of neurogenesis and growth of brain regions to song learning. Brain and Language. 115, 29-44 (2010).
- Fisher, S. E., Scharff, C. FOXP2 as a molecular window into speech and language. Trends in Genetics. 25, 166-167 (2009).
- Tokarev, K., Tiunova, A., Scharff, C., Anokhin, K. Food for Song: Expression of C-Fos and ZENK in the Zebra Finch Song Nuclei during Food Aversion Learning. PLoS One. 6, (2011).
- Vargha-Khadem, F., Gadian, D. G., Copp, A., Mishkin, M. FOXP2 and the neuroanatomy of speech and language. Nat Rev Neurosci. 6, 131-138 (2005).
- Schulz, S. B., Haesler, S., Scharff, C., Rochefort, C. Knockdown of FoxP2 alters spine density in Area X of the zebra finch. Genes, Brain and Behavior. 9, 732-740 (2010).
- Jarvis, E. D., et al. Avian brains and a new understanding of vertebrate brain evolution. Nat Rev Neurosci. 6, 151-159 (2005).
- Brainard, M. S., Doupe, A. J. Translating birdsong: songbirds as a model for basic applied medical research. Annu Rev Neurosci. 36, 489-517 (2013).
- Mayer, U., Watanabe, S., Bischof, H. J. Spatial memory and the avian hippocampus: Research in zebra finches. J Physiol Paris. , (2012).
- Warren, W. C., et al. The genome of a songbird. Nature. 464, 757-762 (2010).
- Agate, R. J., Scott, B., Haripal, B., Lois, C., Nottebohm, F. Transgenic songbirds offer an opportunity to develop a genetic model for vocal learning. Proceedings of the National Academy of Sciences. 106, 17963-17967 (2009).
- Birkhead, T. R., et al. Internal incubation and early hatching in brood parasitic birds. Proceedings of the Royal Society Biological Sciences. 278, 1019-1024 (2011).
- Haesler, S., et al. FoxP2 expression in avian vocal learners and non-learners. J Neurosci. 24, 3164-3175 (2004).
- Godsave, S. F., Lohmann, R., Vloet, R. P. M., Gahr, M. Androgen receptors in the embryonic zebra finch hindbrain suggest a function for maternal androgens in perihatchingsurvival. Journal of Comparative Neurology. 453, 57-70 (2002).
- Stern, C. D. The chick; a great model system becomes even greater. Dev Cell. 8, 9-17 (2005).
- Kuenzel, W. J., Medina, L., Csillag, A., Perkel, D. J., Reiner, A. The avian subpallium: new insights into structural and functional subdivisions occupying the lateral subpallial wall and their embryological origins. Brain Research. 1424, 67-101 (2011).
- Tickle, C. The contribution of chicken embryology to the understanding of vertebrate limb development. Mech Dev. 121, 1019-1029 (2004).
- Vergara, M. N., Canto-Soler, M. V. Rediscovering the chick embryo as a model to study retinal development. Neural Development. 7, (2012).
- Davey, M. G., Tickle, C. The chicken as a model for embryonic development. Cytogenet Genome Research. 117, 231-239 (2007).
- Murray, J. R., Varian-Ramos, C. W., Welch, Z. S., Saha, M. S. Embryological staging of the zebra finch, Taeniopygia guttata. J Morphol. , (2013).
- Hawkins, P., Morton, D. B., Cameron, D., Cuthill, I., Francis, R., Freire, R., Gosler, A., Healy, S., Hudson, A., Inglis, I., Jones, A., Kirkwood, J., Lawton, M., Monaghan, P., Sherwin, C., Townsend, P. Laboratory birds: refinements in husbandry and procedures. Fifth report of BVAAWF/FRAME /RSPCA/UFAW Joint Working Group on Refinement. Lab Anim. , (2001).
- Pearse II, R. V., Esshaki, D., Tabin, C. J., Murray, M. M. Genome-wide expression analysis of intra- and extraarticular connective tissue. Journal of Orthopaedic Research. 27, 427-434 (2009).
- Pizard, A., et al. Whole-mount in situ hybridization and detection of RNAs in vertebrate embryos and isolated organs. Current Protocols in Molecular Biology. 66, (2004).
- Warren, M., Puskarczyk, K., Chapman, S. C. Chick embryo proliferation studies using EdUlabeling. Developmental Dynamics. 238, 944-949 (2009).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA syntesis in vivo. Proceedings of the National Academy of Sciences U S A. 105, 2415-2420 (2008).
- Hoogesteijn, A. L., DeVoogd, T. J., Quimby, F. W., De Caprio, T., Kollias, G. V. Reproductive impairment in zebra finches (Taeinopygia guttata). Environmental Toxicology and Chemistry. 24, 219-223 (2005).
- Winter, V., Williams, T. D., Elliott, J. E. A three-generational study of In ovo exposure to PBDE-99 in the zebra finch. Environmental Toxicology and Chemistry. 32, 562-568 (2013).
- Kitulagodage, M., Buttemer, W. A., Astheimer, L. B. Adverse effects of fipronil on avian reproduction and development: maternal transfer of fipronil to eggs in zebra finch Taeinopygia guttata and in ovo exposure in chickens Gallus domesticus. Ecotoxicology. 20, 653-660 (2011).
- Hallinger, K. K., Zabransky, D. J., Kazmer, K. A., Cristol, D. A. Birdsong differs between mercury-polluted and reference sites. The Auk. 127, 156-161 (2010).
- Chen, C. C., Wada, K., Jarvis, E. D. Radioactive in situ Hybridization for Detecting Diverse Gene Expression Patterns in Tissue. Journal of Visualized Experiments. , (2012).
- Chen, C. C., Balaban, E., Jarvis, E. D. Interspecies Avian Brain Chimeras Reveal That Large Brain Size Differences Are Influenced by Cell–Interdependent Processes. PLoS One. 7, (2012).
- Chen, C. C., Winkler, C. M., Pfenning, A. R., Jarvis, E. D. Molecular profiling of the developing avian telencephalon: Regional timing and brain subdivision continuities. The Journal of Comparative Neurology. 521, 3666-3701 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon