Method Article
外植片培養での歯胚の開発に続いてのためのスライス培養法
要約
ここでは、詳細な組織チョッパーを用いて下顎骨のスライスにおける培養歯胚へのメソッド。この方法は、より伝統的な培養法を用いて、利用できない、操作および系統の追跡のための素晴らしい機会を提供し、開発中に歯に固有のアクセスを許可します。
要約
外植片培養物は、特定の時点で現像器官の操作を可能にし、従って、発生生物学者のための重要な方法である。多くの器官のために、ex vivoで培養中に監視できるように、発達中の組織にアクセスすることは困難である。形態形成運動に従うことができ、特定の細胞集団が、系統操作またはトレースの対象とすることができるようにスライス培養法は、組織へのアクセスを可能にする。
本論文では、種の範囲の歯胚の培養に非常に成功しているスライス培養する方法を説明します。この方法は、他の顎の組織に囲まれた、生体内で観察されたものと同様の速度にて開発歯胚への優れたアクセスを提供します。これは、歯と周囲組織との間の組織の相互作用を監視することを可能にする。本論文では、歯胚に集中していますが、同じプロトコルは数値の発展をたどるために適用することができますこのような唾液腺、メッケル軟骨、鼻腺、舌、耳などの他の臓器の。
概要
多くの実験のためには、培養組織ex vivoでの開発に従うことができることが重要である。組織を発症する培養物は、開発の定義された周期でアクセスを提供し、培養培地への因子の添加による遺伝子の操作、または装填ビーズ上、およびトランスフェクションおよびエレクトロポレーション1を用いて可能にする。多くの実験のために、それが成長するにつれて、組織は、形態形成を受けるように系統標識細胞の運命を追跡するために、例えば、組織を可視化できることが重要である。これは、胚からの組織のブロックを培養するときに明らかにされていません胚の中の深い開発組織に特に問題となり得る。彼らは下顎、上顎骨および前頭鼻プロセス内で開発するように歯が、この良い例です。全体顎骨を培養したときに歯の表面的な構造が見ることができますが、形態の変化は、固定された組織の切片化した後に分析することができます 2まで。私たちは、私たちが歯胚の発達に従うことを可能にし、開発中に歯の様々な部分へのアクセスを提供するライブスライス培養技術を適応している。修正されたTrowellの方法3を使用して気液界面での技術培養歯胚スライス、。これらのスライス培養を直接歯の形態形成に続いて、このようなエナメルの結び目と歯乳頭や毛包1,4-7などの個別のコンポーネントの系譜トレースを可能に非常に有用であった。技術は、マウス胚に限定されず、正常ブタの培養生のスライスとヘビ歯組織8,9に用いられてきた。歯の発生を可視化することができるという利点に加えて、スライス方法はまた、組織の薄いスライスをインキュベーターから媒体と空気から栄養分へのアクセスが増加しているという利点を有する。これが改善され、生体内での開発と一致する歯胚の成長、およびshow invasになり乳頭7への内皮細胞のイオン。これとは対照的に、全体の下顎の文化で歯胚は、 生体内でのものよりも遅く発展と文化の中心地は、多くの場合、長期培養中に壊死性である。スライス培養において、歯は、顎のスライス内で発達し、周囲の現像骨および他の組織との相互作用を監視することができる。本手法では、組織は、直線支持媒体10,11に埋め込 む必要はありませんし、チョッピングブロックに組織を取り付けるための任意のシステムを必要とせず、解剖後に切り刻まれている。方法は、多くの下顎骨が1セッションで区分けすることができるように、そのための非侵襲的かつ迅速である。
プロトコル
1。セットアップする
- (鉱物油で潤滑研ぎ石を使用して)解剖器具をシャープにし、70%エタノールスプレーや乾熱滅菌を使用して器官培養に使用する前に滅菌する。 12 V電源を使用して、2M水酸化ナトリウムで電気分解を使用して解剖針を研ぐ。
- 1%のグルタおよび1%ペニシリン - ストレプトマイシンを補充したアドバンスト·ダルベッコ改変イーグル培地、F12(DMEM F12キー)からなる、胚の器官の解剖と培養に用いる培養液を準備します。
2。胚解剖
- ホームオフィスやその他の管理機関によって承認されたスケジュール1の方法を使用して、時限交配、妊娠女性を間引く。下腹部の周りの皮膚を離れて解剖し、ハサミを使って腹部を開いてカット。下正中線で一緒に接続する2つの子宮角を見つけます。
- 氷の上の媒体で満たされたチューブ内の子宮と場所を解剖する。 WHEnは氷上で、組織は、数時間放置することができる。
- 子宮を取り出して、顕微鏡下で培地中のペトリ皿に置く。可能な胚の解離は、汚染を最小限に抑えるために層流フード内で実行されるべきある。
- 子宮から胚を解剖し、その胚体外組織からそれらを解放。
- タングステン針を使用して胚を斬首し、培地の新鮮な皿に頭を移す。
- 口腔内に針を配置することで、ヘッドから下顎を隔離し、頭の後ろ( 図1Aおよび図1B)に向かってカットスルー。チョッピングを待っている間に単離されたあごを一時的に氷上で媒体に格納することができる。
- 全体下顎のスライスラインステージのためE11.5-E15.5歯胚培養のための理想的です。 E15.5の後に下顎骨の途上骨は、チョッピングのためにあまりにも難しいです。歯のスライスは、まだすることができますが、骨(歯骨や歯槽骨を形成する)は、最初にして除去されなければならない9チョッピングの前に解剖。タングステン針とピンセットを使って慎重に骨を除去。
3。胚スライス
- 標準テーブル組織チョッパー( 図1C)を使用して、下顎骨組織切片を準備します。約200顎後に新鮮な刃を使用し、それが低下したときにはディスク装着と同一平面にあることを確認してください。
- 使用前に70%エタノールでディスク装着し、ブレードを清掃してください。マシンを使用している場合、ブレードは非常にシャープでよう注意が必要があります。
- 標本の年齢に応じて200〜400ミクロンの間の切断距離でチョッパーを設定し、全体の歯胚が必要であるかどうかに応じて。最大でブレード力を設定。
- ピペットまたはピンセットを用いてプラスチック製の取り付けディスクに下顎を転送します。向きがまだ明確で確認して、ディスク上に下顎を配置します。現像舌配向を決定するのに有用なランドマークとして使用することができる。臼歯ためのAFを使用切歯のために、彼らは( 図2Aにチョッピングの面を参照)成長するにつれて、これらの歯の様々な方向を反映するように、下顎の矢状スライスを使用している間rontal /横方向( 図1(b)にチョッピングの面を参照)。
- 少し取り付けディスクに下顎を乾燥させるために、ろ紙を用いて組織の周りから過剰な培地を除去。
- すぐに乾燥させた後、チョッパーの円形のステンレス製のテーブルの上にディスクを置きます。マシンの電源を入れ、[開始]を押します。表は、同時にブレードを担持するチョッピングアームを上昇さ/分、最大200ストロークで滴下しながら左から右に自動的に横断する。
- 組織が完全にスライスされた後、マシンの電源をオフにします。ブレードアームが上昇位置にあることを確認して、ディスクを取り出します。ブレードアームの下に指を入れたりチョッピング時に無人の機械を放置しないでください。
- ディスク装着を取るとすぐにメディアトンを追加過度の乾燥を防ぐために、ディスク上のスライスO。注意深く培地の小さなペトリ皿( 図2A)内にタングステン針、次いでピペットを用いて、ディスクの底からスライスされた組織を取り除く。
- 針を使用してスライスを分離した後、実体顕微鏡( 図1D、1E、および図2B)の下で、目的の組織を含む組織切片を選択します。培地で新鮮な培養皿に選択したスライスを配置します。
4。スライス文化
- 、脱水を防ぐために、外側のウェルにオートクレーブ処理水約2mlを添加して皿の中央を横切って金属グリッドを配置することによって、培養の準備が中央ウェル器官培養皿を準備し( 図3Aおよび3B)。
- ステンレスメッシュのシートからX 1.5センチメートル約4センチのストリップを切断した金属グリッドを準備します。中央に穴を作るために穴パンチを使用し、曲げ千鳥エンドを作成するための側面。グリッドは、ディッシュ( 図3Aと図3B)の底に平行に横たわって、中央だけでなく全体に平らに適合する必要があります。使用前に滅菌するグリッドをオートクレーブ。
- グリッドの穴をカバーするのに十分な大き透明なポリエチレンテレフタレート(PET)膜(孔径0.4μm)での片を切り取る。選択されたスライスと皿にカット膜を置きます。
- 膜の上にスライスを配置し、慎重に中央に平らにスライスして、媒体からメンブレンを持ち上げます。
- 中央にある円形の穴の上にグリッド上にフィルターを置き、膜のレベルまで、ウェルに培養液に約1ミリリットルを追加。
- 操作のために(例えば、8)を培地にタンパク質または小分子阻害剤を追加します。
- 文化の日の0時に形態学のレコードのスライスを撮影しています。
- 5%のCOの加湿雰囲気中で食器を置く 2 UB。
- 平均して7日間、定期的に文化を撮影しています。培養液ごと48〜72時間を変更します。写真撮影のための下( 図2C-E)からの光源を用いてスライスを表示します。
5。リネージュトレース
系譜トレースが必要な場合は、このようにDiIまたはDiOのような親油性染料は、ステップ4、スライス培養の前に歯胚に注入することができる。
- ニードルプラーを用いてガラスキャピラリー針を引き出します。
- ピンセットを用いて、針の先端を破壊し、ダウン色素溶液にチップを置く。染料は、毛細管現象によってチップを埋めながら、数分間のままにしておきます。
- ホルダーに充填された注射針を配置し、注射器や口アスピレーターに管を介して取り付けます。
- ラベルされることになったスライスの領域をタッチし、培地中の針の先端の位置を決めます。針ANから少量の染料を変位させる空気圧を適用する組織上にD。
- 針を取り外し、蛍光下にラベルを確認してください。
- 正常に標識されたスライスは、フィルターに移し、工程4に記載のように培養することができる。
結果
第一大臼歯歯小嚢の動きに追従するためには、250μmの正面切片を上記の方法を用いて下顎を介して採取した。歯小嚢は、発生中の歯の外側のエナメル上皮(OEE)を取り囲む間葉の層であり、先に6の歯周組織の形成に関与することが示されている。顎はE14.5、歯の発生のキャップ段階で解剖した。スライスにおける歯科上皮の輪郭が明らかになった、と凝縮歯科間充織は、歯上皮( 図4A)の周りに暗いリングとして同定することができた。のDiIは舌側( 図4A)上の歯のスライスの外側のエナメル上皮の隣の間充織に注入した。標識後の切片を4日間培養した間隔( 図4Bおよび4C)で写真撮影した。 インビボ歯胚に達したであろうE18.5によるベルステージと、別個のベル段形状がこの期間にわたって類似の進行を示す、切片で観察された。のDiIのスポットは、歯が( 図4Bおよび4C)成長したように、外側の歯科上皮の周りに延びるセルの帯域に拡張することが認められた。

図1。ライブスライスの形成。(A)E14.5胚。破線は斬首のために低いカットから始まり、解剖針で切断面を示している。 (B)は、下顎を解剖した。舌は下向きに直面している。組織チョッパーする部分の面は、破線を用いて示されている。準備された試験片(矢印)とブレードアーム(BA)と白の取付ディスク(MD)を示す(C)組織チョッパー。モルから(D)の代表スライス地域。矢印は、臼歯歯胚を指す。モルスライスの(E)のハイパワービュー。歯胚上皮は黒い斑点を概説する。画像はフォトショップを使用してシャープに。 T =舌、DB =歯骨の骨、MC =メッケル軟骨。 = 3ミリメートル中のスケールバー。 B&D = 1ミリメートル中のスケールバー。 E = 500ミクロン中のスケールバーは。 大きな画像を見るにはここをクリックしてください 。
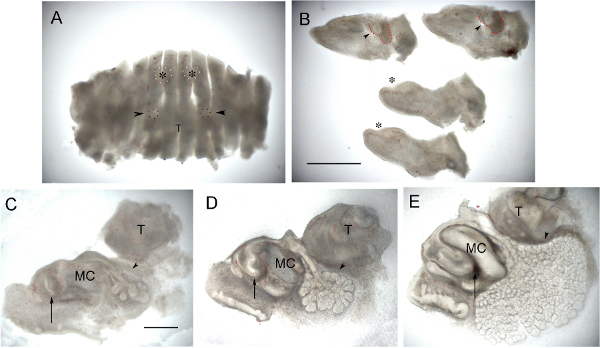
図2。切歯や腺文化。(A)E12.5下顎矢状に切り刻まれたこと。切歯(アスタリスクで輪郭白い斑点)と顎下腺(黒い斑点を概説し、矢印)を開発するだけで作ることができる。 (B)を分離し、中央4のスライスを示す同じ下顎。発展途上顎下腺Cさらに2つの側部(画像の上部)で凝縮した間葉(矢じり)に囲まれた芽と見ること。腺周囲に凝縮する間葉が赤い枠で囲まれている。切歯は2中央のスライス(画像の下)での上皮肥厚段(アスタリスク)である。 (C)0日目E14.0で切歯の矢状スライス。 1日後(D)同じスライス。培養3日後に、(E)同じスライス。 (CE)矢印は切歯と唇子宮頸ループを形成する。アローヘッドは顎下腺の開発を指しています。子宮頸ループが成長するにつれて、唾液腺が形態形成および管腔形成を分岐受けるし続けている間に文化の中で歯胚では、後方に伸びている。画像はフォトショップを使用してシャープに。 T =舌、三菱商事=メッケル軟骨。 A&B = 1ミリメートル中のスケールバー。 C、D、E = 500ミクロン中のスケールバー。 こちらをクリック大きな画像を表示します。
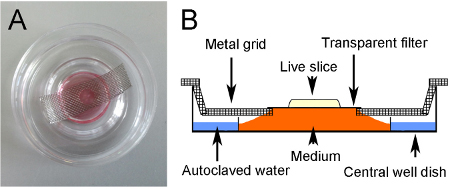
図3。培養方法。(A)培養スライス。文化は、金属格子を経由してメディア上に吊り下げ透明フィルタに位置しています。グリッド内の穴は、スライスが下から光を用いて可視化することができます。 (B)培養法の概略図。

図4。歯小嚢のDiIで標識する。(AC)は発展途上臼歯歯胚とのDiI系譜ラベルの位置を示す光と暗視野画像を合併。 (A)0日目。歯胚(矢頭)は、キャップの段階にある。 DIIを使用する歯の舌側の歯小嚢の細胞を標識する。 (B )1日目。 (C)4日目。歯胚ではベルの段階に達しているとのDiI標識した細胞を開発し、外エナメル上皮を中心とする円弧に広がるように見られている。画像は画面モードを使用してレイヤーをマージした後、Photoshopでシャープにされてきた。歯の上皮は黒い斑点と説明した。インナーエナメル上皮内にあるDP =歯乳頭。外エナメル上皮を中心に実行さDFは=歯小嚢、。 MCはメッケル軟骨を=。 =500μmで、A、B、Cの中のスケールバー。 大きな画像を見るにはここをクリックしてください 。
ディスカッション
歯の文化のこの方法は、歯胚へのアクセスの利点は、上皮または間葉内のビーズの正確な系譜トレースと配置を可能にする優れています。発展途上歯胚の決定された領域は、したがって、特に標的とすることができる。培養中に歯胚の変化形態を続けることができ、かつ操作の効果はすぐに評価した。
これらは正確に細断することができないような方法は、しかし、そのような象牙質及びエナメル質などの硬組織の実質的な形成の前に若い歯胚にのみ適している。 E15.5後顎のためには、チョッピングの前に骨を除去する必要がある。これは、潜在的に密接E16.5からの骨に関連付けられている歯胚を損傷させるという欠点がある。我々が正常に歯がエナメル質の堆積のためにカットするチョッパーのために硬くなりすぎた後、生後4、解剖歯胚をスライスしています。スライスMethodは蕾の段階1,6、つまり 、E13.5からの歯胚に適しています。歯は、上皮肥厚の段階にあるときに、この時点の前に、歯の細菌が発達行うが、成功率が低下し、形態が長期的に影響を受けることができる。
この方法の一つの大きな欠点は、チョッピングが歯を通してランダムに発生するということです。他ではチョッパーが中央突破歯胚を切るかもしれないが、いくつかのスライス全体の歯胚では、スライス内で発見されます。これは、同一スライスの多数を得ることが困難であり得ることを意味する。この問題に対処するためには、真ん中のスライスを分割し、実験群および対照として左右両側を使用することが可能である。このために、しかし、下顎を慎重にスライスが対称的にカットされていることを確認するためにチョッピングディスク上に配置する必要があります。いくつかの実験のためには、歯を解剖スライスを持っていることは有利になるようなエナメルのような内部構造、結び目は、系譜ラベル4のためにアクセスすることができます。歯胚は非常に堅牢で表示され、以前に半分に臼歯歯胚12,13に示すような半歯胚では、培養液中でよく開発することができます。
培養物をスライスするための代替手段として、歯の細菌が下顎骨および単離14中で培養中の解剖することができる。これは、組織の大きなブロックを培養に関連する栄養不足や酸素化の問題を取り除き、良い歯の発生につながるが、結果として歯が周囲の組織との相互作用なしで開発しています。周囲の間充織大量の削除されたときに形成歯胚の数は、正常な歯の発生15周囲の間充織の重要性を強調し、変更することができる。スライス培養は、したがって、骨や歯は歯槽骨の形成にどのように相互作用するかなど、組織の相互作用を研究する、またはどのようにSalIための良い方法です。腺は舌や口腔上皮、これらの組織を分離して培養した場合に失われるものと対話異なります。
本稿では、歯の細菌を培養するためのこの方法の使用を強調したが、同じ方法も開発し、顎下および舌下腺を培養し、そのようなメッケル軟骨( 図2)のような構造の開発を次のために優秀である。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
サラA. Alfaqeehは歯科、高等教育省、サウジアラビア王国の種類サウド大学によって資金を供給される。
資料
| Name | Company | Catalog Number | Comments |
| Ethanol | VWR | 101077Y | 100% ethanol was diluted in distilled H2O to 70%. |
| DMEM F12 | Gibco | 12634-010 | Advanced Dulbecco's Modified Eagle Medium F12 |
| GlutaMAX | Gibco | 35050-061 | |
| Penicillin-streptomycin | Sigma | P0781 | |
| DiI (Molecular probes) | Vybrant | V-22885 | Cell-labeling solution |
| Invitrogen | Cell tracker CM-DiI, C-7000 | ||
| DiO (Molecular probes) | Vybrant | V22886 | |
| Geminator 500 | Thomas | Thomas No. 3885A20 | Dry-heat sterilization |
| McIlwain tissue chopper | Ted Pella, Inc. | 10180 | Standard table |
| Organ culture dish (Center-Well Organ Culture Dish) | Falcon | 353037 | |
| Membranes (Cell Culture Inserts, 0.4 μm pore size) | BD Falcon | 353090 | PET track-etched membrane, 6-well format |
| Metal grids (Stainless Steel - AISI 304 - Mesh) | Goodfellow | FE228710 | (Fe/Cr18/Ni10) |
| AutoFlow Direct Heat CO2 Incubator | Nuaire | NU-5500 | |
| Picospritzer III | Intracel Ltd | 051-0500-900 0-100 psi | Single channel picospritzer III |
| Glass capillary with filament 1 mm | WPI | TW100F-4 | |
| Tungsten wire 0.1 mm | Goodfellow | W005138 | |
| Tungsten wire 0.38 mm | Goodfellow | W005155 | |
| Aspirator tubes | Sigma | A5177 | Used for mouth aspiration lineage tracers |
参考文献
- Rothova, M., Peterkova, R., Tucker, A. S. Fate map of the dental mesenchyme: dynamic development of the dental papilla and follicle. Developmental biology. 366, 244-254 (2012).
- Ferguson, C. A., et al. Activin is an essential early mesenchymal signal in tooth development that is required for patterning of the murine dentition. Genes & development. 12, 2636-2649 (1998).
- Trowell, O. A. The culture of mature organs in a synthetic medium. Experimental cell research. 16, 118-147 (1959).
- Matalova, E., Antonarakis, G. S., Sharpe, P. T., Tucker, A. S. Cell lineage of primary and secondary enamel knots. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 754-759 (2005).
- Mitsiadis, T. A., Tucker, A. S., De Bari, C., Cobourne, M. T., Rice, D. P. A regulatory relationship between Tbx1 and FGF signaling during tooth morphogenesis and ameloblast lineage determination. Developmental biology. 320, 39-48 (2008).
- Diep, L., Matalova, E., Mitsiadis, T. A., Tucker, A. S. Contribution of the tooth bud mesenchyme to alveolar bone. Journal of experimental zoology. Part B, Molecular. 312B, 510-517 (2009).
- Rothova, M., Feng, J., Sharpe, P. T., Peterkova, R., Tucker, A. S. Contribution of mesoderm to the developing dental papilla. The International journal of developmental biology. 55, 59-64 (2011).
- Buchtova, M., et al. Initiation and patterning of the snake dentition are dependent on Sonic hedgehog signaling. Developmental biology. 319, 132-145 (2008).
- Buchtova, M., Stembirek, J., Glocova, K., Matalova, E., Tucker, A. S. Early regression of the dental lamina underlies the development of diphyodont dentitions. Journal of dental research. 91, 491-498 (2012).
- Cho, S. W., et al. The primary enamel knot determines the position of the first buccal cusp in developing mice molars. Differentiation; research in biological diversity. 75, 441-451 (2007).
- Sakano, M., et al. Cell dynamics in cervical loop epithelium during transition from crown to root: implications for Hertwig's epithelial root sheath formation. Journal of periodontal research. , (2012).
- Fisher, A. R. Morphological development in vitro of the whole and halved lower molar tooth germ of the mouse. Archives of oral biology. 16, 1481-1496 (1971).
- Coin, R., Schmitt, R., Lesot, H., Vonesch, J. L., Ruch, J. V. Regeneration of halved embryonic lower first mouse molars: correlation with the distribution pattern of non dividing IDE cells, the putative organizers of morphogenetic units, the cusps. The International journal of developmental biology. 44, 289-295 (2000).
- Kavanagh, K. D., Evans, A. R., Jernvall, J. Predicting evolutionary patterns of mammalian teeth from development. Nature. 449, 427-432 (2007).
- Munne, P. M., Tummers, M., Jarvinen, E., Thesleff, I., Jernvall, J. Tinkering with the inductive mesenchyme: Sostdc1 uncovers the role of dental mesenchyme in limiting tooth induction. Development. 136, 393-402 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved