Method Article
El método de cultivo de la rebanada por Siguiendo desarrollo de gérmenes de dientes en Explante Cultura
En este artículo
Resumen
Aquí detallamos un método de cultivo de gérmenes dentales en rodajas mandíbula usando un cortador de tejidos. Este método permite un acceso único a los dientes durante el desarrollo, que proporciona una excelente oportunidad para la manipulación y el linaje de rastreo, no está disponible utilizando métodos de cultivo más tradicionales.
Resumen
Cultura explante permite, por tanto, la manipulación de desarrollar órganos en puntos específicos de tiempo y es un método importante para el biólogo del desarrollo. Para muchos órganos es difícil acceder a los tejidos en desarrollo para permitir el monitoreo durante el cultivo ex vivo. El método de cultivo de cortes permite el acceso a los tejidos para que los movimientos morfogenéticos pueden ser seguidos y poblaciones específicas de células pueden ser objeto de manipulación o rastreo de linaje.
En este trabajo se describe un método de cultivo de cortes que ha sido muy exitoso para el cultivo de los gérmenes de los dientes en una amplia gama de especies. El método proporciona un excelente acceso a los gérmenes de los dientes, que se desarrollan a un ritmo similar al observado in vivo, rodeado de los otros tejidos de la mandíbula. Esto permite interacciones de tejido entre el diente y el tejido circundante a controlar. Aunque este documento se concentra en los gérmenes de los dientes, el mismo protocolo se puede aplicar a seguir el desarrollo de un númerode otros órganos, como las glándulas salivales, el cartílago de Meckel, glándulas nasales, lengua y orejas.
Introducción
Para un número de experimentos es importante ser capaz de cultivo de tejidos ex vivo para seguir el desarrollo. Cultura de desarrollar tejido proporciona acceso a determinados períodos de desarrollo y permite la manipulación de los genes por la adición de factores al medio de cultivo, o en perlas cargadas, y por el uso de la transfección y la electroporación 1. Para muchos experimentos es importante ser capaz de visualizar el tejido a medida que crece, por ejemplo, para seguir el destino de las células de linaje etiquetado como el tejido se somete a la morfogénesis. Esto puede ser particularmente problemático para los tejidos que se desarrollan profunda dentro del embrión, que no son evidentes cuando un bloque de tejido del embrión se cultiva. Los dientes son buenos ejemplos de esto, a medida que se desarrollan dentro del proceso nasal mandíbula, maxilar y frontal. Cuando se cultiva toda la mandíbula las estructuras superficiales de los dientes se pueden ver pero los cambios en la morfología sólo pueden ser analizados después de la sección de tejido fijado 2. Hemos adaptado una técnica de cultivo de cortes en directo lo que nos permite seguir el desarrollo de gérmenes del diente y el acceso a las diferentes partes del diente durante el desarrollo. Las culturas técnica de las rodajas de germen del diente en la interfase gas-líquido, utilizando un método modificado Trowell 3. Estos cultivos de cortes han sido muy útiles en directamente después de la morfogénesis del diente, y permitiendo linaje rastreo de componentes distintos, tales como el nudo del esmalte y la papila dental y el folículo 1,4-7. La técnica no se limita a los embriones de ratón y con éxito se ha utilizado para la cultura en vivo rebanadas de cerdo y la serpiente 8,9 tejido dental. Además de la ventaja de ser capaces de visualizar el desarrollo del diente, el método rebanada también tiene la ventaja de que las rodajas delgadas de tejido han aumentado el acceso a los nutrientes del medio y el aire de la incubadora. Esto se traduce en un mejor crecimiento de los gérmenes de los dientes, que coinciden con el desarrollo in vivo y espectáculo La invasión masde iones de las células endoteliales en la papila 7. En contraste, los gérmenes de los dientes en la mandíbula culturas enteros desarrollan más lento que los in vivo y el centro de la cultura es a menudo necrótico en cultivos a largo plazo. En la cultura rebanada, el diente se desarrolla dentro de un trozo de la mandíbula, y su interacción con el hueso circundante y el desarrollo de otros tejidos puede ser monitoreado. En nuestro método, el tejido se corta recta después de la disección sin necesidad de integrar en un medio de soporte 10,11 y no hay necesidad para cualquier sistema para sujetar el tejido a la guillotina. El método es, por tanto, no invasiva y rápida, permitiendo que muchos mandíbulas que se seccionaron en una sesión.
Protocolo
1. Establecer
- Enfocar los instrumentos de disección (con una piedra de afilar lubricado con aceite mineral) y esterilizar antes de su uso para el cultivo de órganos utilizando un spray de etanol al 70% y la esterilización de calor seco. Afilar las agujas de disección utilizando la electrólisis en 2 M de hidróxido de sodio utilizando un suministro de 12 V.
- Preparar el medio de cultivo utilizado para la disección y la cultura de órganos embrionarios, que consta de modificación F12 Medio Eagle de avanzada Dulbecco (DMEM F12), complementado con 1% GlutaMAX y 1% de penicilina-estreptomicina.
2. La disección de embriones
- Cull una cronometrada acoplado hembra embarazada que usa un método de programación uno aprobado por el Ministerio del Interior o de otro órgano de gobierno. Diseccionar la piel que rodea el abdomen inferior, y cortar el abdomen con unas tijeras. Localice los dos cuernos uterinos, que se conectan entre sí en la línea media inferior.
- Diseccionar útero y colocar en un tubo lleno con el medio en el hielo. When en hielo, el tejido se puede dejar durante varias horas.
- Extirpar el útero y colocar en una placa de Petri en un medio en el microscopio. Cuando sea posible, las disecciones de embriones se deben realizar en una campana de flujo laminar para minimizar la contaminación.
- Diseccionar los embriones del útero y liberarlos de sus tejidos extraembryonic.
- Decapita a los embriones utilizando una aguja de tungsteno y transferir las cabezas en un plato fresco de medio.
- Aislar las mandíbulas de las cabezas mediante la colocación de una aguja en la cavidad oral y cortar a través hacia la parte posterior de la cabeza (Figuras 1A y 1B). Mandíbulas aisladas pueden ser almacenados temporalmente en un medio en el hielo mientras se espera para picar.
- Para rebanadas mandíbula enteros etapas E11.5-E15.5 son ideales para el cultivo de gérmenes de los dientes. Después E15.5 el hueso en desarrollo en la mandíbula es demasiado difícil para cortar. Rebanadas de dientes todavía se pueden hacer, pero el hueso (hueso alveolar dentario y la formación) primero se debe quitarla disección antes de cortar 9. Retire con cuidado el hueso utilizando agujas de tungsteno y fórceps.
3. Rebanar Embryo
- Preparar los cortes de tejido mandíbula utilizando un helicóptero estándar tejido tabla (Figura 1C). Utilice una hoja fresca después de aproximadamente 200 mandíbulas, y asegúrese de que se encuentra al ras con el disco de montaje cuando se cae.
- Limpie el disco de montaje y la cuchilla con etanol al 70% antes de su uso. Se debe tener cuidado al usar la máquina, cuando la hoja está muy afilada.
- Ajuste el interruptor a una distancia de corte de entre 200-400 micras, de conformidad con la edad de la muestra, y dependiendo de si se requiere todo el germen del diente. Ajuste la fuerza de la cuchilla en el máximo.
- Transferir una mandíbula con el disco de montaje de plástico con una pipeta o fórceps. Organizar la mandíbula en el disco haciendo que la orientación está aún clara. La lengua en desarrollo puede ser utilizado como un punto de referencia útil para la determinación de la orientación. Para molares uso afRontal / orientación transversal (ver plano de cortar en la Figura 1B), mientras que para los incisivos usar un corte sagital a través de la mandíbula para reflejar la diferente orientación de estos dientes a medida que crecen (ver plano de cortar en la Figura 2A).
- Eliminar el exceso de medio de todo el tejido usando papel de filtro con el fin de secar ligeramente la mandíbula en el disco de montaje.
- Inmediatamente después del secado, coloque el disco en la mesa circular de acero inoxidable del helicóptero. Encienda la máquina y pulse Iniciar. La tabla atraviesa automáticamente de izquierda a derecha, mientras que al mismo tiempo el brazo de cortar llevar la cuchilla se eleva y se dejó en hasta 200 golpes / min.
- Apague la máquina una vez que el tejido ha sido completamente cortado. Asegúrese de que el brazo de la cuchilla está en la posición elevada y extraiga el disco. No ponga los dedos debajo del brazo cuchilla o dejar la máquina desatendida cuando cortar.
- Tome el disco de montaje y añade inmediatamente medio to las rebanadas en el disco con el fin de evitar el secado excesivo. Desplazar cuidadosamente el tejido en rodajas de la parte inferior del disco mediante una aguja de tungsteno y luego pipeta en una pequeña placa de Petri de medio (Figura 2A).
- Separe las rebanadas con una aguja y luego seleccionar los cortes de tejidos que contienen el tejido de interés bajo un microscopio estereoscópico (Figuras 1D, 1E, y 2B). Coloque las rebanadas seleccionados en placas de cultivo con medio fresco.
4. Slice Cultura
- Preparar platos de órganos-centrales pocillo de cultivo listos para el cultivo mediante la adición de aproximadamente 2 ml de agua en autoclave para el pocillo exterior para prevenir la deshidratación, y mediante la colocación de una rejilla de metal a través del centro del plato (Figuras 3A y 3B).
- Preparar rejillas de metal cortando tiras de aproximadamente 4 cm x 1,5 cm a partir de láminas de malla de acero inoxidable. Use una perforadora para hacer un agujero en el centro y doblarlos lados para crear un extremo escalonada. La rejilla debe encajar plana a través de la pozo central, situada paralela a la parte inferior del plato (Figuras 3A y 3B). Autoclave las rejillas para esterilizar antes de su uso.
- Cortar una pieza de tereftalato de polietileno transparente (PET) de la membrana (tamaño de poro 0,4 micras) suficientemente grande para cubrir el orificio de la rejilla. Coloque la membrana cortada en el plato con el sector seleccionado.
- Coloque la rebanada en la parte superior de la membrana y luego levante con cuidado la membrana de la media, con una rodaja de aplanado en el centro.
- Coloque el filtro en la rejilla sobre el agujero circular en el centro, y añadir aproximadamente 1 ml de medio de cultivo para el pozo, hasta el nivel de la membrana.
- Para manipulaciones agregan proteínas o inhibidores de molécula pequeña para el medio (por ejemplo 8).
- Fotografiar la rebanada por un récord de la morfología en el día 0 de la cultura.
- Colocar las cápsulas en una atmósfera húmeda de 5% de CO 2 a 37 ° C en una incubadora.
- Fotografía las culturas, a intervalos regulares durante un promedio de 7 días. Cambie el medio de cultivo cada 48 a 72 horas. Para la fotografía ver las rebanadas con una fuente de luz desde abajo (Figuras 2C-E).
5. Tracing Lineage
Si se necesita el rastreo linaje, colorantes lipófilos tales como Dil o DiO pueden ser inyectados en el germen del diente antes de la etapa 4, cultivo de cortes.
- Tire de agujas capilares de vidrio utilizando un extractor de aguja.
- Rompa la punta de la aguja con las pinzas y coloque la punta hacia abajo en la solución de colorante. Dejar reposar unos minutos, mientras que el medio de contraste llena la punta por acción capilar.
- Coloque la aguja se introduce en un soporte y conectar mediante un tubo a un inyector o la boca de aspiración.
- Coloque la punta de la aguja en el medio de cultivo tocar el área de la rebanada debido a etiquetar. Aplicar presión de aire para desplazar una pequeña cantidad de colorante fuera de la una agujad sobre el tejido.
- Retire la aguja y comprobar si el etiquetado en virtud de la fluorescencia.
- Rebanadas con éxito etiquetados pueden ser transferidos a filtros y se cultivaron como se describe en el paso 4.
Resultados
Con el fin de seguir el movimiento de la primera folículo dental molar, 250 micras rodajas frontales fueron tomadas a través de una mandíbula utilizando el método descrito anteriormente. El folículo dental es la capa de mesénquima que rodea el epitelio del esmalte exterior (OEE) del diente en desarrollo, y se ha mostrado previamente para tomar parte en la formación de tejido del periodonto 6. Mandíbulas fueron disecados en E14.5, la etapa de desarrollo de los dientes cap. En la rebanada el contorno del epitelio dental fue clara, y el mesénquima dental de condensación puede ser identificado como un anillo oscuro alrededor del epitelio diente (Figura 4A). Dil se inyectó en el mesénquima al lado del epitelio del esmalte exterior de la rebanada de diente en el lado lingual (Figura 4A). Después del marcaje las rodajas se cultivaron durante 4 días y se fotografiaron a intervalos (Figuras 4B y 4C). In vivo los gérmenes de los dientes se han alcanzadoel estadio de campana por E18.5, y una campana de forma distinta etapa se observó en los cortes, lo que indica una progresión similar durante este período de tiempo. El punto de Dil se vio que se extienden en una banda de células que se extienden alrededor del epitelio dental exterior que el diente creció (Figuras 4B y 4C).

Figura 1. Formación de rebanadas en vivo. (A) de embriones E14.5. Las líneas discontinuas indican los planos de corte con una aguja de disección, comenzando con el corte inferior para la decapitación. (B) disecado mandíbula inferior. La lengua está orientada hacia abajo. El plano de sección para el cortador de tejidos se muestra con líneas discontinuas. (C) cortador de tejidos que muestra el brazo de la cuchilla (BA) y disco de montaje blanco (MD) con muestra preparada (flecha). (D) rebanada Representante a través del molarregión. Las flechas apuntan a los gérmenes de los dientes molares. (E) de visión de alta potencia de una rebanada molar. El epitelio germinal de los dientes se perfila con manchas negras. Imágenes afilan con Photoshop. T = lengua, hueso DB = dentario, el cartílago de Meckel = MC. La barra de escala en A = 3 mm. La barra de escala en B & D = 1 mm. La barra de escala en E = 500 micras. Haga clic aquí para ver más grande la figura .
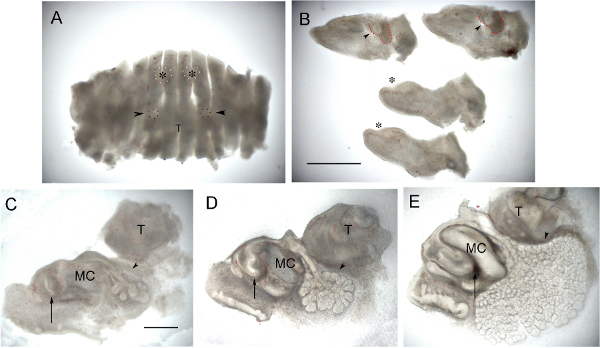
Figura 2. Incisivo y la cultura de la glándula. (A) E12.5 mandíbula que ha sido picado sagittally. Incisivos en desarrollo (puntos esbozados blancos con asterisco) y glándulas submandibulares (señaladas con manchas negras y flechas) pueden ser sólo hechos. (B) La misma mandíbula mostrando centrales 4 rebanadas separa. El desarrollo de la glándula submandibular cun ser visto como una yema rodeada de mesénquima condensado (puntas de flecha) en las dos secciones más laterales (arriba de la imagen). El mesénquima de condensación alrededor de la glándula se resume en rojo. Los incisivos están en la etapa de espesamiento epitelial (asterisco) en las dos rebanadas centrales (parte inferior de la imagen). (C) Corte sagital a través de un incisivo en E14.0 en el día 0. (D) La misma rebanada 1 día después. (E) La misma rebanada después de 3 días de cultivo. (EC) La flecha apunta al incisivo y formando bucle cervical labial. Arrowhead apunta al desarrollo de la glándula submandibular. En la cultura del germen del diente se extiende hacia atrás a medida que crecen los lazos del cuello del útero, mientras que la glándula salival sigue experimentando la morfogénesis de ramificación y la formación del lumen. Imágenes afilan con Photoshop. T = Lengua, cartílago MC = de Meckel. La barra de escala en A & B = 1 mm. La barra de escala en C, D, E = 500 micras. Haga clic aquípara ver más grande la figura.
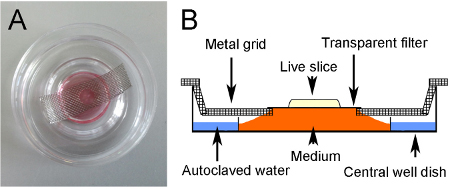
Figura 3. Método de cultivo. (A) rebanada cultivadas. La cultura se asienta sobre un filtro transparente suspendida sobre fuego medio a través de una rejilla de metal. Un agujero en la red permite que el sector a ser visualizada con la luz de abajo. (B) Esquema del método de cultivo.

Figura 4. Etiquetado DiI del folículo dental. (AC) Fusionada de luz y de campo oscuro imágenes que muestran el desarrollo de germen del diente molar y la ubicación de la etiqueta linaje Dil. (A) el día 0. El germen del diente (punta de flecha) se encuentra en fase gorra. Dil marca las células del folículo dental en el lado lingual del diente. (B ) Día 1. (C) Día 4. El germen del diente ha alcanzado el estadio de campana y las células marcadas con Dil se ve a extenderse en un arco alrededor del epitelio externo del esmalte en desarrollo. Las imágenes se han agudizado en Photoshop después de la fusión de las capas utilizando el modo de pantalla. El epitelio de diente esbozó con manchas negras. DP = papila dental situada en el epitelio interno del esmalte. DF = folículo dental, que se extiende alrededor del epitelio externo del esmalte. MC = cartílago de Meckel. La barra de escala en A, B, C = 500 micras. Haga clic aquí para ver más grande la figura .
Discusión
Este método de la cultura de los dientes tiene la ventaja de que el acceso a la germen del diente es excelente, lo que permite linaje precisa la localización y la colocación de los granos en el epitelio o el mesénquima. Por lo tanto, las regiones definidas del germen dentario en desarrollo pueden ser dirigidos específicamente. Durante el cultivo de la morfología cambiante de la germen del diente se puede seguir, y el efecto de las manipulaciones evaluarse rápidamente.
El método, sin embargo, sólo es adecuado para los gérmenes de los dientes jóvenes antes de la formación sustancial de los tejidos duros, como la dentina y el esmalte, ya que estos no pueden ser cortados con precisión. Para mandíbulas después de E15.5 es necesario para retirar el hueso antes de cortar. Esto tiene la desventaja de potencialmente dañar el germen del diente, que está estrechamente asociada con el hueso de E16.5. Hemos rodajas con éxito los gérmenes de los dientes disecados hasta el día postnatal 4, después de lo cual el diente se vuelve demasiado duro para el helicóptero para cortar debido a la deposición de esmalte. La rebanada método funciona bien en los gérmenes del diente de E13.5, es decir, la fase de capullo 1,6. Antes de este punto de tiempo, cuando el diente se encuentra en etapa de espesamiento epitelial, los gérmenes de los dientes hacen desarrollar pero la tasa de éxito se reduce y la morfología pueden ser afectados en el largo plazo.
Una desventaja importante con el método es que el picado se produce al azar a través del diente. En algunas rodajas de un germen de diente entero se puede encontrar dentro de un sector, mientras que en otros el helicóptero puede cortar el germen del diente por el centro. Esto significa que puede ser difícil de obtener un gran número de rodajas idénticas. Para combatir este problema, es posible dividir una rebanada por la mitad y utilizar el lado derecho e izquierdo como experimental y control. Para esto, sin embargo, la mandíbula debe colocarse cuidadosamente en el disco de cortar para asegurar la rodaja se corta simétricamente. Para algunos experimentos es una ventaja tener rebanadas que diseccionar el diente de manera que las estructuras internas, tales como el esmaltenudo, se puede acceder de etiquetado linaje 4. El germen del diente parece muy robusto y tales gérmenes medio de los dientes son capaces de desarrollarse bien en la cultura, como se ha demostrado en los gérmenes de los dientes molares mitades 12,13.
Como alternativa a cortar la cultura, los gérmenes de los dientes pueden ser disecados de la mandíbula y se cultivan en el aislamiento 14. Esto elimina el problema de la mala nutrición y oxigenación asociado con el cultivo de grandes bloques de tejido y conduce a un buen desarrollo de los dientes, pero como consecuencia el diente se desarrolla sin interacción con el tejido circundante. Cuando se deben extraer grandes cantidades de los mesénquima que rodean el número de gérmenes dentales que forman se puede alterar, destacando la importancia del mesénquima circundante para el desarrollo normal del diente 15. Por lo tanto, la cultura Slice es un buen método para el estudio de las interacciones de los tejidos, por ejemplo, cómo el hueso y el diente interactúan en la formación del hueso alveolar, o cómo el SalIvarían glándulas interactúan con la lengua y el epitelio oral, algo que se pierde cuando estos tejidos se cultivan en el aislamiento.
Este documento pone de relieve el uso de este método para el cultivo de los gérmenes de los dientes pero el mismo método también es excelente para el cultivo en desarrollo glándulas submandibulares y sublinguales y siguiendo el desarrollo de la estructura, tales como el cartílago de Meckel (Figura 2).
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Sarah A. Alfaqeeh es financiado por Kind Saud University College de Odontología, Ministerio de Educación Superior, Reino de Arabia Saudita.
Materiales
| Name | Company | Catalog Number | Comments |
| Ethanol | VWR | 101077Y | 100% ethanol was diluted in distilled H2O to 70%. |
| DMEM F12 | Gibco | 12634-010 | Advanced Dulbecco's Modified Eagle Medium F12 |
| GlutaMAX | Gibco | 35050-061 | |
| Penicillin-streptomycin | Sigma | P0781 | |
| DiI (Molecular probes) | Vybrant | V-22885 | Cell-labeling solution |
| Invitrogen | Cell tracker CM-DiI, C-7000 | ||
| DiO (Molecular probes) | Vybrant | V22886 | |
| Geminator 500 | Thomas | Thomas No. 3885A20 | Dry-heat sterilization |
| McIlwain tissue chopper | Ted Pella, Inc. | 10180 | Standard table |
| Organ culture dish (Center-Well Organ Culture Dish) | Falcon | 353037 | |
| Membranes (Cell Culture Inserts, 0.4 μm pore size) | BD Falcon | 353090 | PET track-etched membrane, 6-well format |
| Metal grids (Stainless Steel - AISI 304 - Mesh) | Goodfellow | FE228710 | (Fe/Cr18/Ni10) |
| AutoFlow Direct Heat CO2 Incubator | Nuaire | NU-5500 | |
| Picospritzer III | Intracel Ltd | 051-0500-900 0-100 psi | Single channel picospritzer III |
| Glass capillary with filament 1 mm | WPI | TW100F-4 | |
| Tungsten wire 0.1 mm | Goodfellow | W005138 | |
| Tungsten wire 0.38 mm | Goodfellow | W005155 | |
| Aspirator tubes | Sigma | A5177 | Used for mouth aspiration lineage tracers |
Referencias
- Rothova, M., Peterkova, R., Tucker, A. S. Fate map of the dental mesenchyme: dynamic development of the dental papilla and follicle. Developmental biology. 366, 244-254 (2012).
- Ferguson, C. A., et al. Activin is an essential early mesenchymal signal in tooth development that is required for patterning of the murine dentition. Genes & development. 12, 2636-2649 (1998).
- Trowell, O. A. The culture of mature organs in a synthetic medium. Experimental cell research. 16, 118-147 (1959).
- Matalova, E., Antonarakis, G. S., Sharpe, P. T., Tucker, A. S. Cell lineage of primary and secondary enamel knots. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 754-759 (2005).
- Mitsiadis, T. A., Tucker, A. S., De Bari, C., Cobourne, M. T., Rice, D. P. A regulatory relationship between Tbx1 and FGF signaling during tooth morphogenesis and ameloblast lineage determination. Developmental biology. 320, 39-48 (2008).
- Diep, L., Matalova, E., Mitsiadis, T. A., Tucker, A. S. Contribution of the tooth bud mesenchyme to alveolar bone. Journal of experimental zoology. Part B, Molecular. 312B, 510-517 (2009).
- Rothova, M., Feng, J., Sharpe, P. T., Peterkova, R., Tucker, A. S. Contribution of mesoderm to the developing dental papilla. The International journal of developmental biology. 55, 59-64 (2011).
- Buchtova, M., et al. Initiation and patterning of the snake dentition are dependent on Sonic hedgehog signaling. Developmental biology. 319, 132-145 (2008).
- Buchtova, M., Stembirek, J., Glocova, K., Matalova, E., Tucker, A. S. Early regression of the dental lamina underlies the development of diphyodont dentitions. Journal of dental research. 91, 491-498 (2012).
- Cho, S. W., et al. The primary enamel knot determines the position of the first buccal cusp in developing mice molars. Differentiation; research in biological diversity. 75, 441-451 (2007).
- Sakano, M., et al. Cell dynamics in cervical loop epithelium during transition from crown to root: implications for Hertwig's epithelial root sheath formation. Journal of periodontal research. , (2012).
- Fisher, A. R. Morphological development in vitro of the whole and halved lower molar tooth germ of the mouse. Archives of oral biology. 16, 1481-1496 (1971).
- Coin, R., Schmitt, R., Lesot, H., Vonesch, J. L., Ruch, J. V. Regeneration of halved embryonic lower first mouse molars: correlation with the distribution pattern of non dividing IDE cells, the putative organizers of morphogenetic units, the cusps. The International journal of developmental biology. 44, 289-295 (2000).
- Kavanagh, K. D., Evans, A. R., Jernvall, J. Predicting evolutionary patterns of mammalian teeth from development. Nature. 449, 427-432 (2007).
- Munne, P. M., Tummers, M., Jarvinen, E., Thesleff, I., Jernvall, J. Tinkering with the inductive mesenchyme: Sostdc1 uncovers the role of dental mesenchyme in limiting tooth induction. Development. 136, 393-402 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados