Method Article
ナノFEM:写真活性化ローカライゼーション顕微鏡と電子顕微鏡を用いてタンパク質の局在
要約
我々は、電子顕微鏡写真で蛍光標識タンパク質をローカライズする方法について説明します。蛍光は、第一超薄切片に光活性化ローカライゼーション顕微鏡を使ってローカライズされます。これらの画像は、同じ断面の電子顕微鏡写真に整列されます。
要約
タンパク質の分布をマッピングすると、細胞内のタンパク質の機能を理解するために不可欠です。蛍光顕微鏡は、広範囲のタンパク質局在するために使われますが、細胞内の文脈はしばしば蛍光画像では欠如しているされています。免疫電子顕微鏡法は、他の一方で、タンパク質をローカライズすることができますが、その方法は互換性のある抗体の不足によって制限され、形態学の貧しい保全とほとんどの抗原は、試料表面に露出されていないため。相関アプローチはどちら免疫蛍光または遺伝的にタグ付けされたタンパク質から、最初の全細胞からの蛍光画像を取得することができます。次に、試料を固定し、埋め込 まれた電子顕微鏡観察のため、画像は1から3まで相関しているされています。しかし、低解像度の蛍光画像と基準マーカの欠如は、タンパク質の正確な局在を排除。
あるいは、蛍光イメージングは、プラスチック中の検体を保存した後に行うことができます。でこのアプローチは、ブロックが区分され、蛍光画像と同じ断面の電子顕微鏡写真を4-7相関している。しかし、相関画像の光の回折限界は個々の分子の位置を曖昧にし、蛍光はしばしばセルの境界を越えて延びている。
ナノ分解能蛍光電子顕微鏡(ナノFEM)を撮像することにより、ナノスケールでの光活性化ローカライゼーション顕微鏡(PALM)と電子顕微鏡を使用して同じ部分をタンパク質をローカライズするために設計されています。 Palmはイメージング個々の蛍光タンパク質による回折限界を克服し、その後、各蛍光スポット8-10の重心をマッピングする。
我々は5つのステップでナノFEM手法を概説しています。まず、試料を固定し、タグ付けされたタンパク質の蛍光を維持する条件を使用して、埋め込まれています。第二に、樹脂ブロックが搭載されている極薄のセグメント(70-80 nm)とに区画されているカバーガラス上に。第三に、蛍光はツァイスPALM顕微鏡を用いて、これらのセクションに結像される。第四に、電子密度の高い構造は、走査型電子顕微鏡を用いて、これらの同じセクションに結像される。第五に、蛍光および電子顕微鏡写真は、基準マーカーとしての金粒子を用いて整列されます。要約すると、蛍光標識タンパク質の細胞内局在は、約1週間でナノメートルの分解能で決定することができる。
プロトコル
1。高圧凍結
- あなたの検体に適した媒体(例えば、細胞培養用培地、 線虫C. elegansのためにM9)1mlにBSAの0.2グラムを追加することにより、低温保護剤を準備します。すべてのBSAが溶解するまで37℃の水浴でチューブをインキュベートする。
- 凍結する前に、液体窒素を用いて自動化された凍結置換装置(ライカAFS)を埋める
- AFSのプログラムを設定:-90℃〜5月30日にhr *、5℃/時間、-60℃、-60℃で2時間(またはライカAFSの2を使用している場合は、 "一時停止"オプションを選択します)の場合はC、 72時間5℃/ -30〜HR℃と-30℃。 AFSのマシンに複数の5つのステップを有することが可能である場合は、-30°Cのステップは0時間に設定された "一時停止"オプションに置き換えられなければならず、さらに2つの手順を追加する必要があります:10℃/ hrで-20℃までCおよび-20℃で24時間マシンは5つのステップに限られている場合は、次のように異なるメモリスロットに別のプログラムをセットアップする:10℃/ hrで-20℃および24時間に-20℃でR
ここで*時間は-60℃ステップは早朝に開始するように調整することができます。 - 無水アセトン10ml(EMS、#RT10016)と0.1gの四酸化オスミウムの結晶(EMS、RT19134)を混合することにより、1%四酸化オスミウムストック溶液を調製します。次のように50 mlコニカルチューブに固定液を準備します。まず、ミリQ水の1ミリリットルを追加し、次にその中に過マンガン酸カリウムの0.02グラム(EMS、RT20200)を溶かす。アセトン19ミリリットルを加え、よく混ぜる。最後に、チューブ内に1%オスミウムストック溶液20μlを添加する。アセトンは、フリーラジカルスカベンジャー11であり、従って、プラスチックの重合を防ぎますが、凍結置換媒体としてアセトンの使用は、脂質との相互作用の形態を維持するために必要です。アセトンはプラスチック浸潤前にエタノールで置換されています。アリコート1各クライオバイアルへミリリットル、液体窒素中でチューブを格納することにより、凍結固定剤を保持します。
- 20%BSAや細菌と標本キャリアを記入してください。20%BSAおよび細菌の両方が凍結保護剤としての役割を果たす。標本キャリアのタイプの選択が標本に依存します。 Cのelegansは 、よく100μmを使用しています。
- キャリア内に試料を置き、高圧冷凍庫を使用して、それを凍結します。
- 凍結後、液体窒素下で、固定剤を含むクライオチューブに試料を移す。標本はすべての回で液体の下にとどまることを確認してください。
- リピート1.5) - 1.7)すべての検体が凍結されるまで。
- AFSのユニットにすべてのクライオチューブを転送し、プログラムを再開します。
2。凍結置換
- 温度は、AFSに95%アセトン20mlを含む-60℃、場所バイアルに達すると。
- 温度が-50℃に到達すると、6回2時間かけて95%アセトンで固定液を交換してください。
- チャンバー内に95%アセトンで0.1%酢酸ウラニル(Polysciences社、#21447から25)20mlを含むバイアルを置き、プレクールそれ-50℃
- 洗浄工程の終了時に、各バイアルに酢酸ウラニル溶液の約1 mlを加える。必要に応じてプログラムの一時停止を解除。
- 温度が-30℃に到達すると、6回には2時間かけて95%エタノールで酢酸ウラニルを交換してください。
- 一方で、22.3ミリリットルGMA、10ミリリットルn-ブチルメタクリレート、1ミリリットルミリQ水、及び0.2グラムの過酸化ベンゾイルを混合することにより、97%ポリエチレングリコールメタクリレート樹脂(GMAは、SPI用品/構造プローブ社は、#02630-AA)を構成する(触媒)。 (EMS、#72632)ガラスバイアル中にそれを格納し、95%エタノールと混合することにより30パーセントGMAを準備する。重合の品質はポリエチレン系プラスチックで長期保管して低下するため、 プラスチック製のチューブにGMAのメディアを保管しないでください 。 -30℃〜プレクールGMAソリューション
彼らは無水および蛍光タンパク質を消光酸性であるので、このようなアラルダイトとEPONなどの従来のエポキシ樹脂は、プロトコルで使用することはできません。そのようなLRホワイト、C等のアクリル系樹脂、少量の水に耐え、蛍光タンパク質を保持することができますが、その酸性のpHは、フルオロフォア12をクエンチする傾向がある。 GMAは許容し、実際には、少量の水を必要とし、アルカリ性である(PH8)12。 GMAは残念ながらややもろい。また、GMAは従来のエポキシ樹脂ないような組織と相互リンクしません。品質をセクショニングでGMAの原因の矛盾のこれらの特性は特に80nmよりも薄い切片。
GMAの貯蔵寿命は約1年ですが、GMAは、その品質を確保するために、購入から3ヶ月以内にご使用ください。
3。浸潤と重合
ステップ3.1から3.3までは凍結置換に使用したのと同じクリオバイアル中で行われる。浸潤および重合は蛍光タンパク質を保持するために、AFSに-30℃で行われる。
- 95%エタノールでGMAのストック溶液を混合することにより、浸透メディアを準備します。試料をインキュベート3から5時間で30%GMAインチ
- 4から6時間で70%GMAの標本をインキュベートする。
- 一晩97パーセントGMAの標本をインキュベートする。
- 翌日、新鮮な97パーセントGMAを作る。
- 埋め込み型(EBSciences、#TC)にサンプルを転送します。 "DISCパンチ(テッド·ペラ社製)を3月8日を使用してACLARフィルム(EMS、#50425から10)のディスクを用意して、BEEMカプセルの底部にディスクを置きます。
- 為替-30℃で97%GMA 3回6時間以上
- 第三交換した後、1.5μL/ 1ミリリットルGMAの濃度でGMAにイニシエータN、N-ジメチル-p-トルイジン(Sigma-Aldrich社、#D9912)を追加し、各試料鋳型にこのソリューションを適用する。すぐにAFS内埋め込み型内に試料を配置します。
過酸化ベンゾイルがそう攪拌が不要である触媒であり、すべての浸潤工程の間に存在していることに注意してください。それは化学開始N、N-ジメチル-p-トルイジンに露出するまで過酸化ベンゾイルは、プラスチックを重合していません。イニシエータは、POLを活性化ymerizationはすぐに、1時間内であっても、組織内の樹脂を重合する。それにもかかわらず、組織のドロップアウトが不完全重合による深部組織になることがあります。また、GMAは、うまくブロックに標本を架橋していないので、細菌のマトリックスをタップすることで、凍結防止剤から試料を分離します。
重合は、AFSの外部で実行されている場合は、埋め込み型は、酸素への曝露を遮断するACLARディスクで覆わなければならない。酸素にさらされたときGMAは完全に重合していません。 - それは1時間以内に重合していてもプラスチックが一晩を治癒することができます。
- 蛍光タンパク質は酸素にさらされないように、さらなる処理まで冷凍庫内の窒素ガス充填真空袋(ジップロック)(-20℃)で試料を保管してください。
4。セクショニング
- GMA-組み込み標本の切片はエポン包埋標本の場合と同様の方法で実施することができる。余分な注意が取るでなければなりませんGMAは非常に親水性であり、それらは両側に濡らしている場合はリボンが水浴中に駆動されることになるので、n個の切片表面を濡らしません。
- TIRF顕微鏡をローカライズするために使用されている場合はガラスカバースリップ上のセクション(50-80 nm)のリボンを集める。それ以外の場合は、透過型電子顕微鏡のために作られたグリッドを使用しています。切削速度はat1.6 mm /秒以上に設定する必要があります。それ以外の場合は、リボンが形成されないことがあります。
- すぐに画像化されない場合は、-20℃で保存するセクション。アルミホイルでセクションホルダーを覆うことにより、紫外光から蛍光体を保護します。
5。 PALMイメージング
- 製造業者の推奨に従ってやし顕微鏡をセットアップします。 EMCCDカメラの温度が-70℃以下に設定する必要があります。
- 撮像される試料に溶液中(約50μl) - 金粒子(2倍濃縮された、ミクロス-nanospheres.com#790122から010)を適用します。解決策は、カバーの上に30秒間座ってすることができます黒のカバーケースの下にしばらく唇。
- カバースリップの端にそれを吹いてキムワイプでそれを吸収することにより、金溶液を除去します。
- 円形のカバースリップホルダーにカバースリップを挿入します。必要に応じて、所定の位置にカバースリップを維持するためにリムに真空グリースを塗布してください。
- 直接サンプルを下に、カバーガラスの下側にイマージョンオイルを適用します。
- 顕微鏡のステージ上のスロットに試料ホルダーを挿入します。目標を触れないように特に注意してください。
- それがタイトであり、客観的な上記のセクションを中心のでホルダーを調整します。
- 10倍の対物レンズを使用してセクションを見つけます。
- 100倍対物レンズに変更します。
- 標本に焦点を当てる。
- 蛍光シグナルの強度を観察することによって、関心領域を見つけます。 488 nmのレーザーを使用し、10%にChannelsメニューの強度を増加させる。明るい蛍光の分野に焦点を当てる。この手順は必要ありませんので注意してください地域O IFfの関心は目で明視野で同定することができる。
- 561 nmのレーザーを切り替え、バックグラウンドの自己蛍光アウト漂白剤に100%に強度を増加させる。 〜2分間漂白剤のサンプルを。
- 漂白中のフォーカスが変更された場合は、5分にフォーカスを調整し、画像をキャプチャする前に経過することができます。この一時停止は、温度が安定することができます。 PALMスコープはインキュベーションチャンバーを装備している場合は、℃、チャンバー内の温度を安定させるために〜2時間待って20に温度を設定します。
- 漂白が完了すると、405 nmのレーザーをアクティブにして、最低の強度に設定します。
- 毎秒20フレームで画像の収集を開始します。我々は通常、実験あたり5,000〜6,000フレームを収集しますが、フレームの数は、実験の目的に応じて調整する必要があります。関心領域内のすべてのタンパク質が結像される必要がある場合たとえば、フレーム番号を大きくする必要があります。
- 信号が希薄またはかすかな場合は、ゆっくりincreaSE 405 nmのレーザー強度。
- 取得プロセスの間に、慎重に、必要に応じてノブを調整することによって、フォーカスのサンプルを保管してください。
- 画像が収集されると、ヤシの分析を行うべきである。 tdEosのために、私たちはそれらの信号はおそらく自家蛍光によるものであるので、500ミリ秒よりも長い蛍光を発する任意の信号を除外。
6。 SEMイメージング
- SEMイメージングに先立って、4分間、2.5%酢酸ウラニル(水)を使用してセクションを染色。フィルタリングミリQ水で十分に酢酸ウラニルを洗い落としてください。
- セクションを乾燥された後、カバーグラスはかなり暗くなるまで、カーボンを使用したカーボンコートカバースリップをスパッタする。カバーガラスの表面上に蓄積された電子は接地されているように、カバーガラスと金属スタブ上のもう一方の端の端にある炭素導電性テープの一端を適用します。
- SEMチャンバー(FEIノヴァナノ)に標本をマウントします。
- VCD検出器を挿入します。
- チャンバーを閉じ、高真空の設定を使用してそれをポンプ。
- その電子ビームが試料に印加されるので、一度避難し、カラムバルブを開きます。
- 電子ビームのアラインメントルーチンを実行します。
- 標本の位置を確認します。
- フォーカス調整されると、試料ステージをリンクし、ポールピース5mm以下にステージを持ち出す。
- 試料の低倍率像(5000〜x)を取る。
- 関心のある領域にズームと高倍率(50,000 x)の画像を得る。
- 次のセクションに移動し、すべてのセクションが画像化されるまで、ステップ6.10)および6.11)を繰り返します。
7。整列PALMとEM画像
- Photoshopを開き、SEM画像を取得しました。
- 5,000×5000ピクセル、300ピクセル/インチの解像度のサイズで新しいウィンドウを作成します。
- 新しいウィンドウ( 図1A)に低倍率のSEM画像をコピーします。
- それがいっぱいになるように画像を拡大·縮小変換操作(コマンド+ T、Mac用)を使用して、ウィンドウ全体。
- SEM像を高倍率をコピーし、必要に応じて拡張できます。
- 画像のドロップダウンメニューバーから画像の回転を選択することにより、水平方向に合計TIRF画像を反転します。
- 和TIRF画像(手のひらから)新しいレイヤーにコピーして貼り付けます。
- SEMで可視化し、対応する構造( 図1B)を有する金粒子( 図1Aの白矢印)の蛍光を一致させるために必要に応じて回して変換操作を使用して画像を拡大·縮小します。
- 新しいレイヤーに、PALMイメージをコピーし、同じ変換( 図1C)を適用します 。高倍率の画像は、この画像( 図2)から抽出することができる。
- プレゼンテーションのために、新しいレイヤーに変換PALMイメージをコピーします。 "選択"のドロップダウンメニューの "色の範囲"を使用することによって、PALM信号ではなく、背景を選択します。 SELに確認してください参照画素と背景画素のECTと "反転"オプションをオンにします。
- 希望PALM信号をカットし、新しいレイヤーに貼り付けます。
- 背景レイヤーの透明度を適用し、10%に設定します。これは、それらの強度( 図2D)を損なうことなく、背景を透明にすることによって、Palm信号の可視化を可能にします。
8。代表的な結果
tdEosでタグ付けヒストンを安定的に線虫C.で表現することができますエレガンス 、トランスジェニック動物は、上記のプロトコルを用いて処理した。 Palmと電子顕微鏡写真は、同じセクション( 図1)から得た。画像を配置するには、全体の時間の経過とともに蛍光を合計合計TIRF画像は、電子顕微鏡写真に重ねて表示します。金ナノ粒子は、蛍光および電子顕微鏡の両方で表示され、 'TRANSFを使用して2つの画像を整列するために使用することができPhotoshopでのORM '関数( 図1AおよびB)。次に、同じ'変換'の値は、ヤシの画像( 図1C)に適用した。この倍率では、構造細部の区別ができないので、我々は顕微鏡写真( 図2)の上端近傍の領域にズーム。高倍率画像では、このような核、核小体、核膜孔、小胞体などの細胞内の細部を観察することができた。また、タグ付けされたヒストン分子は、排他的に核に局在しているではなく、核小体に、期待どおり。相関Palmと電子顕微鏡法は、このように最高の解像度でタンパク質の局在化を可能にします。
5つの問題は、画像の品質を損なうことがあります。まず、氷の結晶の損傷は、超微細構造( 図3AおよびB)を歪めることができます。氷の結晶の伝播を減少させる、細菌などの低温保護剤で配置標本は、このダメージを減らすことができます。それにもかかわらず、1つはまだ電子顕微鏡で標本をスクリーニングし、凍結アーティファクトとそれらを捨てなければなりません。第二に、GMAのエポキシ樹脂のような組織へのリンクを通過しない、従って標本はしばしば周囲のプラスチックとストレッチから緩い破る、縮小したり、セクション( 図3CおよびD)から外れる。埋め込 む前に離れて細菌や凍結防止剤の他のサンプルの解剖、標本にプラスチックの大きい接着( 図3C)機能を備えています。同様に、腸内で脂質滴のような構造は、しばしば架橋( 図3E)の欠如のために組織から解離する。第三に、組織の伸張または折るプラスチック原因の不完全重合( 図3F)は 、試料中の酸素の存在はまた、GMAの重合を妨げる。第四に、GMAの貧しいセクショニング品質はしばしば矛盾した形態( 図3GとH)をもたらす。 GMAのセクションは次の場所にカットする必要があります70nm以上厚く、約1.6 mm / sの速度でセクショニングアーチファクトを最小限に抑えます。第五に、カバースリップまたはセクションの塵からのバックグラウンド自己蛍光は避けられない。ほこりから自己蛍光は予備洗浄カバーガラスを使用して、プロトコルで説明されるようにキムワイプ、ろ紙からダスト汚染を回避することにより、最小限に抑えることができます。 PALM解析プログラムは、蛍光タンパク質( 図2およびB)から代表的な信号よりも長い蛍光標本またはプラスチックからの信号を編集することができます。最終的なイメージは、したがって、そのような成果物の自由になる。

図1:金ナノ粒子を用いた蛍光および電子顕微鏡写真を揃える。 Cの断面から、(A)は、低倍率の電子顕微鏡写真タグ付けされたヒストンtdEosを表現するエレガンス :: HIS-11。白rrowsは電子密度の高い金は、従来の基準マークとして、PALMイメージングに適用されたナノ粒子は100nmを示す。 (B)は金ビーズは〜580 nmの光に曝露されると蛍光を発すると蛍光画像における基準マークを作成します。和TIRF画像は基準マークの位置に基づいて、電子顕微鏡写真の上に整列している。和TIRF画像は、実験の時間経過時にカメラによって検出されたすべての光子を表しています。左上(白い矢印)に明るいスポットは、金粒子のクラスターから生じることに注意してください。 (C)は、PALM像は、電子顕微鏡写真および回転に加えて、(B)の合計TIRF画像のアライメントから決定された値に基づいて変換されます。 拡大図を表示するには、ここをクリックしてください 。

図2。 tdEosのヒストン融合タンパク質を用いたナノFEM相関は、(A)の合計TIRF画像:: HIS-11が薄肉部(70nmの)から取得した。 tdEosの(b)対応するやし画像:: HIS-11。自家蛍光(白矢印)が長続きするよりも長い500ミリは、ヤシのプログラムによって濾過した。同じセクションから取得した核の(C)の電子顕微鏡写真。 (D)の相関PALMイメージとtdEosの電子顕微鏡写真:: HIS-11。蛍光はしっかり核内クロマチンに局在している。
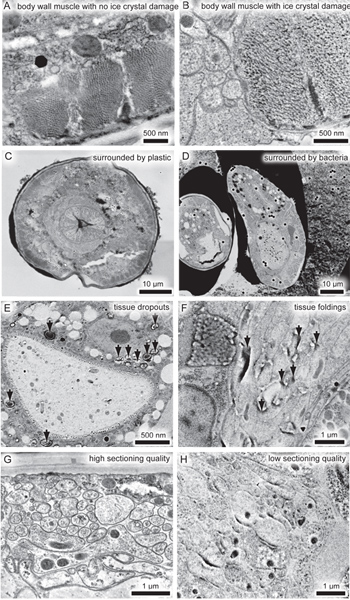
図3ナノFEMに関連する問題。 Cの(A)の電子顕微鏡写真氷の結晶の損傷なし虫体筋。氷の結晶のダメージで体の筋肉の(B)の電子顕微鏡写真。代わりに離散断面の、アクチンとミオシンフィラメントが氷の結晶の形成に起因する凝集体に折りたたまれています。 (C、D)の低倍率の電子顕微鏡写真S、周囲のメディアからワームの解離を示す。セクションでは、試料はプラスチック(C)で囲まれているときよりも低温保護細菌(D)に囲まれている検体でもっとゆがんでいる。 galletteにおける細菌の凍結保護剤は、プラスチック包埋前に固定されたサンプルから解剖されるべきである。 (D)の右側の動物が斜めに区分されたことに注意してください、その結果形状は組織の歪みによるものではない。組織のドロップアウト(黒い矢印)を示す腸の(E)の電子顕微鏡写真。神経環の(F)の電子顕微鏡写真は、プラスチックの不完全重合(黒矢印)に起因するセクションの折りたたみを示す。 (G、H)異なる日付で区分された同じ試料から神経細胞の電子顕微鏡写真。組織の保存は、1日(G)上に素晴らしいですが、このような形態は、矛盾したセクショニング品質(H)で隠されている。 vにはここをクリックIEW拡大図。
ディスカッション
ここでは、プラスチック製で、電子顕微鏡を用いた超微細構造をセクションで蛍光タンパク質をローカライズし、画像の蛍光タンパク質を保持する方法について説明します。タンパク質は、ナノメートル分解能にPALM顕微鏡を用いた回折限界以下局在していた。特定の標本にこのプロトコルを適応させるために、次のパラメータを考慮する必要があります。フルオロフォア、定量化、および配置。
蛍光タンパク質や有機蛍光色素の選択は、アプリケーションとモデルシステムによって異なります。我々は、EGFP、YFP、シトリン、mEosFP、mEos2、tdEos、mOrange、PA-mCherry、とdendronの複数形12を含む蛍光タンパク質の様々なテストをしている。各蛍光色素からの蛍光の保全は、すべての蛍光タンパク質が記載された方法を用いて保存することができることを示唆して、類似していた。それはCでうまく表現ので、我々はtdEosを選んだelegansは 、タンパク質はtdEosに融合したときに機能的に推移し、そのため光活性化特性は、ヤシの顕微鏡検査に最も適していた。しかし、tdEosの凝集したか失敗した式が、時折12観察されている。
アプリケーションに応じて、異なる蛍光団はより適しているかもしれません。多くの場合、それは光活性化蛍光性タンパク質を使用する必要はありません。単純な相関蛍光電子顕微鏡では、光活性化蛍光タンパク質を必要としません。 GFPまたは有機色素は、回折限界上記のセクションでタグ付けされたタンパク質からの蛍光画像に使用することができます。例えば、人はイメージ、蛍光顕微鏡を用いて神経網の軸索とイメージングによる電子顕微鏡写真で特定の軸索蛍光顕微鏡で蛍光を蛍光シグナルを関連付けることができます。このような誘導放出の枯渇顕微鏡(STED)12、個々の分子リターン(GSDIM)13続いて基底状態の枯渇顕微鏡のような他の超解像技術や、構造化照明顕微鏡(SIM)14は 、光活性化蛍光タンパク質を必要としません。また、有機色素9,15,16または蛍光プローブ17の固有の特性を使用した超解像イメージング技術は、容易に適用可能である。
各分子の蛍光が空間的にも時間的に分離されているので、手のひらに、分子数を定量化することができる。酸化、過少、過大、および過剰発現:しかし、定量化は、4つの理由のために誤解を招く可能性があります。まず、蛍光タンパク質の画分を変性またはサンプル処理5,12間に酸化することができる。蛍光シグナルの約90%が我々のプロトコルでの固定と包埋を通して維持されたが、試料が切削されており、表面が酸素にさらされた後に、蛍光タンパク質の酸化が発生することがあります。第二に、光活性タンパク質の活性化は、確率的であるため、複数の分子ができる所定の回折限界のスポット8で活性化。複数の分子からの蛍光は1スポットとして現れるでしょう、そして、その結果、タンパク質の総数はundercountedされます。第三に、同様の問題は過大につながることができます。手のひらに漂白することにより、それぞれの蛍光タンパク質は、ローカライズされた後、 "消去"。しかし、蛍光タンパク質は18永久に漂白されることなく、暗い状態から戻ることができます。このような分子は、複数回カウントされます。第四に、タグ付けされたタンパク質は、トランスジーンとして表現され、しばしば過剰発現につながることができます複数のコピーに存在しています。したがって、Palmから定量化は、与えられた場所での分子の数を推定するが、正確には判断できないために使用することができます。
電子顕微鏡写真とヤシの画像の位置合わせもあるため、電子ビームによる光と電子顕微鏡と歪みで解像度の違いから挑戦することができます。金粒子は、しっかりとlocのサーブ電子顕微鏡写真で基準マーカーを未実現。しかし、金粒子からfluoresecenceは、光活性化ではなく、大規模な回折限界スポットとして表示されます。このように、電子顕微鏡写真上の蛍光画像の配置は推定値です。歪みもプラスチックセクションと電子の相互作用から生じる可能性があります。そのようなGMA等のアクリル系樹脂は、電子ビームの下にあまり安定しており、プラスチック製の寸法を変更することができます。このような状況下では、超微細構造と蛍光を整列する基準マーカーの非線形変換が必要な場合があります。
開示事項
この記事への生産とフリーアクセスはカールツァイス社が主催している
謝辞
我々は固定プロトコル、試薬や励ましを共有するための証明の原理実験、リチャード·フェッター用のPalm顕微鏡へのアクセスのためにハラルドヘスとBetzigエリックに感謝します。我々は、マイケルソン、ジェラルディンSeydoux、ステファンアイマー、ルドルフロイベ、キースNehrke、クリスチャンFrøkjr·ジェンセン、DNA構築のためのオードADA-ヌグエマとMarc Hammarlundに感謝します。我々はまた、ツァイスPAL-M、ツァイスELYRA P.1やし顕微鏡のベータ版へのアクセスを提供するためにカールツァイス社に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬や機器の名称 | 会社 | カタログ番号 | 注釈 |
| 高圧冷凍庫 | アブラ州 | HPM 010 | WohlwendからライカやHPF-01からEMPactとHPM 100を使用することもできます。 |
| 自動凍結置換ユニット | ライカ | AFSの2 | AFSの1を使用することもできます。 |
| ツァイスPALM | ツァイス | ELYRA P.1 | ニコンとVutaraはまた、商業やし顕微鏡を販売しています。 |
| 走査型電子顕微鏡 | FEI | ノバナノ | 他の高分解能SEM顕微鏡を使用することができます。 |
| アセトン | EMSの | RT10016 | |
| エタノール | シグマアルドリッチ | 459844-1L | |
| オスミウムトンetroxide | EMSの | RT19134 | |
| 過マンガン酸カリウム | EMSの | RT20200 | |
| ウシ血清アルブミンから | シグマアルドリッチ | A3059-50G | |
| 酢酸ウラニル | ポリサイエンス | 21447から25 | この会社の酢酸ウラニルのpHがわずかに高くなっています。 |
| グリコールメタクリレート(GMA) | SPI | 02630-AA | 低酸、TEM用グレード。 |
| N、N-ジメチル-p-トルイジン | シグマアルドリッチ | D9912 | |
| クライオバイアル | ナルゲン | 5000-0020 | |
| ガラスバイアル | EMSの | 72632 | |
| ACLARフィルム | EMSの | 50425から10 | |
| BEEMカプセル | EBSciences | TC | ポリプロピレン |
| 3月8日 "DISCパンチ | テッドペラ | 54741 | |
| 金ナノ粒子 | ミクロス-nanospheres.com | 790122-010 | 2倍濃縮液を要求 |
参考文献
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Oberti, D., Kirschmann, M. A., Hahnloser, R. H. R. Correlative microscopy of densely labeled projection neurons using neural tracers. Front. Neuroanat. 4, 24(2010).
- Bishop, D., et al. Near-infrared branding efficiently correlates light and electron microscopy. Nat. Meth. 8, 568-570 (2011).
- Sims, P. A., Hardin, J. D. Fluorescence-integrated transmission electron microscopy images: integrating fluorescence microscopy with transmission electron microscopy. Methods Mol. Biol. 369, 291-308 (2007).
- Micheva, K., Smith, S. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Nixon, S. J., et al. A single method for cryofixation and correlative light, electron microscopy and tomography of zebrafish embryos. Traffic. 10, 131-136 (2009).
- Kukulski, W., et al. Correlated fluorescence and 3D electron microscopy with high sensitivity and spatial precision. J. Cell Biol. 192, 111-119 (2011).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313, 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods. 3, 793-795 (2006).
- Hess, S. T., Girirajan, T. P. K., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91, 4258-4272 (2006).
- Weibull, C., Christiansson, A. Extraction of proteins and membrane lipids during low temperature embedding of biological material for electron microscopy. J. Microsc. 142, 79-86 (1986).
- Watanabe, S., et al. Protein localization in electron micrographs using fluorescence nanoscopy. Nat. Methods. 8, 80-84 (2011).
- F lling, J., et al. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat. Methods. 5, 943-945 (2008).
- Gustafsson, M. G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198, 82-87 (2000).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nature Methods. 7, 717-719 (2010).
- Dertinger, T., Colyer, R., Iyer, G., Weiss, S., Enderlein, J. Fast, background-free, 3D super-resolution optical fluctuation imaging (SOFI). PNAS. 106, 22287-22292 (2009).
- Burnette, D. T., Sengupta, P., Dai, Y., Lippincott-Schwartz, J., Kachar, B. Bleaching/blinking assisted localization microscopy for superresolution imaging using standard fluorescent molecules. PNAS. , (2011).
- Annibale, P., Vanni, S., Scarselli, M., Rothlisberger, U., Radenovic, A. Identification of clustering artifacts in photoactivated localization microscopy. Nat. Meth. 8, 527-528 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved