Method Article
نانو FEM: تعريب البروتين عن طريق الصور التي تنشط المجهر التعريب والمجهر الإلكتروني
In This Article
Summary
وصفنا طريقة لتوطين البروتينات fluorescently المفتاحية في micrographs الإلكترون. يتم ترجمة باستخدام صور 1 مضان المجهري تنشيط الترجمة في أقسام سامسونج. ثم يتم محاذاة هذه الصور لmicrographs الإلكترون من نفس القسم.
Abstract
رسم خرائط توزيع البروتينات ضرورية لفهم وظيفة البروتينات في الخلية. ويستخدم على نطاق واسع لتوطين مضان المجهري البروتين، ولكن السياق التحت خلوية غالبا ما تكون غائبة في الصور مضان. المناعية الإلكترون المجهري، من ناحية أخرى، يمكن ترجمة البروتينات، ولكن يقتصر تقنية بسبب عدم وجود الأجسام المضادة متوافقة، وحفظ الفقراء من التشكل، ولأن عدم تعرض معظم المستضدات على سطح العينة. ويمكن للنهج مترابط الحصول على صورة مضان من خلية كاملة الأولى، سواء من المناعة أو البروتينات الموسومة مضان وراثيا. ثم يتم إصلاح العينة وجزءا لا يتجزأ من لالمجهر الإلكتروني، وترتبط الصور 1-3. ومع ذلك، فإن الصورة منخفضة الدقة مضان وعدم وجود علامات إيمانية يمنع التوطين دقيقة من البروتينات.
وبدلا من ذلك، يمكن القيام مضان التصوير بعد الحفاظ على عينة من البلاستيك. فيهذا النهج، هو كتلة مقطوع، وترتبط الصور مضان وmicrographs الإلكترون من نفس القسم 4-7. ومع ذلك، فإن الحد حيود الضوء في الصورة المترابطة يحجب المواقع من الجزيئات الفردية، ومضان غالبا ما يتجاوز حدود الخلية.
تم تصميم نانو القرار المجهر الإلكتروني مضان (نانو FEM) لتوطين البروتينات في مقياس النانو من قبل أقسام التصوير باستخدام نفس الصورة تنشيط الترجمة المجهر (PALM) والمجهر الإلكتروني. PALM يتغلب على الحد حيود من البروتينات الفلورية الفردية التصوير ورسم الخرائط لاحقا النقطة الوسطى من كل بقعة 8-10 الفلورسنت.
نحن الخطوط العريضة لتقنية النانو FEM في خمس خطوات. أولا، يتم إصلاح العينة وجزءا لا يتجزأ باستخدام الشروط التي تحفظ مضان من البروتينات ذات الكلمات الدلالية. الثانية، هي لبنات الراتنج مقطوع الى شرائح سامسونج (70-80 نانومتر) التي يتم تحميلهاعلى الزجاج غطاء. الثالث، هو تصوير هذه المقاطع في مضان باستخدام المجهر PALM زايس. الرابعة، وتصوير المنشآت كثيفة الإلكترون في هذه المقاطع نفسها باستخدام المجهر الإلكتروني الماسح. الخامسة، يتم محاذاة micrographs الإلكترون ومضان باستخدام جزيئات الذهب كعلامات الإيمانية. وباختصار، يمكن تحديد توطين التحت خلوية من البروتينات الموسومة fluorescently في القرار نانومتر في أسبوع واحد تقريبا.
Protocol
1. الضغط العالي تجميد
- إعداد البرد حاصن عن طريق إضافة 0.2 جم من BSA في 1 مل من وسيلة مناسبة لعينة الخاص بك (على سبيل المثال، ثقافة المتوسط للثقافات الخلية، M9 لايليجانس C.). احتضان الأنبوب في حمام مائي 37 ° C حتى يذوب جميع BSA.
- قبل التجميد، وملء الآلي تجميد استبدال الجهاز (لايكا AFS) مع النيتروجين السائل
- وضع برنامج AFS: -90 ° C ل* 5-30 ساعة، 5 ° C / ساعة إلى -60 ° C، -60 ° C لمدة 2 ساعة (أو حدد "وقفة" الخيار إذا كنت تستخدم لايكا AFS 2)، 5 ° C / ساعة إلى -30 ° C -30 ° C ولمدة 72 ساعة. إذا كان الجهاز قادر على AFS وجود أكثر من خمس خطوات، ينبغي الاستعاضة الخطوة -30 ° C مع خيار "وقفة" تعيين إلى 0 ساعة، وينبغي أن يضاف المزيد من خطوتين: 10 ° C / ساعة إلى -20 درجة C و 24 ساعة في -20 ° C. إذا اقتصرت الجهاز لخمس خطوات، وإنشاء برنامج آخر في فتحة ذاكرة مختلفة على النحو التالي: 10 ° C / ساعة إلى -20 درجة مئوية و 24 ساعةR في -20 ° C.
* يمكن ضبط الساعة هنا بحيث -60 ° C خطوة يبدأ في الصباح الباكر. - إعداد 1٪ الأسهم رابع أكسيد الأوزميوم حل عن طريق خلط 0،1 رابع أكسيد الأوزميوم بلورات ز (EMS، RT19134) مع 10 مل من الاسيتون اللامائية (EMS، # RT10016). إعداد مثبتات في أنبوب مخروطي 50 مل على النحو التالي. الأولى، إضافة 1 مل من الماء milliQ، ثم تذوب في ذلك 0،02 غرام من برمنغنات البوتاسيوم (EMS، RT20200). إضافة 19 مل من الأسيتون ويخلط جيدا. وأخيرا، إضافة 20 ميكرولتر من 1٪ الأزميوم محلول المخزون في أنبوب. الأسيتون هو زبال الحرة الراديكالية 11 و بالتالي يمنع البلمرة من البلاستيك، ولكن استخدام الأسيتون كوسيلة تجميد استبدال ضروري للحفاظ على مورفولوجيا بسبب تفاعلها مع الدهون. وسيتم استبداله مع الأسيتون الايثانول قبل تسلل البلاستيك. قسامة 1 مل لكل cryovial والحفاظ على مثبتات المجمدة عن طريق تخزين الأنابيب في النيتروجين السائل.
- ملء مع الناقل العينة 20٪ BSA أو البكتيريا.كل BSA 20٪ والبكتيريا تكون بمثابة وقاية البرد. اختيار لنوع الناقل العينة يعتمد على العينة. لC. ايليجانس، استخدم ميكرومتر 100 أيضا.
- وضع العينة في الحامل وتجميده باستخدام الثلاجة ذات الضغط العالي.
- بعد تجميد وتحت النيتروجين السائل، ونقل العينة إلى cryotube تحتوي على مثبتات. تأكد من أن عينة السائل يبقى تحت في جميع الأوقات.
- كرر 1.5) - 1.7) حتى يتم تجميد جميع العينات.
- نقل جميع cryotubes في وحدة AFS، واستئناف البرنامج.
2. تجميد استبدال
- عندما تصل درجة الحرارة إلى -60 درجة مئوية، قارورة تحتوي على 20 مل مكان من الأسيتون 95٪ في AFS.
- عندما تصل درجة الحرارة إلى -50 ° C، استبدال مثبتات مع الأسيتون 95٪ ست مرات خلال الفترة من 2 ساعة.
- ضع قارورة تحتوي على 20 مل من خلات اليورانيل 0.1٪ (Polysciences، # 21447-25) في الأسيتون 95٪ إلى غرفة وقبل أن تبرد إلى -50 ° C.
- في نهاية الخطوة الغسيل، إضافة ~ 1 مل من محلول خلات اليورانيل إلى كل قنينة. غير مهلة البرنامج إذا لزم الأمر.
- عندما تصل درجة الحرارة إلى -30 ° C، استبدل خلات اليورانيل مع الايثانول 95٪ ست مرات خلال الفترة من 2 ساعة.
- في غضون ذلك، تشكل 97٪ راتنج ميتاكريليت غليكول (GMA ولوازم SPI / دقق هيكل، وشركة، # 02630-AA) عن طريق خلط 22،3 مل GMA، N-10ML بوتيل الميثاكريليت، 1 مل ماء milliQ، و 0.2 البنزويل بيروكسايد ز (حافز). تخزينه في قنينة زجاجية (EMS، # 72632) وإعداد GMA 30٪ عن طريق خلطه مع الايثانول 95٪. لا تخزن في وسائل الإعلام GMA أنابيب بلاستيكية، حيث ان نوعية البلمرة يحط مع التخزين على المدى الطويل في البولي اثيلين على أساس البلاستيك. قبل باردة الحل GMA إلى -30 ° C.
لا يمكن راتنجات الايبوكسي التقليدية مثل Araldite وEPON أن تستخدم في بروتوكول لأنها اللامائية والتي يروي الحمضية البروتينات الفلورية. الاكريليك الراتنج، مثل الأبيض LR، جوتحمل كمية صغيرة من الماء، ويمكن الحفاظ على بروتين فلوري، ولكن الرقم الهيدروجيني الحمضية لها يميل إلى إخماد fluorophore 12. GMA تتسامح، في الواقع يتطلب، وكمية صغيرة من الماء وقلوية (pH8) 12. GMA للأسف هشة إلى حد ما. وعلاوة على ذلك، لا يعبر GMA الارتباط مع الأنسجة مثل راتنجات الايبوكسي التقليدية القيام به. هذه الخصائص وجود تضارب في قضية GMA تقطيع الجودة وخصوصا عندما مقطوع أرق من 80 نانومتر.
على الرغم من أن العمر الافتراضي للGMA هو نحو سنة، يجب استخدام GMA خلال 3 أشهر من شراء لضمان جودتها.
3. تسلل والبلمرة
يتم تنفيذ الخطوات 3،1-3،3 عليها في cryovials نفسها التي استخدمت لإحلال للتجمد. وتتم عمليات التسلل والبلمرة بها في -30 ° C في AFS للحفاظ على بروتين فلوري.
- إعداد وسائل الاعلام تسلل خلط محلول الإيثانول مع GMA 95٪. احتضان العيناتفي GMA 30٪ لمدة 3-5 ساعة.
- احتضان العينات في GMA 70٪ لمدة 4-6 ساعة.
- احتضان العينات في GMA 97٪ بين عشية وضحاها.
- في اليوم التالي، ويشكلون 97٪ GMA الطازجة.
- نقل العينات إلى تضمين القالب (EBSciences، # TC). إعداد قرص من فيلم ACLAR (EMS، # 50425-10) باستخدام 3/8 "DISC لكمة (تيد بيلا شركة) ووضع القرص في الجزء السفلي من الكبسولة BEEM.
- صرف 97٪ GMA ثلاث مرات أكثر من 6 في ساعة -30 ° C.
- وبعد تبادل الثالث، إضافة البادئ N، N-ثنائي ميثيل-P طولويدين-(سيغما الدريخ، # D9912) لGMA بتركيز قدره 1.5 ميكرولتر / GMA 1 مل وتطبيق هذا الحل إلى كل قالب نموذج. وضع العينة على الفور في قالب التضمين في AFS.
نلاحظ أن البنزويل بيروكسايد هو الحافز موجود وخلال جميع الخطوات تسلل ذلك ليس من الضروري اثارة. البنزويل بيروكسايد لا تتبلمر من البلاستيك حتى يتم تعرضت لالبادئ الكيميائية N، N، ثنائي ميثيل-P-طولويدين. البادئ ينشط POLymerization فورا وسوف تتبلمر الراتنج حتى في الأنسجة داخل 1 ساعة. ومع ذلك، قد يؤدي التسرب الأنسجة في الأنسجة العميقة نظرا لبلمرة غير مكتملة. وعلاوة على ذلك، لا GMA تشعبي العينة إلى كتلة أيضا، وبالتالي فإن فصل عينة من cryoprotectant بالنقر على مصفوفة من البكتيريا.
إذا يتم تنفيذ البلمرة خارج من AFS، يجب أن يتم تغطية القالب تضمين مع قرص aclar لمنع التعرض للأكسجين. GMA لا تتبلمر تماما عند التعرض للأوكسجين. - تسمح البلاستيك لعلاج بين عشية وضحاها على الرغم من أنها يبلمر داخل 1 ساعة.
- تخزين العينات في فراغ حقيبة مليئة بالغاز النيتروجين (زيبلوك) في الفريزر (-20 ° C) حتى مزيد من المعالجة حتى لا تتعرض البروتينات الفلورية للأكسجين.
4. باجتزاء
- يمكن باجتزاء من GMA-جزءا لا يتجزأ من العينات أن ينفذ بطريقة مماثلة لتلك التي لEPON جزءا لا يتجزأ من العينات. وينبغي أن يكون اتخاذ الحذرن عدم الرطب سطح تقطيع لأن GMA هو ماء للغاية وسوف يكون الدافع وراء شرائط في حمام مائي إذا كانت ترطب على كلا الجانبين.
- جمع شرائط من المقاطع (50-80 نانومتر) على ساترة الزجاج في حالة استخدام المجهر لTIRF الترجمة. وإلا، استخدم شبكة مصنوعة لنقل المجهر الإلكتروني. يجب تعيين سرعة القطع at1.6 ملم / ثانية أو أعلى. خلاف ذلك، قد لا تشكل الشريط.
- أقسام المحل في -20 درجة مئوية إن لم يكن تصوير فورا. حماية من الأشعة فوق البنفسجية fluorophores من خلال تغطية أصحاب القسم مع رقائق الألومنيوم.
5. PALM التصوير
- إعداد المجهر PALM وفقا لتوصيات الشركة المصنعة. يجب تعيين درجة حرارة كاميرا EMCCD -70 ° C إلى أو أقل.
- تطبيق جزيئات الذهب (# 790122-010 - 2X المركزة، المجهرية، nanospheres.com) في حل (حوالي 50 ميكرولتر) إلى عينة ليمكن تصوير. يسمح الحل للجلوس لمدة 30 ثانية على أغلفةالشفة في حين ظل حالة تغطية أسود.
- إزالة الحل الذهب مع هبوبها إلى حافة ساترة واستيعابه مع kimwipe.
- إدراج ساترة إلى صاحب ساترة دائرية. إذا لزم الأمر، وتطبيق الشحوم فراغ إلى حافة ساترة للحفاظ على في المكان.
- تطبيق زيت الغمر إلى الجانب السفلي من ساترة، مباشرة تحت عينات.
- إدراج حامل العينة في الفتحة على مسرح المجهر. عناية خاصة عدم لمس الأهداف.
- ضبط صاحب ذلك من ضيق ومراكز المقاطع فوق الهدف.
- تحديد موقع المقاطع باستخدام عدسة الهدف 10X.
- تغيير العدسة والهدف 100X.
- التركيز على العينة.
- تحديد موقع المنطقة ذات الاهتمام بملاحظة قوة الإشارات مضان. استخدام الليزر نانومتر 488 و زيادة كثافة في القائمة القنوات إلى 10٪. التركيز على مجالات ألمع مضان. لاحظ أن هذه الخطوة ليست ضرورية إذا كان س المنطقةويمكن تحديد الفائدة و مشرق في مجال بالعين.
- تبديل إلى 561 نانومتر ليزر وزيادة كثافة إلى 100٪ لتبييض خارج تألق ذاتي الخلفية. التبييض العينة لحد أدنى 2 ~.
- إذا تغير التركيز خلال التبييض، والسماح لمرور 5 دقائق قبل ضبط التركيز والتقاط الصور. هذا يسمح قفة درجة الحرارة لتحقيق الاستقرار. إذا تم تجهيز نطاق PALM مع دائرة الحضانة، تعيين درجة الحرارة إلى 20 ° C وانتظر ساعة 2 ~ لتحقيق الاستقرار في درجات الحرارة في الغرفة.
- عندما تبيض اكتمال تفعيل الليزر نانومتر 405 و تعيينها إلى أدنى كثافة.
- البدء في جمع الصور في 20 لقطة في الثانية. نجمعها عادة 5،000-6،000 لقطة في التجربة، ولكن ينبغي تعديل عدد الإطارات اعتمادا على الهدف من التجربة. على سبيل المثال، إذا كان يجب تصوير جميع البروتينات في منطقة ذات أهمية، ينبغي زيادة عدد الإطار.
- إذا كانت إشارات قليلة أو باهتة، increa ببطءSE 405 نانومتر ليزر كثافة.
- أثناء عملية الاستحواذ، تأكد للحفاظ على عينات في التركيز بعناية من خلال تعديل مقبض حسب الضرورة.
- عندما يتم جمع الصور، ينبغي إجراء تحليل PALM. لtdEos، ونحن تصفية أي إشارات أن يتألق أطول من 500 ميللي ثانية لأن تلك الإشارات هي الأرجح بسبب تألق ذاتي.
6. SEM التصوير
- قبل التصوير SEM، وصمة عار المقاطع باستخدام خلات اليورانيل 2.5٪ (في الماء) لمدة 4 دقائق. يغسل خلات اليورانيل جيدا بالماء milliQ تصفيتها.
- بعد يتم تجفيفها المقاطع، الكربون معطف ساترة باستخدام الكربون تفل حتى يصبح الظلام ساترة إلى حد ما. تطبيق واحدة من نهاية الشريط الكربون موصل في حافة ساترة والطرف الآخر على كعب المعدنية بحيث ترتكز الالكترونات التي تتراكم على سطح ساترة.
- تحميل العينة في غرفة SEM (FEI نوفا نانو).
- إدراج VCD كاشف.
- إغلاق الغرفة وضخه باستخدام الإعداد فراغ عالية.
- أجلت مرة واحدة، افتح صمام العمود بحيث يتم تطبيق هذا شعاع الالكترون على عينة.
- إجراء محاذاة الروتيني للشعاع الالكترون.
- تحديد موقع العينة.
- مرة واحدة يتم ضبط التركيز، ربط المرحلة العينات وطرح المرحلة إلى 5 مم تحت قطعة القطب.
- التقاط صورة تضخم منخفضة للعينة (~ 5000 X).
- التكبير في المنطقة للفائدة والحصول على تضخم عالية (50،000 X) الصور.
- الانتقال إلى المقطع التالي، وكرر الخطوة 6.10) و6.11) حتى يتم تصوير جميع الأقسام.
7. التوفيق بين النخيل وEM الصور
- فوتوشوب مفتوحة والحصول على الصور SEM.
- إنشاء إطار جديد مع الأبعاد من 5،000 بكسل 5000 X 300 بكسل و/ بوصة القرار.
- نسخ صورة SEM منخفضة التكبير في نافذة جديدة (الشكل 1A).
- حجم الصورة بحيث تملأنافذة بالكامل باستخدام التلاعب تحويل (القيادة + T لنظام التشغيل Mac).
- نسخ أعلى التكبير SEM الصور وتوسيع نطاق لهم عند الضرورة.
- قلب الصورة أفقيا TIRF المبلغ عن طريق اختيار صورة من التناوب في القائمة شريط الصور المنسدلة.
- نسخ ولصق الصورة TIRF مبلغ (من PALM) في طبقة جديدة.
- حجم الصورة باستخدام التلاعب تحويل وتدوير ثم الضرورة لمطابقة مضان من جزيئات الذهب (الأسهم البيضاء في الشكل 1A) مع الهياكل المماثلة في تصور SEM (1B الشكل).
- نسخ الصورة PALM إلى طبقة جديدة وتطبيق التحول نفسه (الشكل 1C). ويمكن استخراج صورة من أعلى التكبير هذه الصورة (الشكل 2).
- للعرض، نسخ الصورة PALM تتحول إلى طبقة جديدة. حدد إشارات PALM الخلفية ولكن ليس باستخدام "مجموعة لون" في "تحديد" القائمة المنسدلة. تأكد من SELإلخ بكسل الخلفية والمرجعية بكسل وتشغيل الخيار "قلب".
- قطع الإشارات PALM المطلوب ولصقها على طبقة جديدة.
- تطبيق الشفافية على طبقة الخلفية، وتعيين إلى 10٪. وهذا يسمح لرؤية الإشارات PALM بجعل الخلفية شفافة دون المساس كثافتها (الشكل 2D).
8. ممثل النتائج
يمكن هيستون ذات الكلمات الدلالية مع tdEos أعرب ثابت في الديدان الخيطية C. تم تجهيز ايليجانس، والحيوانات المعدلة وراثيا باستخدام بروتوكول الموصوفة أعلاه. تم الحصول عليها من micrographs الإلكترون وPALM من نفس القسم (الشكل 1). لمحاذاة الصور، ومضافين الصورة TIRF المبلغ الذي يلخص ومضان على مدى طوال الوقت، على صورة مجهرية الإلكترون. وتظهر جزيئات الذهب في micrographs كل مضان والإلكترون، ويمكن استخدامها لمحاذاة الصورتين باستخدام transf 'ORM 'وظيفة في فوتوشوب (الشكل 1A وB). ثم، تم تطبيق نفس القيمة 'تحويل' إلى الصورة PALM (الشكل 1C). في هذا التكبير، لا يمكن تمييزها التفاصيل الهيكلية، لذلك نحن أسرع إلى منطقة قرب نهاية العلوي من صورة مجهرية (الشكل 2). في الصورة تضخم عالية، يمكن أن يلاحظ تفاصيل التحت خلوية مثل نواة، نوية ل، المسام النووية، والشبكة الإندوبلازمية. وعلاوة على ذلك، يتم ترجمة حصرا الجزيئات الموسومة هيستون إلى النواة ولكن ليس إلى نوية، كما هو متوقع. والمجهر الإلكترون PALM ومترابط يسمح بالتالي للتوطين البروتين في أعلى دقة.
يمكن خمس مشاكل تؤثر سلبا على جودة الصور. أولا، يمكن أن الجليد الكريستال الضرر تشويه التركيب الدقيق (الشكل 3A وB). يمكن وضع العينات في أحد البكتيريا البرد حاصن مثل، مما يقلل من انتشار بلورات الثلج، والحد من هذا الضرر. ومع ذلك،يجب شاشة واحدة لا تزال عينات من المجهر الإلكتروني وإلغاء تلك القطع الأثرية مع التجميد. الثاني، لا يعبر GMA-تصل إلى الأنسجة مثل راتنجات الايبوكسي، وبالتالي كسر العينات في كثير من الأحيان فضفاضة من البلاستيك المحيطة بها وتمتد، حتى تقليص أو تقع خارج القسم (الشكل 3C وD). تشريح العينة بعيدا عن البكتيريا أو غيرها من البرد حاصن قبل تضمين ينص على زيادة التصاق من البلاستيك لالعينة (الشكل 3C). وبالمثل، هياكل مثل قطرات الدهون في الأمعاء غالبا ما تنأى من الأنسجة بسبب عدم وجود ربط عبر (الشكل 3E). ثالثا، لأسباب غير وافية البلمرة البلاستيك قابلة للطي أو تمتد للأنسجة (الشكل 3F)، وجود الأكسجين في العينة يعوق أيضا بلمرة GMA. رابعا، نوعية رديئة من تقطيع GMA غالبا ما يؤدي في التشكل غير متناسقة (الشكل 3G وH). وينبغي خفض أقسام GMA في70 نانومتر أو أكثر سمكا وبسرعة تبلغ نحو 1.6 مم / ثانية لتقليل تقطيع القطع الأثرية. الخامسة، تألق ذاتي الخلفية من الغبار على ساترة أو القسم أمر لا مفر منه. يمكن التقليل من تألق ذاتي من الغبار باستخدام مسبقا تنظيف coverslips وتجنب تلوث الغبار من kimwipes ورقة الترشيح كما هو موضح في البروتوكول. يمكن للبرنامج تحليل PALM تحرير إشارات من عينة أو البلاستيكية التي يتألق أطول من إشارات نموذجية من البروتينات الفلورية (الشكل 2 A و B). الصورة النهائية سوف تكون خالية من القطع الأثرية ولذلك من هذا القبيل.

الشكل 1. محاذاة micrographs الإلكترون ومضان باستخدام جزيئات الذهب. (A) A الإلكترون صورة مجهرية من تضخم منخفضة قطاع عريض من C. ايليجانس معربا عن tdEos الموسومة هيستون :: HIS-11. الأبيضتشير rrows 100 نانومتر الإلكترون الكثيفة الذهب النانوية قبل تطبيق PALM التصوير التي تشكل علامات إيمانية. (B) وحبات الذهب يتألق عند التعرض للضوء ~ نانومتر 580 و إنشاء علامات إيمانية في الصورة مضان. يتم محاذاة الصورة TIRF المبلغ على أحد مجهرية الإلكترون يعتمد على مكان وجود علامات إيمانية. الصورة TIRF يمثل هذا المبلغ جميع الفوتونات الكشف عنها بواسطة كاميرا أثناء وقت التجريبية. لاحظ أن النقاط المضيئة على اليسار العلوي (السهم الأبيض) تنشأ عن مجموعات من جزيئات الذهب. (C) ثم يتم إضافة صورة إلى PALM مجهرية الإلكترون واستدارة وترجمتها على أساس القيم التي تحدد من محاذاة مجموع الصور في TIRF (B). اضغط هنا لمشاهدتها بشكل اكبر شخصية .
 الشكل 2. المتلازم النانو باستخدام FEM البروتينات الانصهار هيستون. (A) الصورة TIRF مجموع tdEos :: HIS-11 تم الحصول عليها من قسم رقيقة (70nm). (B) الصورة PALM مراسل في tdEos :: HIS-11. تم تصفيتها تألق ذاتي (أبيض سهم) أطول أمدا من 500 مللي ثانية من قبل برنامج PALM. (C) اكتسبت الكترون مجهرية من نواة من نفس القسم. (D) صورة PALM مترابط ومجهرية الإلكترون من tdEos :: HIS-11. يتم ترجمة بإحكام مضان إلى لونين في النواة.
الشكل 2. المتلازم النانو باستخدام FEM البروتينات الانصهار هيستون. (A) الصورة TIRF مجموع tdEos :: HIS-11 تم الحصول عليها من قسم رقيقة (70nm). (B) الصورة PALM مراسل في tdEos :: HIS-11. تم تصفيتها تألق ذاتي (أبيض سهم) أطول أمدا من 500 مللي ثانية من قبل برنامج PALM. (C) اكتسبت الكترون مجهرية من نواة من نفس القسم. (D) صورة PALM مترابط ومجهرية الإلكترون من tdEos :: HIS-11. يتم ترجمة بإحكام مضان إلى لونين في النواة.
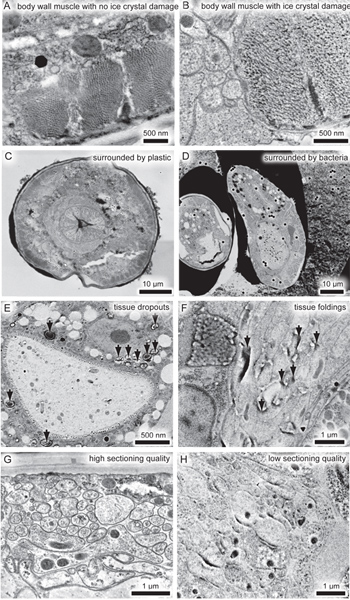
الشكل 3. المشاكل المرتبطة FEM نانو. (A) صورة مجهرية إلكترونية من C. ايليجانس عضلات الجسم دون ضرر الكريستال الجليد. (B) صورة مجهرية إلكترونية من عضلات الجسم مع الضرر الكريستال الجليد. بدلا من منفصلة المقاطع العرضية، وانهارت أكتين وخيوط الميوسين في المجاميع نظرا لتكوين بلورات الثلج. (C، D) منخفض التكبير صورة مجهرية الإلكترونق، والتي تبين من الديدان تفارق من وسائل الإعلام المحيطة بها. القسم هو أكثر مشوهة في عينة التي تحيط بها البكتيريا البرد حماية (D) مما كانت عليه عندما ويحيط العينة من البلاستيك (C). وينبغي تشريح البكتيرية البرد حاصن في gallette بعيدا عن العينة الثابتة قبل التضمين البلاستيك. نلاحظ أن هذا الحيوان على الحق في (D) كان مقطوع بشكل غير مباشر، وبالتالي شكل ليس بسبب تشويه الأنسجة. (E) الكترون مجهرية من الأمعاء، والتي تبين المتسربين من الأنسجة (الأسهم السوداء). (F) صورة مجهرية إلكترونية من الحلقة العصبية، والتي تبين للطي من الأقسام نظرا لبلمرة غير مكتملة من البلاستيك (الأسهم السوداء). (G، H) micrographs الإلكترون من الخلايا العصبية من العينة نفسها، مقطوع في تواريخ مختلفة. الحفاظ على الأنسجة هو رائع في يوم واحد (G)، ولكن تحجب التشكل مثل هذه نوعية باجتزاء غير متناسقة (H). اضغط هنا لVالرقم أكبر iew.
Discussion
هنا نحن تصف كيفية الحفاظ على البروتينات الفلورية في البلاستيك، وتوطين البروتينات الفلورية في الفروع، وصورة التركيب الدقيق باستخدام المجهر الإلكتروني. تم ترجمة البروتينات أقل من الحد الحيود باستخدام المجهر PALM بالقرار نانومتر. للتكيف مع هذا البروتوكول إلى عينات خاصة، ينبغي النظر في المعايير التالية: fluorophore، الكمي، والمحاذاة.
اختيار بروتين فلوري أو fluorophore العضوية تعتمد على الطلب والنظام النموذجي. لقد اختبرنا مجموعة متنوعة من البروتينات الفلورية، بما في ذلك EGFP، YFP، السترين، mEosFP، mEos2، tdEos، mOrange، PA mCherry، وDendra 12. كان الحفاظ على مضان من كل fluorophore مماثلة، مما يوحي بأن لا يمكن الحفاظ جميع البروتينات الفلورية باستخدام الطريقة الموصوفة. اخترنا tdEos لأنه أعرب بشكل جيد في C. ظلت البروتينات ايليجانس والفنية عندما تنصهر لtdEos، ولأن لهاكانت الصور تفعيل الخصائص الأمثل للفحص المجهري PALM. ومع ذلك، فقد تم تجميع أو فشل تعبير عن tdEos أحيانا يشاهد 12.
بالاعتماد على التطبيق، قد fluorophore مختلفة تكون في وضع أفضل. في كثير من الحالات، فإنه ليس من الضروري استخدام البروتين المنشط الصور الفلورسنت. بسيطة المجهر الإلكترون المترابطة مضان الصورة لا يتطلب تنشيط بروتين الفلورية. ويمكن استخدام GFP أو الأصباغ العضوية لمضان صورة من البروتينات في أقسام الموسومة فوق الحد الحيود. على سبيل المثال، يمكن للمرء صورة محور عصبي في neuropil باستخدام المجهر مضان وربط إشارة مضان مع محور عصبي معين في صورة مجهرية الإلكترون عن طريق التصوير مضان المجهر على مضان. أخرى فائقة القرار التقنيات، مثل الانبعاث المستحث المجهر استنزاف (STED) 12، المجهري الأرض استنزاف الدولة تليها عودة جزيء الفردية (GSDIM) 13، ومنظم الإضاءة المجهر (SIM) 14، لا تحتاج الصورة تنشيط البروتينات الفلورية. وعلاوة على ذلك، فائقة القرار تقنيات التصوير التي تستخدم الأصباغ العضوية 9،15،16 أو الملكية لا يتجزأ من تحقيقات الفلورسنت 17 هي سهلة التطبيق.
في PALM، يمكن تحديد عدد من الجزيئات لأن يتم فصل كل جزيء من مضان مكانيا وزمانيا. ومع ذلك، قد يكون مضللا الكمي لأربعة أسباب: أكسدة، الحساب الدقيق، overcounting، و overexpression. أولا، يمكن التشويه والتحريف جزء صغير من البروتينات الفلورية أو المؤكسد خلال تجهيز العينات 5،12. على الرغم من الحفاظ على ~ 90٪ من إشارة مضان من خلال تثبيت وتضمينها في البروتوكول الخاص بنا، فقد أكسدة البروتين الفلوري تحدث بعد العينة كان مقطوع والسطح المعرض للأكسجين. ثانيا، تفعيل الصور activatable البروتينات هو مؤشر ستوكاستيك، وبالتالي يمكن أن تكون الجزيئات متعددةتنشيط في مكان معين الحيود محدودة 8. ومضان من جزيئات متعددة تظهر بقعة واحدة، وبالتالي سيتم قلل من العدد الإجمالي للبروتينات. الثالث، يمكن أن يؤدي إلى مشكلة مماثلة overcounting. في PALM، يتم ترجمة كل بروتين فلوري ثم "مسح" من قبل التبييض. ومع ذلك، يمكن العودة من البروتينات الفلورية الدولة دون أن تكون مقصورة الظلام بشكل دائم 18. ومثل هذه الجزيئات ثم تحسب عدة مرات. يتم التعبير عن الرابعة، ويوصف بانه البروتينات الجينات المحورة وغالبا يوجد في نسخ متعددة، والتي يمكن أن تؤدي إلى overexpression. ولذلك، يمكن استخدام القياس الكمي من PALM لتقدير ولكن لا يحدد بدقة عدد الجزيئات في موقع معين.
يمكن محاذاة صورة PALM مع صورة مجهرية الإلكترون أيضا أن يكون تحديا بسبب الاختلاف في القرار المجهر الضوئي والإلكتروني والتشويه الناجم عن شعاع الالكترون. جزيئات الذهب تعمل بإحكام كما في الموضعalized علامات إيمانية في micrographs الإلكترون. ومع ذلك، fluoresecence من جزيئات الذهب ليست الصورة تفعيلها، ويظهر على شكل بقعة حيود محدودة كبير. وهكذا، فإن وضع صورة مضان عبر صورة مجهرية الإلكترون هو تقدير. يمكن أيضا التشوهات تنشأ من التفاعلات الإلكترونات مع قسم البلاستيك. راتنجات الاكريليك مثل GMA أقل استقرارا تحت شعاع الالكترون، ويمكن تغيير أبعاد البلاستيك. وفي ظل هذه الظروف، قد محاذاة مضان مع التركيب الدقيق تتطلب غير الخطية التحول من علامات إيمانية.
Disclosures
ويرعى الإنتاج وحرية الوصول إلى هذه المقالة عن طريق شركة كارل زايس
Acknowledgements
نشكر هارالد هيس واريك Betzig للوصول إلى PALM المجهر لإثبات صحة المبدأ التجارب، ريتشارد القيد لتبادل بروتوكولات التثبيت والكواشف والتشجيع. نشكر مايكل ديفيدسون، Seydoux جيرالدين، Eimer ستيفان، Leube رودولف، Nehrke كيث والمسيحية Frøkjr-جنسن، AUDE ادا نغيما وHammarlund مارك ليبني DNA. كما نشكر شركة كارل زايس لتوفير الوصول إلى زايس PAL-M، إصدار بيتا من المجهر Elyra زايس PALM P.1.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف أو المعدات | شركة | كتالوج رقم | تعليقات |
| الضغط العالي الفريزر | ABRA | HPM 010 | ويمكن أيضا EMPact HPM 100 من ايكا أو HPF 01-Wohlwend من استخدامها. |
| استبدال وحدة تجميد الآلي | لايكا | AFS 2 | ويمكن أيضا أن تستخدم AFS 1. |
| زايس PALM | زايس | ELYRA P.1 | نيكون وVutara أيضا بيع المجاهر PALM التجارية. |
| المسح الضوئي المجهر الالكتروني | الاتحاد الدولي للفروسية | نوفا نانو | ويمكن استخدام غيرها عالية الدقة المجاهر SEM. |
| الأسيتون | EMS | RT10016 | |
| الإيثانول | سيغما الدريخ | 459844-1L | |
| الأزميوم رetroxide | EMS | RT19134 | |
| برمنغنات البوتاسيوم | EMS | RT20200 | |
| ألبومين المصل البقري من | سيغما الدريخ | A3059-50G | |
| اليورانيل خلات | Polysciences | 21447-25 | الرقم الهيدروجيني من خلات اليورانيل من هذه الشركة هو أعلى قليلا. |
| ميتاكريليت غليكول (GMA) | SPI | 02630-AA | انخفاض حامض، الصف TEM. |
| N، N-ثنائي ميثيل-P-طولويدين | سيغما الدريخ | D9912 | |
| قارورة البرد | Nalgene | 5000-0020 | |
| قارورة زجاجية | EMS | 72632 | |
| فيلم Aclar | EMS | 50425-10 | |
| BEEM كبسولة | EBSciences | TC | البولي بروبلين |
| 3/8 "DISC اللكمات | تيد بيلا | 54741 | |
| الذهب النانوية | المجهرية-nanospheres.com | 790122-010 | طلب محلول مركز 2X |
References
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Oberti, D., Kirschmann, M. A., Hahnloser, R. H. R. Correlative microscopy of densely labeled projection neurons using neural tracers. Front. Neuroanat. 4, 24(2010).
- Bishop, D., et al. Near-infrared branding efficiently correlates light and electron microscopy. Nat. Meth. 8, 568-570 (2011).
- Sims, P. A., Hardin, J. D. Fluorescence-integrated transmission electron microscopy images: integrating fluorescence microscopy with transmission electron microscopy. Methods Mol. Biol. 369, 291-308 (2007).
- Micheva, K., Smith, S. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Nixon, S. J., et al. A single method for cryofixation and correlative light, electron microscopy and tomography of zebrafish embryos. Traffic. 10, 131-136 (2009).
- Kukulski, W., et al. Correlated fluorescence and 3D electron microscopy with high sensitivity and spatial precision. J. Cell Biol. 192, 111-119 (2011).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313, 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods. 3, 793-795 (2006).
- Hess, S. T., Girirajan, T. P. K., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91, 4258-4272 (2006).
- Weibull, C., Christiansson, A. Extraction of proteins and membrane lipids during low temperature embedding of biological material for electron microscopy. J. Microsc. 142, 79-86 (1986).
- Watanabe, S., et al. Protein localization in electron micrographs using fluorescence nanoscopy. Nat. Methods. 8, 80-84 (2011).
- F lling, J., et al. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat. Methods. 5, 943-945 (2008).
- Gustafsson, M. G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198, 82-87 (2000).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nature Methods. 7, 717-719 (2010).
- Dertinger, T., Colyer, R., Iyer, G., Weiss, S., Enderlein, J. Fast, background-free, 3D super-resolution optical fluctuation imaging (SOFI). PNAS. 106, 22287-22292 (2009).
- Burnette, D. T., Sengupta, P., Dai, Y., Lippincott-Schwartz, J., Kachar, B. Bleaching/blinking assisted localization microscopy for superresolution imaging using standard fluorescent molecules. PNAS. , (2011).
- Annibale, P., Vanni, S., Scarselli, M., Rothlisberger, U., Radenovic, A. Identification of clustering artifacts in photoactivated localization microscopy. Nat. Meth. 8, 527-528 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved