Method Article
リビングでの動的動原体タンパク質の挙動と染色体の動きを図解して有糸分裂チェックポイントを勉強
要約
SACは、姉妹染色分体の有糸分裂分離を監視し、その信号を開始する場所を動原体である。方法は、染色体の動きと動原体タンパク質とその調整のいずれかの採用と離職率を可視化するために記述されているショウジョウバエライカレーザー走査共焦点顕微鏡システムを用いた胚。
要約
スピンドル·アセンブリーのチェックポイント(SAC)機構は染色体が正しく接続されるまで、後期発症を防ぐために、染色体の動原体と紡錘体微小管との間の相互作用を監視し、アクティブな信号です。細胞が異数性やゲノム不安定性、それゆえ癌や先天性欠損症やアルツハイマー病の1のような他の人間の病気を防ぐために、このメカニズムを使用します。そのようなMad1としてSACコンポーネントの数、MAD2、Bub1、BubR1、Bub3、Mps1、Zw10、ロッドとオーロラBキナーゼを同定し、それらは2すべての動原体の動的蛋白質であるされています。証拠はSAC信号が開始されている動原体であることを示唆している。 SAC素数の規制対象はCdc20です。 Cdc20は不可欠APC / C(naphase P romoting C omplexまたはC yclosome)活性化因子3のいずれかであり、また、動原体の動的なタンパク質4月6日です。アクティブにすると、SACの活性を阻害するPC / Cそれによって転移7,8後期にかけて中期を防止するため、2つのキー基板、サイクリンBとsecurinの破壊を防ぐことができます。 SAC信号が開始され、組み立てられた動原体に、その機能はまだとらえどころのないままに阻害するためにAPC / Cに中継される方法を正確に。
ショウジョウバエは非常に扱いやすい実験系である。人間が、一般的な株式の基本的なプロセスその1に比べてはるかに単純で、より良く理解し生物。初期胚が同期して13急速な核分裂サイクル(8-10分を通過するとして、それは、特に時間と空間の分裂イベントの可視化のため、おそらく、生きた細胞内バイオイメージング研究のために使用するための最良の生物の一つである25°C)で、各サイクルごとに徐々にだけ皮質下に9つの単分子層の核を開催しています。
ここでは、トランスジェニックショウジョウバエの発現を用いたバイオイメージング法を提案する歌うGFP(緑色蛍光タンパク質)またはその変異体をターゲットとした関心とSACコンポーネントの一部のGFP融合タンパク質のイメージを示すことによって、ハエのSACの機能を研究するためにライカTCS SP2共焦点レーザー走査型顕微鏡システムのタンパク質、Cdc20とMAD2 、例として。
プロトコル
1。トランスジェニックハエとメンテナンス
- UBQ-GFP-Cdc20(II *)、UBQ-GFP-Cdc20(II *); MAD2 EY(UBQ-GFP-Cdc20(II)、UBQ-RFP-His2B(X *):トランスジェニックは、このデモで使用されているハエ III *)とUBQ-GFP-Cdc20トランスジェニックハエは、以前の研究室で標準的なP-エレメントを介したトランスジェニックアプローチ10,11を介して生成されるとUBQ-RFP-His2Bは UMR 144 CNRS /研究所キュリーでYohannsBelaïcheから親切な贈り物です。たが、パリ、フランス。それらは標準のショウジョウバエ遺伝学を経由してMAD2変異体背景に導入されました。 MAD2 EYオリジナルの変異体ラインはブルーミントンストックセンターから購入した。我々は、このプロトコルで形質転換体を持上げに使用する手順については説明しません。
注:*染色体番号を表します。 - メンテナンス:トランスジェニックハエを25℃に維持したプラスチックバイアルcontaininのCgは食べ物を飛ぶと上に追加の乾燥酵母粉末と。バイアルは、定期的にすべての3-4週間生育条件( 図1)に応じて置き換えられました。
2。 (ラボスケール)食事の準備を飛ぶ
- フライ食品·ミックスの適切な量の成分を溶解するために絶えず撹拌しながら加熱した。
- この培地の約8-10 mlをJencons科学株式会社蠕動ポンプを使用して、それぞれプラスチックバイアル(2.5 cm直径×8 cmの長さ)にスラリーとして配布されました。
- 食品のスラリーが設定され、室温まで冷却したとき、バイアルは、その後綿フォームプラグで接続されている。これらの食品のバイアルは、その後ビニール袋に密封し、℃で後で使用するために4℃で保持されるトレイに配置されています。
3。小規模採卵
- 2〜3日の古い成虫の約50のペアが産卵のために25℃で、その表面上に追加の乾燥酵母粉末を供給する新鮮なフライ食品バイアル°Cに移したる胚。
- ハエは、その後新鮮なバイアルに毎時間転送し、核は徐々に皮質に移行しているときに収集胚の一部は核の分裂周期8-10歳前後されていることを確認する30分間バイアル中に胚を残すとして編成されています単分子層。それは頻繁に条件が産卵に適していなかった女性の身体に保持された高齢者の胚が含まれているので最初の1時間のコレクションは、通常は破棄されます。
4。カバーグラスとスライドの準備
- 50×22 mmのカバーガラスを取り出し、少し湿った微細なペンのブラシを使用して、水の非常に少量の片側に、その四隅を濡らすとカバースリップが原因毛細血管の表面張力の移動しないように顕微鏡スライド上に置く薄い液膜によって引き起こされる。
- カバースリップの中央にヘプタン接着剤の薄いストリップを適用し、ヘプタンはカバースリップに接着剤を残すために数秒で蒸発させる必要があります。
- 小さ な四角(〜1.5ミリメートル2)にダイヤモンドペンで別のカバースリップをカット、次のいずれかをピックアップし、接着剤ストリップの一端(これはマイクロインジェクションが必要なときに針先を開くために使用されています)の上に置き、将来のために他人を保存使用しています。
- 別の顕微鏡スライドを取るとカバー紙を約2cm、それまで長いと皮両面粘着テープの部分を貼り付けます。 ( 図2A&Bを参照してください。)
5。 Dechorionate胚
- 生鮮食品バイアルにハエを移し、卵が広がってできるようにするために液体の適切な量のスライド上に両面粘着テープの上に約50卵を転送するために湿らせた微細なペンのブラシを使用しています。液体が蒸発したとき卵は、テープに付着します。
- 解剖顕微鏡のタッチの下での長軸に沿って卵を数回漿膜まで静かにピンセットの半分の外側を使用すると、壊れた、オープンであるが、合唱に胚を残す急激な脱水症状を防ぐために、イオンシェル。卵の10〜20まで、このプロセスを続ける(単一の実験に必要な卵の数に応じて)処理されています。
- 胚はその後ピックアップと絨毛膜のシェルから削除され、穏やかにいずれかの接着剤ストリップ1に配置することができます。卵は、それらがマイクロインジェクションされる場合には依存に置かれ、胚のパラレルまたは接着剤ストリップの長辺に反平行の長辺のいずれかで整列することができます。
- 胚は、即時イメージングのための更なる乾燥を防ぐためにVoltalefの10S油の適量(Holocarbon 700オイルと27のオイルの5:1混合物、Sigma)ですぐに覆われたり、ために3-8分間乾燥チャンバー内に配置することができます部屋の湿度と実験の目的に応じて、さらにそれらを脱水する。マイクロインジェクションが必要な場合は、過乾燥を防ぐため、適切な場合脱水胚は10S油で覆われている必要があります。 ( 図を参照してください。2C、D&E)。
6。イメージング胚
- 生きている胚のタイムラプスまたはシングルイメージはHCX PL APO CS 40X 1.25油浸対物レンズ(60または100×目標とライカTCS SP2共焦点倒立顕微鏡システムを用いて収集された以上、実験の目的に応じても使用できます。倍率)が発生します漂白多くの写真を使用していました。
- イメージング複数のスペクトルを重複している蛍光体と、が同じ胚に共発現されている場合、各蛍光タンパク質の発光波長が連続して採取した。ライカTCS SP2システム上で利用可能な励起および発光波長は、次のとおりです。GFP、λ 例 :488 nmとλEM:500から600 nmである。 RFP、λ 例 :543 nmとλEM:555から700 nmである。
- 単一のイメージは一般的に2フレーム·スキャンの平均で2走査線の平均値として得られた。これは512×512 pをスキャンするために6.3秒の最小値をとるixel同時スキャンモードでのイメージ、およびシーケンシャルスキャンモードの15.44秒と良好な信号対雑音比を生成します。これらの時間は、タイムラプス画像の収集に時間枠を設定するときに考慮する必要があります。
- ピンホールは、通常1から2 AU(風通しの良いユニット)に設定されて、レーザーパワーが重要な退色を避けるために、可能な限り低いレベルに調整した。
7。適切な試薬で胚をマイクロインジェクションすることでSACを引き起こす
- 実験前に針を準備します。パラメータを使用して:熱= 600、= 90、VEL = 70を引く:私たちは燃える/茶色のマイクロピペットプラー(P-97サッターインストゥルメント、モデル)を使用してsiliconisedガラスキャピラリー(GC-100-10、ハーバード大学)から針を引っ張ることを好む、デル= 150。
- 細かいローディングチップ(:W215818J20μlをエッペンドルフロット)を使用してインジェクション、バッファ内の試薬の適切な濃度の1〜2 mlの針のバックフィル。
- 針HOに針をマウントします。エッペンドルフ噴射制御システムに接続されている圧力管と顕微鏡でlder。
- 40X目的で胚を見つけて、視野の中心に針を移動し、徐々に右側の焦点面に下げることによって、焦点面を変更することなく、針の影を見つける。
- 壊れたカバースリップの接着ストリップの一方の端部にあらかじめマウントされているの小さな広場を見つけて静かに胚を移動します。それは小さな正方形のカバースリップの端に当たると静かに開いた、それを中断するまで、非常に静かに針の先端に移動します。
- ビューに戻す胚を移動し、注入に適した年齢の胚を選択します。核は大脳皮質に外側に移行する前にこれはように私は通常は5月7日に、核分裂周期で胚を注入します。核分裂サイクルのステージは、GFP-Cdc20または注射前9〜RFP-ヒストン2Bの核信号の蛍光シグナルのクイックスキャンによって決定することができる。
- 慎重にエンブリーを移動O針に近く、胚と針の両方に焦点面を再調整します。針に胚を移動し、希望の位置に試薬の液滴を注入し、離れて胚を移動(またはマイクロインジェクションシステムの指示に従ってください。)胚は、その後部から、または実験の目的に応じて側から注入することができます。
- 一度注入された胚は、適切なタイミングで撮像できるようになりました。 ( 図2F&Gを参照してください)
8。代表的な結果

図1。必要な材料。細かいペンのブラシA、B。小さ な正方形の壊れたメガネのコンテナは、c。 22×50ミリメートルカバースリップは、d。顕微鏡スライド、 電子 。両面粘着テープは、f。蓋は、gの穴に試験管内で乾燥酵母粉末。酵母顆粒は、フライのメンテナンス、 時間に使用されます。食品バイアル、iを飛ぶ。 dechorionate胚に使用されるピンセットの半分、J。ペアピンセット、K。ヘプタン糊液容器(メスフラスコ)。
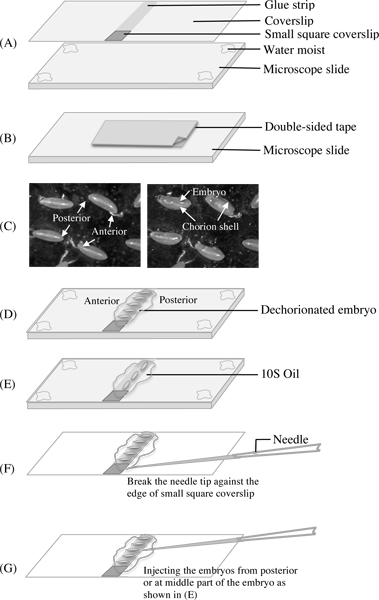
図2。図は、手順4、手順5と手順7のマイクロインジェクションのための針の準備に胚dechorionationでカバーガラスとスライドの準備を示しています。 A。上の写真は、その真ん中を越えヘプタン接着剤のストリップの一端に付着し、壊れたカバースリップの小さな正方形のカバースリップを示しています。下の写真は、カバースリップを保持するために、その四隅に薄い水の層を有する顕微鏡スライドを示しています。あなたはスライド上に両面テープを持っているので、しばらくあなたのar顕微鏡をリフォーカスを避けたときにそれが見られるようにカバースリップを保持するためにスライドを使用する理由は、ほぼ同じ焦点距離を維持することですテープとカバーガラスの間に胚を解剖し、転送する電子。B。両面スコッチテープの長さが短いとスライドが胚。Cを dechorionatingに使用する、カバー紙を剥がす前に適用されます。左の写真はマークされた前部および後部末端を持つ無傷の絨毛膜のシェルで胚を示しています。それらは接着剤ストリップでカバースリップ上に転写される前に、右の写真は壊れた絨毛膜のシェルで胚を示していますD&E図2を示す。接着剤ストリップにdechorionated胚を、転送配置し、整列させるための方法。胚は、適切な乾燥期間の後、10S油で覆われていた。F&G.図は針の先端を開いて注入するように配置する方法を示す。
上記の実験から得られた単一またはタイムラプス画像は、直接ライカソフトウェアを使用して分析したり、開いているFOとして。TIFファイルに保存することができますこれを説明するようなイメージJは、PhotoshopおよびMetaMorph等二つの例のような他の一般的な画像解析プログラムを使用して、さらに定量化や編集の分析のために利用できるrmatは、以下に説明されています。
例1:タイムラプスムービー( 図3)は、 ショウジョウバエシンシチウム胚を生体内でGFP-Cdc20と染色体の動きのダイナミックな動原体の動員を示しています。オリジナルのタイムラプスシーケンス画像から関心領域が決定/編集および自動バッチPhotoshopのソフトウェアを使用して変換されました。ムービーは、QuickTimeソフトウェアを使用して組み立てた。
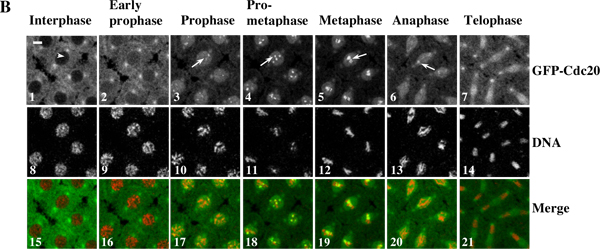
図3。タイムラプスムービーは、 ショウジョウバエのシンシチウム胚を生体内でGFP-Cdc20と染色体の動きのダイナミックな動原体の動員を示しています。 (A)タイムラプス画像は、GFP-Cdc20(緑)の共発現するトランスジェニックシンシチウム胚から採取されたとRFP-ヒストンは、2B(赤)の融合タンパク質とは、°C核分裂サイクルの間に7月8日18歳でライカTCS SP2共焦点顕微鏡システムを用いて記録した。フレームは10秒ごとに撮影された。既に前期の細胞を持つフレームは、ゼロ時点10として扱われます。 図3Aムービーを表示するには、ここをクリック 。(B)GFP-Cdc20が容 易に前期及び前中期動原体(B3&4、白矢印)で観察することができ、中期と後期キネトコア(B5&6、白矢印)に保持されます。 GFP-Cdc20は、早期前期で核を入力し、間期核(白矢印)から除外されます。クロマチンの形態は、マーカー(B8-14)などの共発現His2BmRFPを用いて測定した。バー= 5ミリメートル。
例2:SACの機能は、マイクロインジェクション、抗体、蛍光標識したタンパク質またはchemicaで胚を操作することによって学ぶことができます。潜在的にSACを引き起こす興味lの化合物。例えば、 図4〜10に示すように、SACを刺激できるように微小管を解重合するためにコルヒチンを注入する。

図4。 MAD2は、コルヒチン、呼び出されたSAC機能 10 には不可欠です 。 GFP-cdc20、MAD2 + / +、GFP-cdc20、MAD2 EY(MAD2 - / -ヌル変異体)とGFP-MAD2、MAD2 EY胚をマイクロインジェクションによってコルヒチンで処理した。タイムラプス共焦点画像は(; 8月12日、中央のパネルは、14から18、底部パネル02から06、天板)の前(01、07&13)、または注入後に撮影されました。 GFP-Cdc20(上部および中央のパネル)またはGFP-MAD2(下パネル)動原体の信号が細胞周期の進行のマーカーとして使用された。上部パネル、矢印は2月6日に逮捕された動原体を示しています。 01の矢印でマークされたエリアには、コルヒチン処理、GFP-Cの前にそれを示していますDC20は、故間期核から除外されます。細胞質分裂が存在する場合には、微小管を欠く胚で予想されるように、欠陥があるように見えるが、中央のパネルには、内因性MAD2の不在下で、GFP-Cdc20信号は、核の外で振動し続け、動原体のオンとオフコルヒチンの(07から12の矢印で示される)コルヒチン処理に応答して細胞を逮捕に失敗したSACの機能を示唆している。娘核の分離は、図10に失敗しました。底部パネルには、14から18に矢印が蓄積されたGFP-MAD2融合タンパク質救助にMAD2変異体胚でSAC欠陥表現型を機能的なGFP-MAD2を示唆すると逮捕された動原体を示しています。 13の矢印は遅い間期核でGFP-MAD2蓄積を示しています。バーは5mm =。胚は、1×PBSで100mg/mlコルヒチン原液〜1%の卵体積とマイクロインジェクションされた。
ディスカッション
ここで説明するプロトコルは、ライカTCS SP2共焦点レーザー走査顕微鏡を用いてシンシチウム胚を飛ぶと、他の顕微鏡システムに合わせて変更することができ、また、 ショウジョウバエ多核の胚を使用して、他の遺伝子の機能を研究するために適応させることができます。イメージングのための汎用的なメソッドです。我々は、スピンドル·アセンブリーのチェックポイントは、タンパク質のダイナミクスとの生活や固定サンプル4,6,12-14中のタンパク質の局在を可視化するトランスジェニックハエまたはポリクローナル抗体を用いたタンパク質のタンパク質分解の多くの側面を研究するために、このプロトコルを使用しています。
卵の - それは小さな数字(100〜10)を収集する際に、新鮮なフライ食品のバイアル中にハエを維持するのが最も簡単です。これは、製造および他の刊行物15,16に記載され追加のリンゴジュース寒天プレートと卵の収集室を準備する手間を減らすことができます。カバースリップ上の接着剤ストリップの一方の端に壊れたカバースリップガラスの小さな正方形の添加は、それは非常に簡単になります針を開いて、針が10S油に浸漬されている間マイクロインジェクションシステムの設定を調整することにより、注入量を決定します。胚の乾燥の程度は、漏れを避けるため、特に長い期間を必要としたり、注射した後、形質転換を発生させる場合、これらの実験のために胚の生存性を維持するために注射を成功させるために重要である。しかし、必要とされる正確にどのくらいの乾燥のための黄金のルールはありません。これは実験から実験に変化し、注入溶液および作業環境の湿度の量に依存します。
興味のある特定のタンパク質の機能は、モノ - 又はポリクローン抗体は、特定のタンパク質、メッセンジャーRNAまたは野生型または遺伝子変異の背景の下で蛍光標識したペプチドに対して、特定のタンパク質の阻害剤をマイクロインジェクションすることによって操作することができます。これらの変異系統またはGFPタグ付きのトランスジェニック系統の多くは公にAVです。ショウジョウバエストックセンターからailable、それらのほとんどはFlybaseに記載されています( http://flybase.org/~~V )とオンライン検索することができます。
開示事項
我々は、開示することは何もありません。
謝辞
このプロトコルは、ウェルカム·トラストの助成金の下に開発されました。私たちは、系統を維持し、年間でフライ食品を準備するために氏モーリーンシンクレアに感謝します。また、このプロトコルの開発の彼のヘルプおよび技術サポートのために氏マイケルAitchisonが感謝したい。
資料
不可欠な機器と試薬:
共焦点イメージングシステム:このプロトコールに記載の撮像システムでは、共焦点倒立顕微鏡システムのスキャンはライカTCS SP2レーザである。記載されている方法は、他のイメージングシステムのためのいくつかのマイナーな変更で多分にも適しています。
顕微鏡解剖:我々はDF PLAPO 1X-4レンズとオリンパスSZX7を使用しています。
ニードルプラー/茶色マイクロピペットプラーを(:P-97サッター楽器、モデルからの)フレーミング。
マイクロインジェクションシステム:エッペンドルフマイクロインジェクションシステムが記載されているが、他の適切なシステムを使用することができます。
Jencons科学株式会社蠕動ポンプ:食品の販売代理店に飛ぶ 。
試薬:
| Name | Company | Catalog Number | Comments |
| 材料 | 重さの | 資源 | ロットNo。 |
| トウモロコシの食事 | 100.0グラム | SUMA、英国 | |
| ブラウンシュガー | 50.0グラム | ビリントンの、英国 | |
| ドライイースト | 25.0グラム | DCL酵母(株)英国 | |
| 寒天 | 12.5グラム | フィッシャー·サイエンティフィック | 106556 |
| ソルビン酸 | 0.4グラム | BDH、VWRインターナショナル株式会社英国 | 8829310 |
| 安息香酸 | 2.9グラム | フィッシャー·サイエンティフィック | 1019599 |
| Nipagin (メチル-4 - ハイドロ xybenzoate) | 0.9グラム | BDH、VWRインターナショナル株式会社英国 | K35969015 |
| 1LのH 2 Oまで | |||
Sigmaから購入しHolocarbon 700と27のオイル。
ドライイースト:トーマス·アリソン、英国。
ヘプタン接着剤を準備する:両面スコッチテープの約1.5メートルテイクヘプタン5mlのと15ミリリットルのファルコンチューブに入れて3-5時間または一晩回転させます。その時間が経過した後、任意の残骸を削除するには、ベンチトップ遠心機で速い速度で5分間1.5mlエッペンドルフ遠心チューブとスピンで4つの等しいアリコートに分割します。 10mlのメスフラスコにヘプタン糊液を保存して使用するために保持します。接着強度は、濃度、使用接着剤の量に応じて異なります。通常は、薄い接着剤は、共焦点顕微鏡によってスキャンされたより低い騒々しい背景を生成します。
- カバースリップ:BDH、VWRインターナショナル株式会社英国
- 顕微鏡スライド:BDH、VWRインターナショナル株式会社英国
- Siliconisedガラスキャピラリー:GC-100-10、ハーバード大学
- ファインロードのヒント:20μlのエッペンドルフロット:W215818J
- ピンセット
- ファインペンのブラシ
参考文献
- Holland, A. J., Cleveland, D. W. Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis. Nat. Rev. Mol. Cell Biol. 10, 478-4787 (2009).
- Zekanowski, C., Wojda, U. Aneuploidy, chromosomal missegregation, and cell cycle reentry in Alzheimer's disease. Acta Neurobiol. Exp. (Wars). 69, 232-253 (2009).
- Buffin, E., Emre, D., Karess, R. E. Flies without a spindle checkpoint. Nat. Cell Biol. 9, 565-572 (2007).
- Tang, Z., Shu, H., Oncel, D., Chen, S., Yu, H. Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint. Mol. Cell. 16, 387-397 (2004).
- Huang, J., Raff, J. W. The disappearance of cyclin B at the end of mitosis is regulated spatially in Drosophila cells. EMBO Journal. 18, 2184-2195 (1999).
- Xia, G. Conformation-specific binding of p31(comet) antagonizes the function of Mad2 in the spindle checkpoint. Embo. J. 23, 3133-3143 (2004).
- Lorca, T. Fizzy is required for activation of the APC/cyclosome in Xenopus egg extracts. Embo. J. 17, 3565-3575 (1998).
- Howell, B. J. Cytoplasmic dynein/dynactin drives kinetochore protein transport to the spindle poles and has a role in mitotic spindle checkpoint inactivation. J. Cell Biol. 155, 1159-1172 (2001).
- Foe, V. E., Alberts, B. M. Studies of nuclear and cytoplasmic behaviour during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis. Journal of cell science. 61, 31-70 (1983).
- Li, D., Morley, G., Whitaker, M., Huang, J. Y. Recruitment of Cdc20 to the kinetochore requires BubR1 but not Mad2 in Drosophila melanogaster. Mol. Cell Biol. 30, 3384-3395 (2010).
- Karess, R. E., Glover, D. P element mediated germ line transformation of Drosophila. DNA cloning: A practical approach. 2, 121-141 (1985).
- Wakefield, J. G., Huang, J. Y., Raff, J. W. Centrosomes have a role in regulating the destruction of cyclin B in early Drosophila embryos. Current Biology. 10, 1367-1370 (2000).
- Huang, J. Y., Raff, J. W. The dynamic localisation of the Drosophila APC/C: evidence for the existence of multiple complexes that perform distinct functions and are differentially localised. Journal of Cell Science. 115, 2847-2856 (2002).
- Raff, J. W., Jeffers, K., Huang, J. Y. The roles of Fzy/Cdc20 and Fzr/Cdh1 in regulating the destruction of cyclin B in space and time. Journal of Cell Biology. 157, 1139-1149 (2002).
- Brust-Mascher, I., Scholey, J. M. Microinjection Techniques for Studying Mitosis in the Drosophila melanogaster Syncytial Embryo. J. Vis. Exp. (31), e1382 (2009).
- Figard, L., Sokac, A. M. Imaging Cell Shape Change in Living Drosophila Embryos. J. Vis. Exp. (49), e2503 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved