Method Article
Studieren mitotischen Checkpoint durch Veranschaulichung Dynamische Kinetochor Protein Verhalten und Chromosome Motion in Lebens-
In diesem Artikel
Zusammenfassung
Das Kinetochor ist, wo der SAC initiiert sein Signal Überwachung der mitotischen Segregation der Schwesterchromatiden. Es wird eine Methode beschrieben, um die Rekrutierung und den Umsatz von einer der Kinetochorproteine und ihre Abstimmung mit dem Chromosom Bewegung visualisieren, in Drosophila Embryonen mit einem Leica Laser-Scanning-konfokalen System.
Zusammenfassung
Die Spindelanordnung Prüfpunkt (SAC) Mechanismus ist ein aktives Signal, das die Interaktion zwischen Chromosom Kinetochoren und der Spindel-Mikrotubuli überwacht, um Anaphase Einsetzen verhindern, bis die Chromosomen korrekt angeschlossen sind. Zellen nutzen diesen Mechanismus, um Aneuploidie oder genomische Instabilität und damit Krebs und andere Krankheiten des Menschen wie Geburtsfehler und Alzheimer-1 zu verhindern. Eine Reihe der SAC-Komponenten wie Mad1, Mad2, Bub1, BubR1, Bub3, Mps1, Zw10, haben Rod und Aurora B-Kinase identifiziert worden und sie sind alle Kinetochor dynamische Proteine 2. Hinweise darauf, dass das Kinetochor, wo der SAC-Signal wird ausgelöst ist. Der SAC Prime regulatorische Ziel ist Cdc20. Cdc20 ist eines der wesentlichen APC / C (A naphase P ÖRDERUNG C omplex oder C yclosome) Aktivatoren 3 und ist auch eine dynamische Protein Kinetochor 4-6. Wenn aktiviert, verhindert die SAC die Aktivität der APC / C zu verhindern, dass die Zerstörung der beiden wichtigsten Substrate, Cyclin B und Securin, wodurch die Metaphase, um den Übergang 7,8 Anaphase. Genau wie die SAC-Signal ausgelöst wird und auf den Kinetochoren montiert und weitergeleitet auf den APC / C zu hemmen, seine Funktion noch in weiter Ferne.
Drosophila ist ein extrem gefügig experimentelles System, eine viel einfachere und besser verstandenen Organismus für das menschliche, sondern ein Vergleich, dass die Aktien grundlegenden Prozesse gemeinsam. Es ist vielleicht eine der besten Organismen für Bio-Imaging-Studien in lebenden Zellen zu verwenden, besonders für die Visualisierung der mitotische Ereignisse in Raum und Zeit, wie der frühe Embryo geht durch 13 schnelle Kernteilung Zyklen synchron (8-10 Minuten für jeden Zyklus bei 25 ° C) nach und nach organisiert die Kerne in einer einzelnen Monoschicht nur unter dem Kortex 9.
Hier präsentiere ich eine Bio-Imaging-Methode unter Verwendung von transgenen Drosophila expressingen GFP (Green Fluorescent Protein) oder dessen Variante gezielte Proteine von Interesse und einem Leica TCS SP2 konfokalen Laser-Scanning-Mikroskop-System, um die SAC-Funktion im Fliegen zu studieren, indem sie zeigt Bilder von GFP-Fusionsproteinen von einigen der SAC-Komponenten, Cdc20 und Mad2 , als Beispiel.
Protokoll
1. Transgenen Fliegen und Wartung
- Transgene Fliegen in diesem Beispiel verwendet: UBQ-GFP-Cdc20 (II), UBQ-Rfpschablonen His2B (X *); UBQ-GFP-Cdc20 (II *), UBQ-GFP-Cdc20 (II *); MAD2 EY ( III *) und UBQ Cdc20-GFP-transgenen Fliegen wurden zuvor im Labor über einen Standard-P-Element-vermittelten transgenen Ansatz 10,11 und UBQ-RFP-His2B ist eine Art Geschenk von Yohanns Belaïche an UMR 144 CNRS / Institut Curie erzeugt, Paris, Frankreich. Sie wurden in eine Mad2 mutierten Hintergrund über Standard-Drosophila-Genetik eingeführt. Die MAD2 EY ursprünglichen mutanten Linie wurde aus dem Bloomington Stock Center gekauft. Wir diskutieren nicht das Verfahren zum Anheben der Transformanten in diesem Protokoll verwendet.
Hinweis: * steht für die Chromosomenzahl. - Wartung: Transgene Fliegen wurden bei 25 ° C gehalten, in Plastikröhrchen containing fliegen Nahrung und mit zusätzlichen Trockenhefe Pulver auf der Oberseite. Das Fläschchen wurde routinemäßig ersetzt alle 3-4 Wochen, je nach Anbaubedingungen (Abbildung 1).
2. Fly Food Preparation (Lab-Skala)
- Eine geeignete Menge der Fliege Futtermischung wurde unter konstantem Rühren erhitzt, um die Komponenten zu lösen.
- Etwa 8-10 ml dieses Mediums als Aufschlämmung in jedes Kunststoffphiole (2,5 cm Durchmesser und 8 cm Länge) unter Verwendung eines Jencons Scientific Ltd Schlauchpumpe verteilt.
- Als das Essen Gülle gesetzt wurde und auf Raumtemperatur abgekühlt, wird die Flasche gesteckt dann mit einem Baumwoll-Schaum-Stecker. Diese Nahrungsmittel Fläschchen werden in einem Fach, das dann in einem Plastikbeutel wird verschlossen und bei 4 ° C für die spätere Verwendung gebracht.
3. Small-scale Egg Collection
- Über 50 Paare von 2-3 Tage alten erwachsenen Fliegen wurden in ein frisches Röhrchen essen fliegen mit zusätzlichen Trockenhefe Pulver auf seiner Oberfläche bei 25 ° C zugeführt für Laien übertragenÝng Embryonen.
- Die Fliegen werden dann in ein frisches Gefäß überführt und jede Stunde verlassen die Embryonen in der Ampulle für 30 Minuten, um sicherzustellen, einige der gesammelten Embryonen um Kernteilung Zyklus 8-10 Jahre alt sind, wenn die Kerne allmählich werden die Migration auf der Rinde und organisiert als einzelnen Monolage. Die erste Stunde Sammlung wird in der Regel verworfen, da es enthält häufig im Alter von Embryonen, die in den weiblichen Körper zurückgehalten wurden, wenn die Bedingungen waren nicht geeignet für die Verlegung.
4. Vorbereiten Deckgläser und Objektträger
- Nehmen Sie ein 50 x 22 mm Deckglas und leicht feucht seinen vier Ecken auf einer Seite mit einer sehr geringen Menge von Wasser mit einem feuchten Pinsel feinen Stift und setzte sie auf einen Objektträger, so dass das Deckglas nicht, weil der Kapillare Oberflächenspannung bewegen die durch die dünnen Flüssigkeitsfilm.
- Eine dünne Streifen aus Heptan Klebstoff, der die Mitte des Deckglases, sollte die Heptan in Sekunden verdampfen, um den Klebstoff auf das Deckglas zu verlassen.
- Schneiden Sie einen anderen Deckglas mit einer Diamant-Stift in kleine Quadrate (~ 1,5 mm 2), nehmen Sie ein und legen Sie es auf ein Ende der Klebestreifen (wird verwendet, um die Nadelspitze zu öffnen, wenn Mikroinjektion wird benötigt) und speichern Sie die andere für die Zukunft verwenden.
- Nehmen wir ein anderes Mikroskop-Objektträger und kleben Sie ein Stück doppelseitiges Klebeband etwa 2 cm lang, um es und ziehen Sie die Deckblätter. (Siehe Abbildung 2 A & B).
5. Dechorionate Embryonen
- Übertragen Sie die Fliegen auf einen frischen Lebensmitteln Fläschchen und verwenden Sie einen befeuchteten feinen Pinsel Stift auf etwa 50 Eier auf dem doppelseitigen Klebeband auf die Folie übertragen mit einer entsprechenden Menge an Flüssigkeit, damit die Eier ausgebreitet werden. Wenn die Flüssigkeit verdampft die Eier auf dem Band kleben.
- Unter einem Binokular Touch die Eier mehrmals entlang ihrer Längsachse mit der Außenseite der einen Hälfte einer Pinzette vorsichtig bis zum Chorion ist gebrochen und offen, aber lassen Sie das Embryo im ChorIonen-Schale zu schnelle Austrocknung zu verhindern. Diesen Prozess fort, bis die Eier 10-20 behandelt worden ist (abhängig von der Anzahl der Eier für einen einzigen Experiment erforderlich).
- Die Embryonen können dann abgeholt werden und aus dem Chorion-Shell und sanft auf den Klebestreifen einer nach dem anderen gelegt. Die Eier können angeordnet werden und entweder mit der langen Seite des Embryos parallel oder anti-parallel zu der langen Seite des Klebestreifens davon abhängen, ob sie mikroinjiziert werden ausgerichtet.
- Die Embryonen können sofort mit einer geeigneten Menge der Voltalef 10S Öl (ein 5:1-Gemisch von Öl Holocarbon 700 und 27 Öl, Sigma) bis zu weiteren Austrocknung telbaren verhindern abgedeckt werden, oder in einer Austrocknung Kammer für 3-8 Minuten dehydrieren sie weiter in Abhängigkeit von der Luftfeuchtigkeit des Raumes und der Zweck des Versuches. Die entwässerten Embryonen sollten mit 10S Öl bedeckt sein, wenn entsprechende over-Dehydrierung zu verhindern, wenn die Mikroinjektion ist nicht erforderlich. (Siehe Abbildung. 2C, D& E).
6. Imaging Embryonen
- Zeitraffer oder einzelne Bilder von lebenden Embryonen werden mittels eines Leica TCS SP2 invertierten konfokalen Mikroskopie-System mit einem HCX PL APO CS 40X 1,25 Ölimmersionsobjektiv (60 oder 100x Objektive können verwendet werden zu je nach Zweck des Experiments ist, desto höher werden die Vergrößerung verwendet die mehr Photobleichung auftreten werden).
- Bei der Darstellung mehrere Fluorophore, die überlappende Spektren wurden und in der gleichen Embryos co-exprimiert, wurde jede fluoreszierende Protein Emissionswellenlänge gesammelt sequentiell. Die Anregungs-und Emissionswellenlänge auf dem Leica TCS SP2-Systems sind: GFP, λ Ex: 488 nm und λ Em: 500-600 nm. RFP, λ Ex: 543 nm und λ Em: 555-700 nm auf.
- Ein einzelnes Bild allgemein als durchschnittlich 2 Abtastlinien mit einem Durchschnitt von 2 Frame-Scans erhalten. Dies dauert mindestens 6,3 Sekunden, um eine 512x512 p scannenIxel Bild in einem gleichzeitigen Scan-Modus und 15,44 Sekunden für eine sequentielle Abtastung ausgeführt und ein gutes Signal-Rausch-Verhältnis. Diese Zeiten müssen berücksichtigt werden, wenn die Einrichtung der Zeitrahmen für Zeitraffer-Bild Sammeln.
- Die Lochkamera wurde in der Regel auf 1-2 AU (Airy Einheit) gesetzt, und die Laserleistung wurde auf der niedrigst möglichen Ebene, um eine erhebliche Ausbleichen zu vermeiden angepasst.
7. Provozieren die SAC durch Mikroinjektion des Embryos mit geeigneten Reagenzien
- Bereiten Sie die Nadel vor dem Experiment. Wir bevorzugen es, die Nadel aus silikonisierte Glaskapillaren (GC-100-10, Harvard) ziehen mit dem flammenden / braun Feinpipettenziehvorrichtung (Sutter, Modell: P-97) mit den Parametern: Wärme = 600, ziehen = 90, vel = 70 , del = 150.
- Verfüllen Sie die Nadel mit 1-2 ml eines geeigneten Konzentration des Reagenzes in Injektionspuffer mit einem feinen Laden Spitze (20 ul Eppendorf Menge: W215818J).
- Montieren Sie die Nadel in der Nadel holder am Mikroskop mit dem Druckrohr verbunden mit dem Eppendorf-Steuersystem.
- Finden Sie einen Embryo unter dem 40X-Objektiv und finden Sie die Nadel Schatten ohne Änderung der Fokalebene durch Verschieben der Nadel in der Mitte des Sichtfeldes und allmählich senken Sie ihn nach rechts Brennebene.
- Bewegen Sie den Embryo entfernt sanft auf den kleinen Platz des gebrochenen Deckglas an einem Ende des Klebestreifens vormontiert zu finden. Sehr sanft bewegen die Nadelspitze bis er den Rand des kleinen quadratischen Deckglas trifft und sanft bricht sie zu öffnen.
- Verschieben Sie die Embryonen wieder in Sicht, und wählen Sie den Embryo im richtigen Alter für die Injektion. Ich normalerweise spritzen sie den Embryo in Kernteilung Zyklus bei 5-7, da dies, bevor die Kerne wandern nach außen zur Rinde. Die Kernteilung Zyklus Phasen kann durch einen schnellen Scan der Fluoreszenzsignale der GFP-Cdc20 oder die nukleare Signal des RFP-Histon-2B vor der Injektion 9 bestimmt werden.
- Bringen Sie den Embryo in der Nähe der Nadel und stellen dann eine Brennebene sowohl für den Embryo und die Nadel. Bewegen Sie den Embryo in die Nadel zu injizieren und einen Tropfen des Reagens in die gewünschte Position und bewegen Sie den Embryo weg (oder folgen Sie den Anweisungen für die Mikroinjektion-System). Der Embryo kann von der hinteren oder von der Seite abhängig von dem Zweck des Experiments injiziert werden.
- Nach der Injektion wird der Embryo abgebildet zu gegebener Zeit abgebildet werden. (Siehe Abbildung 2F & G)
8. Repräsentative Ergebnisse

Abbildung 1. Benötigte Materialien: ein. feinen Pinsel Stift, b. kleinen Platz gebrochenen Gläsern Container, c. 22 x 50 mm Deckglas, d. Objektträger, E. Doppel-Klebeband, f. Trockenhefe Pulver in Teströhrchen mit Löchern auf dem Deckel, g. HefeGranulat für Fliegenfischer Wartung, h verwendet. fliegen Lebensmittel Fläschchen, i. eine Hälfte einer Pinzette für dechorionate Embryonen verwendet, j. ein Paar Pinzette, k. Heptan Leim Flüssigkeitsbehälter (Messkolben).
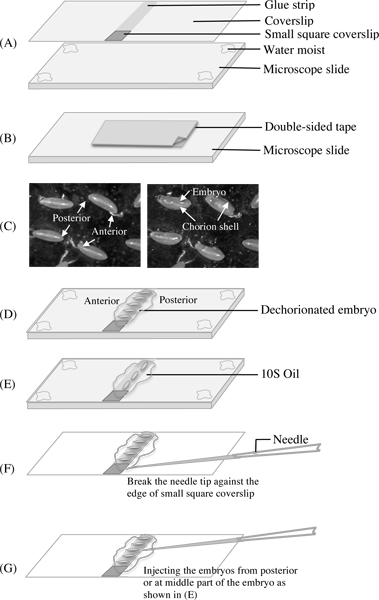
Abbildung 2. Die Diagramme zeigen die Vorbereitung der Deckgläser und Objektträger in Schritt 4, Embryo dechorionation in Schritt 5 und Nadel Vorbereitungen für die Mikroinjektion in Schritt 7. Ein. Das obere Bild zeigt ein Deckglas mit einem Streifen aus Heptan Kleber in der Mitte durch und einem kleinen Platz an einem gebrochenen Deckglas geklebt zu einem Ende. Das untere Bild zeigt einen Mikroskop-Objektträger mit einer dünnen Schicht von Wasser an seinen vier Ecken, um ein Deckglas zu halten. Der Grund für die Verwendung einer Folie auf das Deckglas zu halten ist, um etwa die gleiche Brennweite wie die gefunden wird, wenn Sie doppelseitiges Klebeband auf den Folien haben und somit die Vermeidung der Neuausrichtung des Mikroskops während Sie are Sezieren und die Übertragung der Embryonen zwischen Band und Deckglas. B. Eine Folie mit einer kurzen Länge von doppelseitigen Klebeband vor Abziehen seine Deckblätter für dechorionating den Embryo. C angewandt. Das Bild links zeigt Embryonen mit intakter Chorion Schalen mit gekennzeichneten vorderen und hinteren Ende, das Bild rechts zeigt die Embryonen in den zerbrochenen Schalen Chorion, bevor sie auf das Deckglas mit dem Klebestreifen übertragen D & E-Diagramme zeigen zwei.. Möglichkeiten für die Übertragung, Platzieren und Ausrichten der dechorionated Embryonen auf Klebestreifen. Die Embryonen wurden von 10S-Öl nach einer angemessenen Frist Austrocknung abgedeckt. F & G-Diagramme zeigen, wie man die Spitze der Nadel und positionieren Sie es so wie zu injizieren zu öffnen.
Einzel-oder Zeitraffer-Aufnahmen aus den oben beschriebenen Experimenten können direkt analysiert werden mit Leica-Software gespeichert oder in. TIF-Dateien als offenes FOrmat zur weiteren Bearbeitung oder Quantifizierung Analysen mit anderen gängigen Bild-Analyse-Programme wie Image J, Photoshop und MetaMorph usw. Zwei Beispiele zur Illustration werden im Folgenden erörtert:
Beispiel 1: Ein Zeitraffer-Film (Abbildung 3) zeigt die dynamische Kinetochor Rekrutierung von GFP-Cdc20-und Chromosomen-Bewegung in lebenden Drosophila-Syncytial-Embryonen. Die Region of Interest aus original Zeitraffer-Sequenz Bildern war bestimmt / herausgegeben und automatisierte Batch-Software konvertiert mit Hilfe von Photoshop. Der Film wurde mithilfe von QuickTime-Software.
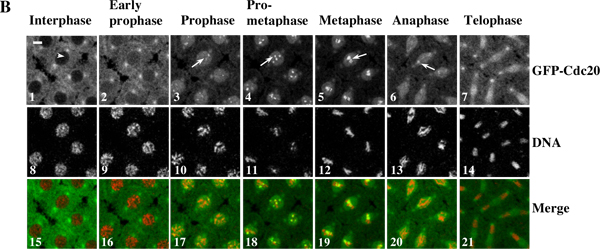
Abbildung 3. Ein Zeitraffer-Film zeigt die dynamische Kinetochor Rekrutierung von GFP-Cdc20-und Chromosomen-Bewegung in lebenden Drosophila-Syncytial-Embryonen. (A) Zeitraffer-Bilder wurden von einer transgenen Syncytial Embryo entnommen, die GFP-Cdc20 (in grün)und RFP-Histon-2B (in rot) und Fusionsproteine wurden mit einem Leica TCS SP2 konfokalen System bei 18 ° C während der Kernteilung Zyklen 7-8. Frames waren alle 10 Sekunden aufgenommen. Der Rahmen mit den Zellen bereits in Prophase wird als Zeitpunkt Null 10 behandelt. Klicken Sie hier, um den Film für 3A ansehen . (B) GFP-Cdc20 kann ohne weiteres auf Prophase und Prometaphase Kinetochoren (B3 & 4, weiße Pfeile) zu beobachten und weiterhin besteht auf Metaphase und Anaphase Kinetochoren (B5 & 6, weiße Pfeile). GFP-Cdc20 wird von Interphasekern (Weißer Pfeil) ausgeschlossen, Eintritt in den Zellkern von der frühen Prophase. Chromatin Morphologien wurden unter Verwendung koexprimierter His2BmRFP als Marker (B8-14). Balken = 5 mm.
Beispiel 2: SAC-Funktionen lassen sich durch die Manipulation der Embryonen durch Mikroinjektion Antikörper, fluoreszenzmarkierten Proteine oder chemica studiert werdenl Verbindungen von Interesse, dass potenziell auslösen SAC. Zum Beispiel Einspritzen Colchicin, um die Mikrotubuli depolymerisieren, so provoziert die SAC wie in 4 10 bezeichnet.

Abbildung 4. Mad2 ist essentiell für Colchicin-SAC aufgerufene Funktion 10. GFP-Cdc20; MAD2 + / +, GFP-Cdc20; MAD2 EY (MAD2 - / - Null-Mutante) und GFP-MAD2; MAD2 EY Embryonen wurden mit Colchicin durch Mikroinjektion behandelt. Zeitraffer-konfokalen Bilder wurden vor (01, 07 & 13) oder nach der Injektion genommen (02-06, Abdeckplatten, 08-12, Mitte Platten; 14-18, Bodenplatten). GFP-Cdc20 (obere und mittlere Panels) oder GFP-Mad2 (unten) Kinetochor Signale wurden als Zellzyklus-Marker verwendet. Top Panel zeigen die Pfeile die verhafteten Kinetochoren in 6.2. Der durch einen Pfeil in 01 gekennzeichnet darauf hinweisen, dass vor Colchizinbehandlung, GFP-CDC20 wird aus dem späten Interphasekern ausgeschlossen. Das mittlere Feld, in Abwesenheit von endogener Mad2, weiterhin GFP-Cdc20-Signale zum Schwingen in und aus dem Kern, und auf und abseits der Kinetochoren, obwohl Zytokinese scheint defekt sind, würde in Mäusen ohne Mikrotubuli zu erwarten, in Gegenwart von Colchicin (durch Pfeile in 07 bis 12) was auf eine nicht SAC-Funktion bei der Verhaftung Zellen als Reaktion auf Colchicin Behandlung. Die Trennung von Tochterkern scheiterte in Bild 10. Unteres Feld, zeigen Pfeilspitzen in 14-18 verhaftet Kinetochoren mit den kumulierten GFP-Fusionsproteine Mad2, um die funktionelle GFP-Mad2 in die Rettung SAC Defekt Phänotyp in Mad2 mutierten Embryo vorschlagen. Arrowhead in 13 zeigt GFP-Mad2 Anreicherung in einem späten Interphasekern. Bar = 5mm. Die Embryonen wurden mit ~ 1% Ei Volumen eines 100mg/ml Colchicin Stammlösung in 1 x PBS mikroinjiziert.
Diskussion
Das hier beschriebene Protokoll ist ein generisches Verfahren zur Abbildung von fliegen-Syncytial-Embryonen mit einem Leica TCS SP2 konfokalen Laser Scanning Mikroskop und kann modifiziert werden, um anderen Mikroskop-Systeme angepasst werden und kann auch so angepasst, andere Genfunktionen mit Drosophila-Syncytial-Embryonen zu untersuchen. Wir haben dieses Protokoll verwendet, um viele Aspekte der Spindel Checkpoint-, Protein-und Protein-Dynamik Proteolyse unter Verwendung von transgenen Fliegen oder polyklonale Antikörper, das Protein-Lokalisierung in lebenden oder fixierten Proben 4,6,12-14 visualisieren zu studieren.
Am einfachsten ist es, um die Fliegen in frisch essen fliegen Fläschchen halten bei der Erhebung kleinen Zahlen (~ 10 - 100) von Eiern. Dies reduziert den Aufwand zu machen und die Vorbereitung zusätzlicher Apfelsaft Agarplatten und Eiersammlung Kammern wie auch in anderen Publikationen 15,16 beschrieben. Die Zugabe von einem kleinen Stück Defekten Deckglas Glas an einem Ende des Klebestreifens auf dem Deckglas macht es viel leichter, um die Nadel zu öffnen und bestimmt die Einspritzmenge durch Einstellen der Mikroinjektion Systemeinstellungen, während die Nadel in der 10S Öl eingetaucht ist. Der Grad der Austrocknung des Embryos ist für den Erfolg der Injektion in der Vermeidung von Leckagen und die Aufrechterhaltung der Lebensfähigkeit Embryonen besonders für jene Experimente, die einen langen Zeitraum erfordern oder beim Anheben Transformanten nach der Injektion wichtig. Jedoch gibt es keine goldene Regel für wie lange Austrocknung erforderlich ist. Dies variiert von Versuch zu Versuch und hängt von der Menge der Lösung injiziert und der Feuchtigkeit der Arbeitsumgebung.
Die Funktionen eines bestimmten Protein von Interesse kann durch Mikroinjektion spezifischen Protein-Hemmer, mono-oder poly-klonale Antikörper gegen ein bestimmtes Protein, Boten-RNA oder fluoreszenzmarkierte Peptide unter Wildtyp oder genetische Mutation Hintergründe manipuliert werden. Viele dieser Mutante Linien oder GFP-markierten transgenen Linien sind öffentlich avht verfügbar ab Lager Drosophila-Zentren und die meisten von ihnen basieren auf FlyBase (aufgelistet http://flybase.org/~~V ) und kann für Online durchsucht werden.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Dieses Protokoll wurde im Rahmen eines Wellcome Trust Zuschuss entwickelt. Wir danken Frau Maureen Sinclair für die Pflege der Bestände und der Vorbereitung Fliege die Fliege Nahrung im Laufe der Jahre. Wir möchten auch an Herrn Michael Aitchison für seine Hilfe und technische Unterstützung bei der Entwicklung dieses Protokolls zu danken.
Materialien
Wesentliche Geräte und Reagenzien:
Konfokale Abbildungssystem: Abbildungssystem nach diesem Protokoll beschrieben ist ein Leica TCS SP2 konfokaler invertierten Mikroskop-System. Das beschriebene Verfahren ist auch geeignet vielleicht mit leichten Modifikationen für andere bildgebende Systeme.
Seziermikroskop: Wir verwenden eine Olympus SZX7 mit DF PLAPO 1X-4-Objektiv.
Needle Puller: Flaming / braun Feinpipettenziehvorrichtung (von Sutter, Modell: P-97).
Mikroinjektion System: Eine Mikroinjektion Eppendorf-System beschrieben, aber jede andere geeignete System verwendet werden kann.
Fly Lebensmittel Distributor: Jencons Scientific Ltd Schlauchpumpe.
Reagenzien:
| Name | Company | Catalog Number | Comments |
| Zutaten | Gewichts | Ressourcen | Los Nr. |
| Maismehl | 100,0 g | SUMA, UK | |
| Brauner Zucker | 50,0 g | Billingtons, UK | |
| Trockenhefe | 25,0 g | DCL HEFE Ltd UK | |
| Agar | 12.5g | Fisher Scientific | 106556 |
| Sorbinsäure | 0,4 g | BDH, VWR International Ltd UK | 8829310 |
| Benzoesäure | 2.9g | Fisher Scientific | 1019599 |
| Nipagin (Methyl-4-Hydro xybenzoate) | 0,9 g | BDH, VWR International Ltd UK | K35969015 |
| H 2 O bis zu 1 l | |||
Holocarbon 700 und 27 Ölen von Sigma bezogen.
Trockenhefe: Thomas Allison, UK.
Vorbereiten des Heptan Leim: Nehmen Sie etwa 1,5 Meter von doppelseitigen Klebeband, steckte es in einen 15ml Falcon-Röhrchen mit 5 ml Heptan und drehen für 3-5 Stunden oder über Nacht. Nach dieser Zeit in 4 gleiche Aliquots in 1,5 ml Eppendorf-Zentrifugenröhrchen aufgeteilt und Spin für 5 min bei hoher Geschwindigkeit in einer Tischzentrifuge, um die Verunreinigungen zu entfernen. Lagern Sie den Leim Heptan-Lösung in einem 10 ml-Messkolben und halten für den Einsatz. Der Klebstoff Stärke wird je nach der Konzentration und die Mengen des verwendeten Klebers variieren. Normalerweise produziert der dünneren Leim weniger verrauschten Hintergrund, wenn sie von konfokalen Mikroskop gescannt.
- Deckglas: BDH, VWR International Ltd UK
- Objektträger: BDH, VWR International Ltd UK
- Silikonisierte Glaskapillaren: GC-100-10, Harvard
- Feine Ladetipp: 20 &mgr; Eppendorf Menge: W215818J
- Pinzette
- Feine Pinsel Stift
Referenzen
- Holland, A. J., Cleveland, D. W. Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis. Nat. Rev. Mol. Cell Biol. 10, 478-4787 (2009).
- Zekanowski, C., Wojda, U. Aneuploidy, chromosomal missegregation, and cell cycle reentry in Alzheimer's disease. Acta Neurobiol. Exp. (Wars). 69, 232-253 (2009).
- Buffin, E., Emre, D., Karess, R. E. Flies without a spindle checkpoint. Nat. Cell Biol. 9, 565-572 (2007).
- Tang, Z., Shu, H., Oncel, D., Chen, S., Yu, H. Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint. Mol. Cell. 16, 387-397 (2004).
- Huang, J., Raff, J. W. The disappearance of cyclin B at the end of mitosis is regulated spatially in Drosophila cells. EMBO Journal. 18, 2184-2195 (1999).
- Xia, G. Conformation-specific binding of p31(comet) antagonizes the function of Mad2 in the spindle checkpoint. Embo. J. 23, 3133-3143 (2004).
- Lorca, T. Fizzy is required for activation of the APC/cyclosome in Xenopus egg extracts. Embo. J. 17, 3565-3575 (1998).
- Howell, B. J. Cytoplasmic dynein/dynactin drives kinetochore protein transport to the spindle poles and has a role in mitotic spindle checkpoint inactivation. J. Cell Biol. 155, 1159-1172 (2001).
- Foe, V. E., Alberts, B. M. Studies of nuclear and cytoplasmic behaviour during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis. Journal of cell science. 61, 31-70 (1983).
- Li, D., Morley, G., Whitaker, M., Huang, J. Y. Recruitment of Cdc20 to the kinetochore requires BubR1 but not Mad2 in Drosophila melanogaster. Mol. Cell Biol. 30, 3384-3395 (2010).
- Karess, R. E., Glover, D. P element mediated germ line transformation of Drosophila. DNA cloning: A practical approach. 2, 121-141 (1985).
- Wakefield, J. G., Huang, J. Y., Raff, J. W. Centrosomes have a role in regulating the destruction of cyclin B in early Drosophila embryos. Current Biology. 10, 1367-1370 (2000).
- Huang, J. Y., Raff, J. W. The dynamic localisation of the Drosophila APC/C: evidence for the existence of multiple complexes that perform distinct functions and are differentially localised. Journal of Cell Science. 115, 2847-2856 (2002).
- Raff, J. W., Jeffers, K., Huang, J. Y. The roles of Fzy/Cdc20 and Fzr/Cdh1 in regulating the destruction of cyclin B in space and time. Journal of Cell Biology. 157, 1139-1149 (2002).
- Brust-Mascher, I., Scholey, J. M. Microinjection Techniques for Studying Mitosis in the Drosophila melanogaster Syncytial Embryo. J. Vis. Exp. (31), e1382 (2009).
- Figard, L., Sokac, A. M. Imaging Cell Shape Change in Living Drosophila Embryos. J. Vis. Exp. (49), e2503 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten