Method Article
ホールマウントマッスル分析による再現性のあるマウスの坐骨神経クラッシュと再生のその後の評価
要約
本報告では、マウス坐骨神経を粉砕する方法を説明します。このメソッドは、容易に利用可能な止血鉗子を使用して、簡単かつ再現性を完全に坐骨神経のときめきを生成します。さらに、坐骨神経挫滅後の神経再生の解析に適した筋肉全体のマウントを準備する方法について説明します。
要約
末梢神経系(PNS)の再生が広く、両方のヒトの疾患との関連性について検討されており、それによっておそらくCNS再生1の障害を照らすPNSニューロンによってマウントされた堅牢な回生応答を理解する。坐骨神経のときめき(軸索断裂)は、げっ歯類の2の末梢神経損傷の最も一般的なモデルの一つです。その再生が3,4に最適ですので、破砕の割り込みはすべての軸索がシュワン細胞基底層は保持されます。これは研究者が正確にシュワン細胞と基底層4の両方と相互作用する軸索成長の能力を研究することができます。ラットは、一般的に実験的な神経の粉砕のための好ましい動物モデルをされている。彼らは広く入手可能であり、その病変坐骨神経は、ヒトの神経病変5,4の合理的な近似値を提供しています。ラットの神経よりもサイズが小さくても、マウスの神経は、多くの類似した性質を持っています。最も重要なのはしかし、覚書Eモデルがあるためトランスジェニック系統の幅広い可用性、ますます貴重なものになりまし神経再生6、7の重要な個々の分子の詳細な解剖を可能にします。前の調査官は、単純な直角鉗子、チルド鉗子、止血鉗子、血管クランプ、および治験責任医師に設計されたクランプ8,9,10,11,12含む神経クラッシュやけがを生成するために複数のメソッドを使用しています。捜査官はまた、縫合糸、炭素粒子と蛍光ビーズ13,14,1含む損傷部位のマーキングの様々な方法を使用しています。我々は、クラッシュサイトのマーキングを正確かつ永続的な細かい止血鉗子とそれに続く炭素ときめきサイトマーキングを使用して再現性を完全に坐骨神経のときめきを得るための手法を説明します。坐骨神経挫滅手順の我々の記述の一部として、我々はまた我々はその後再生を定量化するために使用するマウント筋肉全体の比較的単純な方法が含まれている。
プロトコル
1。動物の科目
1.1。治療
- すべての動物の手順は、痛みや不快感を最小限に抑えるためにとられた措置で、地元の金融機関の動物のケアと倫理委員会の承認を得て衛生ガイドラインの使用と委員会と国立研究所に従って実行する必要があります。
- 私たちのマウスは、給餌マウス飼料および水を自由に摂取しながら、12時間逆明暗サイクルで温度制御された条件下で飼育した。
- 坐骨神経のときめきが実行されたときに大人の再生の研究のために、マウスは生後少なくとも6週間である必要があります。この年齢はpolyneural神経筋接合部の剪定が行われた時間を超えています。
- これらの実験では、チャールズリバーから取得した6から8週齢のC57BL / 6マウスを使用していました。坐骨神経挫滅後の再生を比較するとき(すなわち、軸索の成長率)軸索再生の違いはないされているように、マウスの系統は、同じでなければなりません15,16異なる近交系間でED。遺伝子操作マウスを使用する場合は、同腹のコントロールが最も適しています。
1.2。手術の準備
- 動物は、腹腔内注射によりケタミン(100 mg / kg)及びキシラジン(10 mg / kg)のカクテルを使用して、手術のために深く麻酔をかけています。各動物はまた、手術後の痛みを最小限に抑えるためにメロキシカムの皮下注射(10 mg / kg体重)を受け取ります。
- 両方の後半部は、慎重に手術のバリカン(Roboz、RC-5903)を使用して脱毛がNairさんの脱毛クリーム(地元の薬局で発見)で完了します剃られています。
- 皮膚は滅菌綿先端のアプリケーターとbetadine外科スクラブ(フィッシャーサイエンティフィック、19066452)を使用して清めます。
- 眼軟膏(フィッシャーサイエンティフィック、19082795)を滅菌綿先端のアプリケーターを使用して、目に適用されます。
- マウスは予熱homeotに配置されている下で、クリーンなステンレス鋼プレート上に配置されているhermicブランケットシステム(ハーバード装置、507222F)。動物の温度は37℃に維持する。
- すべての手足は、膝関節は、体(図1、パネルA)と直角を作ること対称ので、後肢を配置するために取られた心配で、下にテープされています。
- 手術野を無菌ドレープで覆われています。全ての楽器は、オートクレーブまたはホットビーズ滅菌(ファイン科学ツール、18000から45)と、外科医は、マスク、ガウン、滅菌手袋を身に着けていることにより滅菌されています。
2。再現性の坐骨神経クラッシュ
- 調製後、正中線(図1)の両端の半円形の切開は、皮膚で作られています。肌を穏やかに、基礎となる筋肉から解剖し、手順の実行中に邪魔を維持する上に折り畳まれています。それは手順の間に0.1 mLの滅菌生理食塩水(ホスピーラ、0409-4888-20)のアプリケーションを使用して湿った保たれます。
- 大殿筋と上腕二頭筋femoriの前頭部との間の筋膜面を開くsは坐骨神経(図1、パネルA)を明らかにする。外科手術を制御するには、反対側の坐骨神経を露出し、動員されたが、そのままにする必要があります。臀部の筋肉が再度反対し、6から0まで編んだシルク、非吸収性縫合糸(Roboz、SUT-1073から1011)を用いて縫合されています。
- 実験的な坐骨神経は、その後可視化(図1、パネルB)を容易にする代わりに、トラクターで、同じ方法で公開されています。リトラクターは、使用前に滅菌されています。
注:トラクターシステムが市販されているが、彼 らはしばしば非常に高価です。我々は安価なハードウェアの供給と虫ピン( 材料の項を参照)を使用して、十分なリトラクターシステムを作ることができました。 - 坐骨神経は、その後静かに虹彩切除術のはさみを使用して、周囲の結合組織から解放されます。
- 罰金45分の5(ファイン科学ツール、11251から35)鉗子を用いて、神経が超微細止血鉗子(ファイン科学トゥーの下部顎に置かれlsは、13020から12)。 3束を順次ません互いの上部(図1、はめ込みB)に、整列されます。止血鉗子は、その先端から1.5 mmのマークが刻まれています。坐骨の外側の部分がクラッシュする前に、このマークの付いた行に配置されます。これは、均一な幅の破砕を保証し、破砕力により平坦化されたときに神経が止血鉗子のジョーを越えないことに注意してください。神経が鉗子先端部を超えた場合、神経は部分的にしか粉砕されます。
- 坐骨神経の経路を近似するスレッドによって測定されたクラッシュは、第3趾から45ミリメートルで、神経に垂直にされています。神経は、止血鉗子の3回のクリックで15秒に一度粉砕されています。ケアは、神経を伸ばすないように注意されています。 hemostatsが再オープンされている場合、全体の神経はクラッシュサイトで半透明でなければなりません。
- で事前に浸漬された止血鉗子の番目のペア(最初と同じ)粉末活性炭(フィッシャーサイエンティフィック、C272-500)は、クラッシュサイトをマークするために使用されています。神経は、3回のクリックで15秒間同じクラッシュサイトで粉砕されています。マーキング、炭素は初期ときめきの境界を越えないように注意してください。挫滅部位のマーキング精密が要求される場合、これは特に重要です。使用する前に、カーボン粉末を2時間UV光に曝露することによって滅菌され、その後無菌テクニックを使用して処理されます。
- 炭素に鉗子をプレディップが手術部位に広範囲の炭素を排除するために、鉗子をシャットダウンします(ただし、クリックしない)をそっと閉じて、粉末状の炭素で開かれている、とhemostatsの外側の炭素は、滅菌ガーゼを使用してオフに消去され。鉗子は、破砕面が均一に粉末状炭素でコーティングされていることを確認するには、少なくとも3倍の倍率で確認しています。必要であれば、それらは再浸漬し、消去されます。
- 臀部の筋肉を再反対し、反対側と同じ方法で縫合されています。
- 最後に、皮膚切開は9ミリメートル反射クリップ(; 500345 APPLIER世界の精密機器、500346)を使用して閉じます。 9ミリメートル反射クリップが移動を制限することが判明した場合、より小さい反射クリップまたは6から0縫合糸(Roboz、SUT-1073から1011)が代わりに使用することができます。
3。術後のケア
- 彼らは運動の兆しを見せてまで、この手順の後、動物は37°Cで加熱パッド上に配置されています。
- 彼らはその後、水と食べ物はヒドロゲルと濡れた食品の形で床に容易にアクセス可能である自分のホームケージに戻されます。
4。セミ薄型準備
- ペントバルビタールの過剰摂取(300 mg / kg)を以下の足の筋肉は、坐骨神経*を公開するために削除されます。その場に残っている神経で、後四半部は、2%パラホルムアルデヒドで30分間氷上に0.1 Mリン酸緩衝液で2%グルタルアルデヒドに浸漬されています。
*全体のマウントの筋肉の準備を完了した場合、筋肉が収穫です。坐骨神経を露出させる前にED。 - 神経は慎重に近位端のみを扱うように注意注意して、削除されます。その後、神経は3つの追加の時間が同じ固定のポスト固定されています。
- 固定した後に神経を0.1Mリン酸緩衝液で3回リンスしています。
- 神経は一時間0.1 Mリン酸緩衝液で2%四酸化オスミウムに浸漬されています。
- 神経は、ますます濃縮されたエタノールで順次浸漬(50%、70%、80%、95%、100%、100%、100%)で脱水します。それぞれの浸漬は15分です。
- 脱水神経は、3分ごとに、プロピレンオキシドで二度インキュベートされる。
- その後、神経はプロピレンオキシドの1:1混合物に浸漬し、少なくとも6時間(通常は一晩)812を埋め込むことができます。
- その後、神経はプロピレンオキシドの2:1混合物に浸漬し、一晩812を埋め込む。
- 最後に、神経が6時間の純粋な埋め込み812に浸漬し、その後、適切な金型とBAに埋め込まれた48時間60℃でヒツジシラミバエ。
- 1.0μm以下のセクションでは、トルイジンブルーのガラスナイフと染色しUltracut UCTウルトラミクロトーム(ライカ)を使用して、クラッシュサイトから設定距離で遠位の神経断端からカットされています。薄切片は、電子顕微鏡による微細構造の検査のために製造することができる。
5。全体のマウント筋肉の準備
- 最初のマウスはペントバルビタールの過剰摂取(300 mg / kg体重)で犠牲にされており、後肢を膝に削除されます。
- 後肢の四筋は分析のために削除されます。前脛骨筋(TA)、長指伸(EDL)、ヒラメ筋、長腓骨と。
- すべての筋肉は慎重に解剖を介して除去と黒sylgard(フィッシャーサイエンティフィック、NC9492579)コートしたディッシュに彼らの結合組織を介して固定されます。彼らは、PBSでリンスし、30分間4%パラホルムアルデヒド中で固定されています。
- TAは、その後10月(フィッシャーサイエンティフィック、14-3に埋め込まれた、PBSでリンスする73から65)、かつ迅速にアセトンとドライアイス浴中で凍結した。
- それは-80°Cで全体のマウントの準備が失敗した場合の薄い切片に保存されます。一般的には、TAは適切な全体のマウントの厚すぎる。
- EDL、ヒラメ筋、および長腓骨は、PBSで3×10分間すすぎ、0.1 Mグリシン*(フィッシャーサイエンティフィック、AC12007-0010、PBSで希釈)に配置されている30分間、再度PBSで3×10分間洗浄した。彼らはその後、-20℃で正確に 5分間氷冷した100%メタノール°Cで急冷し、PBSで3×10分間洗浄し、α-ブンガロトキシン(PBSで1:200希釈)を30分間蛍光コンジュゲートを浴びています。筋肉は2%BSA(KPL、50-61-00)、0.2%トリトンX-100(ドットサイエンティフィック株式会社、9002-93-1)で1時間ブロックに続いて、PBSで3×10分間洗浄する同じ2パーセントBSA/0.2%トリトンブロックで希釈した一次抗体のカクテルで、4℃で揺動しながらPBSで*、および一晩インキュベートした。
*㎘ycineおよびブロッキング溶液は、筋肉の収穫と同じ日に行われ、使用前に室温で30-60分間攪拌されています。- 、マウスモノクローナルシナプス小胞マーカー(SV2 DSHB、1:1000に希釈)と、ローダミン共役α、軸索と神経筋シナプスをマークするために、我々は、マウスモノクローナルフィラメントマーカー(1:1000希釈Covance、SMI-312R)の組み合わせを使用-ブンガロトキシン(Sigma-Aldrich社、1:200に希釈)。反応性シュワン細胞をマークするために我々は、ウサギ抗GAP-43(ノーバスバイオ、NB300-143、1/500に希釈)を使用します。一次抗体は、IgG1サブタイプで特定のフルオレセイン結合ヤギ抗マウス二次抗体とDyLight 649結合ロバ抗ウサギ(ジャクソンイムノ、1:200に希釈)で可視化しています。
- 次の日は、筋肉は3×10分間PBSでリンスし、二次抗体でインキュベートした(2%BSA/0.2%トリトンブロッキング溶液)で1:200に希釈されています。彼らはその後PBSに、foで2×10分間洗浄するDAPIで5分浸漬(Invitrogen社、D3571、脱イオン水で300 nMのに希釈)でllowed、別の10分のPBSですすいでください。
- それぞれの筋肉は、その後黒sylgard(フィッシャーサイエンティフィック、NC9492579)コーティングされたペトリ皿に解剖されています。最初に腱は筋肉に彼らの挿入ポイントで除去され、その後、筋肉が内側筋線維(図3、パネルAC)を離れて剥離によって薄くされています。ケアは、エンドプレートのバンド(図3、パネルDF)を含む筋肉の外側表面を維持するために取られます。その結果筋肉はvectashield(ベクターラボラトリーズ、H-1000)と明確なマニキュアで密封し22×40mmのカバーガラス(フィッシャーサイエンティフィック、12から548-5C)と(フィッシャーサイエンティフィック、12-550-15)に加えてスライド上にマウントされている両側。適切に終バンドの接点はカバースリップのスライドにマウントされます。
6。再生を測定する
- 再生はすべての3つの筋肉(腓骨、EDL、およびヒラメ筋)を推定することができる。私たちはしばしばEX14日間の神経挫滅後のアミン再生、NMJsのかなりの割合が再び支配されている時刻。両方とも、以前と後でポイントが求められている科学的な質問に応じて、また適当である。それぞれの筋肉では、全体のエンドプレートのバンドの再神経支配を検討されています。のみEN面の表面NMJsは採点されます。この方法では、筋ごとに少なくとも200 NMJsをすばやく調べることができます。
- 筋肉再神経支配を獲得するために、我々は "再神経支配比"を決定します。分母は、α-ブンガロトキシン結合とシュワン細胞のGAP-43免疫反応性で標識されたとして除神経筋接合部の数です。 neurofilament/SV2免疫反応によって標識としての分子は、再神経支配NMJsの数です。必要に応じて、NMJsのいずれかの一部(SV2によるα-ブンガロトキシンの不完全なカバレッジ)または完全(SV2によるα-ブンガロトキシンの完全なカバレッジ)の再支配のように分類されることがあります。再神経支配と神経除去NMJsの例は、図3、パネルGとHを参照してください。
7。代表的な結果

図1 神経クラッシュに重要な後肢の解剖学の模式図 。A.半円形の皮膚切開は、基礎となる筋肉を明らかになされている。B.臀部の筋肉が(上記のステップ2.4)分離し、坐骨神経が明らかにされている。矢印は、おおよそのクラッシュサイトを表します。トラクターの配置は一般的なガイドとして示されており、クラッシュのために止血鉗子の坐骨とアプローチの可視化を容易にするために各手術時に調整されているB(挿入図)。ちょうどクラッシュする前に、止血鉗子の下顎に坐骨の配置は、 (上記のステップ2.5)。別の束は、クラッシュ時にはなく、垂直に彼らが水平に隣接していることを証明するために標識されたが、されています。ただし3 fasciclesが、この図ではラベルが付いています、一つは、第4分冊、腓骨の関節枝が表示されることがあります。坐骨神経の分岐パターンの詳細な解剖図は、ときめきポイントへの遠束については、 ラット 、図188 17 のグリーンの解剖学を参照してください。
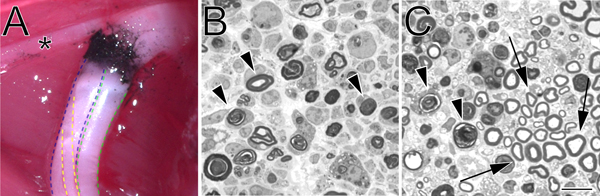
図2砕いた坐骨神経のin situとトルイジンブルー染色、半薄切片の炭素-マーククラッシュサイト。A.その場で破砕サイト(左後肢)の例を示します。カーボンブラックは、クラッシュサイトを表します。アスタリスクは、太ももの筋肉をinnervatesやときめき手術中に便利なランドマークとして脛骨神経の枝をマークします。坐骨神経の脛骨部門は青、緑の腓骨、黄色の腹に概説されています。止血力を使用して実行を完全にクラッシュを示すB.セミ薄いセクションでは、psの。角度鉗子を使用して実行不完全なクラッシュを示すC.セミ薄いセクションを参照してください。画像を変性ミエリンプロファイルの両方に矢印が付いています。パネルCの矢印に保存されミエリンプロファイルと惜しま軸索のクラスタの例をマークします。スケールバーは10μmである。
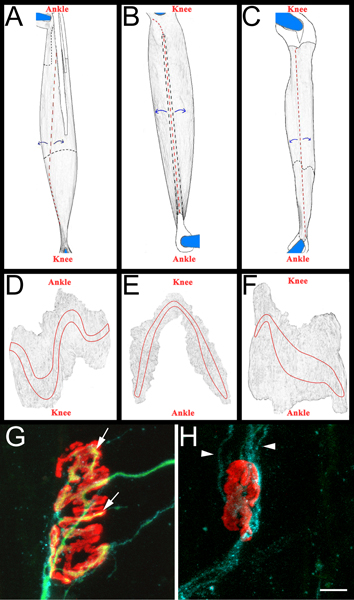
図3ホールマウント筋肉図と代表的なNMJs AC:。後肢から除去した後、EDLの画像()、長腓骨(B)、およびヒラメ筋(C)筋肉をレンダリング。示すように筋肉が右後肢からです。膝と足首の解剖学の向きは、参考のために含まれています。筋肉の上に配置したときに腱は白色と黒の実線に概説されています。彼らは筋肉の下に拡張するとき、それらは黒い破線で概説されています。カットは赤い点線で示されています。筋肉は、青色の矢印で示すように、カット部位から剥離し、その後薄くされています。間伐した後、筋肉が固定された腱のまま何の周りに切断することによってピンから分離されているDFは:結合組織と間伐の後続の除去後に全体のマウントの筋肉からの画像をレンダリング。エンドプレートのバンドは、各筋肉に概説されているGH:14日坐骨神経挫滅後のヒラメ筋全体のマウントは、再神経支配(G)と除神経(H)神経筋接合部を示す。セクション5.5.1で説明したように、これらのパネル、NMJs、軸索とシュワン細胞で可視化しています。アセチルコリン受容体は青、赤、軸索緑、シュワン細胞のプロセスです。パネルGで、矢印は軸索によって再支配されていますNMJの領域を示しています。パネルHの矢印でGAP-43陽性のシュワン細胞プロセスを示しています。軸索のないことに注意してください。スケールバーは10μmである。
ディスカッション
我々は、クラッシュサイトの正確なマーキングを確実に完全に坐骨神経のときめきを取得する方法を提案した。前述のように、坐骨神経のときめきは、マウスとラットの末梢神経損傷の一般的なモデルです。ときめきの各メソッドは、その長所と短所がありますが、我々は、このメソッドは、簡単に特殊な装置(例えば特殊なクランプ、等)の最小値でマークされた完全なクラッシュを作り出しました。
クラッシュ·メソッド
マウス坐骨神経の粉砕に使用される最も一般的な機器は、第5番斜めピンセットです。それがこの方法を使用して、完全なクラッシュを得ることが可能であるが、我々はこの楽器は、特に新規ユーザーの手の中に、変数クラッシュ(神経を引き裂く免れた軸索または大きすぎるを残してあまりにも少ない力)を生成することがわかった。
ときめきを生成するために使用される他のあまり一般的方法は、小さな動脈瘤クリップ、液体窒素で冷やし鉗子、およびspeciallを含むyが製造され、キャリブレーション、非鋸歯状のクランプ9,12,5,7。これらの機器の各々は、確実に、完全なクラッシュを生成することができます。楽器の入手が容易であるため我々は止血鉗子を選択し、信頼性のあるクラッシュを生成し、クラッシュサイトのマーキングをクリアが可能になります。止血鉗子の欠点の一つは、我々が容易に破砕時に発生する力を測定することができないということです。しかし、一度テストし、止血鉗子は、確実に、完全なクラッシュが生成されますと、鉗子が破損した場合、簡単に同一の鉗子で置き換えることができます。
どんなにおそらくクラッシュ手順の最も重要な部分は神経挫滅の完全性を検証することで、クラッシュを実行するために選択された方法。これは小説のユーザーの手の中には特に重要です。損傷部位から遠位の神経の半薄い解析(図2)これを行うには簡単な方法を提供し、完全にクラッシュします(図2、パネルB)または不完全な破砕(図2、パネルC)を明らかにすることができます。
最後の考慮粉砕方法では、クラッシュの期間です。我々は有髄線維の神経や保存の半透明に違いがないと、15秒からの総破砕時間の60秒に粉砕期間をテストされています。これは、ブリッジと宝石商の鉗子を用いたラット坐骨神経における15から60秒間の押しつぶすを比較した同僚の観測と一致していると別のクラッシュの間には有意な形態的、組織学的、電気生理学的、または機能的な違いは18持続時間が見つかりました。しかし、大幅にシュワン細胞の神経内膜を劣化させるより長い粉砕時間や潰しは速度および/または再生の成功を変更します。
マーキング方法
粉末状の炭素以外のマーキングクラッシュサイトの2つの実行可能な方法は、10から0坐骨神経13,19の神経上膜を介して縫合し、Molecular Probes社によって生成されたFluoSpheres、ユージーン、OR 1です。 supの。 10から0縫合糸は肉眼的にクラッシュサイトにマークを付けますが、炭素がマーキングよりも高い顕微スキルのレベル、およびクラッシュサイトの境界のマーキングそれほど正確で縫合の結果、アプリケーション内のばらつきを必要とします。再生の速度を検討する際、クラッシュサイトの境界が正確に以下の損傷をマークする必要があります。我々はFluoSpheresを検討されていませんが、彼らはマーキングクラッシュサイトの精度と永続性のための基準を満たしています。 YFPマウス系統1の再生-in vivoでのイメージング時、彼らは特に便利です。私たちの目的のために我々は簡単に、後続の半薄いまたは電子顕微鏡の評価で見られている追加の利点を、適切かつ安価なマーキングカーボンを発見しました。さらに、炭素マーキングは長い期間の実験に適して少なくとも6週間持続することを発見した。
クラッシュ後における地域再生の解析
完全investigaポスト粉砕再生が5,16、機能的電気生理学的、および形態学的評価を組み合わせたものです。のる再生後に形態学的評価は、おそらく最も一般的です。これらの評価は、成長の遅延、軸索の成長率、および神経再生16の特異性を評価するものに分けることができます。本報告では、我々はすぐに形態学的再生(図3)を評価するために使用することができます全体のマウントの筋肉の手順を紹介しました。この分析では、α-ブンガロトキシンとシュワン細胞GAP-43で標識された除神経NMJsは、定量化し、ニューロフィラメント、SV2、およびα-ブンガロトキシンで標識されたとして再神経支配の接合と比較されます。 GAP-43は、脱神経後のシュワン細胞によって著しくアップレギュレートし、うまく神経筋接合部20で除神経ターミナルシュワン細胞を識別します。 GAP-43は、軸索によって表現されていますが、ニューロフィラメントの併用が容易にシュワン細胞からのGAP-43陽性の軸索を区別します。また、筋肉の奥深くNMJsが容易に抗体(のような小さな分子のα-ブンガロトキシンと比較して)によって標識されない場合がありますので、シュワン細胞のGAP-43免疫反応性は、重要な神経筋接合部の除神経の状態を確認し、除神経NMJsを数えるときに精度が向上します。
このメソッドは、全体を一度に筋終板帯の神経再生の状態を評価するために、シンプルかつ効率的な方法を提供します。他の坐骨神経のときめき2の後に前脛骨筋の再支配に従うことがシュワン細胞の軸索とGFPの急行シアン蛍光タンパク質というあなたの1-CFP(23)/ S100-GFPマウスを使用しています。一つ注意すべき点は、しかし、注意しなければならない。このメソッドは、フィラメントと再神経支配を定量化するSV2免疫反応性に依存しています。それが軸索伸長が妨げられてもよいが、SV2の後続の式が21日遅れるかもしれない可能性があります。したがって、いくつかの実験では、その遅延再生を確認することが重要であるとdはありません観測された表現型のSV2(すなわち、プレシナプス分化)アカウントのシナプス発現をelayed。
開示事項
我々は、開示することは何もありません。
謝辞
この作品は、関節リウマチの国立研究所からの筋骨格系疾患のためのペンセンター、賞の数P30AR050950さらに、NIHの助成金K08NS065157(TAFまで)によってサポートされていました、筋骨格系と皮膚疾患は、(TAFとSteven S.シェーラー)この作業をサポートしていました。最後に、シュライナーズ小児研究センターのシード資金(TAF)は、この作業をサポートしていました。私たちは、最初に図1のスケッチを製造する彼女の援助全体のマウント手順とエイミーA.キムを示すために博士·ヨンジンの息子に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 名前(説明/数量) | サプライヤー | カタログ番号 | |
| 第0000ブレードミニクリッパー | Roboz | RC-5903 | |
| Nairさんヘアリムーバー(9オンス) | 教会とドワイト株式会社 | N / A | |
| Betadine外科スクラブ(1ガロン) | フィッシャー·サイエンティフィック | 19066452 | |
| 眼軟膏(1オンス) | フィッシャー·サイエンティフィック | 19082795 |
手術のツール:
| 名前(説明/数量) | サプライヤー | カタログ番号 |
| FST 250ホットビーズ滅菌器 | ファイン科学ツール | 18000から45 |
| アイリスはさみ(11センチ) | 世界の精密機器 | 500216 |
| ポッツ·スミスピンセット(ストレート18センチメートル、1x2の歯) | ファイン科学ツール | 11024から18 |
| マクファーソン·Vannasはさみ(5 mmのブレード) | 世界の精密機器 | 14124-G |
| デュモン#5鉗子 - Dumoxel標準的なチップ | ファイン科学ツール | 11252から30 |
| デュモン#45分の5鉗子 - Dumoxel標準的なチップ | ファイン科学ツール | 11251から35 |
| ウルトラファインHemostats(ストレートスムーズ内側の表面) | ファイン科学ツール | 13020から12 |
| 粉末活性炭(500グラム) | フィッシャー·サイエンティフィック | C272-500 |
| C-1ニードル(滅菌、絹、黒、編んだ、とサイズ6から0縫合糸非吸収性、18 "長さ、36のボックス) | Roboz | SUT-1073から1011 |
| 反射クリッププライヤ(9ミリメートルクリップ用) | 世界の精密機器 | 500345 |
| 9ミリメートルステンレス鋼反射クリップ(100/box) | 世界の精密機器 | 500346 |
動物のケア:
| 名前(説明/数量) | サプライヤー | カタログ番号 |
| 0.9%塩化ナトリウム注射液(防腐剤フリー、20 mL)で | ホスピーラ | 0409-4888-20 |
| 柔軟性の高いプローブを用いた完全な恒温動物ブランケットシステム(ミディアム、115 VAC、60 Hz)を | ハーバード装置 | 507222F |
外科Platformとトラクター。
(地元の金物店で購入)
| 名前(説明/) | 量 |
| ステンレス鋼のプラットフォーム(ミルド。〜12 "X12" X1 / 8 ") | 1 |
| ボタンマグネット(例:EclipseのE825) | 3 |
| ステンレスボルト(3 "ロング、ボタンマグネットによって決定される直径) | 3 |
| ステンレスナット(ボルトに合わせてサイズ) | 9 |
| ゴムバンド(ライトテンション) | 3 |
| 虫ピン(両端がフックをフォームにベント) | 3 |
セミ薄く:
| 名前(説明/数量) | サプライヤー</強い> | カタログ番号 |
| パラホルムアルデヒド(1キロ) | Sigma-Aldrich社 | P6148-1KG |
| リン酸ナトリウム二塩基性無水(500グラム、リン酸緩衝液を調製するのに使用) | フィッシャー·サイエンティフィック | S375-500 |
| ナトリウム一塩基性リン酸無水(1キロ、リン酸緩衝液を調製するのに使用) | フィッシャー·サイエンティフィック | AC38987-0010 |
| グルタルアルデヒド(50%、10×10 mL)で | テッド·ペラ社 | 18431 |
| 四酸化オスミウム(4%水溶液、10×10 mL)で | テッド·ペラ社 | 18465 |
| プロピレンオキサイド(450 mL)を | テッド·ペラ社 | 18601 |
| 埋め込み812(キット、ハードブロック/高画像コントラストのために) | 電子顕微鏡学 | 14120 |
| ToluidiNEブルー(25グラム) | テッド·ペラ社 | 19451 |
全体のマウント筋の調製と免疫組織化学:
| 名前(説明/数量) | サプライヤー | カタログ番号 |
| パラホルムアルデヒド(1キロ) | Sigma-Aldrich社 | P6148-1KG |
| リン酸ナトリウム二塩基性無水(500グラム、リン酸緩衝液を調製するのに使用) | フィッシャー·サイエンティフィック | S375-500 |
| ナトリウム一塩基性リン酸無水(1キロ、リン酸緩衝液を調製するのに使用) | フィッシャー·サイエンティフィック | AC38987-0010 |
| 10%BSA希釈液/ブロッキング溶液(200 mL)で | キルケゴール&ペリー·ラボラトリーズ社 | 50-61-00 |
| トリトンX-100(100mL)中 | ドットサイエンティフィック株式会社 | 9002-93-1 |
| グリシン、98%(1キロ) | フィッシャー·サイエンティフィック | AC12007-0010 |
| 組織テッククライオ-OCT化合物(12の場合、4オンスボトル) | フィッシャー·サイエンティフィック | 14-373-65 |
| Sylgardダウ170(2ポンドキット) | フィッシャー·サイエンティフィック | NC9492579 |
| ステンレス鋼の昆虫ピン、サイズ1(100/pkg) | ファイン科学ツール | 26001から40 |
| テトラメチルローダミン-ブンガロトキシン(0.5 mg)を | Sigma-Aldrich社 | T0195-.5MG |
| SMI-312(0.1 mL)をに対するマウスモノクローナル抗体 | Covance | SMI-312R |
| SV2(0.1 mL)をに対するマウスモノクローナル抗体 | 発達研究ハイブリドーマバンク(DSHB) | SV2 |
| ウサギポリGAP-43に対するモノクローナル抗体 | ノーバスバイオ | NB300-143 |
| Flourescein共役ヤギ抗マウスIgG、Fcγ受容サブクラス1特異的 | ジャクソンイムノ | 11 5-095-205 |
| DyLight 649共役ロバ抗ウサギIgG | ジャクソンイムノ | 711-495-152 |
| 4 ',6-ジアミジノ-2 - フェニルインドール(DAPI、dilactate、10 mg)を | インビトロジェン | D3571 |
| Vectashield封入剤(10mL)中 | ベクターラボラトリーズ | H-1000 |
| Superfrostプラス顕微鏡スライド(ホワイト、サイズ:75×25ミリメートル、144のパック) | フィッシャー·サイエンティフィック | 12-550-15 |
| Fisherfinestプレミアムカバーガラス(サイズ:40×22ミリメートル、1オンスのパック)。 | フィッシャー·サイエンティフィック | 12から548-5C |
参考文献
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved