Method Article
Riproducibile nervo sciatico Crush mouse e successiva valutazione da parte della Rigenerazione intera analisi Muscle Monte
In questo articolo
Riepilogo
In questo rapporto si descrive un metodo per schiacciare nervo sciatico mouse. Questo metodo utilizza pinze emostatiche immediatamente disponibili e facilmente riproducibile e produce completo schiacciamento del nervo sciatico. Inoltre, si descrive un metodo per preparare supporti muscolo intero adatti per l'analisi di rigenerazione nervosa dopo schiacciamento del nervo sciatico.
Abstract
Rigenerazione del sistema nervoso periferico (SNP) è ampiamente studiata sia per la sua rilevanza per le malattie umane e comprendere la robusta risposta rigenerativa montato dai neuroni PNS così eventualmente illuminano i fallimenti di rigenerazione CNS 1. Schiacciamento del nervo sciatico (assonotmesi) è uno dei modelli più comuni di lesioni dei nervi periferici nei roditori 2. Frantumazione interrompe tutti gli assoni delle cellule di Schwann, ma lamine basali sono conservati in modo che la rigenerazione è ottimale 3,4. Ciò consente al ricercatore di studiare proprio la capacità di un assone di interagire sia con il cellule di Schwann e lamine basale 4. I ratti sono stati generalmente i modelli animali preferiti per schiacciamento del nervo sperimentale. Essi sono ampiamente disponibili e la loro nervo sciatico lesionato fornisce una ragionevole approssimazione delle lesioni nervose umane 5,4. Anche se di dimensioni inferiori rispetto ratto del nervo, il nervo mouse è dotato di molte qualità simili. Ma, soprattutto, mousmodelli E sono sempre più prezioso per l'ampia disponibilità di linee transgeniche permette ora una dissezione dettagliata delle singole molecole fondamentali per la rigenerazione del nervo 6, 7. Precedenti ricercatori hanno usato diversi metodi per produrre uno schiacciamento del nervo o lesioni anche semplici pinzette angolate, pinze fredde, pinze emostatiche, pinze vascolari, e morsetti investigatore progettati 8,9,10,11,12. Gli investigatori hanno anche utilizzato vari metodi di marcatura del sito procurando lesioni sutura, particelle di carbonio e perline fluorescenti 13,14,1. Descriviamo il nostro metodo per ottenere uno schiacciamento del nervo sciatico riproducibile completa con un accurato e persistente marcatura del crush-sito utilizzando una pinza emostatica e sottili di carbonio conseguente schiacciamento-site marcatura. Come parte della nostra descrizione della procedura crush del nervo sciatico abbiamo anche incluso un metodo relativamente semplice di montare tutto muscoli che usiamo per quantificare successivamente rigenerazione.
Protocollo
1. Soggetti animali
1,1. Trattamento
- Tutte le procedure sugli animali deve essere effettuata con l'approvazione della Animal Care dell'istituzione locale e del comitato etico e in conformità con l'uso e il Comitato e le linee guida dei National Institutes of Health, con le misure adottate per ridurre al minimo il dolore e disagio.
- I nostri topi sono stati alloggiati in condizioni di temperatura controllata di 12 ore di luce di retromarcia e del ciclo di scuro, mentre il mouse alimentato chow e acqua ad libitum.
- Per gli studi di rigenerazione adulto, topi deve essere di almeno 6 settimane di età, quando la calca nervo sciatico viene eseguita. Questa età è oltre il momento in cui la potatura di polyneural giunzioni neuromuscolari luogo.
- In questi esperimenti, abbiamo utilizzato 6-8 settimane vecchio C57BL / 6 topi acquistati presso Charles River. Quando si confrontano rigenerazione dopo schiacciamento del nervo sciatico (es.: tasso di crescita degli assoni) ceppi di topi dovrebbe essere la stessa, come differenze di rigenerazione assonale non sono statied tra i diversi ceppi inbred 15,16. Se topi geneticamente manipolati devono essere utilizzati, controlli cucciolata più appropriate.
1,2. Preparazione chirurgica
- Gli animali sono profondamente anestetizzati per la chirurgia usando un cocktail di ketamina (100 mg / kg) e xilazina (10 mg / kg) tramite iniezione intraperitoneale. Ogni animale riceve anche una iniezione sottocutanea di meloxicam (10 mg / kg) per ridurre al minimo dolore post-operatorio.
- Entrambi i quarti posteriori sono accuratamente rasata utilizzando un tagliaunghie chirurgici (Roboz, RC-5903) e depilazione viene completata la rimozione dei peli con la crema Nair (che si trova in farmacia).
- La pelle è purificata utilizzando applicatori di cotone sterili punta e macchia Betadine chirurgico (Fisher Scientific, 19066452).
- Unguento oftalmico (Fisher Scientific, 19.082.795) viene applicata agli occhi con applicatori cotone sterili punta.
- Il mouse viene posizionato su una piastra pulita acciaio inossidabile, in cui è posto un pre-riscaldato homeotcoperta sistema hermic (Harvard Apparatus, 507222F). Animal temperatura viene mantenuta a 37 ° C.
- Tutti gli arti sono nastrate basso, facendo attenzione a posizionare gli arti posteriori simmetricamente in modo che l'articolazione del ginocchio fa un angolo retto con il corpo (figura 1, pannello A).
- Il campo chirurgico viene coperto con una garza sterile. Tutti gli strumenti sono sterilizzati in autoclave o la sterilizzazione a caldo tallone (strumenti per le scienze Belle, 18000-45) e il chirurgo indossa una maschera, camice e guanti sterili.
2. Crush nervo sciatico riproducibile
- Dopo la preparazione, un semi-circolare incisione attraverso la linea mediana (Figura 1) è realizzato in pelle. La pelle viene delicatamente sezionato dalla muscolatura sottostante, e ripiegato a rimanere fuori strada durante la procedura. Si è tenuto umido utilizzando le applicazioni di 0,1 ml di soluzione salina sterile (Hospira, 0409-4888-20) durante la procedura.
- Apertura del piano fasciale tra il gluteo e la testa anteriore del bicipite femoris rivela il nervo sciatico (figura 1, pannello A). Per un controllo chirurgico, il nervo sciatico controlaterale deve essere esposto e mobilitati, ma ha lasciato intatto. La muscolatura dei glutei viene poi ri-opposizione e suturato con un 6-0 di seta intrecciata, suture non riassorbibili (Roboz, SUT-1073-11).
- Il nervo sciatico sperimentale è quindi esposto nello stesso modo, con divaricatori in atto per facilitare la visualizzazione (Figura 1, pannello B). I divaricatori vengono sterilizzati prima dell'uso.
Nota: Anche se i sistemi retrattori sono disponibili in commercio, sono spesso molto costosi. Siamo stati in grado di fare un soddisfacente sistema divaricatore con forniture hardware economico e perni insetti (vedi sezione Materiali). - Il nervo sciatico è quindi delicatamente liberata dal tessuto connettivo che circonda con le forbici iridectomia.
- Utilizzando un fine 5/45 (Strumenti di scienze Arti, 11251-35) pinza, il nervo è posto sulla parte inferiore della mandibola una pinza emostatica super-sottili (Science troppo benels, 13020-12). I tre fascicoli sono allineati in sequenza, non uno sopra l'altro (figura 1, riquadro B). Le pinze emostatiche sono state incise con un segno a 1.5 mm dalla loro punta. La parte più esterna dello sciatico è posto in linea con questo marchio prima cotta. Questo garantisce una cotta di larghezza uniforme, e che il nervo non si estende oltre le ganasce della pinza emostatica quando appiattito a causa della forza di schiacciamento. Se il nervo si estende oltre la punta della pinza il nervo saranno solo parzialmente schiacciato.
- La compressione è perpendicolare al nervo a 45 mm dal terzo dito, come misurato da un filo che approssima il percorso del nervo sciatico. Il nervo è schiacciato una volta per 15 secondi a 3 scatti delle pinze emostatiche. La cura è attenzione a non allungare il nervo. Quando i hemostats sono riaperti, il nervo intero dovrebbe essere trasparente sul sito cotta.
- Una seconda coppia di pinze emostatiche (identico al primo), che è stato pre-immerso inpolvere di carbonio (Fisher Scientific, C272-500) è usato per marcare il sito cotta. Il nervo è schiacciato sul sito stesso cotta per 15 secondi a 3 scatti. No di carbonio marcatura deve estendersi oltre il confine della cotta iniziale. Ciò è particolarmente importante se contrassegno esatto del sito cotta è richiesto. Prima dell'uso, polvere di carbone viene sterilizzato mediante esposizione a luce UV per due ore, e successivamente viene gestito utilizzando una tecnica sterile.
- Per pre-immergere le pinze di carbonio ma esclude carbonio diffusa sul sito chirurgico, le pinze si aprono in carbonio in polvere, quindi delicatamente chiuso (ma non cliccato) chiusa, e il carbonio all'esterno delle hemostats viene rimosso utilizzando garza sterile . Le pinze vengono controllati in almeno 3x per verificare che le superfici di frantumazione sono uniformemente rivestite di carbonio in polvere. Se necessario, sono ri-immersa e si asciugò.
- La muscolatura gluteo sono ri-oppone e suturata nello stesso modo come il lato controlaterale.
- Infine, l'incisione cutanea viene chiusa con 9 clip mm reflex (Strumenti di precisione del Mondo, 500346; applicatrice: 500345). Se 9 clip mm reflex si trovano a limitare il movimento, più piccole clip reflex o 6-0 punti di sutura (Roboz, SUT-1073-11) può essere utilizzato in sostituzione.
3. Post-operatorio
- Seguendo la procedura, gli animali vengono posti su un cuscinetto riscaldante a 37 ° C finché non mostrano segni di movimento.
- Essi sono poi spostati nella loro gabbia di casa, dove l'acqua e il cibo sono facilmente accessibili sul pavimento, sotto forma di idrogel e cibo umido.
4. Semi-Thin Preparazione
- Dopo una overdose di pentobarbital (300 mg / kg) la muscolatura delle gambe viene rimossa per esporre l'* nervo sciatico. Con il nervo rimane in situ, il quarto posteriore è immerso in paraformaldeide al 2% e il 2% di glutaraldeide in tampone fosfato 0,1 M in ghiaccio per 30 minuti.
* Se completando tutta la preparazione muscolare di montaggio, i muscoli vengono raccolteprima di esporre ed il nervo sciatico. - Il nervo viene accuratamente rimossa, facendo attenzione a gestire solo l'estremità prossimale. Poi il nervo è post-fissa nella stessa fissativo per tre ore aggiuntive.
- Dopo fissazione del nervo viene lavata tre volte in tampone fosfato 0,1 M.
- Il nervo è immerso in tetrossido di osmio 2% in tampone fosfato 0,1 M per un'ora.
- Il nervo è poi disidratato per immersione sequenziale in etanolo sempre più concentrato (50%, 70%, 80%, 95%, 100%, 100%, 100%). Ogni immersione è di 15 minuti.
- Il nervo disidratato viene incubato per due volte in ossido di propilene per tre minuti ciascuno.
- Poi il nervo è immerso in una miscela 1:1 di ossido di propilene e incorporare 812 per almeno 6 ore (di solito una notte).
- Poi il nervo è immerso in una miscela 02:01 di ossido di propilene e incorporare 812 durante la notte.
- Infine, il nervo è immerso in puro Incorporare 812 per sei ore, poi incorporato nello stampo appropriato e baked a 60 ° C per 48 ore.
- 1.0 micron sezioni sono tagliate dal tronco nervo distale ad una distanza impostata dal sito utilizzando uno schiacciamento Ultracut UCT ultramicrotomo (Leica) con un coltello in vetro e colorate con blu di toluidina. Sezioni sottili possono anche essere prodotti per l'esame della ultrastruttura al microscopio elettronico.
5. Tutta Monte preparazione muscolare
- I primi topi vengono sacrificati con una overdose di pentobarbital (300 mg / kg) e gli arti posteriori sono stati rimossi alle ginocchia.
- Quattro muscoli dell'arto posteriore vengono rimossi per l'analisi: il tibiale anteriore (TA), estensore lungo delle dita (EDL), soleo e peroneo lungo.
- Tutti i muscoli vengono rimossi attraverso la dissezione attenta e appuntato attraverso il loro tessuto connettivo ad un Sylgard nero (Fisher Scientific, NC9492579) piatto rivestito. Essi sono lavate in PBS, e quindi fissati in paraformaldeide al 4% per 30 minuti.
- Il TA viene quindi lavate in PBS, incorporato in OCT (Fisher Scientific, 14-373-65), e congelati rapidamente in un bagno di acetone e ghiaccio secco.
- E 'conservato a -80 ° C per il sezionamento sottili nel caso in cui tutta la preparazione del montaggio non riesce. In generale, il TA è troppo spesso per adeguati supporti interi.
- Il EDL, soleus e peroneo lungo vengono risciacquati per 3 x 10 minuti in PBS, posti in 0,1 M glicina * (Fisher Scientific, AC12007-0010, diluito in PBS) per 30 minuti, e risciacquate 3 x 10 minuti in PBS nuovamente. Vengono quindi bloccata in metanolo ghiacciato 100% per 5 minuti esatti a -20 ° C, risciacquati 3 x 10 minuti in PBS, e immersi in fluorescentemente coniugato alfa-bungarotossina (diluito 1:200 in PBS) per 30 minuti. I muscoli sono risciacquati per 3 x 10 minuti in PBS, seguito da 1 ora di blocco in 2% BSA (KPL, 50-61-00) e 0,2% Triton X-100 (Dot Scientific Incorporated, 9002-93-1) * in PBS e incubate per una notte, mentre a dondolo a 4 ° C in un cocktail di anticorpi primari diluito nello stesso blocco 2% Triton BSA/0.2%.
* Glycine e soluzioni di bloccaggio sono realizzati lo stesso giorno di raccolta muscolare e si agita per 30-60 minuti a temperatura ambiente prima dell'uso.- Per celebrare assoni e sinapsi neuromuscolari, si usa una combinazione di un marcatore monoclonale neurofilamenti mouse (Covance, SMI-312R, diluito 1:1000), un anticorpo monoclonale marker delle vescicole sinaptiche del mouse (SV2 DSHB, diluito 1:1000), e alfa rodamina coniugata -bungarotossina (Sigma-Aldrich, diluito 1:200). Per celebrare reattive cellule di Schwann che usiamo di coniglio anti-GAP-43 (Novus Biologicals, NB300-143, diluito 1/500). Gli anticorpi primari sono visualizzati con una IgG1 sottotipo specifico di capra coniugato con fluoresceina anticorpo anti-topo secondaria e DyLight 649 coniugato asino anti-coniglio (ImmunoResearch Jackson, diluito 1:200).
- Il giorno seguente, i muscoli sono lavate in PBS per 3 x 10 minuti, e incubate in anticorpi secondari diluito 1:200 (in soluzione al 2% Triton BSA/0.2 blocco%). Essi vengono poi risciacquate 2 x 10 minuti in PBS, FOllowed da 5 minuti di immersione in DAPI (Invitrogen, D3571, diluita a 300 nM in acqua deionizzata), e altri 10 minuti di risciacquo in PBS.
- Ogni muscolo è poi sezionato in una Sylgard nero (Fisher Scientific, NC9492579) rivestito capsula di Petri. Inizialmente i tendini vengono rimossi i punti di inserimento nel muscolo, e quindi i muscoli sono diluiti con staccando fibre muscolari interni (Figura 3, pannelli AC). Si deve aver cura di mantenere superficie esterna del muscolo, comprese le bande piastra terminale (Figura 3, i pannelli DF). I muscoli risultanti sono montate su slitte più (Fisher Scientific, 12-550-15) con Vectashield (Vector Laboratories, H-1000) e 22 x 40 mm vetrini (Fisher Scientific, 12-548-5C) sigillati da una chiara smalto su due lati. Se correttamente montato sulla slitta i contatti placca motrice band il coprioggetti.
6. Rigenerazione di misura
- La rigenerazione può essere stimato in tutti e tre i muscoli (peroneo, EDL, e soleo). Spesso exammina rigenerazione quattordici giorni dopo la sbandata del nervo, un momento in cui una percentuale sostanziale di NMJs sono ri-innervate. Entrambi i punti precedenti e successivi il tempo sono anche adatti, a seconda della questione scientifica viene chiesto. In ogni muscolo, ri-innervazione della band intera piastra terminale viene esaminato. Solo en NMJs superficie viso vengono segnati. In questo modo, almeno 200 NMJs per muscolo può essere rapidamente esaminati.
- Per segnare muscolare reinnervazione si determina una "ri-innervazione ratio". Il denominatore è il numero di denervati giunzioni neuromuscolari, come etichettati da α-bungarotossina GAP-43 cellule di Schwann vincolante e immunoreattività. Il numeratore è il numero di ri-innervazione NMJs come etichettati da neurofilament/SV2 immunoreattività. Se necessario, NMJs può essere classificato come parzialmente (copertura incompleta del α-bungarotossina da SV2) o completamente (copertura completa di α-bungarotossina da SV2) re-innervata. Per esempi di NMJs re-innervati e denervati Figura 3, i pannelli G e H.
7. Risultati rappresentativi

Figura 1. Schema dell'anatomia dell'arto posteriore, importante per schiacciamento del nervo. A. Un semi-circolare incisione cutanea è stata effettuata rivelando la muscolatura sottostante. B. La muscolatura dei glutei è stato separato, e il nervo sciatico rivelato (passo 2.4). Una freccia indica il sito approssimativa cotta. Posizionamento Retractor è mostrato come una guida generale, e viene regolato nel corso di ogni intervento chirurgico per facilitare la visualizzazione dello sciatico e l'approccio delle pinze emostatiche per schiacciare B (inserto). Posizionamento dello sciatico sulla mascella inferiore delle pinze emostatiche appena prima cotta (punto 2.5). Fascicoli separati sono etichettati in modo da dimostrare che sono adiacenti in orizzontale, ma non verticalmente, durante la calca. Anche se tre fascicles sono etichettati in questo diagramma, si può anche vedere un quarto fascicolo, il ramo articolare del peroneo. Per un disegno anatomico più dettagliata dei modelli di ramificazione del nervo sciatico fascicoli distale al punto di schiacciare, consultare Anatomy Greene del Topo, 188 Figura 17.
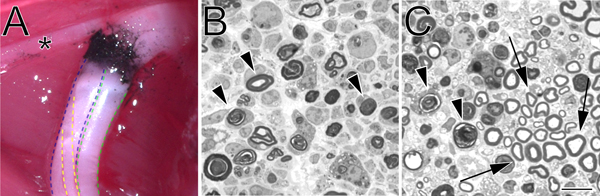
Figura 2. A-carbonio marcato sito di schiacciamento in situ e blu toluidina macchiati, semi-sottili sezioni schiacciato nervo sciatico. A. Un esempio di un sito di schiacciamento in situ (arto posteriore sinistra). Nerofumo indica il sito di schiacciamento. L'asterisco indica un ramo del nervo tibiale che innerva la muscolatura della coscia e serve come utile punto di riferimento durante l'intervento cotta. La divisione tibiale del nervo sciatico è delineata in blu, il peroneo in verde, e il surale in giallo. B. Semi-sezioni sottili dimostrando una cotta completo eseguito con la forza emostaticops. C. Semi-sezioni sottili che dimostrano una cotta incompleta eseguita con una pinza ad angolo. In entrambe le immagini profili di degenerazione della mielina sono contrassegnati con punte di freccia. Nel pannello frecce C indicare esempi di profili mielina conservati e un gruppo di assoni risparmiati. Barra della scala è di 10 micron.
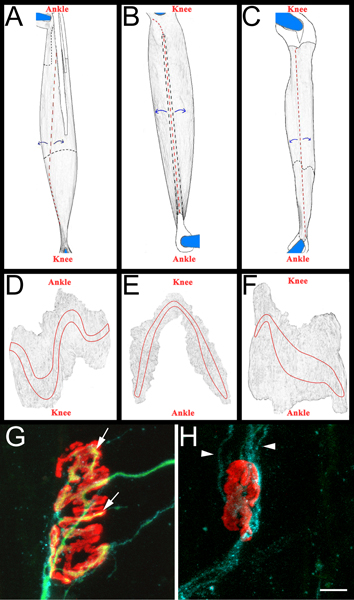
Figura 3 intero schema di montaggio e muscolare NMJs rappresentativi AC:.. Immagini di rendering di EDL (A), peroneo lungo (B), e il soleo (C) i muscoli dopo la rimozione da arti posteriori. I muscoli mostrati sono da destra arti posteriori. Ginocchio e della caviglia anatomico orientamento sono inclusi anche per riferimento. Tendini sono bianco colorato ed illustrato in una linea nera quando posizionato sulla sommità del muscolo. Vengono delineate in una linea nera tratteggiata quando estendono sotto il muscolo. I tagli sono mostrati in rosso linee tratteggiate.Muscle viene staccato dai siti di taglio, come indicato dalle frecce blu, e successivamente diluito. Dopo il diradamento, il muscolo viene separato dalle spine da taglio intorno a ciò che resta dei tendini bloccati: DF. Immagini renderizzate dai muscoli di montaggio intero, previa rimozione del tessuto connettivo e conseguente diradamento. Le bande piastra terminale sono riportate su ogni muscolo GH:. Muscolo soleo tutta mount quattordici giorni dopo il crush del nervo sciatico dimostrando nuovamente innervate (G) e denervati (H) giunzioni neuromuscolari. In questi pannelli, NMJs, assoni, e cellule di Schwann sono visualizzati come descritto sopra nel paragrafo 5.5.1. Recettori per l'acetilcolina sono di colore rosso, verde assoni e cellule di Schwann elabora blu. Nel pannello G, le frecce indicano le aree del NMJ che sono stati ri-innervati da un assone. Nel pannello H frecce indicano GAP-43 positive processi di cellule di Schwann. Si noti l'assenza di assoni. Barra della scala è di 10 micron.
Discussione
Abbiamo presentato un metodo per ottenere uno schiacciamento del nervo sciatico affidabile completo con marcatura precisa del sito cotta. Come accennato in precedenza, crush del nervo sciatico è un modello comune di lesione dei nervi periferici nei topi e nei ratti. Sebbene ogni metodo di compressione ha i suoi vantaggi e svantaggi, abbiamo trovato questo metodo ha prodotto una cotta completo che era facilmente contrassegnata con un minimo di attrezzature speciali (ad esempio pinze speciali, ecc.)
Metodi di Crush
Lo strumento più comunemente utilizzato per il mouse crush del nervo sciatico è il n ° 5 pinze ad angolo. Mentre è possibile ottenere uno schiacciamento completo utilizzando questo metodo, abbiamo scoperto che questo strumento produce una cotta variabile (troppo poca forza assoni risparmiati in partenza o troppo grandi lacerazione del nervo), soprattutto nelle mani di un nuovo utente.
Altri metodi meno comuni utilizzati per produrre crush includere clip per aneurisma di piccole dimensioni, pinze refrigerati in azoto liquido, e specially fabbricati, calibrati, non dentellate morsetti 9,12,5,7. Ciascuno di questi strumenti possono produrre in modo affidabile una cotta completa. Abbiamo scelto pinze emostatiche, perché lo strumento è facile da ottenere, produce una cotta affidabile, e permette una chiara delimitazione del sito cotta. Uno svantaggio delle pinze emostatiche è che non possiamo facilmente misurare la forza prodotta durante la cotta. Tuttavia, una volta testato, una pinza emostatica in modo affidabile produrrà una cotta completa, e può essere facilmente sostituito da una pinza identici se la pinza danneggiarsi.
Non importa il metodo scelto per effettuare una cotta, forse la parte più critica della procedura cotta è quello di verificare la completezza dei crush del nervo. Ciò è particolarmente importante nelle mani di un utente romanzo. Semi-sottile analisi del nervo distale al sito della lesione (Figura 2) fornisce un metodo semplice per farlo e può rivelare una cotta completa (Figura 2, pannello B), o una cotta incompleta (Figura 2, pannello C).
L'ultima considerazione nel metodo schiacciamento è la durata del cotta. Abbiamo testato durate schiacciamento da 15 secondi a 60 secondi di tempo di schiacciare totale, con nessuna differenza nella semitrasparenza del nervo o la conservazione delle fibre mieliniche. Ciò è coerente con le osservazioni di Bridge e colleghi, che rispetto schiaccia durata di 15-60 secondi nel nervo sciatico di ratto utilizzando una pinza di un gioielliere e non ha trovato significative morfologici, istologici, le differenze elettrofisiologiche, o funzionale tra le diverse durate cotta 18. Tempi di schiacciamento, tuttavia, più o schiaccia notevolmente degradano la endoneurium cellule di Schwann modificherà il tasso e / o il successo di rigenerazione.
Metodi di marcatura
I due metodi possibili per sito sbandata marcatura diverso dal carbonio in polvere sono 10-0 sutura attraverso il epineurio del nervo sciatico 13,19, e FluoSpheres prodotto da Molecular Probes, Eugene, OR 1 . Un 10-0 sutura segna grossolanamente il sito schiacciamento, ma richiede un maggior livello di abilità microchirurgico, e variabilità applicazione dei risultati di sutura meno preciso marcatura del perimetro del sito di carbonio cotta marcatura. Quando studiare il tasso di rigenerazione, il confine del sito schiacciamento deve essere contrassegnata precisamente lesioni seguente. Non abbiamo indagato FluoSpheres, tuttavia, che soddisfino i criteri per la precisione e la persistenza di crush-site marcatura. Essi sono particolarmente utili quando l'imaging in vivo rigenerazione in linee murine YFP 1. Per i nostri scopi abbiamo trovato il carbonio marcatura adeguata e poco costoso, con l'ulteriore vantaggio di essere facilmente visibile in una valutazione ex post semi-sottile o al microscopio elettronico. Inoltre, abbiamo trovato che il carbonio marcatura persiste per almeno sei settimane che lo rende adatto per gli esperimenti di durata più lunga.
Analisi di rigenerazione dopo Crush
Una completa indaginezione di rigenerazione dopo cotta combina valutazioni funzionali, elettrofisiologici e morfologici 5,16. Valutazioni morfologiche seguenti rigenerazione sono forse il più comune. Queste valutazioni possono essere separati in quelli che valutare latenza di crescita, tasso di crescita assonale, e la specificità di reinnervazione 16. In questo rapporto, abbiamo presentato una intera procedura muscolare montaggio, che possono essere utilizzati per valutare rapidamente la rigenerazione morfologica (Figura 3). In questa analisi NMJs denervati etichettati da alfa-bungarotossina e cellule di Schwann GAP-43 sono quantificati e rispetto ad una ri-innervazione giunzioni, come etichettati da neurofilamenti, SV2, e alfa-bungarotossina. GAP-43 è marcatamente upregulated dalle cellule di Schwann dopo denervazione e ben identifica denervato terminali cellule di Schwann a livello della giunzione neuromuscolare 20. Anche se GAP-43 è espressa da assoni, l'uso concomitante di neurofilamenti distingue facilmente GAP-43 assoni positivi da cellule di Schwann. Inoltre,perché NMJs profondità all'interno del muscolo non può essere facilmente da anticorpo marcato (rispetto alla piccola molecola alfa-bungarotossina) cellule di Schwann GAP-43 immunoreattività importante conferma lo stato denervato di una giunzione neuromuscolare e migliora la precisione nel conteggio NMJs denervati.
Questo metodo fornisce un metodo semplice ed efficace per valutare lo stato reinnervazione di tutta la banda placca motrice del muscolo alla volta. Altri hanno usato la tua-1-CFP (23) / S100-GFP topi che esprimono ciano proteina fluorescente GFP e negli assoni nelle cellule di Schwann a seguire ri-innervazione delle tibiale anteriore dopo schiacciamento del nervo sciatico 2. Un avvertimento deve rilevare, però. Questo metodo si basa sulla neurofilamenti e SV2 immunoreattività per quantificare reinnervazione. È possibile che l'estensione assonale può essere impedito, ma successiva espressione di SV2 può essere ritardata 21. Pertanto, in alcuni esperimenti sarà importante per confermare che la rigenerazione ritardata e non delayed espressione presinaptica di SV2 (cioè pre-sinaptica differenziazione) rappresentano un fenotipo osservato.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal NIH K08NS065157 (al TAF) Inoltre, il Centro Penn per disordini muscoloscheletrici, Numero P30AR050950 Award dal National Institute of Arthritis, malattie del sistema muscoloscheletrico e Pelle sostenuto questo lavoro (TAF e Steven S. Scherer). Infine, Shriners Pediatric Research finanziamento Seed Center (TAF) ha sostenuto questo lavoro. Vorremmo ringraziare il dottor Young-Jin Son inizialmente per dimostrare tutta la procedura di montaggio e di Amy A. Kim per la sua assistenza nella produzione i disegni della figura 1.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome (descrizione / quantità) | Fornitore | Numero di catalogo | |
| Clipper Mini 0000 il n Lama | Roboz | RC-5903 | |
| Nair Remover Capelli (9 oz.) | Chiesa e Dwight Co., Inc. | N / A | |
| Betadine Scrub chirurgico (1 gallone) | Fisher Scientific | 19066452 | |
| Unguento oftalmico (1 oz.) | Fisher Scientific | 19082795 |
Strumenti chirurgici:
| Nome (descrizione / quantità) | Fornitore | Numero di catalogo |
| FST 250 Hot tallone sterilizzatore | Strumenti di Scienza Fine | 18000-45 |
| Scissors Iris (11 cm di lunghezza) | Mondo Strumenti di precisione | 500216 |
| Potts-Smith Pinza (Straight, 18 centimetri; 1x2 Teeth) | Strumenti di Scienza Fine | 11024-18 |
| McPherson-Vännäs Scissors (5 lame mm) | Mondo Strumenti di precisione | 14124-G |
| Dumont # 5 - Pinza Dumoxel standard Tip | Strumenti di Scienza Fine | 11252-30 |
| Dumont # 5/45 - Pinza Dumoxel standard Tip | Strumenti di Scienza Fine | 11251-35 |
| Ultra hemostats Arti (Diritto; superfici interne lisce) | Strumenti di Scienza Fine | 13020-12 |
| Carbone attivo in polvere (500 g) | Fisher Scientific | C272-500 |
| Dimensione 6-0 suture con C-1 ago (sterile, Seta, Nero, intrecciato,Non assorbibile, 18 "Length, Box di 36) | Roboz | SUT-1073-1011 |
| Reflex Applier Clip (per 9 clip mm) | Mondo Strumenti di precisione | 500345 |
| 9 mm in acciaio inossidabile Clips Reflex (100/box) | Mondo Strumenti di precisione | 500346 |
Animal Care:
| Nome (descrizione / quantità) | Fornitore | Numero di catalogo |
| 0,9% cloruro di sodio per iniezione (conservanti, 20 mL) | Hospira | 0409-4888-20 |
| Sistema completo Blanket omeotermi con sonda flessibile (Medium, 115 VAC, 60 Hz) | Harvard Apparatus | 507222F |
Platfor chirurgicom retrattori di:
(Acquistato nel negozio di ferramenta locale)
| Nome (descrizione /) | Quantità |
| Piattaforma in acciaio inossidabile (Lavorato; x1 ~ 12 "x12" / 8 ") | 1 |
| Magneti Button (Esempio: Eclipse e825) | 3 |
| Viti in acciaio inox (3 "Long; Diametro Determinato da Magneti Button) | 3 |
| Dadi in acciaio inox (di dimensioni adatte a Bulloni) | 9 |
| Elastici (Tension Light) | 3 |
| Pins insetti (entrambe le estremità piegate a formare ganci) | 3 |
Semi-Fluidifica:
| Nome (descrizione / quantità) | Fornitore </ Strong> | Numero di catalogo |
| Paraformaldeide (1 kg) | Sigma-Aldrich | P6148-1KG |
| Sodio fosfato bibasico anidro (500 g; utilizzato per preparare tampone fosfato) | Fisher Scientific | S375-500 |
| Sodio fosfato monobasico anidro (1 kg, utilizzati per preparare tampone fosfato) | Fisher Scientific | AC38987-0010 |
| Glutaraldeide (50%, 10 x 10 mL) | Ted Pella, Inc. | 18431 |
| Osmio di diazoto (4% acquosa, 10 x 10 mL) | Ted Pella, Inc. | 18465 |
| Ossido di propilene (450 mL) | Ted Pella, Inc. | 18601 |
| Incorpora 812 (Kit, per i blocchi duri / contrasto immagine ad alta) | Scienze della microscopia elettronica | 14120 |
| Toluidine blu (25 g) | Ted Pella, Inc. | 19451 |
Tutta Monte Preparazione muscolare e Immunoistochimica:
| Nome (descrizione / quantità) | Fornitore | Numero di catalogo |
| Paraformaldeide (1 kg) | Sigma-Aldrich | P6148-1KG |
| Sodio fosfato bibasico anidro (500 g; utilizzato per preparare tampone fosfato) | Fisher Scientific | S375-500 |
| Sodio fosfato monobasico anidro (1 kg, utilizzati per preparare tampone fosfato) | Fisher Scientific | AC38987-0010 |
| 10% di BSA diluente / Blocking Solution (200 mL) | Kirkegaard & Perry Laboratories, Inc. | 50-61-00 |
| Triton X-100 (100 mL) | Dot scientifico Incorporated | 9002-93-1 |
| Glicina, 98% (1 kg) | Fisher Scientific | AC12007-0010 |
| Tissue-Tek Cryo-OCT Compound (causa del 12, 4 bottiglie oz) | Fisher Scientific | 14-373-65 |
| Sylgard DOW 170 (2 Kit lb) | Fisher Scientific | NC9492579 |
| Insetti in acciaio inox Pins, Size 1, 100/PKG) | Strumenti di Scienza Fine | 26001-40 |
| Tetrametilrodamina-A-bungarotossina (0,5 mg) | Sigma-Aldrich | T0195-.5MG |
| Mouse anticorpo monoclonale contro SMI-312 (0,1 ml) | Covance | SMI-312R |
| Mouse anticorpo monoclonale contro SV2 (0,1 mL) | Developmental Studies ibridomi Bank (DSHB) | SV2 |
| Coniglio PolyAnticorpo clonale Contro GAP-43 | Novus Biologicals | NB300-143 |
| Flourescein capra coniugato anti-topo IgG, Fcy Subclass uno specifico | Jackson ImmunoResearch | 11 5-095-205 |
| DyLight 649 coniugata Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-495-152 |
| 4 ',6-Diamidino-2-fenilindolo (DAPI, dilactate; 10 mg) | Invitrogen | D3571 |
| Vectashield Mezzo di montaggio (10 mL) | Vector Laboratories | H-1000 |
| SuperFrost Plus preparati microscopici (Bianco; Dimensioni: 75 x 25 mm, confezione da 144) | Fisher Scientific | 12-550-15 |
| Fisherfinest Premium Occhiali copertina (dimensioni: 40 x 22 mm, confezione da 1 oz.) | Fisher Scientific | 12-548-5C |
Riferimenti
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon