Method Article
Ratón reproducible aplastamiento del nervio ciático y posterior evaluación de la regeneración mediante el análisis de músculo entero Monte
En este artículo
Resumen
En este informe se describe un método para aplastar el nervio ciático del ratón. Este método usa unas pinzas hemostáticas fácilmente disponibles y fácilmente reproducible y produce aplastamiento completo del nervio ciático. Además, se describe un método para preparar soportes de músculo entero adecuadas para el análisis de la regeneración del nervio después de aplastamiento del nervio ciático.
Resumen
La regeneración en el sistema nervioso periférico (SNP) está ampliamente estudiada tanto por su relevancia para las enfermedades humanas y entender la respuesta contundente de regeneración montada por las neuronas del SNP por lo tanto, posiblemente, iluminando los fracasos de la regeneración del SNC 1. Aplastamiento del nervio ciático (axonotmesis) es uno de los modelos más comunes de lesión del nervio periférico en roedores 2. Triturado interrumpe todos los axones pero láminas de Schwann de células basales se conservan por lo que la regeneración es óptimo 3,4. Esto permite que el investigador para estudiar precisamente la capacidad de un axón en crecimiento para interactuar tanto con la célula de Schwann y láminas basales 4. Las ratas han sido por lo general los modelos animales preferidos para el aplastamiento del nervio experimental. Están ampliamente disponibles y su nervio ciático lesionado proporciona una aproximación razonable de las lesiones nerviosas humanas 5,4. Aunque de menor tamaño que los nervios de rata, el nervio del ratón tiene muchas cualidades similares. Pero lo más importante, los Memorandos de Entendimientomodelos e son cada vez más valiosa, debido a la amplia disponibilidad de líneas transgénicas ahora permite una disección detallada de las moléculas individuales fundamentales para la regeneración del nervio 6, 7. Antes los investigadores han utilizado varios métodos para producir un aplastamiento del nervio o lesión incluyendo simples pinzas de ángulo, pinzas frías, pinzas hemostáticas, pinzas vasculares, y las abrazaderas diseñadas por el investigador 8,9,10,11,12. Los investigadores también han utilizado diversos métodos para marcar el sitio de la lesión incluyendo la sutura, las partículas de carbono y perlas fluorescentes 13,14,1. Se describe nuestro método para obtener un flechazo nervio ciático reproducible completa con información precisa y persistente marcaje de la aglomeración de sitio, con una pinza hemostática y finas de carbono posteriores al aplastamiento marcar el sitio. Como parte de nuestra descripción del procedimiento del nervio ciático aplastar también hemos incluido un método relativamente simple de montar todo el músculo que utilizamos para cuantificar posteriormente la regeneración.
Protocolo
1. Los sujetos animales
1,1. Tratamiento
- Todos los procedimientos con animales se debe realizar con la aprobación del Cuidado de Animales de la institución local y el Comité de Ética y de acuerdo con el uso y el Comité y de los Institutos Nacionales de Salud directrices, con las medidas adoptadas para minimizar el dolor y el malestar.
- Nuestros animales fueron alojados en condiciones controladas de temperatura en una luz de marcha atrás de 12 horas y el ciclo oscuro, mientras que alimentó ratón chow y el agua ad libitum.
- Para los estudios de regeneración de adultos, los ratones deben tener al menos 6 semanas de edad cuando el aplastamiento del nervio ciático, se lleva a cabo. Esta edad está más allá del momento en que la poda de las uniones neuromusculares polyneural llevará a cabo.
- En estos experimentos, hemos utilizado de 6-8 semanas de edad C57BL / 6 ratones adquiridos de Charles River. Al comparar la regeneración después de aplastamiento del nervio ciático (es decir: tasa de crecimiento del axón) cepas de ratón debe ser la misma, como las diferencias en la regeneración axonal no han sidoed entre las diferentes cepas puras 15,16. Si los ratones manipulados genéticamente se van a utilizar, los controles littermate son los más apropiados.
1,2. Preparación quirúrgica
- Los animales son profundamente anestesiados para la cirugía usando un cóctel de ketamina (100 mg / kg) y xilazina (10 mg / kg) mediante inyección intraperitoneal. Cada animal recibe también una inyección subcutánea de meloxicam (10 mg / kg) para minimizar el dolor postoperatorio.
- Tanto los cuartos traseros son cuidadosamente afeitado con un cortaúñas quirúrgicos (Roboz, RC-5903) y la depilación se ha completado con la crema de depilación Nair (que se encuentra en la farmacia local).
- La piel se limpia con aplicadores de algodón estériles con punta y matorrales betadine quirúrgico (Fisher Scientific, 19066452).
- Ungüento oftálmico (Fisher Scientific, 19082795) se aplica a los ojos, utilizando aplicadores de algodón estériles con punta.
- El ratón se coloca sobre una placa de acero inoxidable limpio, en virtud del cual se ha colocado un homeot precalentadosistema de manta hermic (Harvard Apparatus, 507222F). Animales temperatura se mantiene a 37 ° C.
- Todas las extremidades son grabadas hacia abajo, teniendo cuidado de situar las extremidades posteriores simétricamente de modo que la articulación de la rodilla hace un ángulo recto con el cuerpo (Figura 1, panel A).
- El campo quirúrgico se cubre con un paño estéril. Todos los instrumentos se esterilizan en autoclave o la esterilización en caliente talón (Herramientas de Bellas Ciencias, 18000-45) y el cirujano usa una máscara, bata y guantes estériles.
2. Crush reproducible del nervio ciático
- Después de la preparación, una incisión semicircular a través de la línea media (Figura 1) se hace en la piel. La piel es suavemente disecados de la musculatura subyacente, y pliega para permanecer fuera del camino durante el procedimiento. Se mantiene húmedo el uso de aplicaciones de 0,1 ml de solución salina estéril (Hospira, 0409-4888-20) durante el procedimiento.
- Abrir el plano fascial entre el glúteo mayor y el jefe anterior de la femori bícepss revela el nervio ciático (Figura 1, panel A). Para un control quirúrgico, el nervio ciático contralateral debe ser expuesto y movilizado, pero dejó intacta. La musculatura de los glúteos se vuelve a frente y se sutura con seda trenzada 6-0, suturas no absorbibles (Roboz, SUT-1073-11).
- El nervio ciático experimental se expone entonces de la misma manera, con retractores en lugar de facilitar la visualización (Figura 1, el panel B). Los retractores se esterilizan antes de su uso.
Nota: aunque los sistemas de retractores están disponibles comercialmente, a menudo son bastante caros. Hemos sido capaces de hacer un sistema de retracción satisfactoria el uso de fuentes de bajo costo de hardware y los pasadores de insectos (ver la sección de Materiales). - El nervio ciático está suavemente liberada del tejido conectivo que rodea el uso de tijeras iridectomía.
- Uso de una multa de 5/45 (Herramientas de Bellas ciencia, 11.251-35) con fórceps, el nervio se coloca en la mandíbula inferior de unas pinzas hemostáticas super-fino (Ciencia bien tambiénls 13020-12). Los tres fascículos son secuencialmente alineado, no en la parte superior de la otra (figura 1, recuadro B). Las pinzas hemostáticas han sido grabadas con una marca de 1,5 mm de la punta. La porción más externa de la ciática se coloca en línea con esta marca antes de aplastamiento. Esto asegura un aplastamiento de anchura uniforme, y que el nervio no se extiende más allá de las mordazas de las pinzas hemostáticas cuando aplanada debido a la fuerza de aplastamiento. Si el nervio se extiende más allá de la punta fórceps el nervio sólo será parcialmente aplastado.
- La aglomeración se hace perpendicular al nervio a 45 mm desde el tercer dedo, según se mide por un hilo que se aproxima a la trayectoria del nervio ciático. El nervio es aplastado una vez durante 15 segundos a 3 clics de las pinzas hemostáticas. Hay que tener cuidado de no estirar el nervio. Cuando las pinzas hemostáticas se volvió a abrir, todo el nervio óptico debe ser transparente en el sitio de aplastamiento.
- Un segundo par de pinzas hemostáticas (idéntica a la primera) que ha sido pre-inmersión enpolvo de carbono (Fisher Scientific, C272-500) se utiliza para marcar el sitio de aplastamiento. El nervio es aplastado en el lugar de aplastar misma durante 15 segundos a 3 clics. No de carbono marcado debe extenderse más allá de los límites del enamoramiento inicial. Esto es particularmente importante si precisa marcado del sitio aplastamiento se requiere. Antes de su uso, el polvo de carbono se esteriliza por exposición a luz UV durante dos horas, y posteriormente se maneja utilizando una técnica estéril.
- Para pre-sumergir las pinzas en el carbono, pero excluye carbono generalizado en el sitio quirúrgico, las pinzas se abren en carbón en polvo, entonces suavemente cerrada (pero no hace clic) cerrado, y el carbono en el exterior de las pinzas hemostáticas se limpió con una gasa estéril . Las pinzas se observan bajo por lo menos 3 aumentos para verificar que las superficies de trituración se recubre uniformemente en carbón en polvo. Si es necesario, se sumergió de nuevo y se secó.
- La musculatura glútea es re-oposición y se sutura en la misma forma que el lado contralateral.
- Por último, la incisión de la piel se cierra con 9 clips mm reflex (World Precision Instruments, 500346, 500345: Aplicador). Si 9 clips reflejas mm se encuentran para restringir el movimiento, más pequeños clips de reflejos o 6-0 suturas (Roboz, SUT-1073-11) se puede utilizar en su lugar.
3. Cuidados post-operatorios
- Siguiendo el procedimiento, los animales se colocan en una almohadilla térmica a 37 ° C hasta que muestren signos de movimiento.
- Luego se trasladó de nuevo a su jaula, donde el agua y los alimentos son fácilmente accesibles en el suelo en forma de hidrogel y comida mojada.
4. Semi-delgadas Preparación
- Tras una sobredosis de pentobarbital (300 mg / kg), la musculatura de la pierna se retira para exponer el * nervio ciático. Con el nervio restante in situ, el cuarto trasero se sumerge en paraformaldehído al 2% y 2% glutaraldehído en tampón fosfato 0,1 M en hielo durante 30 minutos.
* Si se completa la preparación muscular en todo el montaje, los músculos son la cosechaed antes de exponer el nervio ciático. - El nervio se retira cuidadosamente, teniendo cuidado de manejar solamente el extremo proximal. A continuación, el nervio es post-fija en el mismo fijador durante tres horas adicionales.
- Después de la fijación del nervio se enjuaga tres veces en tampón fosfato 0,1 M.
- El nervio se sumerge en tetróxido de osmio al 2% en tampón fosfato 0,1 M durante una hora.
- El nervio es entonces deshidratada por inmersión secuencial en etanol cada vez más concentrada (50%, 70%, 80%, 95%, 100%, 100%, 100%). Cada inmersión es de 15 minutos.
- El nervio deshidratado se incuba dos veces en óxido de propileno durante tres minutos cada uno.
- A continuación, el nervio se sumerge en una mezcla 1:1 de óxido de propileno y Embed 812 por lo menos 6 horas (normalmente durante la noche).
- A continuación, el nervio se sumerge en una mezcla 2:1 de óxido de propileno y Embed 812 durante la noche.
- Finalmente, el nervio se sumerge en pura Insertar 812 durante seis horas, a continuación, incrustado en el molde apropiado y BAked a 60 ° C durante 48 horas.
- 1.0 micras secciones se cortan del tronco del nervio distal a una distancia determinada desde el sitio de aplastamiento con una Ultracut UCT ultramicrótomo (Leica), con una cuchilla de vidrio y se tiñeron con azul de toluidina. Secciones delgadas también pueden ser producidos por el examen de la ultraestructura por microscopía electrónica.
5. Todo el montaje en la preparación muscular
- Primeros ratones son sacrificados con una sobredosis de pentobarbital (300 mg / kg) y las extremidades posteriores se eliminan en las rodillas.
- Cuatro músculos de la extremidad posterior se eliminan para el análisis: el tibial anterior (TA), el extensor largo de los dedos (EDL), soleo y peroneo lateral largo.
- Todos los músculos se eliminan a través de una cuidadosa disección y fijado a través de su tejido conectivo a una Sylgard negro (Fisher Scientific, NC9492579) plato cubierto. Se enjuagaron en PBS, y se fija entonces en paraformaldehído al 4% durante 30 minutos.
- El TA se enjuaga en PBS, incrustado en octubre (Fisher Scientific, 14-373-65), y se congela rápidamente en un baño de hielo acetona y seco.
- Se almacena a -80 ° C para la sección delgada en el caso de toda la preparación de montaje no funciona. En general, la TA es demasiado grueso para montajes completos adecuados.
- La EDL, sóleo, peroneo largo y se enjuagó durante 3 x 10 minutos en PBS, colocados en 0,1 M de glicina * (Fisher Scientific, AC12007-0010; diluido en PBS) durante 30 minutos, y se enjuagó 3 x 10 minutos en PBS nuevo. Luego se enfrió en hielo frío metanol al 100% durante exactamente 5 minutos a -20 ° C, se enjuagó 3 x 10 minutos en PBS, y se bañó en fluorescentemente conjugado alfa-bungarotoxina (diluido 1:200 en PBS) durante 30 minutos. Los músculos se enjuagó durante 3 x 10 minutos en PBS, seguido por un bloque de 1-hora en 2% de BSA (KPL, 50-61-00) y 0,2% de Triton X-100 (Dot Científico Incorporated, 9002-93-1) en PBS *, y se incubaron durante la noche mientras se balancea a 4 ° C en un cóctel de anticuerpos primarios diluidos en el mismo bloque de 2% de Triton BSA/0.2%.
* GLycine y soluciones de bloqueo se realizan en el mismo día que la cosecha músculo y se agitó durante 30-60 minutos a temperatura ambiente antes de su uso.- Con motivo de los axones y las sinapsis neuromusculares, se utiliza una combinación de un marcador del ratón monoclonal neurofilamentos (Covance, SMI-312R, diluido 1:1000), un anticuerpo monoclonal de ratón marcador de las vesículas sinápticas (SV2 DSHB, diluido 1:1000), y alfa conjugada con rodamina -bungarotoxina (Sigma-Aldrich, diluido 1:200). Para marcar las células de Schwann reactivos que utilizamos de conejo anti-GAP-43 (Novus Productos Biológicos, NB300-143, se diluye 1/500). Los anticuerpos primarios se visualizan con una IgG1 subtipo específico de fluoresceína conjugado de cabra anti-anticuerpo secundario del ratón y DyLight 649 burro conjugado anti-conejo (Jackson ImmunoResearch, diluido 1:200).
- El día siguiente, los músculos se enjuagan en PBS durante 3 x 10 minutos, y se incubaron en secundaria de anticuerpos diluida 1:200 (en solución al 2% de Triton BSA/0.2% de bloqueo). Luego se enjuaga 2 x 10 minutos en PBS, FOllowed por una inmersión de 5 minutos en DAPI (Invitrogen, D3571; diluyó a 300 nM en agua desionizada), y otro 10-minutos enjuague en PBS.
- Cada músculo se diseca en un Sylgard negro (Fisher Scientific, NC9492579) recubierto con placa de Petri. Inicialmente, los tendones se eliminan en sus puntos de inserción en el músculo, y luego los músculos se adelgaza por pelar las fibras musculares interiores (Figura 3, los paneles de CA). Se tiene cuidado de mantener la superficie exterior del músculo, incluyendo las bandas de placa terminal (Figura 3, los paneles DF). Los músculos resultantes se montaron en portaobjetos, además de (Fisher Scientific, 12-550-15) con Vectashield (Vector Laboratories, H-1000) y 22 x 40 mm cubreobjetos de vidrio (Fisher Scientific, 12-548-5C) sellados por clara esmalte de uñas en dos lados. Cuando está correctamente montado en la corredera los contactos de la banda placa terminal del cubreobjetos.
6. Medición de la regeneración
- La regeneración puede ser estimado en los tres músculos (peroneo, EDL y soleo). A menudo exla regeneración de amina catorce días después de aplastamiento del nervio, un momento en que son un porcentaje sustancial de NMJs re-inervación. Los dos puntos anteriores, y más tarde también son adecuados, dependiendo de la pregunta científica que se formula. En cada músculo, re-inervación de la banda de la placa terminal es examinado. Solamente EN NMJs superficie de la cara se anotó. De esta manera, por lo menos 200 NMJs por músculo puede ser rápidamente examinados.
- Para marcar los músculos re-inervación se determina una "re-inervación relación". El denominador es el número de uniones neuromusculares, como denervados etiquetados por GAP-43-α bungarotoxina une a las células de Schwann y la inmunorreactividad. El numerador es el número de re-inervados NMJs como etiquetados por neurofilament/SV2 inmunoreactividad. Si es necesario, NMJs puede ser clasificado como parcialmente (cobertura incompleta de α-bungarotoxina por SV2) o totalmente (cobertura completa de α-bungarotoxina por SV2) de re-inervado. Para ejemplos de NMJs inervados y de re-denervado véase la Figura 3, los grupos G y H.
7. Los resultados representativos

Figura 1. Esquema de la anatomía de las extremidades posteriores importante aplastamiento del nervio. A. Una incisión en la piel de medio punto se ha hecho revelando la musculatura subyacente. B. La musculatura glútea se ha separado, y puso de manifiesto el nervio ciático (paso 2.4). Una flecha indica el lugar aproximado de aplastamiento. Colocación retractor se muestra como una guía general, y se ajusta durante cada cirugía para aliviar la visualización del ciático y el enfoque de las pinzas hemostáticas para aplastar B (recuadro):. La colocación del ciático en la mandíbula inferior de las pinzas hemostáticas justo antes de aplastamiento (paso 2,5 supra). Fascículos separados están etiquetados para demostrar que son adyacentes en sentido horizontal, pero no verticalmente, durante el enamoramiento. Aunque tres fascículos están etiquetados en este diagrama, también se puede ver un fascículo en cuarto lugar, la rama articular del peroné. Para un dibujo anatómico más detallado de los patrones de ramificación de fascículos del nervio ciático distal hasta el punto de aplastamiento, por favor refiérase a la anatomía de Greene de la Rata, Figura 188 17.
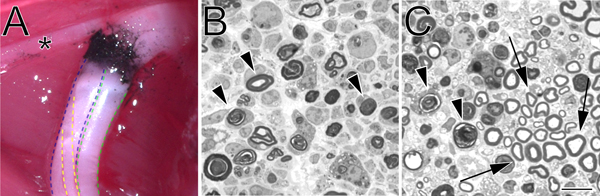
Figura 2. Un sitio aplastamiento de carbono marcado in situ y azul de toluidina-manchado, semi-delgadas secciones de nervio ciático triturado. A. Un ejemplo de un sitio aplastamiento in situ (extremidad posterior izquierda). El carbono negro indica el sitio de aplastamiento. El asterisco marca una rama del nervio tibial que inerva musculatura del muslo y sirve como un punto de referencia útil durante la cirugía por aplastamiento. La división tibial del nervio ciático se describe en el azul, el peroneo en verde, y el sural en amarillo. B. Semi-secciones delgadas demostrando un aplastamiento completo realizado por la fuerza hemostáticaps. C. Semi-secciones delgadas que muestran un aplastamiento incompleta realizó con fórceps angulados. En ambas imágenes degeneración perfiles de mielina están marcados con flechas. En el panel de flechas C marcar ejemplos de perfiles de la mielina en conserva y un conjunto de axones a salvo. Barra de escala es de 10 micras.
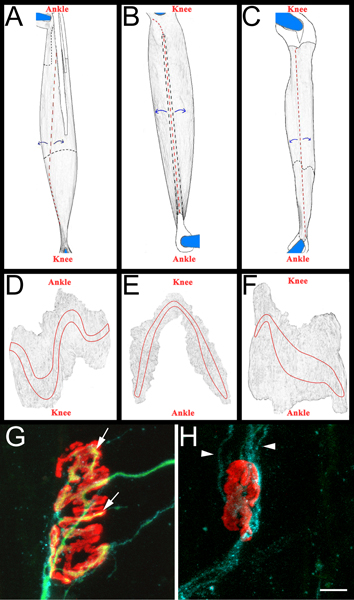
Figura 3 esquemática muscular en todo el montaje y NMJs representativas. AC:. Las imágenes renderizadas de EDL (A), del peroneo lateral largo (B) y sóleo (C) los músculos después de la eliminación de las extremidades posteriores. Los músculos se muestran son de la extremidad posterior derecha. Rodilla y orientación anatómica del tobillo también se incluyen como referencia. Los tendones son de color blanco y se describe en una línea de color negro sólido cuando se lo coloca en la parte superior del músculo. Ellos se resumen en una línea discontinua negro cuando se extienden por debajo del músculo. Los cortes se muestran en líneas discontinuas de color rojo.El músculo se despega de sitios de corte, como se indica por las flechas azules, y se diluyó posteriormente. Después de adelgazamiento, el músculo se separa de los pines, cortando todo lo que queda de los tendones anclados DF:. Las imágenes renderizadas de los músculos de montaje entero tras la eliminación del tejido conectivo y posterior adelgazamiento. Las bandas de placa terminal se exponen en cada músculo de GH:. El músculo sóleo de montaje toda catorce días después de aplastar el nervio ciático que demuestra de nuevo inervados (G) y denervado (H), las uniones neuromusculares. En estos paneles, NMJs, axones y células de Schwann son visualizados como se describió anteriormente en la sección 5.5.1. Los receptores de acetilcolina son de color rojo, verde axones y células de Schwann procesa azul. En el panel G, las flechas indican las zonas de la NMJ que han sido re-inervados por un axón. En el panel de puntas de flecha indican H GAP-43 procesos positivos de células de Schwann. Nótese la ausencia de los axones. Barra de escala es de 10 micras.
Discusión
Hemos presentado un método para obtener un flechazo nervio ciático fiable completa con identificación exacta del sitio de aplastamiento. Como se mencionó anteriormente, aplastamiento del nervio ciático es un modelo común de lesión del nervio periférico en ratones y ratas. Aunque cada método de aplastamiento tiene sus ventajas y desventajas, nos pareció que este método produce un flechazo total que se marcó con facilidad con un mínimo de equipos especiales (por ejemplo, unas pinzas especiales, etc.)
Métodos de Crush
El instrumento más común utilizado para el aplastamiento del nervio ciático del ratón es el N º 5 pinza en ángulo. Si bien es posible obtener un flechazo total con este método, se encontró que este instrumento produce un flechazo variable (muy poca fuerza dejando a los axones ahorrado grandes o demasiado desgarro del nervio), especialmente en las manos de un nuevo usuario.
Otros métodos menos comunes que se utilizan para producir aplastamiento son pequeños clips de aneurisma, pinzas refrigerados con nitrógeno líquido, y specially fabricados, calibrados y no dentadas abrazaderas 9,12,5,7. Cada uno de estos instrumentos de forma fiable puede producir un aplastamiento completo. Elegimos unas pinzas hemostáticas, porque el instrumento es fácil de obtener, produce un flechazo fiable, y permite la clara marca del sitio de aplastamiento. Uno de los inconvenientes de las pinzas hemostáticas es que no puede medir la fuerza producida durante el enamoramiento. Sin embargo, una vez probado, unas pinzas hemostáticas, producirá un aplastamiento completo, y puede ser fácilmente sustituida por una pinza idénticos si las pinzas se dañan.
No importa el método elegido para llevar a cabo un flechazo, tal vez la parte más crítica del procedimiento de aplastamiento es para verificar la integridad de aplastamiento del nervio. Esto es especialmente importante en las manos de un usuario nuevo. Semi-fino análisis de nervio distal al sitio de la lesión (Figura 2) proporciona un método sencillo para hacerlo y puede revelar un aplastamiento completo (Figura 2, panel B) o un aplastamiento incompleto (Figura 2, panel C).
La consideración final en el método de aplastamiento es la duración de la aglomeración. Hemos probado por aplastamiento duraciones de 15 segundos a 60 segundos de tiempo de enamoramiento total, con ninguna diferencia en la translucidez del nervio o la preservación de las fibras mielinizadas. Esto es consistente con las observaciones de la Puente y sus colegas, que en comparación con amores de 15-60 segundos de duración en el nervio ciático de la rata con fórceps de un joyero y no encontró diferencias significativas morfológicos, histológicos, electrofisiológicos, o funcional entre las diferentes duraciones de aplastamiento 18. Sin embargo, mayores tiempos de aplastamiento o aplasta que degradan significativamente el endoneuro células Schwann se altera la tasa y / o el éxito de la regeneración.
Métodos de marcado
Los dos métodos viables para el sitio de aplastamiento de marcado que no sea carbón en polvo son una sutura de 10-0 a través del epineuro del nervio ciático 13,19, y FluoSpheres producido por Molecular Probes, Eugene, OR 1 . Una sutura 10-0 groseramente marca el sitio aplastamiento, pero requiere un mayor nivel de habilidad microquirúrgica, y la variabilidad en la aplicación de los resultados de sutura en menos preciso marcado de los límites del sitio aplastamiento de carbono marcado. Cuando se estudia la tasa de regeneración, el límite del vertedero y al aplastamiento debe ser precisamente marcada después de la lesión. No hemos investigado FluoSpheres, sin embargo, que cumplan los criterios para la precisión y la persistencia de aplastar el sitio marcado. Son particularmente útiles cuando la imagen in vivo regeneración en líneas de ratones YFP 1. Para nuestros propósitos, nos pareció que el marcado de carbono adecuada y de bajo costo, con el beneficio adicional de ser fácilmente visto en la posterior evaluación microscópica semi-fino o de electrones. Además, hemos encontrado que el carbono marcado persiste durante al menos seis semanas por lo que es adecuado para los experimentos de mayor duración.
Análisis de la regeneración después de aplastar
Un total investigacionesción de la regeneración posterior aplastamiento combina evaluaciones funcionales, electrofisiológicas y morfológicas 5,16. Evaluaciones morfológicas después de la regeneración son, quizás, el más común. Estas evaluaciones pueden ser separados en los que evaluar la latencia de crecimiento, tasa de crecimiento axonal, y la especificidad de la reinervación 16. En este informe, hemos presentado un todo el procedimiento de montaje del músculo que se puede utilizar para evaluar de forma rápida la regeneración morfológica (Figura 3). En este análisis NMJs denervados marcados por la alfa-bungarotoxina y la célula de Schwann GAP-43 se han cuantificado y comparado con re-inervados uniones como etiquetados por neurofilamentos, SV2, y alfa-bungarotoxina. GAP-43 es marcadamente upregulated por las células de Schwann después de la denervación y bien identifica denervado terminales células de Schwann en la unión neuromuscular 20. Aunque GAP-43 se expresa por los axones, el uso concomitante de neurofilamentos fácilmente distingue 43 GAP-axones positivos a partir de células de Schwann. Además,porque NMJs profundas dentro del músculo no puede ser fácilmente etiquetados por el anticuerpo (en comparación con la molécula pequeña alfa-bungarotoxina) de células de Schwann GAP-43 inmunoreactividad importante confirma el estado de un denervado unión neuromuscular y mejora la precisión al contar NMJs denervados.
Este método proporciona un método sencillo y eficiente para evaluar el estado de la banda de reinervación muscular placa terminal de una vez. Otros han utilizado tu PPC-1-(23) / S100 buenas prácticas agrarias de los ratones que expresan la proteína fluorescente cian en los axones y las buenas prácticas agrarias en las células de Schwann de seguir re-inervación de los tibiales anteriores después de aplastamiento del nervio ciático 2. Una advertencia debe tenerse en cuenta, sin embargo. Este método se basa en los neurofilamentos y SV2 inmunoreactividad para cuantificar la reinervación. Es posible que axón resultado puede ser sin impedimentos pero la expresión subsiguiente de SV2 puede retrasarse 21. Por lo tanto, en algunos experimentos, será importante para confirmar que la regeneración retardada y no delayed expresión presináptica de SV2 (es decir, pre-sináptica de diferenciación) representan un fenotipo observado.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el NIH subvenciones K08NS065157 (al TAF) Además, el Centro Penn para los trastornos musculoesqueléticos, P30AR050950 Premio Número del Instituto Nacional de Artritis, Enfermedades Musculoesqueléticas y de la Piel apoya este trabajo (TAF y Steven S. Scherer). Por último, Shriners Pediatric Research Center financiación inicial (TAF) apoya este trabajo. Nos gustaría agradecer al Dr. Young-Jin Hijo de un principio que demuestra todo el procedimiento de montaje y Amy A. Kim, por su asistencia en la elaboración de los bocetos de la figura 1.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre (descripción / cantidad) | Proveedor | Número de catálogo | |
| Clipper Mini 0000 con el N º hoja | Roboz | RC-5903 | |
| Nair depilación (9 oz.) | Iglesia y Dwight Co., Inc. | N / A | |
| Betadine lavado quirúrgico (1 galón) | Fisher Scientific | 19066452 | |
| Ungüento oftálmico (1 oz.) | Fisher Scientific | 19082795 |
Herramientas quirúrgicas:
| Nombre (descripción / cantidad) | Proveedor | Número de catálogo |
| FST 250 Hot cordón esterilizador | Herramientas de Bellas Ciencia | 18000-45 |
| Iris Tijeras (11 cm de largo) | World Precision Instruments | 500216 |
| Potts-Smith Pinzas (recta, 18 cm; 1x2 dientes) | Herramientas de Bellas Ciencia | 11024-18 |
| McPherson Vannas Tijeras (5 cuchillas mm) | World Precision Instruments | 14124-G |
| Dumont # 5 Pinzas-Dumoxel Standard Tip | Herramientas de Bellas Ciencia | 11252-30 |
| Dumont º 5/45 Pinzas-Dumoxel Standard Tip | Herramientas de Bellas Ciencia | 11251-35 |
| Ultra Hemostats Bellas (recto; superficies lisas en su interior) | Herramientas de Bellas Ciencia | 13020-12 |
| Carbón activado en polvo (500 g) | Fisher Scientific | C272-500 |
| Tamaño 6-0 Suturas con aguja C-1 (Silk estéril, Negro, trenzado,No absorbible, 18 "de longitud, caja de 36) | Roboz | SUT-1073-1011 |
| Reflejo de aplicador de clips (de 9 mm clips) | World Precision Instruments | 500345 |
| 9 mm de acero inoxidable Reflex Clips (caja de 100) | World Precision Instruments | 500346 |
Cuidado de Animales:
| Nombre (descripción / cantidad) | Proveedor | Número de catálogo |
| De sodio al 0,9% de cloruro de inyección (sin conservantes; 20 ml) | Hospira | 0409-4888-20 |
| Sistema completo Manta homeotérmicos con sonda flexible (mediana, 115 VAC, 60 Hz) | Aparato de Harvard | 507222F |
Platfor quirúrgicam, y retractores:
(Comprada en la tienda local de hardware)
| Nombre (descripción /) | Cantidad |
| Plataforma de acero inoxidable (molido; ~ 12 "x12" x1 / 8 ") | 1 |
| Botón de imanes (Ejemplo: Eclipse E825) | 3 |
| Pernos de acero inoxidable (3 "de largo, diámetro determinado por el imán de botón) | 3 |
| Tuercas de acero inoxidable (tamaño para adaptarse a los pernos) | 9 |
| Las bandas de goma (tensión de Luz) | 3 |
| Pasadores de insectos (ambos extremos doblados para formar ganchos) | 3 |
Semi-Thins:
| Nombre (descripción / cantidad) | Proveedor </ Strong> | Número de catálogo |
| El paraformaldehído (1 kg) | Sigma-Aldrich | P6148-1kg |
| Fosfato de sodio dibásico anhidro (500 g, que se utiliza para preparar tampón fosfato) | Fisher Scientific | S375-500 |
| Fosfato de sodio monobásico anhidro (1 kg, que se utiliza para preparar tampón fosfato) | Fisher Scientific | AC38987-0010 |
| Glutaraldehído (50%; 10 x 10 ml) | Ted Pella, Inc. | 18431 |
| Tetróxido de osmio (4% acuoso, 10 x 10 ml) | Ted Pella, Inc. | 18465 |
| Óxido de propileno (450 ml) | Ted Pella, Inc. | 18601 |
| Insertar 812 (Kit, para los bloques de disco duro o alto contraste de imagen) | Microscopía Electrónica de Ciencias | 14120 |
| Toluidine Azul (25 g) | Ted Pella, Inc. | 19451 |
Todo el montaje en la preparación muscular y de inmunohistoquímica:
| Nombre (descripción / cantidad) | Proveedor | Número de catálogo |
| El paraformaldehído (1 kg) | Sigma-Aldrich | P6148-1kg |
| Fosfato de sodio dibásico anhidro (500 g, que se utiliza para preparar tampón fosfato) | Fisher Scientific | S375-500 |
| Fosfato de sodio monobásico anhidro (1 kg, que se utiliza para preparar tampón fosfato) | Fisher Scientific | AC38987-0010 |
| 10% de diluyente de BSA / solución de bloqueo (200 ml) | Kirkegaard & Perry Laboratories, Inc. | 50-61-00 |
| Triton X-100 (100 ml) | Punto Científico Incorporated | 9002-93-1 |
| La glicina, 98% (1 kg) | Fisher Scientific | AC12007-0010 |
| Tissue-Tek Cryo-octubre Compuesto (Caja de 12, 4 botellas de oz) | Fisher Scientific | 14-373-65 |
| Sylgard DOW 170 (2 Kit de libras) | Fisher Scientific | NC9492579 |
| Pasadores de acero inoxidable de insectos, tamaño 1 (100/caja) | Herramientas de Bellas Ciencia | 26001-40 |
| Tetrametilrodamina-A-bungarotoxina (0,5 mg) | Sigma-Aldrich | T0195-.5MG |
| Anticuerpo monoclonal de ratón contra el SMI-312 (0,1 ml) | Covance | SMI-312R |
| Anticuerpo monoclonal de ratón contra SV2 (0,1 ml) | Estudios del Desarrollo del Banco hibridoma (DSHB) | SV2 |
| Conejo Polyanticuerpo monoclonal contra el GAP-43 | Novus Productos Biológicos | NB300-143 |
| Fluoresceína conjugado de cabra anti-IgG de ratón, Fc gamma Subclase una específica | Jackson ImmunoResearch | 11 5-095-205 |
| DyLight 649 burro conjugado anti-IgG de conejo | Jackson ImmunoResearch | 711-495-152 |
| 4 ',6-diamino-2-fenilindol (DAPI, dilactato; 10 mg) | Invitrogen | D3571 |
| Medio de montaje Vectashield (10 ml) | Vector Laboratories | H-1000 |
| Superfrost Plus preparaciones para microscopio (Blanco, Tamaño: 75 x 25 mm, paquete de 144) | Fisher Scientific | 12-550-15 |
| Fisherfinest gafas Premium Cover (Tamaño: 40 x 22 mm; Paquete de 1 oz.) | Fisher Scientific | 12-548-5C |
Referencias
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados