Creazione di una colonna di Winogradsky: un metodo per arricchire le specie microbiche presenti in un campione di sedimento
Panoramica
Fonte: Elizabeth Suter1, Christopher Corbo1, Jonathan Blaize1
1 Dipartimento di Scienze Biologiche, Wagner College, 1 Campus Road, Staten Island NY, 10301
La colonna Winogradsky è un ecosistema in miniatura e chiuso utilizzato per arricchire le comunità microbiche dei sedimenti, in particolare quelle coinvolte nel ciclo dello zolfo. La colonna fu utilizzata per la prima volta da Sergei Winogradsky nel 1880 e da allora è stata applicata nello studio di molti microrganismi diversi coinvolti nella biogeochimica, come fotosintetizzatori, ossidanti dello zolfo, riduttori di solfato, metanogeni, ossidanti del ferro, ciclori di azoto e altro (1,2).
La maggior parte dei microrganismi sulla Terra sono considerati incoltibili, il che significa che non possono essere isolati in una provetta o su una capsula di Petri (3). Ciò è dovuto a molti fattori, tra cui il fatto che i microrganismi dipendono da altri per determinati prodotti metabolici. Le condizioni in una colonna di Winogradsky imitano da vicino l'habitat naturale di un microrganismo, comprese le loro interazioni con altri organismi, e consentono di farli crescere in laboratorio. Pertanto, questa tecnica consente agli scienziati di studiare questi organismi e capire quanto siano importanti per i cicli biogeochimici della Terra senza doverli coltivare in isolamento.
Gli ambienti della Terra sono pieni di microrganismi che prosperano in tutti i tipi di habitat,come suoli, acqua oceanica, nuvole e sedimenti di acque profonde. In tutti gli habitat, i microrganismi dipendono l'uno dall'altro. Man mano che un microrganismo cresce, consuma particolari substrati,inclusi combustibili ricchi di carbonio come zuccheri e sostanze nutritive, vitamine e gas respiratori come l'ossigeno. Quando queste importanti risorse si esauriscono, diversi microrganismi con diverse esigenze metaboliche possono quindi fiorire e prosperare. Ad esempio, nella colonna Winogradsky, i microbi consumano prima il materiale organico aggiunto mentre esauriscono l'ossigeno negli strati inferiori della colonna. Una volta esaurito l'ossigeno, gli organismi anaerobici possono quindi prendere il sopravvento e consumare diversi materiali organici. Questo sviluppo consecutivo di diverse comunità microbiche nel tempo è chiamato successione (4). La successione microbica è importante in una colonna di Winogradsky, dove l'attività microbica cambia la chimica del sedimento, che quindi influenza l'attività di altri microbi e così via. Molti microrganismi nei suoli e nei sedimenti vivono anche lungo gradienti, che sono zone di transizione tra due diversi tipi di habitat in base alle concentrazioni di substrati (5). Nel punto corretto del gradiente, un microbo può ricevere quantità ottimali di diversi substrati. Man mano che una colonna winogradsky si sviluppa, inizia a imitare questi gradienti naturali, in particolare nell'ossigeno e nel solfuro (Fig. 1).
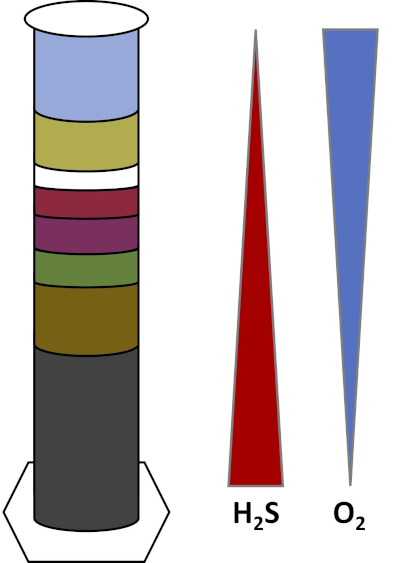
Figura 1: Rappresentazione dei gradienti di ossigeno (O2) e solfuro (H2S) che si sviluppano in una colonna di Winogradsky.
In una colonna Winogradsky, il fango e l'acqua di uno stagno o di una zona umida sono mescolati in una colonna trasparente e lasciati incubare, in genere alla luce. Ulteriori substrati vengono aggiunti alla colonna per fornire alla comunità fonti di carbonio, di solito sotto forma di cellulosa e zolfo. I fotosintetizzatori in genere iniziano a crescere negli strati superiori del sedimento. Questi microrganismi fotosintetici sono in gran parte composti da cianobatteri, che producono ossigeno e appaiono come uno strato verde o rosso-marrone (Fig. 2, Tabella 1). Mentre la fotosintesi produce ossigeno, l'ossigeno non è molto solubile in acqua e diminuisce al di sotto di questo strato (Fig. 1). Questo crea un gradiente di ossigeno, che va da alte concentrazioni di ossigeno negli strati superiori a zero ossigeno negli strati inferiori. Lo strato ossigenato è chiamato strato aerobico e lo strato senza ossigeno è chiamato strato anaerobico.
Nello strato anaerobico, molte diverse comunità microbiche possono proliferare a seconda del tipo e della quantità di substrati disponibili, della fonte dei microbi iniziali e della porosità del sedimento. Nella parte inferiore della colonna, gli organismi che anaerobamente abbattono la materia organica possono prosperare. La fermentazione microbica produce acidi organici dalla scomposizione della cellulosa. Questi acidi organici possono quindi essere utilizzati dai riduttori di solfato, che ossidano quelle sostanze organiche usando il solfato e producono solfuro come sottoprodotto. L'attività dei riduttori di solfato è indicata se il sedimento diventa nero, perché ferro e solfuro reagiscono per formare minerali di solfuro di ferro nero (Fig. 2, Tabella 1). Il solfuro si diffonde anche verso l'alto, creando un altro gradiente in cui le concentrazioni di solfuro sono alte nella parte inferiore della colonna e basse nella parte superiore della colonna (Fig. 1).
Vicino al centro della colonna, gli ossidanti di zolfo sfruttano l'apporto di ossigeno dall'alto e solfuro dal basso. Con la giusta quantità di luce, gli ossidanti fotosintetici dello zolfo possono svilupparsi in questi strati. Questi organismi sono noti come batteri dello zolfo verde e viola e spesso appaiono come filamenti e macchie verdi, viola o rosso porpora (Fig. 2, Tabella 1). I batteri dello zolfo verde hanno una maggiore tolleranza per il solfuro e di solito si sviluppano nello strato direttamente sotto i batteri dello zolfo viola. Sopra i batteri dello zolfo viola, possono anche svilupparsi batteri viola non solforo. Questi organismi fotosintetizzano usando acidi organici come donatori di elettroni invece di solfuro e spesso appaiono come uno strato rosso, viola, arancione o marrone. Gli ossidanti di zolfo non fotosintetici possono svilupparsi sopra i batteri viola non solforati, e questi di solito appaiono come filamenti bianchi (Fig. 2, Tabella 1). Inoltre, le bolle possono anche formarsi nella colonna Winogradsky. Le bolle negli strati aerobici indicano la produzione di ossigeno da parte dei cianobatteri. Le bolle negli strati anaerobici sono probabilmente dovute all'attività dei metanogeni,organismi che anaerobicamente abbattono la materia organica e formano il metano come sottoprodotto.
| Posizione nella colonna | Gruppo funzionale | Esempi di organismi | Indicatore visivo |
| In alto | Fotosintetizzatori | Cianobatteri | Strato verde o bruno-rossastro. A volte bolle di ossigeno. |
| Ossidanti dello zolfo non fotosintetici | Beggiatoa, Thiobacilus | Strato bianco. | |
| Batteri viola nonsolforo | Rhodomicrobium, Rhodospirilum, Rhodopseuodmonas | Strato rosso, viola, arancione o marrone. | |
| Batteri dello zolfo viola | Cromatio | Strato viola o rosso porpora. | |
| Batteri dello zolfo verde | Clorobio | Strato verde. | |
| Batteri che riducono il solfato | Desulfovibrio, Desulfotomaculum, Desulfobacter, Desulfuromonas | Strato nero. | |
| Fondoschiena | Metanogeni | Metanococco, Metanosarcina | A volte bolle di metano. |
Tabella 1: I principali gruppi di batteri che possono apparire in una classica colonna Winogradsky, dall'alto verso il basso. Vengono forniti esempi di organismi di ciascun gruppo e vengono elencati gli indicatori visivi di ciascuno strato di organismi. Basato su Perry et al. (2002) e Rogan et al. (2005).
Procedura
1. Configurazione
- Per impostare una colonna Winogradsky, avrai bisogno di alcune forniture di base:
- Una pala, un secchio e una bottiglia per raccogliere i campioni sul campo
- Un recipiente verticale e trasparente, come un cilindro graduato o una bottiglia d'acqua di plastica di circa 1L
- Involucro di plastica e elastici
- grandi ciotole di miscelazione e cucchiaio grande per mescolare
- Una fonte di zolfo (tuorlo d'uovo o solfato di calcio)
- Una fonte di carbonio organico (cellulosa, sotto forma di giornale triturato)
- Una fonte di luce (finestra soleggiata o lampada da tavolo)
- Suolo o fango raccolti da una palude, zona umida, stagno o ruscello
- Acqua dello stesso habitat
- FACOLTATIVO Per alcuni degli esperimenti facoltativi descritti in questo protocollo sarà necessario quanto segue:
- Sale da tavola
- Cellophane di colore diverso
- Una fonte di ferro (come un chiodo o lana d'acciaio)
- Un frigorifero con una fonte di luce
- Un radiatore vicino a una fonte di luce
- Se si utilizza una bottiglia d'acqua di plastica, tagliare l'area del collo in modo che la colonna sia di forma cilindrica. Rimuovere eventuali involucri in modo che la luce possa penetrare attraverso la plastica.
- Le uova crude possono contenere Salmonella e devono essere maneggiate con cura. Dovrebbero essere seguite tecniche adeguate per il lavaggio delle mani. In alternativa, è possibile utilizzare l'uovo sodo. Inoltre, non c'è modo di sapere con certezza se fango o sedimenti sono contaminati da acque reflue o altre sostanze nocive. I guanti devono essere usati quando si mescola il fango e si imposta la colonna.
2. Assemblaggio di una colonna Winogradsky
- Usando la pala, scavare e raccogliere il fango nel secchio. I sedimenti dovrebbero essere vicino al bordo dell'acqua e completamente saturi di acqua. Avrai bisogno di abbastanza fango per riempire ogni colonna Winogradsky. Raccogliere un po 'd'acqua dalla stessa fonte nella bottiglia del campione (sono necessari circa 3000 ml per colonna).
- In laboratorio, trasferisci abbastanza fango nella prima ciotola di miscelazione per riempire ~ 75% della colonna di volume da 1 litro. Quindi, setacciare per rimuovere grandi rocce, ramoscelli o foglie mentre si utilizza il cucchiaio per rompere i ciuffi.
- Aggiungi un po 'dell'acqua che hai raccolto nella ciotola di miscelazione mentre mescoli. Aggiungere fino a quando la consistenza della miscela acqua-fango è come un frappè. Continua ad assicurarti che non ci siano grumi.
- Trasferire circa 1/3 del frappè di fango d'acqua nella seconda ciotola. Aggiungere il tuorlo d'uovo e una manciata di giornale tritato e mescolare.
- Aggiungere la miscela di fango, tuorlo d'uovo e giornale alla colonna fino a quando la colonna è piena di circa 1/4.
- Aggiungere la normale miscela acqua-fango nella colonna fino a quando la colonna è piena di circa 3/4.
- Aggiungi l'acqua aggiuntiva alla colonna, lasciando solo un piccolo spazio (~ 1/2 pollice) di aria in cima.
- Coprire la colonna con un involucro di plastica e fissare con un elastico.
- Incubare la colonna nella luce a temperatura ambiente.
- Per le prossime 4-8 settimane, monitorare i cambiamenti nella colonna Winogradsky per lo sviluppo di diversi strati colorati e la formazione di bolle, come descritto nella Tabella 1. Inoltre, è necessario registrare il tempo necessario per lo sviluppo di diversi livelli.
3. Modifiche opzionali alla colonna Winogradsky classica
- Aggiungere 25-50 g di sale per 1L di colonna Winogradsky al fango raccolto prima di aggiungere acqua e mescolare (passaggio 2.3). L'aggiunta di sale seleziona per i batteri alofili (amanti del sale).
- Substrati alternativi, come il ferro, sotto forma di chiodo o lana d'acciaio, possono essere aggiunti alla colonna insieme al tuorlo d'uovo e al giornale triturato (passaggio 2.4). Questo arricchirà i batteri ossidanti il ferro, come la Gallionella,e apparirà come uno strato color ruggine.
- Invece della temperatura ambiente (passaggio 2.9), la colonna può essere incubata vicino a un radiatore per selezionare i batteri termofili (amanti del calore) o in un frigorifero con una fonte di luce da selezionare per i batteri psicrofili (amanti del freddo).
- La quantità di luce che una colonna riceve durante l'incubazione (passaggio 2.9) può anche essere variata posizionando diverse colonne in condizioni di luce alta, scarsa illuminazione o oscurità.
- La lunghezza d'onda della luce in arrivo può essere limitata coprendo la colonna con cellophanes diversamente ombreggiati mentre incuba (passaggio 2.9) per determinare quali colori selezionano per diversi gruppi batterici.
4. Analisi dei dati
- Dopo 1-3 settimane, dovrebbe essere visibile una colorazione verde sulla parte superiore dello strato di fango della classica colonna Winogradsky (Fig. 2A). Questi sono i primi segni di crescita dello strato cianobatterico.
- Nel tempo, continuare a monitorare l'aspetto e l'evoluzione dei diversi strati, ognuno indicativo dei diversi tipi batterici. SUGGERIMENTO: Fare riferimento ai concetti e alla tabella 1 per capire quali batteri contribuiscono ai diversi strati.

Figura 2A: Una foto di una classica colonna Winogradsky che ha incubato a temperatura ambiente per 21 giorni. Si noti il sedimento verde, indicativo di cianobatteri, nella parte superiore della colonna.
- Se sono state preparate anche modifiche alla classica colonna Winogradsky, confrontare i risultati di ciascuna colonna.
- Osservate i livelli in ciascuna delle colonne Winogradsky modificate. Prendi nota di quanto segue:
- Le colonne presentano lo stesso numero di livelli?
- Gli strati sono dello stesso colore e spessore?
- Gli strati si verificano alle stesse profondità?
- Quanto tempo ci è voluto per sviluppare ogni colonna?
- Una colonna si è sviluppata più lentamente delle altre?
- Osservate i livelli in ciascuna delle colonne Winogradsky modificate. Prendi nota di quanto segue:
Risultati
In questo esperimento, acqua e sedimenti sono stati raccolti da un habitat di acqua dolce. Due colonne Winogradsky sono state costruite e lasciate sviluppare: una classica colonna Winogradsky incubata nella luce a temperatura ambiente (Fig. 2A) e una colonna Winogradsky incubata al buio a temperatura ambiente (Fig. 2B).

Figura 2B: Una foto della classica colonna Winogradsky (a sinistra), incubata a temperatura ambiente alla luce per 68 giorni e una colonna Winogradsky incubata a temperatura ambiente al buio per 68 giorni (a destra).
Dopo aver permesso alle colonne di svilupparsi per 7-9 settimane, gli strati nella colonna classica possono essere confrontati con la colonna incubata al buio (Fig. 2B). Nella classica colonna Winogradsky, uno strato cianobatterico verde può essere osservato vicino alla parte superiore del tubo. Vicino al centro del tubo, si può osservare uno strato rosso-viola, indicativo di batteri viola nonulfur. Sotto questo strato, si osserva uno strato rosso porpora, indicativo di batteri di zolfo viola. Direttamente sotto questo strato, il sedimento nero può essere osservato nella regione anaerobica della colonna, indicativo di batteri che riducono il solfato.
La colonna cresciuta al buio (Fig. 2B) si sviluppò in modo diverso rispetto alla classica colonna Winogradsky. Come la colonna classica, la colonna scura produceva sedimenti neri vicino al fondo della colonna, indicativi di batteri che riducono il solfato. La colonna scura non ha prodotto lo strato cianobatterico verde, né gli strati rossi, viola o verdi indicativi di batteri viola non solforo, zolfo viola e zolfo verde, rispettivamente. Questi gruppi dipendono dalla luce per la crescita e quindi non sono in grado di crescere al buio.
I risultati precisi di ogni colonna di Winogradsky varieranno ampiamente con le loro condizioni di incubazione e i loro habitat di origine.
Le comunità microbiche provenienti da habitat d'acqua dolce non saranno abituate ad alte concentrazioni di sale e l'aggiunta di sale può rallentare o inibire la crescita. Al contrario, ci possono essere sufficienti batteri alofili negli habitat salmastri e di acqua salata in modo che l'aggiunta di sali non faccia alcuna differenza o addirittura migliori la crescita di particolari strati rispetto a una colonna senza sali aggiunti.
I sedimenti sabbiosi sono più porosi dei sedimenti fangosi. Se in tali sedimenti porosi viene prodotto abbastanza solfuro, i solfuri possono diffondersi fino alla cima della colonna e inibire la crescita degli organismi aerobici. In questo caso, la colonna può contenere solo strati indicativi di anaerobi e non può contenere aerobi, come i cianobatteri.
L'acqua dolce contiene generalmente meno solfato dell'acqua salata. Il solfato è importante per la crescita dei batteri che riducono il solfato. I riduttori di solfato creano solfuro come sottoprodotto e sono indicati dallo sviluppo di uno strato nero nella parte inferiore della colonna. Se il solfato non viene integrato alle comunità di acqua dolce, i riduttori di solfato potrebbero non produrre abbastanza solfuro. La creazione del sottoprodotto del solfuro è importante per la crescita dei batteri dello zolfo verde e viola e degli ossidanti dello zolfo non fotosintetici. In questi casi, gli ossidanti dello zolfo possono ancora crescere usando il tuorlo d'uovo come fonte di zolfo, anche se i riduttori di solfato (strato nero) non si sviluppano mai.
Diverse lunghezze d'onda della luce dovrebbero selezionare per organismi con diversi pigmenti di assorbimento. Una colonna tenuta al buio consentirà solo agli organismi non fotosintetici di crescere, compresi i riduttori di solfato, gli ossidanti del ferro e i metanogeni. I fotosintetizzatori hanno pigmenti che assorbono la luce a diverse lunghezze d'onda all'interno dell'intervallo visibile (~ 400-700nm). Coprendo una colonna con, ad esempio, cellophane blu, la luce blu (~ 450-490nm) viene bloccata dall'entrare nella colonna. Tutti i fotosintetizzatori nella colonna hanno pigmenti che richiedono le lunghezze d'onda blu (6) e la loro crescita dovrebbe essere inibita. D'altra parte, il cellophane rosso bloccherà la luce di ~ 635-700nm. Queste lunghezze d'onda sono importanti per i pigmenti utilizzati dai cianobatteri (6), mentre lo zolfo viola, lo zolfo verde e i batteri viola non solforati possono ancora essere in grado di crescere.
Diverse comunità microbiche possono avere capacità adattive molto diverse per far fronte ai cambiamenti di temperatura. Le alte temperature possono aumentare i tassi di attività microbica quando sono presenti sufficienti termofili. D'altra parte, in assenza di termofili, le alte temperature possono ridurre l'attività microbica complessiva. Allo stesso modo, le basse temperature possono ridurre l'attività microbica complessiva a meno che la comunità microbica non contenga abbastanza psicrofili.
Applicazione e Riepilogo
La colonna Winogradsky è un esempio di ecosistema microbico interdipendente. Dopo aver mescolato fango, acqua e substrati aggiuntivi di carbonio e zolfo in una colonna verticale, l'ecosistema stratificato dovrebbe stabilizzarsi in zone separate e stabili per diverse settimane. Queste zone sono occupate da diversi microrganismi che prosperano in un punto particolare lungo il gradiente tra il sedimento ricco di solfuro nella parte inferiore e il sedimento ricco di ossigeno nella parte superiore. Manipolando le condizioni e i substrati all'interno della colonna Winogradsky, si può osservare la presenza e l'attività di diversi microrganismi come alofili, termofili, psicrofili, ossidanti dello zolfo, riduttori di zolfo, ossidanti del ferro e fotosintetizzatori.
Riferimenti
- Zavarzin G. (2006). Winogradsky and modern microbiology. Microbiology 75(6): 501-511. doi: 10.1134/s0026261706050018
- Esteban DJ, Hysa B, and Bartow-McKenney C (2015). Temporal and Spatial Distribution of the Microbial Community of Winogradsky Columns. PLoS ONE 10(8): e0134588. doi:10.1371/journal.pone.0134588
- Lloyd KG, Steen AD, Ladau J, Yin J, and Crosby L. (2018). Phylogenetically novel uncultured microbial cells dominate Earth microbiomes. mSystems 3(5): e00055-18. doi:10.1128/mSystems.00055-18
- Anderson DC, and Hairston RV (1999). The Winogradsky Column & Biofilms: Models for Teaching Nutrient Cycling & Succession in an Ecosystem. The American Biology Teacher, 61(6): 453-459. doi: 10.2307/4450728
- Dang H, Klotz MG, Lovell CR and Sievert SM (2019) Editorial: The Responses of Marine Microorganisms, Communities and Ecofunctions to Environmental Gradients. Frontiers in Microbiology 10(115). doi: 10.3389/fmicb.2019.00115
- Stomp M, Huisman J, Stal LJ, and Matthijs HCP. (2007) Colorful niches of phototrophic microorganisms shaped by vibrations of the water molecule. ISME Journal. 1(4): 271-282. doi:10.1038/ismej.2007.59
- Perry JJ, Staley JT, and Lory S. (2002) Microbial Life, First Edition, published by Sinauer Associates
- Rogan B, Lemke M, Levandowsky M, and Gorrel T. (2005) Exploring the Sulfur Nutrient Cycle Using the Winogradsky Column. The American Biology Teacher, 67(6): 348-356. doi: 10.2307/4451860
Vai a...
Video da questa raccolta:

Now Playing
Creazione di una colonna di Winogradsky: un metodo per arricchire le specie microbiche presenti in un campione di sedimento
Microbiology
128.6K Visualizzazioni

Diluizioni seriali e piastratura: la conta microbica
Microbiology
314.4K Visualizzazioni

Culture di arricchimento: coltura di microbi aerobici e anaerobici su terreni selettivi e differenziali
Microbiology
131.8K Visualizzazioni

Colture pure e piastratura per striscio: isolamento di singole colonie batteriche da un campione misto
Microbiology
165.8K Visualizzazioni

Sequenziamento dell'rRNA 16S: una tecnica basata sulla PCR per identificare le specie batteriche
Microbiology
188.1K Visualizzazioni

Curve di crescita: generazione di curve di crescita utilizzando le unità formanti colonia e la misurazione della densità ottica
Microbiology
293.7K Visualizzazioni

Test di suscettibilità agli antibiotici: test dell'epsilometro per determinare i valori MIC di due antibiotici e valutare la sinergia antibiotica
Microbiology
93.5K Visualizzazioni

Microscopia e colorazioni: la colorazione di Gram, delle endospore e del capside
Microbiology
362.6K Visualizzazioni

Saggio delle placche: un metodo per determinare il titolo virale in unità formanti placca (UFP)
Microbiology
185.8K Visualizzazioni

Trasformazione di cellule di E. coli tramite l'utilizzo di una procedura basata sul metodo del cloruro di calcio
Microbiology
86.4K Visualizzazioni

Coniugazione: un metodo per trasferire la resistenza all'ampicillina dal donatore al ricevente E. coli
Microbiology
38.1K Visualizzazioni

La trasduzione batterica tramite fagi: un metodo per trasferire la resistenza all'ampicillina da una cellula donatore di E. coli ad una ricevente
Microbiology
29.0K Visualizzazioni