Création d'une colonne de Winogradsky : une méthode pour enrichir les espèces microbiennes dans un échantillon de sédiments.
Vue d'ensemble
Source: Elizabeth Suter1, Christopher Corbo1, Jonathan Blaize1
1 Département des sciences biologiques, Wagner College, 1 Campus Road, Staten Island NY, 10301
La colonne Winogradsky est un écosystème miniature et clos utilisé pour enrichir les communautés microbiennes des sédiments, en particulier celles qui participent au cycle du soufre. La colonne a été utilisée pour la première fois par Sergueï Winogradsky dans les années 1880 et a depuis été appliquée dans l'étude de nombreux micro-organismes divers impliqués dans la biogéochimie, tels que les photosynthétiseurs, les oxydants de soufre, les réducteurs de sulfate, les méthanogènes, les oxydants de fer, l'azote cyclistes, et plus (1,2).
La majorité des micro-organismes sur Terre sont considérés comme inexplicables,ce qui signifie qu'ils ne peuvent pas être isolés dans un tube à essai ou sur un plat de Pétri (3). Cela est dû à de nombreux facteurs, y compris que les micro-organismes dépendent d'autres pour certains produits métaboliques. Les conditions d'une colonne Winogradsky imitent étroitement l'habitat naturel d'un micro-organisme, y compris leurs interactions avec d'autres organismes, et permettent de les cultiver en laboratoire. Par la présente, cette technique permet aux scientifiques d'étudier ces organismes et de comprendre à quel point ils sont importants pour les cycles biogéochimiques de la Terre sans avoir à les cultiver isolément.
Les environnements de la Terre sont pleins de micro-organismes qui prospèrent dans tous les types d'habitats,tels que les sols, l'eau de mer, les nuages et les sédiments des eaux profondes. Dans tous les habitats, les micro-organismes dépendent les uns des autres. Comme un micro-organisme se développe, il consomme des substratsparticuliers , y compris les combustibles riches en carbone comme les sucres ainsi que les nutriments, vitamines et gaz respiratoires comme l'oxygène. Lorsque ces ressources importantes s'épuisent, différents micro-organismes ayant des besoins métaboliques différents peuvent alors fleurir et prospérer. Par exemple, dans la colonne Winogradsky, les microbes consomment d'abord la matière organique ajoutée tout en appauvrissant l'oxygène dans les couches inférieures de la colonne. Une fois que l'oxygène est utilisé, les organismes anaérobies peuvent alors prendre le relais et consommer différentes matières organiques. Ce développement consécutif de différentes communautés microbiennes au fil du temps s'appelle la succession (4). La succession microbienne est importante dans une colonne Winogradsky, où l'activité microbienne modifie la chimie des sédiments, ce qui affecte ensuite l'activité d'autres microbes et ainsi de suite. De nombreux micro-organismes dans les sols et les sédiments vivent également le long des gradients,qui sont des zones transitoires entre deux types différents d'habitats en fonction des concentrations de substrats (5). Au bon endroit dans le gradient, un microbe peut recevoir des quantités optimales de différents substrats. Au fur et à mesure qu'une colonne Winogradsky se développe, elle commence à imiter ces gradients naturels, en particulier dans l'oxygène et le sulfure (fig. 1).
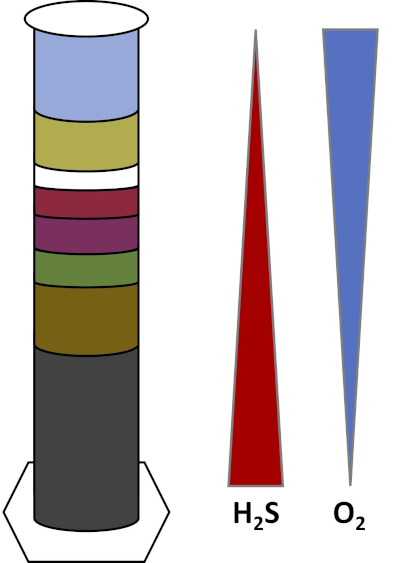
Figure 1 : Représentation des gradients d'oxygène (O2) et de sulfure (H2S) qui se développent dans une colonne Winogradsky.
Dans une colonne Winogradsky, la boue et l'eau d'un étang ou d'une zone humide sont mélangées dans une colonne transparente et autorisées à incuber, généralement dans la lumière. Des substrats supplémentaires sont ajoutés à la colonne pour donner à la communauté des sources de carbone, généralement sous forme de cellulose, et de soufre. Les photosynthétiseurs commencent généralement à pousser dans les couches supérieures des sédiments. Ces micro-organismes photosynthétiques sont en grande partie composés de cyanobactéries,qui produisent de l'oxygène et apparaissent sous forme de couche verte ou rouge-brun (fig. 2, tableau 1). Bien que la photosynthèse produise de l'oxygène, l'oxygène n'est pas très soluble dans l'eau et diminue en dessous de cette couche (fig. 1). Cela crée un gradient d'oxygène, allant de fortes concentrations d'oxygène dans les couches supérieures à zéro oxygène dans les couches inférieures. La couche oxygénée est appelée la couche aérobie et la couche sans oxygène est appelée la couche anaérobie.
Dans la couche anaérobie, de nombreuses communautés microbiennes différentes peuvent proliférer selon le type et la quantité de substrats disponibles, la source des microbes initiaux et la porosité des sédiments. Au bas de la colonne, les organismes qui décomposent anaérobiement la matière organique peuvent prospérer. La fermentation microbienne produit des acides organiques à partir de la dégradation de la cellulose. Ces acides organiques peuvent ensuite être utilisés par les réducteurs de sulfate,qui oxydent ces matières organiques à l'aide de sulfate, et produisent du sulfure comme sous-produit. L'activité des réducteurs de sulfate est indiquée si les sédiments deviennent noirs, car le fer et le sulfure réagissent pour former des minéraux noirs sulfureux de fer (fig. 2, tableau 1). Le sulfure se diffuse également vers le haut, créant un autre gradient dans lequel les concentrations de sulfure sont élevées dans le bas de la colonne et basses dans le haut de la colonne (fig. 1).
Près du milieu de la colonne, les oxydants de soufre profitent de l'approvisionnement en oxygène d'en haut et de sulfure d'en bas. Avec la bonne quantité de lumière, des oxydants de soufre photosynthétiques peuvent se développer dans ces couches. Ces organismes sont connus sous le nom de bactéries de soufre vert et violet,et apparaissent souvent sous forme de filaments et de taches vert, violet ou rouge pourpre (fig. 2, tableau 1). Les bactéries de soufre vert ont une plus grande tolérance pour le sulfure et se développent habituellement dans la couche directement au-dessous des bactéries de soufre pourpre. Au-dessus des bactéries de soufre pourpre, les bactéries nonsulfures pourpres peuvent également se développer. Ces organismes photosynthétisent à l'aide d'acides organiques comme donneurs d'électrons au lieu de sulfure et apparaissent souvent comme une couche rouge, pourpre, orange ou brune. Les oxydants de soufre non photosynthétiques peuvent se développer au-dessus des bactéries non sulfureuses violettes, et ceux-ci apparaissent habituellement sous forme de filaments blancs (Fig. 2, tableau 1). En outre, des bulles peuvent également se former dans la colonne Winogradsky. Les bulles dans les couches aérobies indiquent la production d'oxygène par les cyanobactéries. Les bulles dans les couches anaérobies sont probablement dues à l'activité des méthanogènes,des organismes qui décomposent anaérobiement la matière organique et forment le méthane comme sous-produit.
| Position dans la colonne | Groupe fonctionnel | Exemples d'organismes | Indicateur visuel |
| Retour au début | Photosynthétiseurs | Cyanobactéries | Couche verte ou brun-rougeâtre. Parfois des bulles d'oxygène. |
| Oxydants de soufre non photosynthétiques | Thiobacilus Beggiatoa | Couche blanche. | |
| Bactéries non sulfureuses violettes | Rhodomicrobium, Rhodospirilum, Rhodopseuodmonas | Couche rouge, violette, orange ou brune. | |
| Bactéries de soufre pourpre | Chromatium | Couche pourpre ou rouge pourpre. | |
| Bactéries vertes de soufre | Chlorobium | Couche verte. | |
| Sulfate Réduction des bactéries | Desulfovibrio, Desulfotomaculum, Desulfobacter, Desulfuromonas | Couche noire. | |
| bas | Methanogens | Méthanocoque, Methanosarcina | Parfois des bulles de méthane. |
Tableau 1 : Les principaux groupes de bactéries qui peuvent apparaître dans une colonne classique Winogradsky, de haut en bas. Des exemples d'organismes de chaque groupe sont donnés, et les indicateurs visuels de chaque couche d'organismes sont énumérés. D'après Perry et coll. (2002) et Rogan et coll. (2005).
Procédure
1. Mise en place
- Pour configurer une colonne Winogradsky, vous aurez besoin de fournitures de base :
- Une pelle, un seau et une bouteille pour recueillir les échantillons sur le terrain
- Un récipient vertical et transparent, tel qu'un cylindre gradué ou une bouteille d'eau en plastique d'environ 1 L
- Enveloppement plastique et élastiques
- grands bols à mélanger et grande cuillère à remuer
- Source de soufre (jaune d'œuf ou sulfate de calcium)
- Une source de carbone organique (cellulose, sous forme de journal déchiqueté)
- Une source de lumière (fenêtre ensoleillée ou lampe de bureau)
- Sol ou boue recueillis dans un marais, une zone humide, un étang ou un cours d'eau
- Eau du même habitat
- OPTIONAL Ce qui suit sera nécessaire pour certaines des expériences facultatives décrites dans ce protocole :
- sel
- Cellophane de couleur différente
- Une source de fer (comme un clou ou de la laine d'acier)
- Un réfrigérateur avec une source lumineuse
- Un radiateur près d'une source de lumière
- Si vous utilisez une bouteille d'eau en plastique, coupez la zone du cou de sorte que la colonne soit de forme cylindrique. Retirez les emballages afin que la lumière puisse pénétrer à travers le plastique.
- Les œufs crus peuvent contenir Salmonella et doivent être manipulés avec soin. Des techniques appropriées de lavage des mains doivent être suivies. Alternativement, l'œuf bouilli peut être utilisé. De plus, il n'y a aucun moyen de savoir avec certitude si de la boue ou des sédiments sont contaminés par des eaux usées ou d'autres substances nocives. Les gants doivent être utilisés lors du mélange de la boue et la mise en place de la colonne.
2. Assemblage d'une colonne Winogradsky
- À l'aide de la pelle, déterrer et ramasser la boue dans le seau. Les sédiments doivent être près du bord de l'eau et complètement saturés d'eau. Vous aurez besoin de suffisamment de boue pour remplir chaque colonne Winogradsky. Recueillir de l'eau de la même source dans la bouteille de l'échantillon (environ 3000 ml par colonne est nécessaire).
- Dans le laboratoire, transférer suffisamment de boue dans le premier bol à mélanger pour remplir 75 % de votre colonne de volume d'un litre. Ensuite, tamisez pour enlever les grosses roches, les brindilles ou les feuilles tout en utilisant la cuillère pour briser les touffes.
- Ajouter un peu d'eau que vous avez recueillie dans le bol à mélanger en remuant. Ajouter jusqu'à ce que la consistance du mélange eau-boue soit comme un milk-shake. Continuez à vous assurer qu'il n'y a pas d'amas.
- Transférer environ 1/3 du milk-shake eau-boue dans le deuxième bol. Ajouter le jaune d'œuf et une poignée de papier journal râpé et mélanger.
- Ajouter le mélange de boue, de jaune d'œuf et de papier journal à la colonne jusqu'à ce que la colonne soit pleine d'environ 1/4.
- Ajouter le mélange régulier eau-boue dans la colonne jusqu'à ce que la colonne est d'environ 3/4 plein.
- Ajouter l'eau supplémentaire à la colonne, ne laissant qu'un petit espace (1/2 pouce) d'air sur le dessus.
- Couvrir la colonne d'une pellicule plastique et fixer avec un élastique.
- Incuber la colonne dans la lumière à température ambiante.
- Pendant les 4 à 8 prochaines semaines, surveillez les changements dans la colonne Winogradsky pour le développement de différentes couches colorées et la formation de bulles, tel que décrit dans le tableau 1. En outre, vous devez enregistrer le temps qu'il faut pour que différentes couches se développent.
3. Modifications facultatives à la colonne Winogradsky classique
- Ajouter 25-50g de sel par colonne Winogradsky 1L à la boue recueillie avant d'ajouter de l'eau et en remuant (étape 2.3). L'ajout de sel sélectionne pour les bactéries halophiles (aimant le sel).
- D'autres substrats, comme le fer, sous la forme d'un clou ou d'une laine d'acier, peuvent être ajoutés à la colonne avec le jaune d'œuf et le journal déchiqueté (étape 2.4). Ceci enrichira les bactéries oxydantes de fer, telles que Gallionella,et apparaîtra comme couche rouille-colorée.
- Au lieu de la température ambiante (étape 2.9), la colonne peut être incubée près d'un radiateur pour choisir pour les bactéries thermophiles (aimant la chaleur) ou dans un réfrigérateur avec une source de lumière à choisir pour les bactéries psychrosphiles (aimant le froid).
- La quantité de lumière qu'une colonne reçoit pendant qu'elle couve (étape 2.9) peut également être modifiée en plaçant différentes colonnes dans la lumière élevée, la lumière basse, ou l'obscurité.
- La longueur d'onde de la lumière entrante peut être limitée en couvrant la colonne avec des cellophanes différemment ombragés pendant qu'elle couve (étape 2.9) pour déterminer quelles couleurs choisissent pour différents groupes bactériens.
4. Analyse des données
- Après 1-3 semaines, une certaine coloration verte sur le dessus de la couche de boue de la colonne classique Winogradsky devrait être visible (Fig. 2A). Ce sont les premiers signes de croissance de la couche cyanobactérienne.
- Au fil du temps, continuer à surveiller l'apparence et l'évolution des différentes couches, chacune indicatrice des différents types bactériens. ASTUCE: Consultez les concepts et le tableau 1 pour comprendre quelles bactéries contribuent aux différentes couches.

Figure 2A : Une photo d'une colonne classique de Winogradsky qui a incubé à la température ambiante pendant 21 jours. Notez les sédiments verts, indicatifs de cyanobactéries, dans la partie supérieure de la colonne.
- Si des modifications à la colonne Classique de Winogradsky ont également été préparées, comparez les résultats de chaque colonne.
- Observez les couches dans chacune des colonnes Winogradsky modifiées. Prenez note des éléments suivants :
- Les colonnes présentent-ils le même nombre de couches ?
- Les couches sont-elles de la même couleur et de la même épaisseur ?
- Les couches se produisent-elles aux mêmes profondeurs ?
- Combien de temps chaque colonne a-t-elle pris à se développer ?
- Une colonne s'est-elle développée plus lentement que les autres ?
- Observez les couches dans chacune des colonnes Winogradsky modifiées. Prenez note des éléments suivants :
Résultats
Dans le le le cours de cette expérience, de l'eau et des sédiments ont été recueillis dans un habitat d'eau douce. Deux colonnes Winogradsky ont été construites et autorisées à se développer : une colonne Winogradsky classique incubée dans la lumière à température ambiante (Fig. 2A) et une colonne Winogradsky incubée dans l'obscurité à température ambiante (fig. 2B).

Figure 2B : Une photo de la colonne classique De Winogradsky (à gauche), incubée à température ambiante en lumière pendant 68 jours et une colonne Winogradsky incubée à température ambiante dans l'obscurité pendant 68 jours (à droite).
Après avoir laissé les colonnes se développer pendant 7-9 semaines, les couches de la colonne classique peuvent être comparées à la colonne incubée dans l'obscurité (Fig. 2B). Dans la colonne classique de Winogradsky, une couche cyanobactérienne verte peut être observée près du sommet du tube. Près du centre du tube, une couche rouge-violet peut être observée, indicatif de bactéries pourpres nonsulfures. Sous cette couche, une couche pourpre-rouge est observée, indicatif de bactéries de soufre pourpre. Directement sous cette couche, les sédiments noirs peuvent être observés dans la région anaérobie de la colonne, indicatif de sulfate réduisant les bactéries.
La colonne cultivée dans l'obscurité (Fig. 2B) s'est développée différemment de la colonne classique de Winogradsky. Comme la colonne classique, la colonne sombre a produit des sédiments noirs près du fond de la colonne, indicatif de sulfate réduisant les bactéries. La colonne foncée n'a pas donné la couche cyanobactérienne verte, ni les couches rouges, pourpres, ou vertes indicatifs de nonsulfur violet, de soufre pourpre, et de bactéries vertes de soufre, respectivement. Ces groupes dépendent de la lumière pour la croissance, et donc incapables de croître dans l'obscurité.
Les résultats précis de chaque colonne Winogradsky varieront considérablement en fonction de leurs conditions d'incubation et de leurs habitats sources.
Les communautés microbiennes provenant d'habitats d'eau douce ne seront pas habituées à des concentrations élevées de sel et l'ajout de sel pourrait ralentir ou inhiber la croissance. Inversement, il peut y avoir suffisamment de bactéries halophiles dans les habitats saumâtres et d'eau salée de sorte que l'ajout de sels ne fait aucune différence ou même améliore la croissance de couches particulières par rapport à une colonne sans sels ajoutés.
Les sédiments sablonneux sont plus poreux que les sédiments boueux. Si suffisamment de sulfure est produit dans de tels sédiments poreux, les sulfures peuvent se diffuser jusqu'au sommet de la colonne et inhiber la croissance des organismes aérobies. Dans ce cas, la colonne ne peut contenir que des couches indicatives d'anaerobes et ne peut contenir aucun aerobes, comme les cyanobactéries.
L'eau douce contient généralement moins de sulfate que l'eau salée. Le sulfate est important pour la croissance des bactéries qui réduisent le sulfate. Les réducteurs de sulfate créent le sulfure comme sous-produit et sont indiqués par le développement d'une couche noire dans le bas de la colonne. Si le sulfate n'est pas complété par les communautés d'eau douce, les réducteurs de sulfate peuvent ne pas produire assez de sulfure. La création du sous-produit sulfureux est importante pour la croissance des bactéries de soufre vert et pourpre et des oxydants de soufre non photosynthétiques. Dans ces cas, les oxydants de soufre peuvent encore pousser en utilisant le jaune d'œuf comme source de soufre, même si les réducteurs de sulfate (couche noire) ne se développent jamais.
Différentes longueurs d'onde de la lumière devraient choisir pour les organismes avec différents pigments d'absorption. Une colonne maintenue dans l'obscurité ne permettra qu'à la croissance d'organismes non photosynthétiques, y compris les réducteurs de sulfate, les oxydants de fer et les méthanogènes. Les photosynthétiseurs ont des pigments qui absorbent la lumière à différentes longueurs d'onde dans la plage visible (400-700nm). En couvrant une colonne avec, par exemple, du cellophane bleu, la lumière bleue (450-490nm) est bloquée d'entrer dans la colonne. Tous les photosynthétiseurs de la colonne ont des pigments qui nécessitent les longueurs d'onde bleues (6) et leur croissance doit être inhibée. D'autre part, le cellophane rouge bloquera la lumière de 635-700nm. Ces longueurs d'onde sont importantes pour les pigments utilisés par les cyanobactéries (6), tandis que le soufre violet, le soufre vert et les bactéries pourpres non sulfureuses peuvent encore être en mesure de croître.
Différentes communautés microbiennes peuvent avoir des capacités d'adaptation très différentes pour faire face aux changements de température. Des températures élevées peuvent augmenter les taux d'activité microbienne lorsqu'il y a suffisamment de thermophiles. D'autre part, en l'absence de thermophiles, des températures élevées peuvent diminuer l'activité microbienne globale. De même, les basses températures peuvent diminuer l'activité microbienne globale à moins que la communauté microbienne ne contienne suffisamment de psychrophiles.
Applications et Résumé
La colonne Winogradsky est un exemple d'écosystème microbien interdépendant. Après avoir mélangé de la boue, de l'eau et des substrats de carbone et de soufre supplémentaires dans une colonne verticale, l'écosystème stratifié devrait se stabiliser en zones séparées et stables pendant plusieurs semaines. Ces zones sont occupées par différents micro-organismes qui s'épanouissent à un endroit particulier le long du gradient entre les sédiments riches en sulfures dans le fond et les sédiments riches en oxygène au sommet. En manipulant les conditions et les substrats dans la colonne Winogradsky, la présence et l'activité de différents micro-organismes tels que les halophiles, les thermophiles, les psychrophiles, les oxydateurs de soufre, les réducteurs de soufre, les oxydateurs de fer et les photosynthétiseurs peuvent être observés.
References
- Zavarzin G. (2006). Winogradsky and modern microbiology. Microbiology 75(6): 501-511. doi: 10.1134/s0026261706050018
- Esteban DJ, Hysa B, and Bartow-McKenney C (2015). Temporal and Spatial Distribution of the Microbial Community of Winogradsky Columns. PLoS ONE 10(8): e0134588. doi:10.1371/journal.pone.0134588
- Lloyd KG, Steen AD, Ladau J, Yin J, and Crosby L. (2018). Phylogenetically novel uncultured microbial cells dominate Earth microbiomes. mSystems 3(5): e00055-18. doi:10.1128/mSystems.00055-18
- Anderson DC, and Hairston RV (1999). The Winogradsky Column & Biofilms: Models for Teaching Nutrient Cycling & Succession in an Ecosystem. The American Biology Teacher, 61(6): 453-459. doi: 10.2307/4450728
- Dang H, Klotz MG, Lovell CR and Sievert SM (2019) Editorial: The Responses of Marine Microorganisms, Communities and Ecofunctions to Environmental Gradients. Frontiers in Microbiology 10(115). doi: 10.3389/fmicb.2019.00115
- Stomp M, Huisman J, Stal LJ, and Matthijs HCP. (2007) Colorful niches of phototrophic microorganisms shaped by vibrations of the water molecule. ISME Journal. 1(4): 271-282. doi:10.1038/ismej.2007.59
- Perry JJ, Staley JT, and Lory S. (2002) Microbial Life, First Edition, published by Sinauer Associates
- Rogan B, Lemke M, Levandowsky M, and Gorrel T. (2005) Exploring the Sulfur Nutrient Cycle Using the Winogradsky Column. The American Biology Teacher, 67(6): 348-356. doi: 10.2307/4451860
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Création d'une colonne de Winogradsky : une méthode pour enrichir les espèces microbiennes dans un échantillon de sédiments.
Microbiology
128.7K Vues

Dilutions en série et ensemencement des géloses : numération des micro-organismes
Microbiology
314.6K Vues

Cultures enrichies : Cultiver des micro-organismes aérobies et anaérobies dans des milieux sélectifs et différentiels
Microbiology
131.9K Vues

Cultures pures et ensemencement des géloses : isolement des colonies bactériennes pures à partir d'un échantillon mixte
Microbiology
165.9K Vues

Séquençage de l'ARNr 16S : une technique basée sur la PCR pour l'identification d'espèces bactériennes
Microbiology
188.1K Vues

Courbes de croissance : Générer des courbes de croissance en comptant les unités formant colonies (UFC) et en mesurant l'absorbance
Microbiology
293.8K Vues

Tests de sensibilité aux antibiotiques : Utilisation du ETEST pour déterminer la CMI de deux antibiotiques et évaluer la synergie des antibiotiques
Microbiology
93.5K Vues

Microscopie et coloration : Gram, Capsule et endospores.
Microbiology
362.7K Vues

Test de la plaque : méthode de détermination de la charge virale exprimée en unités formant des plaques
Microbiology
185.8K Vues

Transformation des cellules E. coli en utilisant le chlorure de calcium
Microbiology
86.4K Vues

Conjugaison : méthode de transfert de la résistance à l'ampicilline du donneur à l'hôte E. coli
Microbiology
38.1K Vues

Transduction via bactériophage : méthode de transfert de la résistance à l'ampicilline du donneur au receveur E. coli
Microbiology
29.0K Vues