Immunoistochimica e immunocitochimica: imaging dei tessuti tramite microscopia ottica
Panoramica
Fonte: Michael S. Lee1 e Tonya J. Webb1
1 Dipartimento di Microbiologia e Immunologia, University of Maryland School of Medicine e Marlene and Stewart Greenebaum Comprehensive Cancer Center, Baltimora, Maryland 21201
L'immunoistochimica (IHC) e l'immunocitochimica (ICC) sono tecniche utilizzate per visualizzare l'espressione e la localizzazione di antigeni specifici utilizzando anticorpi. Il primo uso pubblicato di IHC fu nel 1941 quando Albert Coons usò la tecnica per visualizzare la presenza di antigene pneumococcico nelle sezioni di tessuto di topi infetti da Pneumococco (1). Il nome, immunoistochimica, deriva dalle radici "immuno-", in riferimento agli anticorpi, e "histo-", in riferimento alle sezioni tissutali utilizzate nell'IHC. La radice "cyto-" in immunocitochimica evidenzia la differenza chiave tra ICC e IHC. Mentre IHC utilizza sezioni di tessuto intero, ICC utilizza cellule che sono state isolate dal tessuto o coltivate in coltura. La differenza nei campioni utilizzati significa che la preparazione del campione differisce tecnicamente tra IHC e ICC, ma per il resto i protocolli per ICC e IHC sono identici e si scoprirà che i termini sono spesso usati in modo intercambiabile.
Sia in IHC che in ICC, gli anticorpi con tag chimici o fluorescenti, come rispettivamente la perossidasi o la rodamina, vengono utilizzati per visualizzare la distribuzione di qualsiasi antigene di interesse attraverso il legame specifico dell'anticorpo marcato all'antigene. Nel caso dell'IHC, sottili fette di tessuto vengono immobilizzate su un vetrino per mantenere la struttura del tessuto prima di essere macchiate, consentendo la visualizzazione di antigeni nel contesto di interi tessuti (Figura 1). Nel caso dell'ICC, le cellule vengono distribuite uniformemente su un vetrino prima di essere macchiate, consentendo la visualizzazione della distribuzione dell'antigene all'interno delle singole cellule ma non all'interno della struttura di un tessuto specifico. A causa delle somiglianze tra i due protocolli, questo protocollo si concentrerà sull'IHC per affrontare le ulteriori complessità della preparazione del campione coinvolte nell'IHC.

Figura 1: Schema del protocollo IHC. Profilo visivo di un protocollo IHC per tessuto incorporato in paraffina sezionato da un topo. Questo protocollo utilizza un anticorpo secondario biotinilato e strepavidin-HRP per visualizzare la posizione del legame anticorpale. Sono possibili anche altre opzioni, come gli anticorpi marcati fluorescenti. Fare clic qui per visualizzare una versione più grande di questa figura.
La prima decisione importante quando si esegue L'IHC è come preparare le sezioni di tessuto al fine di mantenere la struttura del tessuto durante tutto il processo di colorazione. Le due scelte principali sono sezioni fissate in formalina di tessuto incorporato in paraffina o sezioni fresche di tessuto congelato. Non esiste una risposta semplice su quale metodo utilizzare in quanto dipende da quale analisi a valle verrà condotta. La fissazione della formalina dei tessuti incorporati di paraffina è generalmente pensata per preservare meglio la morfologia del tessuto per un'imaging ottimale, mentre il congelamento del tessuto fresco può preservare la funzione proteica per i successivi saggi al di fuori dell'IHC. Inoltre, le sezioni di tessuto fresco congelato hanno dimostrato di essere più adatte per l'analisi dell'espressione genica (2). Una terza considerazione è se gli anticorpi per il tuo antigene di interesse sono adatti o meno per sezioni di tessuto fisse o congelate, poiché alcuni anticorpi sono stati ottimizzati solo per un tipo specifico di sezione e potrebbero non funzionare per altri. Infine, è necessario determinare per quanto tempo devono conservare le sezioni di tessuto, poiché i campioni freschi congelati devono essere conservati a -80 ° C e non possono durare oltre un anno, mentre le sezioni fisse possono essere conservate per molto più tempo a temperatura ambiente. Queste sono alcune delle principali considerazioni per determinare se utilizzare sezioni fissate in formalina di tessuto incorporato in paraffina o sezioni fresche di tessuto congelato. In definitiva, se uno ha abbastanza tessuto, potrebbe essere meglio avere solo un po 'di entrambi.
In questo esperimento, abbiamo deciso di determinare se l'espressione della ciclina D1 era aumentata nella milza ingrossata da un modello murino spontaneo di sviluppo del linfoma. I campioni di tessuto splenico sono stati isolati per la prima volta da topi wild-type, topi transgenici che non hanno linfoma o topi transgenici che hanno sviluppato spontaneamente linfoma. I campioni di tessuto della milza sono stati fissati in paraformaldeide, incorporati nella paraffina, sezionati, colorati utilizzando un anticorpo primario anticiclina D1 di topo seguito da un anticorpo secondario anti-topo di cavallo e sviluppati utilizzando 3,3-diaminobenzidina (DAB). Le sezioni sono state poi controcolorate nella soluzione di ematossilina di Harris e quindi le sezioni sono state riprese con un ingrandimento 20X.
Reagenti
Sezioni incorporate in paraffina
- 4% Paraformaldeide (PFA)
- Etanolo (denaturato anidro, grado istologico 100%, 95%, 80%, 75% e 50%). Può essere diluito al 100% con acqua doppia distillata (ddH2O)
- Xilene
- Vetrino compatibile IHC per garantire che la sezione tissutale rimanga attaccata durante l'intera procedura. Le vetrini compatibili IHC hanno un rivestimento specializzato e sono prontamente disponibili presso più rivenditori. Se si esegue ICC, utilizzare una diapositiva camerata. I vetrini camerati consentono alle cellule di essere seminate nelle camere e poste nell'incubatore fino a quando le cellule non si attaccano al vetrino e raggiungono la corretta confluenza, a quel punto le camere possono essere rimosse e la colorazione può procedere allo stesso modo di IHC.
- Paraffina
- 0,3% perossido di idrogeno (H2O2)/metanolo: per preparare, aggiungere 1 mL 30% H2O2 a 99 ml di metanolo. Conservare a -20°C
- Tampone di recupero dell'antigene: tampone citrato IHC pH 6.0
Sezioni fresche congelate
- Composto di incorporamento a temperatura di taglio ottimale (OCT)
- Fissativo ottimale: 4% PFA o acetone che è stato raffreddato a -20 °C
Macchiatura
- Buffer di blocco: deve essere determinato dall'utente. Un esempio è il siero di cavallo diluito in 1X PBS
- Anticorpo primario diluito: vedere le specifiche del produttore
- Anticorpo secondario biotinilato diluito: vedere le specifiche del produttore
- Avidina-Rafano perossidasi diluita (HRP): Solo per la visualizzazione della perossidasi. Vedere le specifiche del produttore.
- DAB o un altro substrato compatibile
- Controstain (opzionale)
- Etanolo (denaturato anidro, grado istologico 100% e 95%)
- Xilene
- Organo/Limonene Mount
Procedura
1. Preparazione di cellule per immunocitochimica
- Semina cellule di interesse su vetrini camerati o coverslip camerati aggiungendo 0,5 ml di sospensione cellulare ai pozzetti di una piastra di coltura a 24 pozzi.
Nota: Alcune cellule possono richiedere la crescita su coverslips trattati, come coverslips trattati con poli-lisina. Le condizioni di trattamento ottimali devono essere determinate dall'utente in base al tipo di cellula utilizzata. - Posizionare la piastra in un incubatore a CO2 umidificato e consentire alle cellule di crescere a 37 ° C fino al 50-70% di confluente.
- Una volta che le cellule raggiungono la confluenza ottimale, rimuovere i mezzi di coltura da ciascun pozzo e quindi fissare le cellule incubandole in 0,5 ml di PFA al 4% (diluito in 1X PBS) e incubare per 20 minuti a temperatura ambiente.
- Rimuovere il fissativo e lavare i fori tre volte con 1 mL di 1X PBS.
- Successivamente, permeabilizzare le cellule aggiungendo 0,5 ml di Triton-X-100 allo 0,1% in 1X PBS a ciascun pozzezzo e incubare per 15 minuti a temperatura ambiente.
- Aspirare il tampone di permeabilizzazione e lavare i pozzi tre volte con 1 mL di 1X PBS.
- Le cellule su coverslips sono ora fisse e permeabilizzate. Procedere alla procedura di colorazione dimostrata per il seguente esempio di immunoistochimica, con l'eccezione che le incubazioni devono essere eseguite all'interno dei pozzetti della piastra a 24 pozzetti piuttosto che direttamente su un vetrino di sezione tissutale.
2. Preparazione di sezioni fissate con formalina e incorporata in paraffina per la colorazione
- Ottenere sezioni di tessuto incorporate in paraffina fissate in formalina preparate.
Deparaffinizzazione
- Immergere le diapositive in 100% xilene 2 volte per 5 minuti ciascuna.
Reidratazione
- Immergere le diapositive in etanolo al 100% 2 volte per 3 minuti ciascuna.
- Immergere i vetrini in etanolo al 95% per 3 min.
- Immergere i vetrini in etanolo al 70% per 3 min.
- Immergere i vetrini in etanolo al 50% per 3 min.
Blocco dell'attività della perossidasi endogena
- Incubare i vetrini in 100 mL di 0,3% H2O2 per 30 min a temperatura ambiente.
- Lavare le diapositive con 1X PBS 2 volte per 5 minuti ciascuna.
Recupero dell'antigene
- Immergere i vetrini nel tampone citrato IHC (pH 6) e farli bollire per 20 minuti.
- I vetrini in tessuto sono ora pronti per la colorazione.
3. Preparazione di sezioni fresche congelate, OTC-Embedded per la colorazione
- Posizionare 5 mm di tessuto fresco isolato in uno stampo e aggiungere OCT fino a quando la sezione non è completamente coperta.
- Immergere lentamente il blocco di tessuto in azoto liquido fino a completo congelamento. Il campione può ora essere conservato a -80°C per un massimo di 1 anno.
- Una volta pronto per il sezionamento, trasferire il blocco di tessuto congelato su un criostato e consentire all'intera configurazione di arrivare a -20 ° C.
- Tagliare sezioni di tessuto spesse 5-10 μm usando un criostato e utilizzare la spazzola per posizionare le sezioni direttamente su vetrini compatibili IHC.
- Lasciare asciugare le diapositive durante la notte a temperatura ambiente. Le diapositive possono anche essere conservate a -80°C.
- Immergere i vetrini in 250 ml di PFA al 4% per 15 minuti a temperatura ambiente per fissare i vetrini prima della colorazione. Il metodo di fissazione ottimale dovrebbe essere determinato dall'utente.
- Immergere le diapositive in 250 mL di 1X PBS 2 volte per 5 minuti ciascuna.
- Immergere le diapositive in 250 mL di 0,3% H2O2 per 30 minuti a temperatura ambiente al fine di bloccare qualsiasi attività endogena della perossidasi.
- Immergere le diapositive in 250 mL di 1X PBS 2 volte per 5 minuti ciascuna.
- Le diapositive sono ora pronte per la colorazione.
4. Colorazione
- Circondare il tessuto con una barriera idrofoba usando una penna barriera.
Inceppamento
- Utilizzando una pipetta, posizionare 100 μL di tampone bloccante (siero di cavallo diluito in 1X PBS) - sopra la sezione per 1 ora a temperatura ambiente.
- Rimuovere il buffer di blocco utilizzando una pipetta.
Incubazione di anticorpi primari
- Incubare il tessuto circondato con 100 μL di soluzione anticorpale primaria diluita (ciclina D1 anti-umana di topo diluita 1:100 in tampone bloccante) per 30 minuti a temperatura ambiente.
- Scaricare l'anticorpo primario da ogni vetrino e lavare i vetrini con 1X PBS 2 volte per 5 minuti ciascuno.
Incubazione di anticorpi secondari
- Incubare il campione con 100 μL di anticorpo secondario biotinilato diluito (IgG di cavallo biotinilato anti-topo diluito 1:200) per 30 minuti a temperatura ambiente.
- Rimuovere l'anticorpo secondario drenando le sezioni e lavare con 1X PBS 2 volte per 5 minuti ciascuna.
Sviluppo del colore
- Visualizzazione utilizzando HRP: aggiungere 100 μL di reagente del complesso avidina-biotina (ABC) e incubare le sezioni al buio per 30 minuti a temperatura ambiente
Nota: Gli anticorpi marcati con fluorescenza possono anche essere utilizzati e visualizzati utilizzando un microscopio appropriato. - Lavare le diapositive con 1X PBS 2 volte per 5 minuti ciascuna.
- Sviluppare le diapositive incubando le sezioni in 100 μL di DAB per un massimo di 5 minuti.
- Interrompere lo sviluppo aggiungendo acqua distillata (dH2O) per 5 minuti a temperatura ambiente.
Controbattere (se lo si desidera)
- Immergere brevemente i vetrini nella soluzione di ematossilina Harris (o verde metile allo 0,5% in acetato di sodio 0,1 M (pH 4,2)) per 10 minuti.
- Risciacquare la controstita lavando i vetrini in dH2O due volte per 5 minuti ciascuno.
Disidratazione
- Immergere i vetrini in etanolo al 95% 2 volte per 5 minuti ciascuno.
- Immergere le diapositive in etanolo al 100% 2 volte per 5 minuti ciascuna.
- Immergere le diapositive in 100% xilene 2 volte per 5 minuti ciascuna.
- Asciugare le diapositive con un asciugamano di carta.
Montaggio e applicazione coverslip
- Aggiungere una goccia di supporto di montaggio come Organo-Limonene Mount alle diapositive e posizionare un coperchio sulle sezioni.
Analisi microscopica
- Osservare le sezioni macchiate sotto un microscopio appropriato per l'analisi. Qui è stato utilizzato un microscopio ottico standard per l'osservazione e una fotocamera digitale montata è stata utilizzata per l'imaging.
Risultati
IHC e ICC hanno una vasta gamma di applicazioni. Ad esempio, un uso di IHC è quello di esaminare l'espressione di oncogeni in modelli murini spontanei di sviluppo tumorale. Nella Figura 2,ci siamo prefissati di determinare se l'espressione della ciclina D1 fosse aumentata nella milza ingrossata in un modello murino spontaneo di sviluppo del linfoma. I campioni di tessuto splenico sono stati fissati in paraformaldeide, incorporati nella paraffina, sezionati, colorati usando un anticorpo anticiclina D1 (diluito 1:200 in tampone bloccante), e quindi le sezioni sono state riprese con ingrandimento 20X. Le cellule che esprimono la ciclina D1 sono indicate dal colore bruno-rossastro sullo sfondo del tessuto blu. Questi risultati suggeriscono che l'espressione della ciclina D1 è aumentata nella milza ingrossata, indicando una correlazione tra lo sviluppo del cancro e l'espressione della ciclina D1 in questo modello.
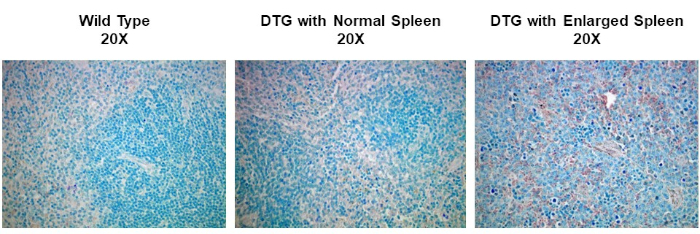
Figura 2: Espressione della ciclina splenica D1 in un modello murino spontaneo di linfoma a doppio transgenico (DTG). Un'immagine di tessuto splenico colorato con un anticorpo primario anti-ciclina D1, contromaccato con verde metilico e visualizzato utilizzando un anticorpo secondario biotinilato e un reagente ABC attivato con substrato DAB. Il colore bruno-rossastro rappresenta le posizioni in cui l'anticorpo si è legato indicando la presenza di cellule tumorali che esprimono ciclina D1 all'interno della struttura del tessuto splenico che è stato controcolorato blu. Fare clic qui per visualizzare una versione più grande di questa figura.
Applicazione e Riepilogo
L'immunoistochimica (IHC) e l'immunocitochimica (ICC) sono tecniche utilizzate per visualizzare l'espressione e la localizzazione di antigeni specifici utilizzando anticorpi. I tessuti vengono prima tagliati in sezioni sottili che mantengono la morfologia del tessuto e posizionati su un vetrino. Gli anticorpi vengono quindi aggiunti e legheranno l'antigene di interesse e sono dotati di un tag specifico che consente di visualizzarli al microscopio. Pertanto, attraverso questo concetto di base, la distribuzione degli antigeni nel contesto della struttura tissutale può essere visualizzata e studiata. Tuttavia, mentre il concetto generale è di base, ci sono più approcci e variazioni diversi che sono stati sviluppati che aumentano sia la complessità che l'utilità di queste tecniche. Questo documento ha coperto il concetto di base di IHC e ICC, le principali decisioni che devono essere considerate quando si utilizzano queste tecniche e un protocollo dettagliato passo-passo. Le immagini prodotte da IHC e ICC sono generalmente il prodotto finale e possono essere pubblicate così com'è per evidenziare evidenti differenze nelle quantità o nella distribuzione della colorazione tra le diverse condizioni.
Riferimenti
- Coons, A. H. Creech, H. J., Jones, N. and Berliner, E. The Demonstration of Pneumococcal Antigen in Tissues by the Use of Fluorescent Antibody, The Journal of Immunology, 45 (3), 159-170 (1942).
- Ripoli, F. L., Mohr, A., Hammer, S. C., Willenbrock, S., Hewicker-Trautwein, M., Hennecke, S., Escobar, H. M. and Nolte, I. A comparison of fresh frozen vs. Formalin-fixed, paraffin-embedded specimens of canine mammary tumors via branched-DNA assay. International Journal of Molecular Sciences, 17 (5) (2016).
Vai a...
Video da questa raccolta:

Now Playing
Immunoistochimica e immunocitochimica: imaging dei tessuti tramite microscopia ottica
Immunology
78.7K Visualizzazioni

Citometria a flusso e selezione cellulare attivata dalla fluorescenza (FACS): isolamento dei linfociti B della milza
Immunology
92.7K Visualizzazioni

Magnetic Activated Cell Sorting (MACS): isolamento dei linfociti T timici
Immunology
22.8K Visualizzazioni

Saggi ELISA: indiretti, sandwich e competitivi
Immunology
237.4K Visualizzazioni

EliSPOT Assay: Rilevamento di splenociti secernenti IFN-γ
Immunology
28.4K Visualizzazioni

Generazione di anticorpi: produzione di anticorpi monoclonali attraverso l'utilizzo di ibridomi
Immunology
43.4K Visualizzazioni

Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Immunology
53.7K Visualizzazioni

Microscopia a fluorescenza confocale: una tecnica per determinare la localizzazione delle proteine nei fibroblasti di topo
Immunology
43.0K Visualizzazioni

Tecniche basate sull'immuno-precipitazione: purificazione di proteine endogene con l'impiego di microsfere di agarosio
Immunology
87.5K Visualizzazioni

Analisi del ciclo cellulare: valutazione della proliferazione delle cellule T CD8 e CD4 in seguito a stimolazione tramite colorazione CFSE e citometria a flusso
Immunology
24.1K Visualizzazioni

Trasferimento di cellule adottive: introduzione degli splenociti di topo donatore a un topo ospite e valutazione del successo tramite FACS
Immunology
22.2K Visualizzazioni

Saggio per la morte cellulare: saggio di rilascio di cromo della capacità citotossica
Immunology
151.4K Visualizzazioni