Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Panoramica
Fonte: Thomas Chaffee1, Thomas S. Griffith2,3,4e Kathryn L. Schwertfeger1,3,4
1 Dipartimento di Medicina e Patologia di Laboratorio, Università del Minnesota, Minneapolis, MN 55455
2 Dipartimento di Urologia, Università del Minnesota, Minneapolis, MN 55455
3 Masonic Cancer Center, Università del Minnesota, Minneapolis, MN 55455
4 Centro di Immunologia, Università del Minnesota, Minneapolis, MN 55455
Le analisi patologiche delle sezioni tissutali possono essere utilizzate per ottenere una migliore comprensione della normale struttura tissutale e contribuire alla nostra comprensione dei meccanismi della malattia. Le biopsie tissutali, sia da pazienti che da modelli sperimentali in vivo, sono spesso conservate fissando in formalina o paraformaldeide e incorporando nella cera di paraffina. Ciò consente la conservazione a lungo termine e il seziono dei tessuti. I tessuti vengono tagliati in sezioni sottili (5 μm) utilizzando un microtomo e le sezioni sono aderenti a vetrini. Le sezioni dei tessuti possono essere colorate con anticorpi, che consentono il rilevamento di proteine specifiche all'interno delle sezioni tissutali. La colorazione con anticorpi coniugati a fluorofori (noti anche come fluorocromi) - composti che emettono luce a lunghezze d'onda specifiche quando eccitati da un laser - è nota come immunofluorescenza. La capacità di rilevare proteine all'interno di una sezione può fornire informazioni come l'eterogeneità del tipo di cellula all'interno del tessuto, l'attivazione di specifiche vie di segnalazione e l'espressione di biomarcatori. A seconda dei fluorofori utilizzati e del tipo di microscopio disponibile per l'analisi, è possibile utilizzare più colori, il che consente l'analisi multiplexata dei bersagli.
Il seguente protocollo delinea i passaggi di base coinvolti nella colorazione immunofluorescenza delle sezioni di tessuto incorporato di paraffina. È importante notare che questo protocollo non includerà alcun dettaglio sulla fissazione del tessuto, sul processo di incorporamento della paraffina o sul sezionamento dei tessuti. Una volta che i tessuti sono stati sezionati e posizionati su vetrini, vengono reidratati attraverso una serie di incubazioni di etanolo graduato (EtOH). Le sezioni vengono incubate con un reagente bloccante per ridurre il legame non specifico dell'anticorpo alla sezione tissutale. Le sezioni vengono quindi incubate con un anticorpo primario che può o non può essere etichettato direttamente con un fluoroforo. Se l'anticorpo primario non è etichettato direttamente, le sezioni vengono quindi incubate con un anticorpo secondario etichettato con un fluoroforo. Anticorpi diversi possono richiedere condizioni di colorazione diverse, quindi sono inclusi suggerimenti per l'ottimizzazione degli anticorpi. Dopo il lavaggio per rimuovere tutti gli anticorpi non legati, i vetrini sono montati con supporti contenenti DAPI per etichettare fluorescentemente il nucleo. Una volta che il supporto di montaggio si è asciugato, i vetrini possono essere ripresi utilizzando un microscopio con laser in grado di rilevare i diversi fluorofori.
Procedura
1. Configurazione
- Il tipico protocollo di colorazione prevede i seguenti passaggi:
- Reidratare le sezioni di tessuto sui vetrini utilizzando una serie di etanolo graduati.
- Incubazione delle sezioni tissutali con un tampone bloccante, che aiuterà a bloccare il legame non specifico degli anticorpi al tessuto e ridurre la fluorescenza di fondo.
- Rimozione del tampone bloccante e incubazione della sezione nell'anticorpo primario, momento in cui l'anticorpo legherà il suo bersaglio peptidico.
- Rimozione dell'anticorpo primario e lavaggio estensivo delle sezioni nel tampone di lavaggio.
- Incubazione delle sezioni con anticorpo secondario per consentire il legame con l'anticorpo primario, se l'anticorpo primario non è direttamente etichettato con un fluoroforo ed è richiesto un anticorpo secondario.
- Lavare l'anticorpo secondario dai vetrini.
- Montare i vetrini nel supporto di montaggio e consentirgli di asciugarsi prima della visualizzazione su un microscopio fluorescente.
- Sono necessari i seguenti elementi: portascivolo (vetro o plastica), barattoli, pipette, pap pen, camera umida, coperchi e supporti di montaggio con DAPI.
- Lo xilene viene utilizzato per la reidratazione dei vetrini. Lo xilene è pericoloso e deve essere utilizzato in una cappa aspirante insieme a DPI appropriati, compresi guanti e un camice da laboratorio.
- Ricette per tamponi, soluzioni e reagenti
-
Etanolo graduato
Etanolo - 160 mL 200 proof EtOH e 40mL ddH2O
Etanolo - 140 mL 200 proof EtOH e 60mL ddH2O -
Soluzione di recupero dell'antigene
10 mM citrato di sodio, pH 6,0 -
Buffer di blocco
100 μL di siero dall'animale ospite da cui è stato prodotto l'anticorpo secondario
900 μL 1X PBS
Nota: Questo è il volume per 10 sezioni; regolare il volume per circa 100 μL di buffer per sezione, se necessario. - Tampone di lavaggio (1X PBS)
-
Etanolo graduato
2. Protocollo
- Reidratazione con xileni ed etanolo
- Posizionare le diapositive in un supporto per diapositive e quindi immergere le diapositive nella soluzione di isomeri 100% xilene, assicurandosi che le diapositive siano interamente coperte di soluzione.
- Incubare i vetrini negli isomeri 100% Xilene per 3 min. Ripetere due volte per un totale di 3 incubazioni separate. Assicurarsi di pulire il portaslievi con un tovagliolo di carta prima di passare a una nuova soluzione per ridurre al minimo la contaminazione.
Nota: Si raccomanda che queste incubazioni vengano eseguite in tre contenitori separati. - Incubare i vetrini in 100% EtOH per 2 min. Ripetere due volte per un totale di 3 incubazioni separate.
Nota: Si raccomanda che queste incubazioni vengano eseguite in tre contenitori separati. - Incubare i vetrini in EtOH al 95% per 2 min.
- Incubare i vetrini in 80% EtOH per 2 min.
- Incubare i vetrini in 70% EtOH per 2 min.
- Incubare i vetrini in 1X PBS per 5 min.
- (Facoltativo) Recupero dell'antigene per smascherare gli epitopi riconosciuti dall'anticorpo primario
Nota 1: Questa procedura dipende fortemente dall'anticorpo utilizzato e si raccomanda di eseguire procedure di ottimizzazione iniziali per determinare il requisito per il recupero dell'antigene.
Nota 2: Questa procedura non è stata eseguita con la colorazione F4/80 mostrata di seguito. Il requisito per il recupero dell'antigene deve essere ottimizzato con ogni nuovo anticorpo.- Posizionare le diapositive in un supporto per vetrine in plastica o vetro resistente al calore e assicurarsi che il rack sia riempito con vetrini per garantire una distribuzione uniforme del calore. Le diapositive vuote possono essere utilizzate se ci sono meno campioni rispetto agli slot nel rack.
- Posizionare il rack in 1000 mL di soluzione di smascheramento dell'antigene in un becher da 2 L - 10 mL di antigene smascherando lo stock a 990 ml di acqua.
- Microonde in alto per 20 minuti totali, assicurarsi che i vetrini rimangano coperti d'acqua.
- Raffreddare le diapositive per 20 minuti in becher.
- Lavare il portaslievi in portasciovi contenenti ddH2O per 5 minuti ciascuno. Ripetere due volte per un totale di 3 incubazioni separate utilizzando ddHfresco 2O ogni volta. Le diapositive possono essere lavate nello stesso portasciole durante ogni lavaggio.
- Incubare i vetrini in 1X PBS per 5 min.
- Sezioni circolari con una penna pap. Ciò consentirà l'uso di un volume minimo di tamponi necessari per coprire le sezioni di tessuto. Non lasciare asciugare le sezioni di tessuto.
- Aggiungere il buffer di blocco a ogni sezione. La quantità di buffer necessaria per coprire la sezione varia a seconda delle dimensioni della sezione, ma può variare da 25 a 500 μL. È necessario utilizzare un buffer sufficiente per formare un perla che copra l'intera superficie della sezione, compresi i bordi.
Nota: La scelta del tampone bloccante può variare a seconda dell'anticorpo utilizzato. Ad esempio, il siero al 10% dell'animale ospite in cui è stato allevato l'anticorpo secondario può essere utilizzato per ridurre il legame non specifico dell'anticorpo secondario (ad esempio, il siero di capra normale può essere utilizzato se l'anticorpo secondario è stato allevato in capra). L'ottimizzazione del tampone di blocco deve essere eseguita per ciascun anticorpo primario. Per macchiare le sezioni tumorali mammarie con F4/80, sono stati utilizzati 0,1 ml di siero di capra normale al 10% in PBS. - Incubare le sezioni in tampone di blocco in una camera umidificata per 1 ora a temperatura ambiente o 4°C fino a 24 ore. La camera umidificata assicura che le sezioni non si asciughino.
- Rimuovere il tampone di blocco scaricandolo dalla diapositiva. In alternativa, il buffer di blocco può essere rimosso utilizzando una pipetta, anche se fare attenzione a non toccare la sezione con la punta della pipetta.
- Diluire l'anticorpo primario nel tampone bloccante.
Nota: La diluizione corretta dovrà essere determinata per ciascun tipo di anticorpo e campione. L'ottimizzazione includerebbe l'esecuzione di una serie di diluizioni per identificare la colorazione ottimale. Per macchiare le sezioni tumorali mammarie con F4/80, le sezioni di tessuto sono state incubate durante la notte a 4 ° C in 0,1 mL di anticorpi anti-F4/80 di ratto diluiti 1:100 in siero di capra normale all'1% in PBS. - Aggiungere l'anticorpo primario a ciascuna sezione e incubare in una camera umidificata per un massimo di 16 ore (durante la notte) a 4°C. Lasciare almeno una sezione nel tampone di blocco senza anticorpo primario per fungere da controllo, che aiuterà a identificare il legame non specifico da parte dell'anticorpo secondario.
- Scaricare l'anticorpo primario o il tampone di blocco dalla sezione e lavare le sezioni con PBS posizionando le diapositive nel rack di scorrimento e posizionandole in un supporto per vetrini con 1x PBS. Lavare 3 volte per 10 minuti ogni volta.
- Diluire l'anticorpo secondario 1:200 nel tampone bloccante. La diluizione può essere ottimizzata a seconda dell'anticorpo secondario.
- Aggiungere l'anticorpo secondario a tutte le sezioni, compreso il controllo, e incubare per 1 ora in una camera umidificata protetta dalla luce.
- Drenare l'anticorpo secondario dalle sezioni e lavare 3 volte in PBS per 10 minuti ogni volta.
- Aggiungere 2-3 gocce di supporti di montaggio contenenti DAPI alle diapositive e posizionare un coperchio sui campioni. Se il supporto di montaggio non è un tipo di supporto ad asciugatura rapida, potrebbe essere necessario sigillare i bordi del vetrino con cera di paraffina fusa o smalto per unghie per evitare perdite e mantenere i campioni a lungo termine.
- Lasciare asciugare i vetrini durante la notte al buio e immaginare le sezioni usando un microscopio fluorescente.
3. Analisi dei dati e risultati
- Le sezioni macchiate vengono analizzate utilizzando un microscopio fluorescente. I dettagli specifici dell'acquisizione e dell'analisi delle immagini dipenderanno dalle specifiche del microscopio e dal software utilizzato per eseguire l'analisi. In genere, le immagini possono essere scattate come immagini a colore singolo e sovrapposte per generare immagini multicolore. La percentuale di cellule positive può essere quantificata contando il numero di cellule macchiate positivamente e dividendo per il numero totale di cellule colorate con DAPI all'interno di una sezione. Per la colorazione F4/80 delle sezioni tumorali mammarie, utilizzando il software Leica Application Suite, versione 3.8, nella scheda Acquisisci e in modalità di acquisizione Image Overlay, DAPI e RFP sono stati entrambi abilitati. Esposizione, guadagno e gamma sono stati regolati (20,0 ms, 1,0x e 1,53 rispettivamente per DAPI e 944,2 ms, 1,0x e 1,08 rispettivamente per RFP), anche se questo varia tra gli esperimenti. Il pulsante Acquisisci sovrapposizione è stato utilizzato per creare immagini sovrapposte delle esposizioni DAPI e RFP.
- L'immagine qui sotto (Figura 1) mostra un'immagine di immunofluorescenza di esempio di una sezione tumorale macchiata con F4/80, che rileva un antigene su macrofagi e altre cellule mieloidi. La sezione è stata montata utilizzando supporti di montaggio contenenti DAPI e i nuclei sono mostrati in blu.
Risultati
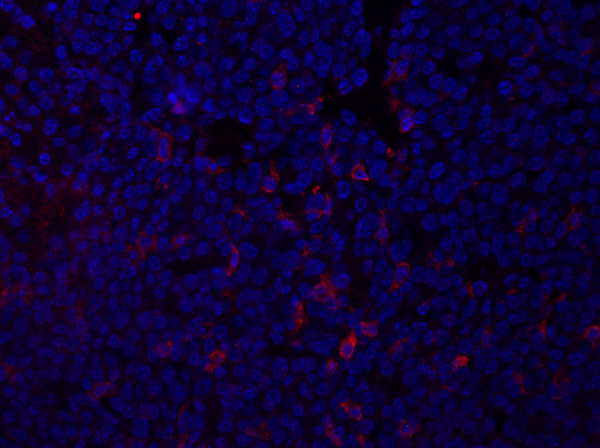
Figura 1: Colorazione F4/80 di una sezione di tumore mammario. Dopo la fissazione, un tumore mammario di topo è stato sezionato e macchiato con anti-F4/80 e montato utilizzando un supporto di montaggio contenente DAPI. La colorazione è mostrata dalla colorazione della superficie cellulare F4/80 in rosso. Fare clic qui per visualizzare una versione più grande di questa figura.
I dati ottenuti dall'imaging forniranno informazioni riguardanti l'intensità e la localizzazione dell'espressione della proteina di interesse all'interno della sezione tissutale. A seconda della proteina esaminata, questi dati potrebbero anche fornire informazioni sulla frequenza di specifiche popolazioni cellulari all'interno della sezione tissutale. Questo può essere quantificato contando il numero di cellule macchiate positivamente e confrontando con la popolazione cellulare totale.
Applicazione e Riepilogo
L'immunofluorescenza consente lo studio dell'espressione e della localizzazione proteica nel contesto di una sezione tissutale. Questa tecnica può essere utilizzata per capire come i tessuti cambiano nel contesto della malattia esaminando la localizzazione delle proteine o il numero di cellule nei tessuti normali e malati. Le modifiche nella localizzazione o nei modelli di espressione possono essere determinate e collegate ad attributi specifici degli esempi.
Riferimenti
- Im K, Mareninov S., Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Yong W. (eds) Biobanking. Methods in Molecular Biology. 1897, Humana Press, New York, NY (2019)
- Ramos-Vara JA. Principles and Methods of Immunohistochemistry. Gautier JC. (eds) Drug Safety Evaluation. Methods in Molecular Biology. 1641, Humana Press, New York, NY (2017)
- Donaldson JG. Immunofluorescence Staining. Current protocols in Cell Biology. 69 (1):1 4.3.1-4.3.7. (2015)
Vai a...
Video da questa raccolta:

Now Playing
Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Immunology
53.8K Visualizzazioni

Citometria a flusso e selezione cellulare attivata dalla fluorescenza (FACS): isolamento dei linfociti B della milza
Immunology
92.9K Visualizzazioni

Magnetic Activated Cell Sorting (MACS): isolamento dei linfociti T timici
Immunology
22.8K Visualizzazioni

Saggi ELISA: indiretti, sandwich e competitivi
Immunology
238.0K Visualizzazioni

EliSPOT Assay: Rilevamento di splenociti secernenti IFN-γ
Immunology
28.4K Visualizzazioni

Immunoistochimica e immunocitochimica: imaging dei tessuti tramite microscopia ottica
Immunology
78.8K Visualizzazioni

Generazione di anticorpi: produzione di anticorpi monoclonali attraverso l'utilizzo di ibridomi
Immunology
43.5K Visualizzazioni

Microscopia a fluorescenza confocale: una tecnica per determinare la localizzazione delle proteine nei fibroblasti di topo
Immunology
43.1K Visualizzazioni

Tecniche basate sull'immuno-precipitazione: purificazione di proteine endogene con l'impiego di microsfere di agarosio
Immunology
87.6K Visualizzazioni

Analisi del ciclo cellulare: valutazione della proliferazione delle cellule T CD8 e CD4 in seguito a stimolazione tramite colorazione CFSE e citometria a flusso
Immunology
24.2K Visualizzazioni

Trasferimento di cellule adottive: introduzione degli splenociti di topo donatore a un topo ospite e valutazione del successo tramite FACS
Immunology
22.3K Visualizzazioni

Saggio per la morte cellulare: saggio di rilascio di cromo della capacità citotossica
Immunology
151.4K Visualizzazioni