Efficienza di estrazione liquido-liquido
Panoramica
Fonte: Kerry M. Dooley e Michael G. Benton, Dipartimento di Ingegneria Chimica, Louisiana State University, Baton Rouge, LA
L'estrazione liquido-liquido (LLE) è una tecnica di separazione utilizzata al posto della distillazione quando: (a) le volatilità relative dei composti da separare sono molto simili; b) uno o più componenti della miscela sono sensibili alla temperatura anche in prossimità di condizioni ambientali; c) la distillazione richiederebbe una pressione molto bassa o un rapporto distillato/mangime molto elevato. 1 La forza motrice per il trasferimento di massa è la differenza di solubilità di un materiale (il soluto)in altri due flussi immiscibili o parzialmente miscibili (l'alimentazione e il solvente). I flussi di mangime e solvente vengono miscelati e quindi separati, consentendo al soluto di trasferirsi dal mangime al solvente. Normalmente, questo processo viene ripetuto in fasi successive utilizzando il flusso di controcorrente. Il solvente ricco di soluto è chiamato estratto mentre lascia e il mangimeimpoverito di soluto è il raffinato . Quando vi è una ragionevole differenza di densità tra i flussi di alimentazione e di solvente, l'estrazione può essere effettuata utilizzando una colonna verticale, anche se in altri casi può essere utilizzata una serie di serbatoi di miscelazione e decantazione.
In questo esperimento, l'obiettivo operativo è quello di estrarre l'isopropanolo (IPA, ~ 10 - 15 wt. %, il soluto) da una miscela di idrocarburi da C8a C10 usando acqua pura come solvente. È disponibile una colonna di estrazione di tipo York-Scheibel (miscelatori verticali e coalescenti, uno ciascuno per stadio fisico). Come la maggior parte degli estrattori, l'efficienza complessiva (numero di stadi teorici / stadi fisici) di questa colonna è piuttosto bassa, soprattutto rispetto a molte colonne di distillazione. Le basse efficienze derivano sia dal lento trasferimento di massa (due resistenze liquide invece di una come nella distillazione) sia spesso anche dalla cattiva distribuzione delle fasi. Verrà valutato l'effetto della velocità dell'agitatore sia sul recupero del soluto nell'estratto che sull'efficienza complessiva della colonna.
Principi
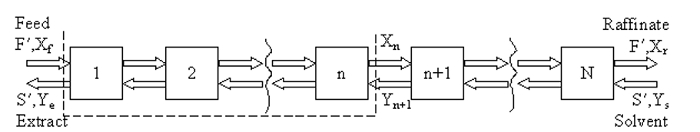
Il metodo a) McCabe-Thiele, o b) un simulatore di processo (ad esempio, ASPEN Plus, HYSYS, ChemSep) può essere utilizzato per stimare il numero di stadi di equilibrio (teorici). Il metodo McCabe-Thiele è impiegato su base priva di solventi, il che significa che vengono trascurate sia le solubilità del solvente nell'estratto che del composto diluente nel raffinato. Una rappresentazione graduale dell'estrazione liquido-liquido controcorrente è mostrata nella Figura 1, dove F' è la portata molare dell'alimentazione (approssimativamente costante), S' è la portata molare dell'estratto (approssimativamente costante), Xf è la frazione molare del soluto nell'alimentazione, Ys è la frazione molare del soluto nel solvente, Ye è la frazione molare del soluto nel solvente nel flusso di estratto, e Xr è la frazione molare del soluto in diluente nel flusso raffinato.
Figura 1: Rappresentazione graduale del processo di estrazione.
Allo stato stazionario, un bilancio materiale sul soluto tra l'estremità di alimentazione della colonna e qualsiasi stadio, n (contorno tratteggiato sopra) conduce alla linea operativa:
 (1)
(1)
In particolare, l'equazione è soddisfatta ad entrambe le estremità della colonna, quindi i punti (Xf,Ye ) e (Xr, Ys) si trovano sulla linea. I dati di equilibrio nell'appendice possono essere utilizzati in combinazione con questa equazione (graficamente o numericamente) per scorrere la colonna.
I simulatori di processo possono eseguire calcoli più rigorosi da fase a fase, ma assumendo comunque fasi di equilibrio. I metodi NRTL o UNIQUAC (entrambi i set di parametri nell'appendice) possono essere utilizzati per modellare la relazione di equilibrio. Si noti che il grande vantaggio dei simulatori è che ti dicono quanto solvente finisce nell'estratto e quanto diluente finisce nel raffinato. Possono anche fornire le temperature di uscita per una colonna adiabatica o il servizio di calore necessario per mantenere la colonna isotermica.
Un apparato York-Scheibel è mostrato nella Figura 2. Il feed può essere introdotto nella parte inferiore (11 fasi) o al centro della colonna (6 fasi).

Figura 2: Apparecchio di estrazione liquido-liquido York-Scheibel.
L'unità di estrazione è costituita da una colonna I.D. Pyrex da 2", con 11 stadi di estrazione, ciascuno costituito da una sezione di miscelazione da un pollice e una sezione di imballaggio in rete metallica da quattro pollici (coalescenza). La colonna è agitata meccanicamente da agitatori a ruota a pale (turbina Rushton). Un motore a velocità variabile, con manopola di controllo e lettura digitale sul pannello di controllo, controlla la velocità dell'agitatore. I rotametri sugli ingresso di alimentazione e solvente vengono utilizzati per misurare tali portate. Le portate dell'estratto e del raffinato possono essere misurate con cilindro graduato e cronometro.
Le seguenti equazioni mettono in relazione le letture del rotametro con le portate volumetriche (le portate possono essere controllate anche con un cilindro graduato):
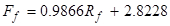 (2)
(2)
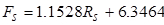 (3)
(3)
dove Ff è la portata di alimentazione (~10 wt. % IPA) in mL/min, Rf è la lettura del rotametro di alimentazione, Fs è la portata del solvente in ml/min e Rs è la lettura del rotametro del solvente.
Procedura
In questo esperimento, le proprietà di n-nonano sono una buona approssimazione a quelle della miscela di idrocarburi ai fini dei dati di equilibrio. Il sistema ternario acqua/isopropanolo/n-nonano mostra un comportamento di equilibrio di tipo I (c'è un certo intervallo di composizione su cui la scissione di fase non avrà luogo) a temperatura ambiente. I dati di equilibrio per questo sistema sono riportati nell'Appendice.
1. Funzionamento della colonna York-Scheibel
- Riempire l'estrattore con miscela di idrocarburi /mangime IPA (se necessario) e spurgare l'aria dalla linea di alimentazione. Disattiva il flusso di alimentazione.
- Avviare il mixer e mantenere costante la velocità dell'agitatore.
- Aprire il solvente, alimentare, estrarre e raffinate valvole a sfera; e avviare il flusso di solvente (acqua) nella colonna.
- Se non è presente alcuna interfaccia tra l'ingresso del solvente e l'uscita raffinata, lasciare che la fase dispersa salma e formi l'interfaccia superiore.
- Quando si forma l'interfaccia superiore, (ri)avviare il flusso di alimentazione.
- Controllare il livello dell'interfaccia regolando l'altezza della U invertita sulla linea di estrazione dal fondo della torre. La regolazione del livello superiore dell'interfaccia (U invertita) è sensibile. I movimenti di una frazione di pollice sono spesso sufficienti.
- Controllare periodicamente il flusso raffinato per lo stato stazionario utilizzando la gascromatografia. Il gascromotagrafo separerà e quantificherà i componenti del campione.
- Utilizzare un idrometro per misurare il peso specifico del flusso di estrazione e determinare la composizione. (Questo può anche aiutare a confermare che lo stato stazionario è stato raggiunto.) La composizione del flusso di estrazione rispetto alle tabelle del peso specifico può essere trovata nel Manuale di Perry. 3 Questi dati possono essere utilizzati per interpolare la percentuale di peso dell'IPA.
- Utilizzare un idrometro per misurare il peso specifico del mangime e raffinato per l'uso nei calcoli successivi.
2. Procedura di spegnimento
- Una volta completati gli esperimenti, spegnere l'agitatore e l'interruttore di alimentazione principale.
- Chiudere le valvole a sfera di alimentazione e solvente, lasciando aperte le valvole a sfera raffinate ed estratte.
Risultati
Le figure 3 e 4 mostrano risultati quando sia l'agitazione che le portate di alimentazione sono state variate su un ampio intervallo. L'efficienza complessiva e il recupero aumentano prima di diventare asintotici, il che è abbastanza tipico degli estrattori liquido-liquido che non sono in prossimità o vicino all'allagamento. In condizioni di quasi alluvione, l'efficienza complessiva e il recupero dovrebbero diminuire drasticamente. Si noti che, a differenza della distillazione, l'allagamento può avvenire nell'estrazione liquido-liquido ad alte velocità di solvente o ad alti tassi di alimentazione (o rapporti). 1 In questo esperimento, la fase organica più leggera è anche la fase dispersa (goccioline), quindi a velocità di alimentazione elevate si prevede che le goccioline si coalessino prima dell'allagamento, portando a tassi più bassi di trasferimento di massa e, quindi, minori recuperi ed efficienze. Ad alti tassi di solvente le goccioline dovrebbero rimanere piccole, quindi si prevede che il recupero e l'efficienza rimangano elevati fino a molto vicino al punto di inondazione.
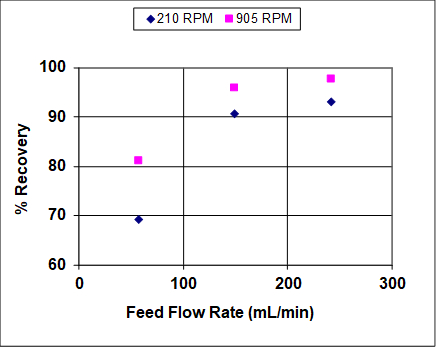
Figura 3: Percentuale di recupero di IPA da miscela di idrocarburi in acqua, per una colonna York-Scheibel, 11 stadi, 16 - 18 mol% IPA in Isopar E (mangime), S/F (molare) = 1,5.
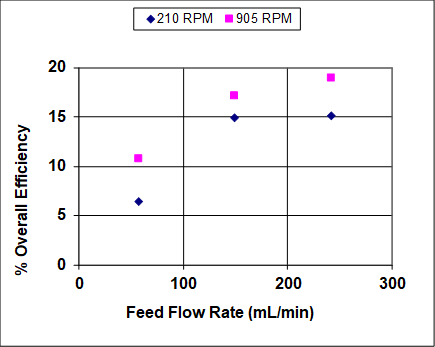
Figura 4: Percentuale di efficienza complessiva dello stadio per l'estrazione ipa utilizzando una colonna York-Scheibel, 11 stadi, 16 - 18 mol% IPA in miscela di idrocarburi (mangime), S/F (molare) = 1,5.
Come si vede dalle figure 3 e 4, l'aumento del tasso di agitazione aumenta sia il recupero che l'efficienza complessiva. Questo perché con una maggiore potenza in ingresso le goccioline della fase dispersa sono più piccole - la dipendenza osservata è approssimativamente inversa rispetto alla velocità dell'agitatore. 4 Il parametro "a" (area interfacciale/volume totale) che appare nelle correlazioni di trasferimento di massa e nelle equazioni fondamentali del flusso di massa può essere scritto come segue per le goccioline sferiche di dimensioni uniformi:
a = 6 ε/d (4)
dove ε è la frazione volumetrica della fase dispersa. Mentre ε può aumentare con un aumento della velocità superficiale di entrambe le fasi, i suoi cambiamenti sono di solito meno marcati del cambiamento di diametro rispetto alla velocità. Quindi (di solito) maggiore è la velocità, maggiore è l'area interfacciale, portando a un trasferimento di massa più veloce.
L'eccezione alla discussione di cui sopra è a velocità molto elevate, che non sono state raggiunte nelle Fig. 3 e 4, dove le due fasi sono così ben mescolate che se la tensione interfacciale tra loro è bassa, l'emulsione avrà luogo. La formazione di un'emulsione influisce negativamente sul recupero e sull'efficienza perché le fasi non possono più separarsi in modo pulito per spostarsi verso l'alto o verso il basso fino alla fase fisica successiva. L'emulsione è un problema in molte estrazioni liquido-liquido e dove non può essere limitata una serie di contenitori miscelatori e coloni in serie è spesso preferita a progetti a colonna come vassoi setaccio o unità York-Scheibel.
Applicazione e Riepilogo
L'estrazione liquido-liquido (LLE) è un'alternativa alla distillazione che si basa sull'immiscibilità solvente-alimentazione (o leggera miscibilità) e sui coefficienti di ripartizione del soluto favorevoli per ottenere elevati recuperi di soluto in una fase solvente al più basso rapporto solvente/mangime possibile. Sebbene l'intervallo di flussi (il "turndown") su cui LLE sarà efficace sia spesso limitato, e mentre le efficienze di fase sono basse in modo tale che l'equilibrio di fase non viene raggiunto, alcune miscele non possono essere separate usando altri metodi in un processo controcorrente continuo. L'analisi matematica del funzionamento di equilibrio di tali estrattori segue una procedura familiare di tipo McCabe-Thiele (sebbene il reflusso sia spesso carente, quindi solo una linea operativa). L'analisi di non equilibrio ("rate-based") delle LLE è complessa e dipende fortemente dalla velocità relativa tra le due fasi (la "velocità di slittamento"), dalla dimensione della bolla e dalla frazione di fase dispersa, che possono essere osservate ma sono difficili da prevedere.
Descrivere perfettamente l'idraulica e il trasferimento di massa di un tipico LLE è al di là della capacità anche dei simulatori di processo più sofisticati, al momento. Pertanto, la progettazione di unità industriali si basa ancora sullo scale-up da unità di tipo impianto pilota, come quella che è stata testata in questo esperimento. Normalmente l'ingegnere tenta di duplicare descrittori chiave come il parametro "a", il rapporto solvente/alimentazione, la potenza totale dell'agitatore in ingresso/volume, la posizione di alimentazione e il numero di stadi fisici per mantenere costante l'efficienza e il recupero dello stadio durante lo scale-up. Anche così, lo scale-up è una scienza inesatta e le impurità, che alterano la tensione interfacciale, possono avere un grande impatto sulle prestazioni dei sistemi reali. Più fattori vengono mantenuti costanti, più è probabile che lo scale-up abbia successo.
Esistono molti contattori LLE diversi: una serie di miscelatori - vasi di sedimenti, imballaggi strutturati simili a quelli utilizzati negli assorbitori e nelle colonne di distillazione, colonne del vassoio del setaccio, contattori a disco rotanti (simili allo York-Scheibel, ma con deflettori invece di rete), contattori Kuhni (una combinazione di dischi rotanti e vassoi setaccio) e contattori Podbielniak ("Pod"), dove il flusso è radiale e la forza centrifuga viene utilizzata per migliorare la separazione di fase liquida. 5
Un classico esempio di LLE industriale è la separazione dell'acido acetico dall'acqua utilizzando etere etilico o acetato di etile; 6 è preferito alla distillazione a concentrazioni di acido acetico più basse. Forse il più grande volume del processo LLE è quello della deasfaltazione del propano, che viene utilizzato per raffinare gli oli lubrificanti nelle raffinerie in condizioni quasi supercritiche. 1 Tuttavia, la maggior parte delle applicazioni si trova nella produzione di prodotti chimici speciali e nelle industrie farmaceutiche, che vanno dall'estrazione dell'acido citrico dal brodo di fermentazione alla purificazione degli antibiotici e alla purificazione delle proteine. 1 In questi casi, viene utilizzata un'ampia varietà di solventi organici ossigenati o sistemi acquosi bifase (con una fase per lo più acqua e l'altra sali e polimeri disciolti acquosi). Per quest'ultimo, un tipico sistema polimerico è il poli(glicole etilenico)/destrano con NaCl e Na2SO4 come sali. Le applicazioni includono la separazione dei globuli rossi e l'estrazione dell'enzima phophofructokinase da S. cerevisiae. 7
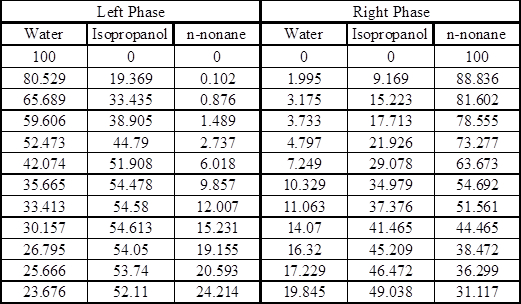
Appendice – Dati di equilibrio8
Linee di cravatte sperimentali in percentuale mole a 25 °C
Parametri specifici del modello in Kelvin
| UNIQUAC | NRTL (a = 0,2) | ||||
| Io | J | AIJ · | AJI · | AIJ · | AJI · |
| 1 | 2 | -186.05 | 104.6 | 814.26 | -468.11 |
| 1 | 3 | 361.91 | 621.82 | 3151 | 1367.4 |
| 2 | 3 | -126.43 | 311.7 | 581.79 | -25.91 |
R1 = 0,92 R2 = 2,7792 R3 = 6,523
Q1 = 1,4 Q2 = 2,508 Q3 = 5,476
| Deviazione media tra concentrazioni calcolate e sperimentali in Mol. % | |
| UNIQUAC (parametri specifici) | 1.4 |
| NRTL (parametri specifici) | 0.54 |
| UNIQUAC (parametri predefiniti) | 1.68 |
Riferimenti
- T.C. Frank, L. Dahuron, B.S. Holden, W.D. Prince, A.F. Seibert and L.C. Wilson, Ch. 15 of “Chemical Engineers Handbook, 8th Edition”, R.H. Perry and D.W. Green, Eds., McGraw-Hill, New York, 2008.
- W.L. McCabe, J.C. Smith, and P. Harriott, “Unit Operations of Chemical Engineering”, 7th Ed., McGraw-Hill, New York, 2005, Ch. 23; C.J. Geankoplis, “Transport Processes and Unit Operations”, 3rd Ed., Prentice-Hall, Englewood Cliffs, 1993, Ch. 12; R.K. Sinnott, “Coulson and Richardson’s Chemical Engineering Vol. 6 – Chemical Engineering Design (4th ed.): http://app.knovel.com/hotlink/toc/id:kpCRCEVCE2/coulson-richardsons-chemical/coulson-richardsons-chemical
- B.E. Poling, G.H. Thomson, D.G. Friend, R.L. Rowley and W.V. Wilding, Ch.2 of “Chemical Engineers Handbook, 8th Edition”, R.H. Perry and D.W. Green, Eds., McGraw-Hill, New York, 2008.
- J.C. Godfrey, R. Reeve and F.I.N. Obi, Chem. Eng. Prog. Dec. 1989. pp. 61-69; I. Alatiqi, G. Aly, F. Mjalli and C.J. Mumford, Canad. J. Chem. Eng., 73, 523-533 (1995).
- http://www.pharmaceuticalonline.com/doc/podbielniak-contactor-a-unique-liquid-liquid-0003 (accessed 12/19/16).
- C.J. King, Ch. 18.5 of “Handbook of Solvent Extraction”, T.C. Lo, M.H.I Baird and C. Hanson, Eds., Wiley, New York, 1983.
- “Methods in Enzymology, Vol. 228, Aqueous Two-Phase Systems,” H. Walter and G. Johannson, Eds., Academic, San Diego, 1994.
- A.I. Vorobeva and M.Kh. Karapetyants, Zh. Fiz. Khim., 41, 1984 (1967). Fits to data from: J. Gmehling, and U. Onken, "Vapor-liquid equilibrium data collection", Dechema, 1977.
Vai a...
Video da questa raccolta:

Now Playing
Efficienza di estrazione liquido-liquido
Chemical Engineering
48.4K Visualizzazioni

Verifica dell'efficienza del trasferimento di calore di uno scambiatore di calore a tubi alettati
Chemical Engineering
17.9K Visualizzazioni

Utilizzo di un essiccatore a vassoio per studiare il trasferimento di calore convettivo e conduttivo
Chemical Engineering
43.9K Visualizzazioni

Viscosità delle soluzioni di glicole propilenico
Chemical Engineering
32.7K Visualizzazioni

Porosimetria della polvere di silicato di alluminio
Chemical Engineering
9.6K Visualizzazioni

Dimostrazione del modello Power Law per estrusione
Chemical Engineering
10.0K Visualizzazioni

Assorbitore di gas
Chemical Engineering
36.6K Visualizzazioni

Equilibrio vapore-liquido
Chemical Engineering
88.6K Visualizzazioni

L'effetto del rapporto di riflusso sull'efficienza della distillazione dei vassoi
Chemical Engineering
77.6K Visualizzazioni

Reattore in fase liquida: inversione del saccarosio
Chemical Engineering
9.7K Visualizzazioni

Cristallizzazione dell'acido salicilico mediante modificazione chimica
Chemical Engineering
24.2K Visualizzazioni

Flusso monofase e bifase in un reattore a letto impaccato
Chemical Engineering
18.9K Visualizzazioni

Cinetica di polimerizzazione per addizione al polidimetilsilossano
Chemical Engineering
16.1K Visualizzazioni

Reattore catalitico: Idrogenazione dell'etilene
Chemical Engineering
30.3K Visualizzazioni

Valutazione del trasferimento di calore di uno Spin-and-Chill
Chemical Engineering
7.4K Visualizzazioni