Reazione di Grignard
Panoramica
Fonte: Vy M. Dong e Faben Cruz, Dipartimento di Chimica, Università della California, Irvine, CA
Questo esperimento dimostrerà come eseguire correttamente una reazione di Grignard. La formazione di un reagente organometallico sarà dimostrata sintetizzando un reagente di Grignard con magnesio e un alogenuro alchilico. Per dimostrare un uso comune di un reagente di Grignard, verrà eseguito un attacco nucleofilo su un carbonile per generare un alcol secondario formando un nuovo legame C-C.
Principi
La reazione di Grignard è un metodo per formare legami carbonio-carbonio tra alogenuri alchilici / arilici e carbonili come aldeidi, chetoni o esteri. Questa chimica vincitrice del premio Nobel consiste in due fasi: la formazione del reagente di Grignard e la successiva aggiunta di Grignard su un carbonile per costruire un nuovo legame carbonio-carbonio. Un reagente di Grignard è un composto organometallico, in particolare un composto organomagnesio. La sintesi di un reagente di Grignard richiede un alogenuro alchilico o arilico (cloruri, bromuri o ioduri) e magnesio. In questa fase, l'alogenuro alchilico elettrofilo (un elettrofilo è carente di elettroni e accetta elettroni) viene trasformato in un composto nucleofilo (un nucleofilo è ricco di elettroni e dona elettroni) composto simile al carbanione. La seconda fase della reazione di Grignard comporta un'aggiunta nucleofila del reagente di Grignard su un carbonile. Dopo questo passaggio, si forma un nuovo legame carbonio-carbonio e il carbonile viene trasformato in un alcol. È importante eseguire entrambe le fasi in condizioni prive di umidità, altrimenti il reagente Grignard utilizzato reagirà con l'acqua e non si desidera che si tratti di formazione di legami Grignard o C-C. La reazione di Grignard è uno strumento importante e ampiamente utilizzato che consente ai chimici sintetici di prendere qualsiasi alogenuro alchilico o arilico e trasformarlo in un composto organomagnesio, che può essere utilizzato per costruire legami carbonio-carbonio.
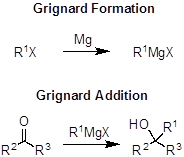
Procedura
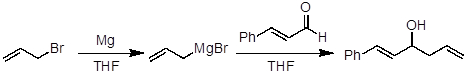
1. Formazione del reagente di Grignard
- Asciugare a fiamma un matraccio a fondo tondo munito di una barra magnetica.
- Aggiungere il magnesio (Mg, 1,1 equiv.) al matraccio a fondo tondo.
- Aggiungere una piccola quantità di iodio (I2, alcuni cristalli). L'aggiunta di iodio è per aiutare a rimuovere qualsiasi MgO sulla superficie del Mg. La rimozione di MgO consente a Mg e all'alogenuro aril / alchilico di entrare in contatto e reagire. La sonicazione o l'aggiunta di ioduro di metile o 1,2-dibromoetano può anche aiutare con l'iniziazione.
- Raffreddare la miscela di reazione a 0 °C con un bagno di acqua ghiacciata
- Aggiungere lentamente una soluzione THF (1 M) di bromuro di allile (1 equiv.) al matraccio a fondo tondo con magnesio.
- Dopo aver aggiunto la soluzione di bromuro di allile, mescolare la miscela di reazione per 3 ore a temperatura ambiente.
2. Addizione nucleofila
- In un matraccio rotondo a fondo essiccato a fiamma separato, aggiungere trans-cinnamaldeide (0,85 equiv.) e THF (0,5 M rispetto alla trans-cinnamaldeide) e raffreddare a 0 °C.
- Aggiungere lentamente la soluzione THF del reagente di Grignard (bromuro di allile-magnesio) alla soluzione trans-cinnamaldeide.
- Dopo l'aggiunta, riscaldare la miscela di reazione a temperatura ambiente rimuovendo il bagno di acqua ghiacciata e mescolare per 4 ore.
- Monitorare l'avanzamento della reazione tramite TLC cercando la scomparsa della trans-cinnamaldeide.
- Dopo il completamento della reazione, raffreddare la miscela a 0 °C con un bagno di acqua ghiacciata.
- Spegnere lentamente la reazione con una soluzione acquosa satura di cloruro di ammonio (NH4Cl).
- Trasferire la miscela in un imbuto separatore ed estrarre lo strato acquoso con acetato di etile 3x.
- Unire gli strati organici e lavare con acqua e salamoia (una soluzione acquosa satura di NaCl).
- Asciugare lo strato organico con MgSO4anidro, filtrare ed evaporare il solvente tramite evaporazione rotativa.
- Purificare il residuo grezzo mediante cromatografia a colonna flash.
Risultati
Il prodotto purificato deve avere il seguente spettro NMR 1H: 1H NMR δ 7,23-7,39 (m, 5H), 6,60 (d, J = 16,0 Hz, 1H), 6,23 (dd, J = 6,4 Hz, 1H), 5,84 (m, 1H), 5,14-5,20 (m, 2H), 4,35 (q, J = 6,4 Hz, 1H), 2,37-2,43 (m, 2H), 1,9 (br s, 1H).
Applicazione e Riepilogo
Questo esperimento ha dimostrato come sintetizzare un reagente di Grignard da un alogenuro arilelico / alchilico e come utilizzare il reagente di Grignard per eseguire un'aggiunta nucleofila su un composto carbonile per costruire un nuovo legame carbonio-carbonio.
La reazione di Grignard è ampiamente applicata nel mondo della chimica sintetica e viene utilizzata nei laboratori di ricerca universitari, nei laboratori nazionali e nelle aziende farmaceutiche. I reagenti Grignard semplici sono disponibili in commercio, ma spesso sono necessari reagenti Grignard unici e specializzati. La reazione di Grignard consente ai chimici sintetici di accedere ai composti necessari dagli alogenuri arilici o alchilici. Oltre a eseguire aggiunte nucleofile sui carbonili, i reagenti di Grignard possono essere utilizzati come nucleofili in combinazione con una grande varietà di altri composti elettrofili. Un esempio di reagente Grignard specializzato può essere trovato nella sintesi di phorboxazole A, un prodotto naturale che presenta potenti proprietà antibatteriche, antifungine e anti-proliferative.
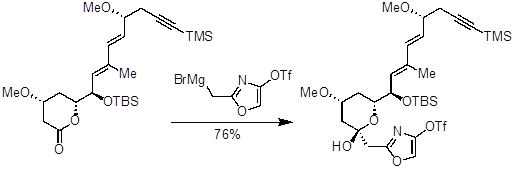
Figura 1. Phorboxazole A
Un altro modo per generare i reagenti di Grignard è tramite lo scambio magnesio-alogeno. Questo metodo utilizza un reagente Grignard prefabbricato invece di utilizzare il magnesio per generare il Grignard desiderato. I reagenti Grignard più comunemente usati per lo scambio magnesio-alogeno sono i-PrMgCl e i-PrMgBr, entrambi disponibili in commercio. Lo scambio magnesio-alogeno ha dimostrato di presentare un'ampia tolleranza del gruppo funzionale1. Di conseguenza, questo metodo si è dimostrato un modo utile per generare reagenti Grignard altamente funzionalizzati. Gli alogenuri alchilici/arilici con gruppi funzionali che tipicamente reagiscono con i reagenti di Grignard possono essere utilizzati per produrre reagenti di Grignard tramite scambio magnesio-alogeno. Esteri, nitrili e cloruri alchilici rimangono intatti durante lo scambio magnesio-alogeno. Inoltre, gli iodi possono subire selettivamente lo scambio magnesio-alogeno in presenza di bromuri.

Figura 2. Scambio magnesio-alogeno
I reagenti di Grignard agiscono tipicamente come nucleofili e si aggiungono ai composti carbonilici, ma le reazioni collaterali possono verificarsi a seconda della natura del Grignard e del carbonile utilizzati. Una reazione laterale comune è un accoppiamento di Wurtz, in cui il reagente di Grignard si accoppia a se stesso per formare un dimero. Grignard o carbonili stericamente voluminosi possono rendere difficile l'aggiunta nucleofila. I potenziali risultati con substrati stericamente voluminosi sono l'assenza di un'aggiunta o riduzione del trasferimento di carbonile tramiteΒββ-idruro. La presenza di protoni enolizzabili nel carbonile può anche rendere difficile l'aggiunta nucleofila a causa dell'enolizzazione carbonile competitiva. Un modo comune per sopprimere queste reazioni collaterali e promuovere l'aggiunta nucleofila è quello di utilizzare sali di lantanidi, in particolare CeCl3, come additivi. I sali di lantanidi sono ossofili (attratti dall'ossigeno), e quindi si coordinano con l'ossigeno carbonilico e aumentano l'elettrofilia del carbonile. Si prevede che l'aggiunta di ciclopentil MgCl nel cicloesenone darebbe l'alcol terziario, ma invece il carbonile è ridotto per dare l'alcol secondario. Questa reazione laterale può essere soppressa a favore dell'aggiunta di Grignard desiderata aggiungendo LaCl3.
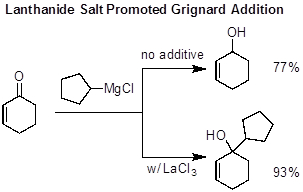
Figura 3. Sale di lantanide promosso Grignard Aggiunta
Riferimenti
- Angew. Chem. Int. Ed.,2003, 42, 4302.
Vai a...
Video da questa raccolta:

Now Playing
Reazione di Grignard
Organic Chemistry II
149.0K Visualizzazioni

Pulizia della vetreria
Organic Chemistry II
123.5K Visualizzazioni

Sostituzione nucleofila
Organic Chemistry II
99.5K Visualizzazioni

Agenti riducenti
Organic Chemistry II
43.0K Visualizzazioni

Titolazione di n-butillitio
Organic Chemistry II
47.7K Visualizzazioni

Dispositivo di Dean Stark
Organic Chemistry II
100.2K Visualizzazioni

Ozonolisi degli alcheni
Organic Chemistry II
67.0K Visualizzazioni

Organocatalisi
Organic Chemistry II
16.6K Visualizzazioni

Reazione di accoppiamento catalizzata da palladio
Organic Chemistry II
34.3K Visualizzazioni

Sintesi in fase solida
Organic Chemistry II
41.0K Visualizzazioni

Idrogenazione
Organic Chemistry II
49.6K Visualizzazioni

Polimerizzazione
Organic Chemistry II
93.8K Visualizzazioni

Punto di fusione
Organic Chemistry II
149.8K Visualizzazioni

Spettroscopia infrarossa
Organic Chemistry II
214.6K Visualizzazioni

Polarimetro
Organic Chemistry II
99.9K Visualizzazioni