Reação de Grignard
Visão Geral
Fonte: Vy M. Dong e Faben Cruz, Departamento de Química da Universidade da Califórnia, Irvine, CA
Este experimento demonstrará como realizar adequadamente uma reação de Grignard. A formação de um reagente organometálico será demonstrada sintetizando um reagente Grignard com magnésio e um halido alquilo. Para demonstrar um uso comum de um reagente Grignard, um ataque nucleofílico em um carbonyl será realizado para gerar um álcool secundário, formando uma nova ligação C-C.
Princípios
A reação de Grignard é um método para formar ligações carbono-carbono entre halidos alquil/aryl e carbonyls como aldeídos, cetonas ou ésteres. Esta química ganhadora do Prêmio Nobel consiste em dois passos: a formação de reagentes Grignard e a subsequente adição de Grignard a um carbonyl para construir uma nova ligação carbono-carbono. Um reagente Grignard é um composto organometólico, especificamente um composto organomagnesium. A síntese de um reagente Grignard requer um halido alquilo ou aryl (cloretos, brometos ou iodetos) e magnésio. Nesta etapa, o eletrofílico (um eletrofilmético é deficiente de elétrons e aceita elétrons) o halido alquilo é transformado em um composto nucleofílico (um nucleófilo é rico em elétrons e doa elétrons) composto semelhante à carbânion. O segundo passo da reação de Grignard implica uma adição nucleofílica do reagente Grignard em um carbonyl. Após esta etapa, uma nova ligação carbono-carbono é formada e o carbonyl é transformado em um álcool. É importante realizar ambas as etapas sob condições livres de umidade, caso contrário, o reagente Grignard usado reagirá com água, e nenhum resultado desejado de formação de títulos Grignard ou C-C. A reação de Grignard é uma ferramenta importante e amplamente utilizada que permite aos químicos sintéticos tomar qualquer halido alquil ou aryl e transformá-lo em um composto organomagnesium, que pode ser usado para construir ligações carbono-carbono.
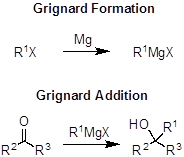
Procedimento
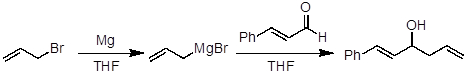
1. Formação de Reagentes Grignard
- Seque um frasco de fundo redondo equipado com uma barra de agitação magnética.
- Adicione magnésio (Mg, 1,1 equiv.) ao frasco fundo redondo.
- Adicione uma pequena quantidade de iodo (I2, alguns cristais). A adição de iodo é para ajudar a remover qualquer MgO na superfície do Mg. Remover MgO permite que Mg e o halido aryl/alkyl entrem em contato e reajam. A sônica ou adição de iodeto de metila ou 1,2-dibromoetano também pode ajudar na iniciação.
- Esfrie a mistura de reação a 0 °C com um banho de água gelada
- Adicione lentamente uma solução THF (1 M) de brometo de alil (1 equiv.) ao frasco fundo redondo com magnésio.
- Depois de adicionar a solução de brometo aliado, mexa a mistura de reação por 3 horas à temperatura ambiente.
2. Adição nucleofílica
- Em um frasco de fundo redondo separado, adicione trans-cinnamaldeído (0,85 equiv.) e THF (0,5 M em relação ao trans-cinnamaldeído) e esfrie a 0 °C.
- Adicione lentamente a solução THF do reagente Grignard (brometo de magnésio aliado) à solução trans-cinnamaldeído.
- Após a adição, aqueça a mistura de reação à temperatura ambiente removendo o banho de água gelada e mexa por 4h.
- Monitore o progresso da reação via TLC procurando o desaparecimento de trans-cinnamaldeído.
- Após a conclusão da reação, esfrie a mistura a 0 °C com um banho de água gelada.
- Sacia lentamente a reação com uma solução aquosa saturada de cloreto de amônio (NH4Cl).
- Transfira a mistura em um funil separador e extraia a camada aquosa com acetato etílico 3x.
- Misture as camadas orgânicas e lave com água e salmoura (uma solução aquosa saturada de NaCl).
- Seque a camada orgânica com MgSO4anidro, filtro e evapore o solvente através da evaporação rotatória.
- Purifique o resíduo bruto através da cromatografia da coluna flash.
Resultados
O produto purificado deve ter o seguinte espectro de 1H NMR: 1H NMR δ 7,23-7,39 (m, 5H), 6,60 (d, J = 16,0 Hz, 1H), 6,23 (dd, J = 6,4 Hz, 1H), 5,84 (m, 1H), 5,14-5,20 (m, 2H), 4,35 (q, J = 6,4 Hz, 1H), 2,37-2,43 (m, 2H), 1,9 (br s, 1H).
Aplicação e Resumo
Este experimento demonstrou como sintetizar um reagente Grignard a partir de um halide aryl/alkyl e como usar o reagente Grignard para realizar uma adição nucleofílica em um composto carbonyl para construir uma nova ligação carbono-carbono.
A reação de Grignard é amplamente aplicada no mundo da química sintética, e é usada em laboratórios de pesquisa universitária, laboratórios nacionais e empresas farmacêuticas. Reagentes Grignard simples estão disponíveis comercialmente, mas muitas vezes reagentes Grignard únicos e especializados são necessários. A reação de Grignard permite que os químicos sintéticos acessem os compostos necessários a partir de halidos aryl ou alquil. Além de realizar adições nucleofílicas em carbonyls, os reagentes grignard podem ser usados como nucleófilos em combinação com uma grande variedade de outros compostos eletrofílicos. Um exemplo de reagente Grignard especializado pode ser encontrado na síntese de phorboxazole A, um produto natural que exibe potentes propriedades antibacterianas, antifúngicas e anti-proliferativas.
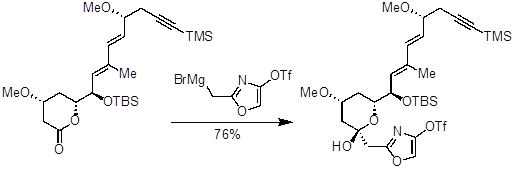
Figura 1. Phorboxazole
Outra maneira de gerar reagentes Grignard é através da troca de magnésio-halógeno. Este método usa um reagente Grignard pré-fabricado em vez de usar magnésio para gerar o Grignard desejado. Os reagentes Grignard mais usados para troca de magnésio-halógeno são i-PrMgCl e i-PrMgBr, ambos disponíveis comercialmente. A troca de magnésio-halógeno mostrou-se exibir uma ampla tolerância funcional do grupo1. Como resultado, este método provou ser uma maneira útil de gerar reagentes Grignard altamente funcionais. Halidos alquil/aryl com grupos funcionais que normalmente reagem com reagentes Grignard podem ser usados para fazer reagentes Grignard através da troca de magnésio-halogênio. Ésteres, niriles e cloretos de alquila permanecem intactos durante a troca de magnésio-halogênio. Além disso, os iodides podem passar seletivamente pela troca de magnésio-halógeno na presença de brometos.

Figura 2. Intercâmbio magnésio-halógeno
Os reagentes grignard normalmente agem como nucleófilos e adicionam compostos carbonyl, mas reações laterais podem ocorrer dependendo da natureza do Grignard e carbonyl usados. Uma reação do lado comum é um acoplamento wurtz, onde o reagente Grignard se casa para formar um dimer. Grignards stericamente volumosos ou carbonyls podem tornar a adição nucleofílica desafiadora. Os resultados potenciais com substratos estreicamente volumosos são a ausência de uma adição ou redução da transferência de carbonila viaΒβ-hidreto. A presença de prótons enolizáveis no carbonyl também pode tornar a adição nucleofílica desafiadora devido à enolização competitiva de carbonyl. Uma maneira comum de suprimir essas reações laterais e promover a adição nucleofílica é usar sais de lantano,especialmentecânticos, como aditivos. Os sais de lantânida são oxofílicos (atraídos pelo oxigênio), e, portanto, coordenam o oxigênio carbonyl e aumentam a elefiliação do carbonyl. Espera-se que a adição de ciclopentil mgcl em ciclohexenona daria o álcool terciário, mas em vez disso o carbonyl é reduzido para dar o álcool secundário. Esta reação lateral pode ser suprimida em favor da adição desejada de Grignard adicionando LaCl3.
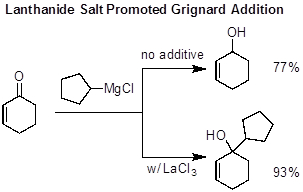
Figura 3. Sal de lantano promovido adição grignard
Referências
- Angew. Chem. Int. Ed.,2003, 42, 4302.
Pular para...
Vídeos desta coleção:

Now Playing
Reação de Grignard
Organic Chemistry II
149.0K Visualizações

Limpeza de Vidraria
Organic Chemistry II
123.5K Visualizações

Substituição nucleofílica
Organic Chemistry II
99.5K Visualizações

Agentes redutores
Organic Chemistry II
43.0K Visualizações

Titulação de n-butil-lítio
Organic Chemistry II
47.7K Visualizações

Trap Dean-Stark para destilação
Organic Chemistry II
100.2K Visualizações

Ozonólise de Alquenos
Organic Chemistry II
67.0K Visualizações

Organocatálise
Organic Chemistry II
16.6K Visualizações

Acoplamento Cruzado Catalisado por Paládio
Organic Chemistry II
34.3K Visualizações

Síntese de Fase Sólida
Organic Chemistry II
41.0K Visualizações

Hidrogenação
Organic Chemistry II
49.6K Visualizações

Polimerização
Organic Chemistry II
93.8K Visualizações

Ponto de fusão
Organic Chemistry II
149.8K Visualizações

Espectroscopia infravermelha
Organic Chemistry II
214.6K Visualizações

Polarímetro
Organic Chemistry II
99.9K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados