Method Article
Nefrectomia 5/6 con bipolectomia acuta tramite laparotomia della linea mediana nei ratti
In questo articolo
Riepilogo
Questo manoscritto introduce un protocollo standardizzato per una nefrectomia 5/6 mediante bipolectomia acuta tramite laparotomia della linea mediana in un modello di ratto, con l'obiettivo di indurre uno stato di insufficienza renale attraverso la riduzione del parenchima renale con un grande grado di precisione metodica e un basso rischio di errore tecnico.
Abstract
La malattia renale cronica (CKD) colpisce oltre il 10% della popolazione globale, pari a più di 800 milioni di individui in tutto il mondo. I progressi nel trattamento della malattia renale cronica hanno avuto un impatto significativo sugli esiti dei pazienti. Mentre in passato la malattia renale cronica era spesso considerata una condanna a morte, con molti pazienti che soccombevano alle complicanze della malattia renale allo stadio terminale, ora viene sempre più gestita come una condizione cronica con la disponibilità di dialisi e trapianto di rene, nonché nuovi sviluppi farmaceutici come gli inibitori SGLT2 o gli antagonisti del recettore dei mineralcorticoidi non steroidei.
Tuttavia, continua ad esserci una crescente domanda di ulteriori esplorazioni sui processi fisiopatologici e sui potenziali interventi terapeutici. Modelli biologici affidabili svolgono un ruolo cruciale nel facilitare questa ricerca. Data la natura multiforme della malattia renale, che comprende non solo la biologia cellulare ma anche la microanatomia vascolare e la segnalazione endocrina, un modello appropriato deve possedere un livello di complessità biologica che solo un modello animale può offrire, rendendo i roditori una scelta ovvia.
Questo manoscritto, quindi, fornisce un protocollo complesso e sistematico per la riduzione chirurgica del parenchima renale attraverso la laparotomia della linea mediana e la nefrectomia totale e parziale combinata nei ratti per applicazioni di sopravvivenza e non di sopravvivenza. Sottolinea il ruolo critico di tecniche chirurgiche precise nel garantire risultati coerenti e affidabili. I principali esempi di potenziali applicazioni di questo modello includono studi biomolecolari e farmaceutici, nonché lo sviluppo di modalità di imaging intraoperatorio innovative, come l'imaging iperspettrale, per visualizzare e differenziare oggettivamente la malperfusione renale.
Introduzione
La malattia renale cronica (CKD) è una condizione progressiva che colpisce una parte significativa della popolazione globale. È caratterizzato dalla graduale perdita della funzione endocrina e filtrativa dei reni nel tempo, che porta all'accumulo di prodotti di scarto e liquidi nell'organismo e a uno squilibrio del sistema endocrino. Dati recenti suggeriscono che dal 9,1% al 13,4% della popolazione mondiale (tra 700 milioni e un miliardo di persone) ha la CKD1. La prevalenza della malattia renale cronica aumenta con l'età, colpendo circa il 34% delle persone di età pari o superiore a 65 anni negli Stati Uniti, rispetto al 12% in quelle di età compresa tra 45 e 64 anni e al 6% in quelle di età compresa tra 18 e 44 anni2.
Pertanto, la malattia renale cronica contribuisce in modo significativo al carico globale di malattie e tassi di mortalità. La diagnosi precoce e la gestione della malattia renale cronica sono fondamentali per rallentarne la progressione e ridurre il rischio di complicanze, come malattie cardiovascolari, anemia e, infine, malattia renale allo stadio terminale, che richiede dialisi o trapianto di rene per la sopravvivenza3.
Gli interventi terapeutici per la malattia renale cronica allo stadio terminale hanno subito una notevole evoluzione negli ultimi decenni. Storicamente, la gestione della malattia renale cronica allo stadio terminale era limitata alla terapia di supporto, con la dialisi che è emersa come modalità di sostegno vitale negli anni '60. Da allora, sono stati compiuti progressi significativi nelle tecniche di dialisi, tra cui lo sviluppo di membrane più biocompatibili, un migliore accesso vascolare e l'avvento della dialisi peritoneale4. Inoltre, il trapianto di rene è emerso come il trattamento ottimale per la malattia renale cronica allo stadio terminale, offrendo una migliore sopravvivenza e qualità della vita rispetto alla dialisi5. Tuttavia, la carenza di organi da donatore rimane una sfida significativa, che spinge la ricerca su nuove strategie come lo xenotrapianto e gli approcci di medicina rigenerativa. Inoltre, la gestione delle complicanze associate alla CKD allo stadio terminale, come l'iperparatiroidismo secondario, è stata migliorata dall'introduzione di agenti calcimimetici come l'etelcalcetide, che modulano efficacemente i livelli di ormone paratiroideo6.
Nonostante questi progressi, la ricerca di terapie più efficaci e mirate continua, alimentata dalla ricerca in corso sui meccanismi molecolari alla base della progressione della CKD allo stadio terminale e sulle comorbidità associate. Pertanto, la malattia renale cronica persiste come una preoccupazione significativa nella cura del paziente, spingendo una continua necessità di un'ampia ricerca sui processi biomedici e sugli approcci terapeutici. Modelli biologici robusti sono essenziali per facilitare tali indagini. Data la natura sfaccettata della CKD, che comprende aspetti che vanno dalla biologia cellulare alla segnalazione endocrina interorgano, all'anatomia funzionale vascolare e alla reologia, un modello ideale deve possedere un livello di complessità biologica che solo un organismo modello completo può fornire. Pertanto, i roditori emergono come il modello preferito grazie alla loro capacità di comprendere efficacemente queste varie dimensioni biologiche.
Il modello di rene residuo di nefrectomia 5/6 funge da strumento comune nella ricerca sulla CKD per esperimenti su ratti e murini grazie alla sua induzione stabile di insufficienza renale 7,8,9,10,11,12,13,14. Questo modello prevede la rimozione di un rene intero e di 2/3 dell'altro. La creazione del rene residuo può essere ottenuta attraverso la resezione chirurgica dei poli renali, definita modello di polectomia, o legando le arterie renali segmentali superiori e inferiori, con conseguente infarto dei poli 7,15,16,17,18,19,20.
Sebbene questo modello di nefrectomia 5/6 con polectomia sia una tecnica consolidata, è stato introdotto solo come protocollo trasparente e comprensibile con un accesso retroperitoneale dorsolaterale21. Questo accesso può essere vantaggioso per una procedura unilaterale con riduzione del parenchima renale su un solo lato o per una procedura in due fasi con una distanza temporale di pochi giorni al fine di aumentare la sopravvivenza postoperatoria dell'animale22. Tuttavia, l'utilizzo di un approccio laparotomico della linea mediana offre vantaggi distinti rispetto alla convenzionale via di accesso retroperitoneale laterodorsale.
Utilizzando una singola incisione addominale sulla linea mediana, il chirurgo ottiene un accesso senza ostacoli all'intera cavità addominale, facilitando così un'esplorazione e una manipolazione complete degli organi intra-addominali. Questo campo chirurgico ampliato non solo semplifica la procedura di nefrectomia, ma consente anche l'esecuzione simultanea di ulteriori interventi che possono essere necessari per specifici protocolli sperimentali, ad esempio procedure sugli ureteri, come la legatura, la resezione o la ricostruzione, che possono essere essenziali per studiare la fisiopatologia dell'uropatia ostruttiva. Inoltre, questo approccio consente la resezione o la manipolazione simultanea di altri organi addominali, come il fegato, la milza o il tratto gastrointestinale, ampliando così l'ambito delle indagini sperimentali sulle interazioni multiorgano o sui modelli di malattia sistemica.
Inoltre, l'approccio della laparotomia della linea mediana facilita la costruzione di un condotto ileo o neovescica, una procedura chirurgica che prevede la creazione di una diversione urinaria utilizzando un segmento dell'ileo, che è particolarmente rilevante negli studi che indagano la disfunzione vescicale o nelle tecniche di urologia ricostruttiva. Questa versatilità nel combinare la nefrectomia con altri interventi chirurgici all'interno dello stesso campo operatorio non solo semplifica i protocolli sperimentali, ma riduce anche al minimo il trauma chirurgico cumulativo e i rischi associati per i soggetti animali. Pertanto, nel caso di chirurgia renale bilaterale in un unico stadio o di procedure intraaddominali aggiuntive simultanee, l'accesso ventrale tramite laparotomia della linea mediana dovrebbe essere l'opzione preferita.
Attualmente, non è disponibile alcuna pubblicazione o protocollo che descriva questa strategia chirurgica. Pertanto, con questo lavoro, il nostro obiettivo è quello di presentare una guida procedurale dettagliata per condurre la resezione renale e l'induzione chirurgica della CKD tramite laparotomia della linea mediana nei ratti, applicabile sia agli studi di sopravvivenza che a quelli di non sopravvivenza. Questo modello sperimentale crea un ambiente regolato favorevole allo studio delle complesse dinamiche della CKD, imitando scenari clinicamente significativi. Questo protocollo è stato specificamente progettato per illustrare la tecnica chirurgica. L'intervento è stato quindi eseguito in un setting di non sopravvivenza su un gruppo omogeneo di 10 ratti maschi. Poiché non vi era alcuna ragione significativa per il confronto con un basale o un intervento alternativo, l'inclusione di un gruppo di controllo non era necessaria. La nefrectomia 5/6 si riferisce esplicitamente all'estensione della resezione chirurgica del parenchima. Questo si traduce certamente in una riduzione funzionale nel senso di una riduzione della velocità di filtrazione glomerulare. Tuttavia, l'esatto grado funzionale non può essere previsto, ma dovrà essere misurato individualmente per ciascun animale, ad esempio utilizzando inulina o clearance dell'acido p-amminoippurico23,24, se necessario.
Protocollo
Tutte le procedure per gli animali descritte in questo documento sono state eseguite all'interno di strutture accreditate e hanno ottenuto l'approvazione dal comitato istituzionale per la cura e l'uso degli animali (IACUC) del Consiglio regionale del Baden-Württemberg a Karlsruhe, Germania (35-9185.81/G-62/23). Gli animali da esperimento sono stati gestiti in conformità con i protocolli istituzionali e nel rispetto della legislazione tedesca in materia di benessere animale, oltre ad aderire alle linee guida stabilite dal Consiglio della Comunità Europea (2010/63/UE) e alle linee guida ARRIVE. Sono stati utilizzati ratti maschi Sprague Dawley con un peso iniziale di 400 g dopo un periodo di acclimatazione di 1 settimana.
1. Anestesia e analgesia
- Narcotizzare il modello di ratto con i farmaci di scelta. Per seguire questo protocollo, eseguire l'induzione volatile della sedazione con isoflurano seguita da un'iniezione intraperitoneale di 100 mg/kg di ketamina per anestesia dissociativa e 4 mg/kg di xilazina del peso corporeo. Ottenere l'analgesia con iniezioni sottocutanee di 5 mg/kg di carprofene di peso corporeo.
NOTA: Un protocollo dettagliato può essere trovato nella letteratura citata25. - Garantire un'adeguata profondità analgesica cercando i riflessi del dolore durante il test di pizzicamento delle dita dei piedi con una pinza chirurgica e rivalutare regolarmente la profondità dell'anestesia durante la procedura.
- Applicare lubrificante oftalmico sugli occhi per prevenire l'essiccazione corneale.
2. Preparazione della procedura
- Preparare il sito operatorio con tutti i materiali e gli strumenti necessari, comprese le legature in polifilamento, gli anelli dei vasi in silicone, i morsetti smussati, le forbici e le pinze per la preparazione fine, nonché i cerotti emostatici tagliati in pezzi di 0,8 x 0,6 cm (Figura 1A-G). Preparare l'apparecchio chirurgico per l'esposizione chirurgica dei roditori, un termoforo e i ganci per la preparazione chirurgica come specificato nella letteratura citata25.
- Radere la lunghezza dell'accesso desiderato, disinfettare il sito chirurgico con tre scrub alternati con etanolo al 70% e tamponi abrasivi a base di iodio o clorexidina con un movimento circolare e ottenere una corretta ossigenazione tramite l'inalazione di ossigeno al 100% utilizzando una maschera facciale neonatale (Figura 1H-J). Coprire il resto del corpo al di fuori del sito chirurgico con teli per evitare contaminazioni.
NOTA: L'animale rappresentativo che è stato utilizzato per ottenere le immagini delle figure non è stato drappeggiato per consentire una migliore visualizzazione dei punti di riferimento anatomici. - Eseguire una mini-laparotomia mediana tramite un'incisione cutanea mediana iniziale sulla lunghezza addominale desiderata di ~3 cm e una successiva incisione leggermente più piccola della fascia lungo la linea alba (Figura 1K-M).
- Ottenere l'esposizione chirurgica del rene utilizzando impacchi chirurgici e ganci per la preparazione chirurgica (Figura 1N-O). Toccare il parenchima renale solo con strumenti di preparazione atraumatici come un batuffolo di cotone inumidito o un impacco inumidito utilizzando una pinza o pinze smussate.

Figura 1: Strumenti sperimentali, materiali e configurazione. (A) Strumenti chirurgici richiesti; (B) legatura in polifilamento; (C) ansa del vaso in silicone; (D) forbici per la preparazione fine. (E-G) Cerotto emostatico tagliato in pezzi di 0,8 x 0,6 cm. (H-J) Modello di ratto rasato e ossigenato con maschera facciale. L'animale rappresentativo che è stato utilizzato per ottenere le immagini delle figure non è stato drappeggiato per consentire una migliore visualizzazione dei punti di riferimento anatomici. (K,L) Incisione cutanea mediana sulla lunghezza addominale desiderata di ~3 cm. (M) Mini-laparotomia mediana; (N) esposizione del rene sinistro mediante un impacco chirurgico, ganci per la preparazione chirurgica e un supporto metallico; (O) esposizione analoga del rene destro e resezione della fascia di Gerota. Clicca qui per visualizzare una versione più grande di questa figura.
3. Nefrectomia parziale
- Esporre il rispettivo rene, afferrare il grasso perirenale che è attaccato alla sottile fascia di Genota e applicare una certa tensione per sollevare localmente la fascia dal parenchima renale (Figura 2A, B.2).
- Incidere e minare la fascia con l'estremità affilata del bordo di una forbice e continuare con una dissezione longitudinale della fascia di Genota (Figura 2B).
- Eseguire un degloving smussato della fascia della Gerota utilizzando le forbici chiuse minando gradualmente la fascia tutt'intorno al parenchima e piegando la capsula fasciale medialmente, facoltativamente resecandola parzialmente (Figura 2C).
- Imbracare l'ilo renale utilizzando un anello vascolare in silicone per un migliore controllo vascolare (Figura 2D).
- Posizionare la punta della pinza nello spazio retroperitoneale per stabilizzare il rene per evitare una fuoriuscita dorsale del rene durante il processo di taglio ed eseguire la polectomia cranica affilata di 1/3 renale con un colpo preciso e mirato utilizzando le forbici (Figura 2E).
NOTA: La linea di dissezione deve essere scelta mediante valutazione clinica in modo che separi l'organo in 1/3 dell'altezza dell'organo cranialmente e caudalmente. - Ottenere l'emostasi applicando un cerotto emostatico, mediante compressione manuale, mediante compressione con strumenti smussati o mediante tensione ilare attraverso l'ansa del vaso in silicone, riducendo efficacemente il flusso sanguigno ilare (Figura 2F-J).
NOTA: L'emostasi è stata regolarmente raggiunta tirando contemporaneamente l'ansa vascolare e l'applicazione del cerotto emostatico per 2,5-3 minuti. - Seguire con una polectomia caudale acuta di 1/3 renale in modo analogo (Figura 2K-N). Per entrambi i colpi di forbice, puntare a un piano di dissezione leggermente angolato che lascerà più parenchima renale sul lato ilare e meno tessuto sul lato laterale per evitare lesioni ilari non intenzionali e ridurre le perdite urinarie dal sistema pelvicocaliceico (Figura 2O). Se si desidera una standardizzazione più elevata della resezione precisa del parenchima 5/6, pesare il resecato, della nefrectomia totale sul lato controlaterale descritto più avanti, pesare i resecati della nefrectomia parziale 2/3 e ripetere la dissezione con una tecnica di "salame-slicing" fino ad ottenere esattamente i 2/3 del peso.

Figura 2: Nefrectomia parziale. (A) Esposizione chirurgica di un rene. (B) Incisione longitudinale della fascia della Gerota con forbici affilate. (C) Smussatura della fascia della Gerota con forbici chiuse. (D) Imbracatura dell'ilo renale utilizzando un anello del vaso in silicone. (E) Polectomia cranica acuta 1/3 con forbici e pinze come guida. (F) Raggiungimento dell'emostasi mediante l'applicazione di un cerotto emostatico; (G) raggiungimento dell'emostasi mediante compressione manuale; (H-J) ottenendo l'emostasi mediante compressione con strumenti smussati e tensione ilare attraverso l'ansa del vaso in silicone. (K-N) Polectomia caudale acuta 1/3 in analogia. (O) Rappresentazione schematica dei piani di dissezione raccomandati per evitare lesioni ilari non intenzionali (linee nere). Clicca qui per visualizzare una versione più grande di questa figura.
4. Nefrectomia totale
- Mobilizzare il rene in analogia con i passaggi sopra descritti e scavare un tunnel nell'ilo renale utilizzando pinze smussate (Figura 3A, B).
- Imbracare l'ilo renale utilizzando una legatura in polifilamento e posizionare un nodo scorrevole sicuro sull'ilo renale piuttosto vicino ai vasi addominali per occludere il flusso sanguigno renale e l'uretere (Figura 3C, D).
- Sezionare bruscamente l'ilo usando le forbici e rimuovere il rene (Figura 3E, F).
- Controllare l'emostasi e tagliare le estremità della legatura (Figura 3G-J).

Figura 3: Nefrectomia totale. (A) Esposizione chirurgica del rene controlaterale; (B) analoga rimozione della fascia di Genota e tunneling dell'ilo renale mediante morsetti smussati overholt; (C) imbracatura dell'ilo utilizzando una legatura in polifilamento. (D) Posizionamento di una legatura a nodo scorrevole sull'ilo renale; (E,F) dissezione acuta dell'ilo con forbici e rimozione del rene; (G-I) per l'emostasi e il taglio delle estremità della legatura. (J) Rappresentazione schematica dell'altezza di legatura consigliata (linea tratteggiata) e del piano di dissezione (linea nera). Clicca qui per visualizzare una versione più grande di questa figura.
5. Chiusura della parete addominale
- Posizionare una sutura d'angolo sulla fascia addominale utilizzando una sutura in polifilamento (Figura 4A-D).
- Continuare a suturare la fascia addominale con una sutura in corsa con ~2 mm di tessuto afferrato ad ogni morso e circa 4 mm tra i morsi (Figura 4E-I).
- Sutura lo strato cutaneo utilizzando punti singoli con ~3 mm di tessuto afferrato ad ogni morso e ~6 mm tra i morsi (Figura 4J-Q).
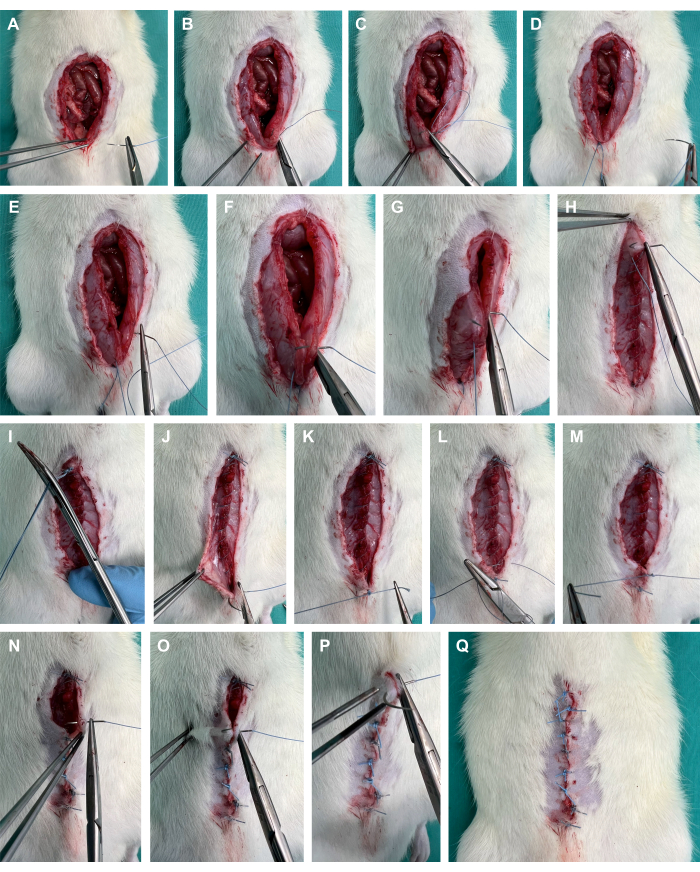
Figura 4: Chiusura della parete addominale. (A-D) Posizionamento di una sutura angolare sulla fascia addominale utilizzando una sutura in polifilamento. (E-I) Sutura in esecuzione della fascia addominale; (J-Q) sutura dello strato cutaneo mediante punti singoli. Clicca qui per visualizzare una versione più grande di questa figura.
6. Ulteriori passaggi
- A seconda dello scenario desiderato, dello scopo della ricerca e del grado di insufficienza renale desiderato, considerare le deviazioni da questo protocollo, inclusa una variazione nella quantità di parenchima renale resecato, ad esempio nefrectomia totale unilaterale (nefrectomia 3/6), nefrectomia totale bilaterale (nefrectomia 6/6), monopolectomia unilaterale (nefrectomia 1/6), monopolectomia bilaterale (nefrectomia 2/6), bipolectomia unilaterale (nefrectomia 2/6) e bipolectomia bilaterale (nefrectomia 4/6).
- In generale, sopprimere gli animali mediante cardiectomia acuta senza previa chiusura della parete addominale per applicazioni non di sopravvivenza o eseguire una chiusura addominale graduale come descritto sopra in caso di esperimenti di sopravvivenza pianificati con follow-up.
- Nel caso di applicazioni di sopravvivenza, mantenere sempre condizioni di sterilità durante l'intervento chirurgico. Prima dell'intervento chirurgico, preparare asetticamente la pelle nel sito chirurgico utilizzando sia uno scrub (a base di iodio o clorexidina) che alcol. Utilizzare una confezione di strumenti autoclavati freschi per ogni animale.
- Dopo l'intervento chirurgico, monitorare l'animale fino a quando non è abbastanza cosciente da mantenere la decubito sternale e isolarlo fino a quando non si è completamente ripreso.
- Come trattamento post-chirurgico dell'animale, includere visite quotidiane attraverso il personale medico e il trattamento del dolore post-chirurgico con iniezioni sottocutanee di 5 mg/kg di carprofene 2 volte al giorno per 2 giorni.
- Utilizzare schede di valutazione con criteri di terminazione chiaramente definiti per la durata fino al completo recupero postoperatorio. Usa la Rat Grimace Scale26 o il Body Condition Score27 dalla letteratura citata. Termina l'esperimento se il punteggio della smorfia ≥ 6 o un punteggio della condizione corporea = 1 dopo l'applicazione del carprofene. Inoltre, terminare in caso di complicanze chirurgiche come un'infezione della ferita postoperatoria o un'insufficienza di chiusura della parete addominale.
Risultati
Questo protocollo è stato condotto su 10 ratti maschi (peso medio 398 ± 35 g) in un contesto di non sopravvivenza e la procedura è stata eseguita da uno specializzando in chirurgia del terzo anno. Il tasso di successo definito dalla sopravvivenza oltre 20 minuti dopo la chiusura della parete addominale è stato del 100%. La durata media della preparazione dall'incisione cutanea fino alla chiusura cutanea è stata di 18 minuti e 34 secondi ± 7 minuti e 31 secondi.
Purtroppo, a causa della natura di non sopravvivenza di questo manoscritto, non ci sono dati sulla funzione renale postoperatoria. I futuri studi sugli animali con impostazioni di sopravvivenza dovrebbero associare il grado di perdita del parenchima con i parametri di funzionalità renale per fornire una migliore comprensione del grado e della variazione dell'insufficienza renale corrispondente alla quantità di resezione renale eseguita.
Per convalidare la vitalità del residuo del parenchima renale, i parametri indice del rene fisiologico (prima della resezione), del residuo perfuso e del parenchima d'organo resecato per l'ossigenazione (StO2) e la perfusione (NIR) sono stati misurati utilizzando l'imaging iperspettrale (HSI) e confrontati (Figura 5). I valori sono stati forniti in unità arbitrarie e hanno mostrato valori fisiologici del residuo, indicando la vitalità del parenchima renale rimanente (Tabella 1).
I risultati iperspettrali sono stati coerenti con le recenti pubblicazioni, indicando che la vitalità e la perfusione tissutale possono essere valutate utilizzando i valori di cut-off HSI StO2 specifici per organo. Questi valori corrispondevano a quelli osservati in questo studio con valori del 60,1% (±7,2%) per la perfusione fisiologica e del 20,9% (±2,7%) per il tessuto renale malperfuso. Poiché si trattava di esperimenti non di sopravvivenza, non ci sono dati sperimentali sugli esiti a lungo termine degli animali.
| parametro | fisiologico | residuo fisiologico | organo resecato |
| StO2 | 60,1% (±7,2%) | 60,7% (±5,2%) | 20,9% (±2,7%) |
| NIR | 37,6% (±11,2%) | 35,5% (±11,5%) | 1,5% (±1,4%) |
Tabella 1: Parametri tissutali. Valori di ossigenazione HSI StO2 e perfusione NIR in unità arbitrarie in tre diversi stati del tessuto renale. Abbreviazioni: StO2 = saturazione di ossigeno nei tessuti; NIR = spettroscopia nel vicino infrarosso; HSI = imaging iperspettrale
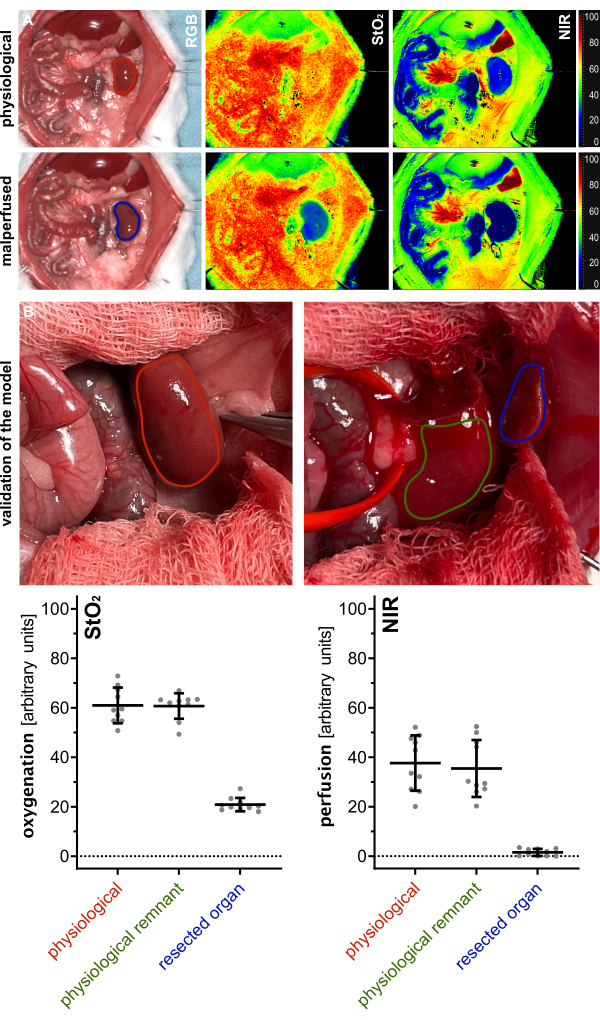
Figura 5: Validazione del modello. (A) Visualizzazione di reni fisiologici (rosso) e malperfusi (blu) utilizzando immagini indice codificate a colori per l'ossigenazione (StO2) e la perfusione (NIR) da imaging iperspettrale. (B) Immagini RGB del rene fisiologico (rosso), del residuo fisiologico renale dopo polectomia (verde) e del tessuto renale resecato (blu) con quantificazione dei rispettivi valori di ossigenazione HSI (StO2) e perfusione (NIR) con n = 10 animali. Abbreviazioni: StO2 = saturazione di ossigeno nei tessuti; NIR = spettroscopia nel vicino infrarosso; HSI = imaging iperspettrale. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La CKD è definita da danno renale o ridotta funzionalità renale per almeno 3 mesi, indipendentemente dalla causa28,29. Il danno renale comprende anomalie patologiche nel rene nativo o trapiantato, identificate tramite imaging, biopsia o dedotte da marcatori clinici come l'aumento dell'albuminuria (rapporto albumina/creatinina > 30 mg/g o 3,4 mg/mmol) o alterazioni del sedimento urinario. Una ridotta funzionalità renale implica una ridotta velocità di filtrazione glomerulare, che di solito viene stimata dalla concentrazione sierica di creatinina.
Secondo i Centri statunitensi per il controllo e la prevenzione delle malattie, si stima che ~37 milioni di persone solo negli Stati Uniti, correlate a ~15% della popolazione adulta degli Stati Uniti, abbiano la malattia renalecronica 29 associata a sostanziali spese sanitarie, con la sola malattia renale allo stadio terminale che causa oltre 30 miliardi di dollari di costi in eccesso per i beneficiari di Medicare negli Stati Uniti30.
Pertanto, la creazione di modelli animali adatti e replicabili è fondamentale per affrontare le ricerche emergenti in questo settore. Inoltre, oltre a svelare i percorsi fisiopatologici fondamentali, la capacità di ridurre il parenchima renale e istigare l'insufficienza renale funge da base essenziale per valutare l'efficacia dei trattamenti farmacologici, delle metodologie chirurgiche e degli approcci terapeutici pionieristici. Sfruttando questo quadro sperimentale, gli scienziati possono accelerare la conversione delle scoperte precliniche in approcci clinici pratici, mitigando così la morbilità e la mortalità legate a varie condizioni renali.
Ad esempio, i ricercatori possono utilizzare questo modello per valutare l'efficacia di composti farmaceutici volti a migliorare la protezione renale e le vie di rigenerazione, come nel caso degli inibitori del cotrasportatore sodio-glucosio 2 (SGLT2), come empagliflozin o dapagliflozin31, antagonisti del recettore dei mineralcorticoidi non steroidei (MRA), come il finerenone 32,33, antagonisti del recettore dell'endotelina (ERA), come lo sparsentan31 o stabilizzatori del fattore inducibile dall'ipossia (HIF)31. Inoltre, questo modello facilita la valutazione di nuovi approcci chirurgici, come l'allotrapianto con regimi avanzati di immunosoppressione o recentemente anche lo xenotrapianto, con il primo trapianto riuscito di reni di maiale geneticamente modificati a pazienti umani cerebralmente morti nel 2021 34,35,36.
Durante l'utilizzo di questo modello di nefrectomia 5/6, è essenziale determinare consapevolmente come esattamente la nefrectomia parziale dovrebbe essere condotta, sia mediante resezione chirurgica dei poli, definita modello di polectomia come introdotto qui, sia legando le arterie renali segmentali superiori e inferiori o il parenchima stesso, con conseguente infarto dei poli 7,15,16,17,18,19,20.
Pur condividendo molte caratteristiche, questi due modelli (resezione vs. legatura) mostrano variazioni fenotipiche significative, ognuna delle quali cattura aspetti distinti della CKD umana. Per quanto riguarda le somiglianze fenotipiche, entrambi i modelli mostrano caratteristiche generali simili alla CKD umana, come uremia, fibrosi, rarefazione capillare e un progressivo declino della funzione renale. Inoltre, entrambi presentano ipertrofia dell'intero organo, iperfiltrazione nei necroni funzionali, diminuzione dell'espressione renale del fattore di crescita dell'endotelio vascolare, aumento dell'espressione renale dell'antiangiogenico trombospondina-1, alterata autoregolazione dei reni e irregolarità nella fisiologia vascolare dell'ossido nitrico. Pertanto, entrambi i modelli, in generale, consentono lo studio di una varietà di aspetti tra cui la pressione arteriosa, il sistema renina-angiotensina-aldosterone, l'autoregolazione, la dinamica dell'ossido nitrico, la fisiologia del singolo nefrone, i fattori angiogenici e antiangiogenici, la rarefazione capillare, l'uremia, la fibrosi, la rarefazione capillare, l'espressione renale del fattore di crescita dell'endotelio vascolare, l'aumento dell'espressione renale della trombospondina-1 antiangiogenica, l'alterata autoregolazione renale e l'anomalia vascolare Fisiologia dell'ossido nitrico.
Le caratteristiche istologiche riscontrate regolarmente includono il danno tubulo-interstiziale riflesso dall'infiammazione, l'atrofia tubulare e la fibrosi e la glomerulosclerosi focale che porta a una massiccia riduzione dei glomeruli sani all'interno della popolazione residua (<10%)21.
Al contrario, emergono notevoli distinzioni fenotipiche tra i due modelli: il modello dell'infarto presenta una rapida insorgenza di ipertensione sistemica da moderata a grave, mentre il modello della polectomia mantiene inizialmente la normotensione prima di passare all'ipertensione da lieve a moderata. Inoltre, è noto che i ratti sottoposti al modello di infarto dimostrano un'attività significativamente aumentata nel sistema renina-angiotensina-aldosterone7. Inoltre, è stata dimostrata l'esistenza di differenze genotipiche nel senso di geni sovraregolati e sottoregolati, cosicché la decisione se utilizzare un modello di resezione o di legatura per l'induzione della CKD deve essere presa consapevolmente e in piena comprensione delle implicazioni biologiche e della domanda di ricerca desiderata37.
Sebbene esistano diverse pubblicazioni sulla nefrectomia 5/6 con accesso dorsolaterale, manca la letteratura scientifica che affronta la nefrectomia 5/6 tramite laparotomia della linea mediana e non esiste esplicitamente un protocollo metodico. Questa è, quindi, l'affermazione di questo manoscritto. I limiti della tecnica presentata includono principalmente l'invasività della procedura e la difficoltà di stimare la corretta quantità di parenchima resecata per raggiungere il livello desiderato di insufficienza renale.
Nell'affrontare le sfide comuni incontrate durante la procedura, desideriamo evidenziare i seguenti punti e raccomandazioni: Raccogliere accuratamente le attrezzature e i farmaci in anticipo ed eseguire meticolosamente il controllo emostatico attraverso una preparazione e una dissezione precise lungo i piani avascolari. Limitare il contatto con il parenchima renale a strumenti non traumatici, come tamponi di cotone inumiditi o impacchi chirurgici maneggiati con una pinza. Iniziare con la nefrectomia parziale in modo che in caso di eccessivo sanguinamento delle superfici di resezione ai poli, la resezione possa essere convertita in una nefrectomia totale per il controllo emostatico e la nefrectomia parziale possa essere eseguita sul lato controlaterale.
Per un controllo emostatico ancora migliore, un morsetto per aneurisma di Yasargil potrebbe essere posizionato sui vasi ilari appena prima della dissezione del parenchima. Il rilascio graduale e cauto di questa pinza Yasargil potrebbe facilitare l'identificazione di singole emorragie arteriose sulla superficie di resezione e consentire la precisa elettrocauterizzazione bipolare di questi.
In genere, a causa dell'elevato rischio di sanguinamento durante la preparazione vascolare, è consigliabile utilizzare pinze smussate per la maggior parte della preparazione chirurgica, piuttosto che fare affidamento su una dissezione acuta. Inoltre, è utile inumidire gli strumenti e gli anelli dei vasi in silicone prima dell'uso per ridurre al minimo l'attrito superficiale.
La fase di preparazione più pericolosa è la legatura dell'ilo renale e la sua dissezione. Una tecnica di nodo scorrevole insufficiente può causare un'emorragia renale. Di conseguenza, si consiglia di preparare l'ilo su una distanza leggermente più lunga in modo che ci sia tessuto sufficiente per il riserraggio e la risutura.
Il rischio di sanguinamento postoperatorio è rilevante, quindi si consiglia di prolungare la chiusura della parete addominale per un periodo prolungato (ad esempio, da 20 a 30 minuti) per osservare il residuo per un periodo più lungo. Si può prendere in considerazione l'applicazione di agenti ipertensivi dopo l'emostasi iniziale, ad esempio la noradrenalina sottocutanea per aumentare la pressione sanguigna sistemica e identificare possibili sanguinamenti.
Oltre a illuminare i meccanismi biomolecolari fondamentali, la capacità di indurre malperfusione renale, resecati d'organo e residui d'organo nei ratti fornisce uno strumento prezioso per valutare interventi farmacologici e modalità di imaging innovative come HSI 38,39,40,41,42. Questo modello è, quindi, cruciale per fornire la verità di base del tessuto biologico alla base dell'insufficienza renale necessaria per utilizzare appieno l'HSI per la valutazione dei tessuti nel contesto urologico della CKD.
Sebbene si ritenga che questo protocollo sia una guida passo passo per un modello di nefrectomia generale nei ratti, la quantità di parenchima renale resecata può essere regolata in base alla specifica domanda di ricerca come descritto sopra. In caso di un grado specifico di insufficienza renale, richiesto per gli esperimenti, il livello di CKD può essere seguito nel tempo misurando l'urea plasmatica, la pressione arteriosa sistolica, la proteinuria e la clearance, ad esempio, utilizzando l'inulina gold standard e l'acido para-amminoippurico (PAH). È generalmente riconosciuto che 6 settimane dopo la procedura, l'insufficienza renale, definita da una riduzione della velocità di filtrazione glomerulare (GFR), si è stabilizzata. Per ottenere livelli ancora più elevati di CKD, può essere applicata una terapia combinata che comprende una dieta ricca di sale e l'applicazione dell'inibizione dell'ossido nitrico sintasi - utilizzando NG-nitro-L-Arginina) (L-NNA) - come precedentemente descritto nella letteratura citata21.
Fornendo una metodologia completa e replicabile, questo protocollo semplifica il processo di modellazione della nefrectomia e della malattia renale cronica (CKD) nei soggetti ratto. Questa standardizzazione migliora l'affidabilità e la robustezza dei dati, promuove l'autonomia dei ricercatori e facilita la comparabilità tra i futuri studi sugli animali. Di conseguenza, emerge come uno strumento essenziale nel kit di strumenti della ricerca biomedica, facendo luce sull'intricata relazione tra il tessuto renale funzionale rimanente e gli impatti sistemici della CKD. Sfruttando l'adattabilità di questo quadro sperimentale, i ricercatori possono tracciare nuovi territori nella medicina traslazionale e, in ultima analisi, far progredire i risultati dei pazienti nel campo della salute renale.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Non c'erano finanziamenti speciali per questo progetto. Gli autori ringraziano il servizio di archiviazione dei dati SDS@hd sostenuto dal Ministero della Scienza, della Ricerca e delle Arti del Baden-Württemberg (MWK) e dalla Fondazione tedesca per la ricerca (DFG) attraverso le sovvenzioni INST 35/1314-1 FUGG e INST 35/1503-1 FUGG. Inoltre, gli autori riconoscono con gratitudine il supporto dell'NCT (National Center for Tumor Diseases di Heidelberg, Germania) attraverso il suo programma post-dottorato strutturato e il programma di oncologia chirurgica. Ringraziamo inoltre il sostegno attraverso i fondi statali approvati dal Parlamento del Land Baden-Württemberg per l'Innovation Campus Health + Life Science Alliance Heidelberg Mannheim dal programma postdoc strutturato per Alexander Studier-Fischer: Artificial Intelligence in Health (AIH) - Una collaborazione di DKFZ, EMBL, Università di Heidelberg, Ospedale universitario di Heidelberg, Ospedale universitario di Mannheim, Istituto centrale di salute mentale, e l'Istituto Max Planck per la ricerca medica. Inoltre, ringraziamo il supporto attraverso il DKFZ Hector Cancer Institute presso il Centro medico universitario di Mannheim. Per il pagamento della quota di pubblicazione, si ringrazia il sostegno finanziario della Deutsche Forschungsgemeinschaft nell'ambito del programma di promozione "Open Access Publikationskosten" e dell'Università di Heidelberg.
Materiali
| Name | Company | Catalog Number | Comments |
| atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| polyfilament suture | Covidien | CL-769 | Covidien Polysorb Braided Absorbable Suture 2-0 75 cm |
| preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| sealing hemostat patch | Baxter | 1506257 | Hemopatch Sealing Hemopatch Baxter 45 x 90 mm |
| silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Riferimenti
- Kovesdy, C. P. Epidemiology of chronic kidney disease: An update 2022. Kidney Int Suppl (2011). 12 (1), 7-11 (2022).
- Sundström, J., et al. Prevalence, outcomes, and cost of chronic kidney disease in a contemporary population of 2·4 million patients from 11 countries: The careme ckd study. Lancet Reg Health Eur. 20, 100438(2022).
- Webster, A. C., Nagler, E. V., Morton, R. L., Masson, P. Chronic kidney disease. Lancet. 389 (10075), 1238-1252 (2017).
- Fassett, R. G. Current and emerging treatment options for the elderly patient with chronic kidney disease. Clin Interv Aging. 9, 191-199 (2014).
- Tarun, T., et al. Updates on new therapies for patients with ckd. Kidney Int Rep. 9 (1), 16-28 (2024).
- Dudar, I., Shifris, I., Dudar, S., Kulish, V. Current therapeutic options for the treatment of secondary hyperparathyroidism in end-stage renal disease patients treated with hemodialysis: A 12-month comparative study. Pol Merkur Lekarski. 50 (299), 294-298 (2022).
- Adam, R. J., Williams, A. C., Kriegel, A. J. Comparison of the surgical resection and infarct 5/6 nephrectomy rat models of chronic kidney disease. Am J Physiol Renal Physiol. 322 (6), F639-F654 (2022).
- Huang, Y., et al. The impact of senescence on muscle wasting in chronic kidney disease. J Cachexia Sarcopenia Muscle. 14 (1), 126-141 (2023).
- Makhloufi, C., et al. Assessment of thrombotic and bleeding tendency in two mouse models of chronic kidney disease: Adenine-diet and 5/6th nephrectomy. TH Open. 4 (2), e66-e76 (2020).
- Liu, J., Lilly, M. N., Shapiro, J. I. Targeting na/k-atpase signaling: A new approach to control oxidative stress. Curr Pharm Des. 24 (3), 359-364 (2018).
- Laget, J., et al. Cafeteria diet-induced obesity worsens experimental CKD. Nutrients. 15 (15), 3331(2023).
- Gritter, M., et al. Chronic kidney disease increases the susceptibility to negative effects of low and high potassium intake. Nephrol Dial Transplant. 39 (5), 795-807 (2024).
- Bovée, D. M., et al. Dietary salt modifies the blood pressure response to renin-angiotensin inhibition in experimental chronic kidney disease. Am J Physiol Renal Physiol. 320 (4), F654-F668 (2021).
- Vettoretti, S., et al. Renal endothelial function is associated with the anti-proteinuric effect of ace inhibition in 5/6 nephrectomized rats. Am J Physiol Renal Physiol. 310 (10), F1047-F1053 (2016).
- Zhang, Y., Kompa, A. R. A practical guide to subtotal nephrectomy in the rat with subsequent methodology for assessing renal and cardiac function. Nephrology (Carlton). 19 (9), 552-561 (2014).
- Ibrahim, H. N., Hostetter, T. H. The renin-aldosterone axis in two models of reduced renal mass in the rat. J Am Soc Nephrol. 9 (1), 72-76 (1998).
- Griffin, K. A., Picken, M., Bidani, A. K. Method of renal mass reduction is a critical modulator of subsequent hypertension and glomerular injury. J Am Soc Nephrol. 4 (12), 2023-2031 (1994).
- Garber, S. L., et al. Effect of relaxin in two models of renal mass reduction. Am J Nephrol. 23 (1), 8-12 (2003).
- Griffin, K. A., Picken, M. M., Churchill, M., Churchill, P., Bidani, A. K. Functional and structural correlates of glomerulosclerosis after renal mass reduction in the rat. J Am Soc Nephrol. 11 (3), 497-506 (2000).
- Vavrinec, P., et al. Vascular smooth muscle function of renal glomerular and interlobar arteries predicts renal damage in rats. Am J Physiol Renal Physiol. 303 (8), F1187-F1195 (2012).
- Van Koppen, A., Verhaar, M. C., Bongartz, L. G., Joles, J. A. 5/6th nephrectomy in combination with high salt diet and nitric oxide synthase inhibition to induce chronic kidney disease in the lewis rat. J Vis Exp. (77), e50398(2013).
- Wang, X., et al. A mouse 5/6th nephrectomy model that induces experimental uremic cardiomyopathy. J Vis Exp. (129), e55825(2017).
- Harvey, A. M., Malvin, R. L. Comparison of creatinine and inulin clearances in male and female rats. Am J Physiol. 209 (4), 849-852 (1965).
- Gloff, C. A., Benet, L. Z. Differential effects of the degree of renal damage on p-aminohippuric acid and inulin clearances in rats. J Pharmacokinet Biopharm. 17 (2), 169-177 (1989).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684(2024).
- Sotocinal, S. G., et al. The rat grimace scale: A partially automated method for quantifying pain in the laboratory rat via facial expressions. Mol Pain. 7, 55(2011).
- Hickman, D. L., Swan, M. Use of a body condition score technique to assess health status in a rat model of polycystic kidney disease. J Am Assoc Lab Anim Sci. 49 (2), 155-159 (2010).
- Levey, A. S., et al. Definition and classification of chronic kidney disease: A position statement from kidney disease: Improving global outcomes (kdigo). Kidney Int. 67 (6), 2089-2100 (2005).
- Wilson, S., Mone, P., Jankauskas, S. S., Gambardella, J., Santulli, G. Chronic kidney disease: Definition, updated epidemiology, staging, and mechanisms of increased cardiovascular risk. J Clin Hypertens (Greenwich). 23 (4), 831-834 (2021).
- Dobaria, V., et al. Clinical and financial impact of chronic kidney disease in emergency general surgery operations. Surg Open Sci. 10, 19-24 (2022).
- Copur, S., et al. Novel strategies in nephrology: What to expect from the future. Clin Kidney J. 16 (2), 230-244 (2022).
- Pradhan, N., Dobre, M. Emerging preventive strategies in chronic kidney disease: Recent evidence and gaps in knowledge. Curr Atheroscler Rep. 25 (12), 1047-1058 (2023).
- Dietrich, M., et al. Hyperspectral imaging for perioperative monitoring of microcirculatory tissue oxygenation and tissue water content in pancreatic surgery - an observational clinical pilot study. Perioper Med (Lond). 10 (1), 42(2021).
- Stone, L. Kidney xenotransplantation. Nat Rev Urol. 20 (11), 641-641 (2023).
- Xu, H., He, X. Developments in kidney xenotransplantation. Front Immunol. 14, 1242478(2023).
- Dos Santos, R. M. N. Kidney xenotransplantation: Are we ready for prime time. Curr Urol Rep. 24 (6), 287-297 (2023).
- Nasci, V. L., et al. Mir-21-5p regulates mitochondrial respiration and lipid content in h9c2 cells. Am J Physiol Heart Circ Physiol. 316 (3), H710-H721 (2019).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. S0748-7983 (23), 00444-00454 (2023).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488(2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Sci Data. 10 (1), 414(2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028(2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon