Method Article
5/6 Nephrektomie mit scharfer Bipolektomie über Midline-Laparotomie bei Ratten
In diesem Artikel
Zusammenfassung
Dieses Manuskript stellt ein standardisiertes Protokoll für eine 5/6-Nephrektomie durch scharfe Bipolektomie über Mittellinien-Laparotomie in einem Rattenmodell vor, das darauf abzielt, einen Zustand der Niereninsuffizienz durch Nierenparenchymreduktion mit einem hohen Maß an methodischer Präzision und geringem Risiko für technische Fehler zu induzieren.
Zusammenfassung
Über 10 % der Weltbevölkerung sind von chronischer Nierenerkrankung (CKD) betroffen, was mehr als 800 Millionen Menschen weltweit entspricht. Die Fortschritte in der Behandlung von CKD haben einen erheblichen Einfluss auf die Ergebnisse für die Patienten. Während CNE in der Vergangenheit oft als Todesurteil galt, da viele Patienten den Komplikationen einer Nierenerkrankung im Endstadium erlagen, wird sie heute zunehmend als chronische Erkrankung behandelt, da Dialyse und Nierentransplantation sowie neue pharmazeutische Entwicklungen wie SGLT2-Hemmer oder nichtsteroidale Mineralokortikoidrezeptor-Antagonisten zur Verfügung stehen.
Dennoch besteht weiterhin ein wachsender Bedarf an weiteren Untersuchungen der pathophysiologischen Prozesse und möglicher therapeutischer Interventionen. Zuverlässige biologische Modelle spielen eine entscheidende Rolle bei der Erleichterung dieser Forschung. Angesichts der Vielschichtigkeit von Nierenerkrankungen, die nicht nur die Zellbiologie, sondern auch die vaskuläre Mikroanatomie und die endokrine Signalübertragung umfasst, muss ein geeignetes Modell ein Maß an biologischer Komplexität aufweisen, das nur ein Tiermodell bieten kann, was Nagetiere zu einer offensichtlichen Wahl macht.
Dieses Manuskript bietet daher ein kompliziertes, systematisches Protokoll zur chirurgischen Reduzierung des Nierenparenchyms durch Mittellinien-Laparotomie und kombinierte totale und partielle Nephrektomie bei Ratten für Überlebens- und Nicht-Überlebensanwendungen. Es unterstreicht die entscheidende Rolle präziser Operationstechniken für die Gewährleistung konsistenter und zuverlässiger Ergebnisse. Paradebeispiele für mögliche Anwendungen dieses Modells sind biomolekulare und pharmazeutische Studien sowie die Entwicklung innovativer intraoperativer Bildgebungsmodalitäten, wie z. B. der hyperspektralen Bildgebung, um die renale Malperfusion objektiv sichtbar zu machen und zu differenzieren.
Einleitung
Die chronische Nierenerkrankung (CKD) ist eine fortschreitende Erkrankung, von der ein erheblicher Teil der Weltbevölkerung betroffen ist. Es ist gekennzeichnet durch den allmählichen Verlust der endokrinen und filtrativen Nierenfunktion im Laufe der Zeit, was zur Ansammlung von Abfallprodukten und Flüssigkeit im Körper und zu einem Ungleichgewicht im endokrinen System führt. Jüngste Daten deuten darauf hin, dass 9,1 % bis 13,4 % der Weltbevölkerung (zwischen 700 Millionen und einer Milliarde Menschen) an CKD1 leiden. Die Prävalenz von CKD nimmt mit dem Alter zu und betrifft etwa 34 % der Menschen im Alter von 65 Jahren oder älter in den Vereinigten Staaten, verglichen mit 12 % bei den 45- bis 64-Jährigen und 6 % der 18- bis 44-Jährigen.
Daher trägt CKD erheblich zur weltweiten Krankheitslast und Sterblichkeitsrate bei. Die Früherkennung und Behandlung von CKD ist entscheidend, um ihr Fortschreiten zu verlangsamen und das Risiko von Komplikationen wie Herz-Kreislauf-Erkrankungen, Anämie und schließlich einer Nierenerkrankung im Endstadium zu verringern, die eine Dialyse oder Nierentransplantation zum Überleben erfordert3.
Therapeutische Interventionen bei chronischer Niereninsuffizienz im Endstadium haben in den letzten Jahrzehnten eine bemerkenswerte Entwicklung durchlaufen. In der Vergangenheit war die Behandlung von CKD im Endstadium auf die unterstützende Versorgung beschränkt, wobei sich die Dialyse in den 1960er Jahren als lebenserhaltende Modalität herausstellte. Seitdem wurden bedeutende Fortschritte bei den Dialysetechniken erzielt, darunter die Entwicklung biokompatiblerer Membranen, ein verbesserter Gefäßzugang und das Aufkommen der Peritonealdialyse4. Darüber hinaus hat sich die Nierentransplantation als optimale Behandlung für CKD im Endstadium herausgestellt und bietet im Vergleich zur Dialyse ein verbessertes Überleben und eine verbesserte Lebensqualität5. Der Mangel an Spenderorganen bleibt jedoch eine große Herausforderung und treibt die Forschung an neuartigen Strategien wie Xenotransplantation und Ansätzen der regenerativen Medizin voran. Darüber hinaus wurde die Behandlung von CKD-assoziierten Komplikationen im Endstadium, wie z. B. sekundärem Hyperparathyreoidismus, durch die Einführung von Calcimimetika wie Etelcalcetid verbessert, die den Parathormonspiegel effektiv modulieren6.
Trotz dieser Fortschritte geht die Suche nach wirksameren und gezielteren Therapien weiter, angetrieben durch die laufende Erforschung der molekularen Mechanismen, die dem Fortschreiten der CKD im Endstadium und den damit verbundenen Begleiterkrankungen zugrunde liegen. Daher ist die CKD nach wie vor ein wichtiges Problem in der Patientenversorgung, was zu einem anhaltenden Bedarf an umfangreicher Forschung zu biomedizinischen Prozessen und Therapieansätzen führt. Robuste biologische Modelle sind unerlässlich, um solche Untersuchungen zu erleichtern. Angesichts der Vielschichtigkeit der CKD, die Aspekte umfasst, die von der Zellbiologie über die endokrine Signalübertragung zwischen Organen bis hin zur funktionellen Anatomie der Gefäße und der Rheologie reichen, muss ein ideales Modell ein Maß an biologischer Komplexität aufweisen, das nur ein umfassender Modellorganismus bieten kann. Daher erweisen sich Nagetiere aufgrund ihrer Fähigkeit, diese verschiedenen biologischen Dimensionen effektiv zu erfassen, als bevorzugtes Modell.
Das 5/6-Nephrektomie-Restnierenmodell dient aufgrund seiner stabilen Induktion der Niereninsuffizienz 7,8,9,10,11,12,13,14 als gängiges Werkzeug in der CKD-Forschung für Ratten- und Mausexperimente. Bei diesem Modell wird eine ganze Niere und 2/3 der anderen Niere entfernt. Die Bildung der Restniere kann durch die chirurgische Resektion der Nierenpole, die als Polektomiemodell bezeichnet wird, oder durch die Ligatur der oberen und unteren segmentalen Nierenarterien erreicht werden, was zum Polinfarkt 7,15,16,17,18,19,20 führt.
Dieses 5/6-Nephrektomiemodell mit Polektomie ist zwar eine etablierte Technik, wurde aber erst als transparentes und nachvollziehbares Protokoll mit dorsolateralem retroperitonealem Zugang eingeführt21. Dieser Zugang kann bei einem einseitigen Eingriff mit Nierenparenchymreduktion auf nur einer Seite oder bei einem zweistufigen Eingriff mit zeitlichem Abstand von wenigen Tagen vorteilhaft sein, um das postoperative Überleben des Tieres zu erhöhen22. Die Verwendung eines Mittellinien-Laparotomie-Ansatzes bietet jedoch deutliche Vorteile gegenüber dem konventionellen laterodorsalen retroperitonealen Zugangsweg.
Durch den Einsatz eines einzigen Mittellinien-Bauchschnitts erhält der Chirurg ungehinderten Zugang zur gesamten Bauchhöhle und ermöglicht so eine umfassende Exploration und Manipulation der intraabdominalen Organe. Dieses erweiterte Operationsfeld rationalisiert nicht nur das Nephrektomieverfahren, sondern ermöglicht auch die gleichzeitige Durchführung zusätzlicher Eingriffe, die für bestimmte experimentelle Protokolle erforderlich sein können, z. B. Eingriffe an den Harnleitern wie Ligatur, Resektion oder Rekonstruktion, die für die Untersuchung der Pathophysiologie der obstruktiven Uropathie unerlässlich sein können. Darüber hinaus ermöglicht dieser Ansatz die gleichzeitige Resektion oder Manipulation anderer Bauchorgane, wie z.B. der Leber, der Milz oder des Magen-Darm-Trakts, und erweitert damit den Umfang experimenteller Untersuchungen in Multiorgan-Wechselwirkungen oder systemische Krankheitsmodelle.
Darüber hinaus erleichtert der Midline-Laparotomie-Ansatz die Konstruktion eines Ileumkanals oder einer Neoblase, ein chirurgischer Eingriff, bei dem eine Harnableitung unter Verwendung eines Ileumsegments hergestellt wird, was besonders in Studien zur Untersuchung von Blasenfunktionsstörungen oder rekonstruktiven urologischen Techniken relevant ist. Diese Vielseitigkeit bei der Kombination der Nephrektomie mit anderen chirurgischen Eingriffen innerhalb desselben Operationsfeldes rationalisiert nicht nur die experimentellen Protokolle, sondern minimiert auch das kumulative chirurgische Trauma und die damit verbundenen Risiken für die Probanden. Daher sollte bei einstufigen bilateralen Nierenoperationen oder gleichzeitigen zusätzlichen intraabdominalen Eingriffen der ventrale Zugang über die Mittellinien-Laparotomie die bevorzugte Option sein.
Derzeit gibt es keine Veröffentlichung oder ein Protokoll, das diese Operationsstrategie beschreibt. Daher ist es unser Ziel, mit dieser Arbeit einen detaillierten Verfahrensleitfaden für die Durchführung einer Nierenresektion und chirurgischen Induktion von CKD mittels Mittellinien-Laparotomie bei Ratten zu präsentieren, der sowohl für Überlebens- als auch für Nicht-Überlebensstudien anwendbar ist. Dieses experimentelle Modell schafft ein reguliertes Umfeld, das für die Untersuchung der komplexen Dynamik von CKD förderlich ist und klinisch signifikante Szenarien nachahmt. Dieses Protokoll wurde speziell entwickelt, um die Operationstechnik zu veranschaulichen. Die Intervention wurde daher in einer Nicht-Überlebenssituation an einer homogenen Gruppe von 10 männlichen Ratten durchgeführt. Da es keinen aussagekräftigen Grund für den Vergleich mit einer Baseline- oder alternativen Intervention gab, war der Einschluss einer Kontrollgruppe nicht notwendig. Die 5/6-Nephrektomie bezieht sich explizit auf das Ausmaß der chirurgischen Parenchymresektion. Dies bedeutet sicherlich eine funktionelle Reduktion im Sinne einer Verringerung der glomerulären Filtrationsrate. Der genaue funktionelle Grad kann jedoch nicht vorhergesagt werden, sondern muss für jedes Tier individuell gemessen werden, z. B. mit Hilfe von Inulin oder p-Aminohippursäure-Clearance23,24, falls erforderlich.
Protokoll
Alle in diesem Dokument beschriebenen Tierverfahren wurden in akkreditierten Einrichtungen durchgeführt und vom Institutionellen Ausschuss für Tierpflege und -verwendung (IACUC) des Regierungspräsidiums Baden-Württemberg in Karlsruhe (35-9185.81/G-62/23) genehmigt. Der Umgang mit den Versuchstieren erfolgte nach institutionellen Protokollen und unter Beachtung der deutschen Tierschutzgesetze sowie unter Einhaltung der Richtlinien des Rates der Europäischen Gemeinschaft (2010/63/EU) und der ALME-Leitlinien. Männliche Sprague Dawley-Ratten mit einem Anfangsgewicht von 400 g wurden nach einer 1-wöchigen Akklimatisierungsphase eingesetzt.
1. Anästhesie und Analgesie
- Narkotisieren Sie das Rattenmodell mit den Arzneimitteln Ihrer Wahl. Um diesem Protokoll zu folgen, führen Sie eine flüchtige Induktion der Sedierung mit Isofluran durch, gefolgt von einer intraperitonealen Injektion von 100 mg/kg Ketamin mit Körpergewicht für die dissoziative Anästhesie und 4 mg/kg Xylazin mit Körpergewicht. Erreichen Sie eine Analgesie mit subkutanen Injektionen von 5 mg/kg Carprofen Körpergewicht.
HINWEIS: Ein ausführliches Protokoll findet sich in der zitierten Literatur25. - Stellen Sie eine angemessene Analgetiktiefe sicher, indem Sie während des Zehenquetschtests mit einer chirurgischen Zange auf Schmerzreflexe achten und die Narkosetiefe während des Eingriffs regelmäßig neu bewerten.
- Tragen Sie ophthalmisches Gleitmittel auf die Augen auf, um ein Austrocknen der Hornhaut zu verhindern.
2. Vorbereitung des Eingriffs
- Bereiten Sie die Operationsstelle mit allen erforderlichen Materialien und Instrumenten vor, einschließlich Polyfilament-Ligaturen, Silikongefäßschlaufen, stumpfen Überholklemmen, Feinpräparationsscheren und -zangen sowie hämostatischen Pflastern, die in 0,8 x 0,6 cm große Stücke geschnitten werden (Abbildung 1A-G). Bereiten Sie die chirurgische Expositionsvorrichtung für Nagetiere, ein Heizkissen und die chirurgischen Vorbereitungshaken vor, wie in der zitierten Literatur25 beschrieben.
- Rasieren Sie die Länge des gewünschten Zugangs, desinfizieren Sie die Operationsstelle durch drei abwechselnde Peelings mit 70 % Ethanol und Jod oder Chlorhexidin-basierten Peelingtupfern in kreisenden Bewegungen und erreichen Sie eine ordnungsgemäße Sauerstoffversorgung durch Inhalation von 100 % Sauerstoff mit einer Gesichtsmaske für Neugeborene (Abbildung 1H-J). Decken Sie den Rest des Körpers außerhalb des chirurgischen Ortes mit Abdecktüchern ab, um eine Kontamination zu vermeiden.
HINWEIS: Das repräsentative Tier, das zur Erstellung von Figurenbildern verwendet wurde, wurde nicht drapiert, um eine bessere Visualisierung der anatomischen Orientierungspunkte zu ermöglichen. - Führen Sie eine mediane Mini-Laparotomie über einen initialen medianen Hautschnitt über die gewünschte Bauchlänge von ~3 cm und einen anschließenden etwas kleineren Schnitt der Faszie entlang der Linea alba durch (Abbildung 1K-M).
- Erreichen Sie eine chirurgische Freilegung der Niere mit chirurgischen Kompressen und chirurgischen Vorbereitungshaken (Abbildung 1N-O). Berühren Sie das Nierenparenchym nur mit atraumatischen Präparationsinstrumenten wie einem angefeuchteten Wattestäbchen oder einer angefeuchteten Kompresse mit einer Pinzette oder stumpfen Überholklemmen.

Abbildung 1: Experimentelle Instrumente, Materialien und Aufbau. (A) Erforderliche chirurgische Instrumente; (B) Ligatur aus Polyfilamenten; (C) Gefäßschlaufe aus Silikon; (D) eine Schere für die feine Vorbereitung. (E-G) Hämostatisches Pflaster in 0,8 x 0,6 cm große Stücke geschnitten. (H-J) Rattenmodell rasiert und mit Gesichtsmaske mit Sauerstoff angereichert. Das repräsentative Tier, das zur Erstellung von Figurenbildern verwendet wurde, wurde nicht drapiert, um eine bessere Visualisierung der anatomischen Orientierungspunkte zu ermöglichen. (K,L) Medianer Hautschnitt über die gewünschte Bauchlänge von ~3 cm. (M) Mediane Mini-Laparotomie; (N) Freilegung der linken Niere unter Verwendung einer chirurgischen Kompresse, chirurgischer Vorbereitungshaken und eines Metallständers; (O) analoge Freilegung der rechten Niere und Resektion der Faszie der Gerota. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Partielle Nephrektomie
- Legen Sie die entsprechende Niere frei, greifen Sie nach dem perirenalen Fett, das an der dünnen Gerota-Faszie befestigt ist, und üben Sie etwas Spannung aus, um die Faszie lokal vom Nierenparenchym abzuheben (Abbildung 2A, B.2).
- Die Faszie mit dem scharfen Ende einer Scherenkante einschneiden und untergraben und mit einer Längssektion der Faszie der Gerota fortfahren (Abbildung 2B).
- Führen Sie eine stumpfe Enthandschuhung der Faszie der Gerota mit einer geschlossenen Schere durch, indem Sie die Faszie um das Parenchym herum allmählich untergraben und die Faszienkapsel medial falten – gegebenenfalls teilweise resezieren (Abbildung 2C).
- Befestigen Sie den Nierenhilum mit einer Silikongefäßschlaufe für eine verbesserte Gefäßkontrolle (Abbildung 2D).
- Platzieren Sie die Spitze der Pinzette in den retroperitonealen Raum, um die Niere zu stabilisieren, um ein dorsales Entweichen der Niere während des Schneidvorgangs zu vermeiden, und führen Sie die kraniale scharfe 1/3 Nierenpolektomie in einem präzisen, gezielten Schlag mit einer Schere durch (Abbildung 2E).
HINWEIS: Die Präparierlinie sollte in der klinischen Untersuchung so gewählt werden, dass sie das Organ in 1/3 der Organhöhe kranial und kaudal trennt. - Die Blutstillung wird durch Auftragen eines hämostatischen Pflasters, durch manuelle Kompression, durch Kompression mit stumpfen Instrumenten oder durch hiläre Spannung über die Silikongefäßschlaufe erreicht, wodurch der hiläre Blutfluss effektiv reduziert wird (Abbildung 2F-J).
HINWEIS: Die Blutstillung wurde regelmäßig durch gleichzeitiges Ziehen der Gefäßschlaufe und Anlegen des hämostatischen Pflasters für 2,5-3 Minuten erreicht. - Es folgt eine kaudale scharfe 1/3 Nierenpolektomie in analoger Weise (Abbildung 2K-N). Streben Sie bei beiden Scherenschlägen eine leicht abgewinkelte Dissektionsebene an, die mehr Nierenparenchym auf der hilären Seite und weniger Gewebe auf der lateralen Seite hinterlässt, um unbeabsichtigte hiläre Verletzungen zu vermeiden und Harnverlust aus dem Beckenkocalicealsystem zu reduzieren (Abbildung 2O). Wenn eine höhere Standardisierung der präzisen 5/6-Parenchym-Resektion gewünscht wird, wiegen Sie das Resektat der totalen Nephrektomie auf der weiter unten beschriebenen kontralateralen Seite, wiegen Sie die Resekate der partiellen 2/3-Nephrektomie und wiederholen Sie die Dissektion in einer "Salami-Slicing"-Technik, bis genau 2/3 des Gewichts erreicht sind.

Abbildung 2: Partielle Nephrektomie. (A) Chirurgische Freilegung einer Niere. (B) Längsschnitt der Faszie der Gerota mit einer scharfen Schere. (C) Stumpfes Enthandschuhen der Faszie der Gerota mit einer geschlossenen Schere. (D) Schleudern des Nierenhilums mit einer Silikongefäßschlaufe. (E) Schädelscharfe 1/3-Polektomie mit Schere und Pinzette als Führung. (F) Erreichen der Blutstillung durch Auftragen eines hämostatischen Pflasters; (G) Erreichen der Blutstillung durch manuelle Kompression; (H-J) Erreichen der Blutstillung durch Kompression mit stumpfen Instrumenten und hiläre Spannung über die Silikongefäßschlinge. (K-N) Kaudalspitz 1/3 Polektomie in Analogie. (O) Schematische Darstellung der empfohlenen Präparierebenen, um unbeabsichtigte hiläre Verletzungen zu vermeiden (schwarze Linien). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Totale Nephrektomie
- Mobilisieren Sie die Niere in Analogie zu den oben beschriebenen Schritten und tunneln Sie den Nierenhilum mit stumpfen Overholt-Klemmen (Abbildung 3A,B).
- Befestigen Sie den Nierenhilum mit einer polyfilen Ligatur und platzieren Sie einen sicheren Gleitknoten auf dem Nierenhilum etwas näher an den Bauchgefäßen, um den renalen Blutfluss und den Harnleiter zu verschließen (Abbildung 3C, D).
- Präparieren Sie den Hilum scharf mit einer Schere und entfernen Sie die Niere (Abbildung 3E,F).
- Kontrolle der Blutstillung und Abschneiden der Ligaturenden (Abbildung 3G-J).

Abbildung 3: Totale Nephrektomie. (A) Chirurgische Freilegung der kontralateralen Niere; (B) analoge Entfernung der Faszie der Gerota und Tunnelung des Nierenhilums mit stumpfen Overholt-Klemmen; (C) Schleudern des Hilums mit einer polyfilen Ligatur. (D) Platzierung einer gleitenden Knotenligatur auf dem Nierenhilum; (E,F) scharfe Dissektion des Hilums mit einer Schere und Entfernung der Niere; (G-I) Kontrolle für die Blutstillung und das Schneiden der Ligaturenden. (J) Schematische Darstellung der empfohlenen Ligaturhöhe (gestrichelte Linie) und der Präparierebene (schwarze Linie). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Verschluss der Bauchdecke
- Legen Sie eine Ecknaht mit einer polyfilen Naht auf die Bauchfaszie (Abbildung 4A-D).
- Fahren Sie mit dem Nähen der Bauchfaszie mit einer Laufnaht fort, wobei ~2 mm Gewebe bei jedem Biss und etwa 4 mm zwischen den Bissen gegriffen werden (Abbildung 4E-I).
- Vernähen Sie die Hautschicht mit Einzelstichen, wobei bei jedem Biss ~3 mm Gewebe und ~6 mm zwischen den Bissen gegriffen werden (Abbildung 4J-Q).
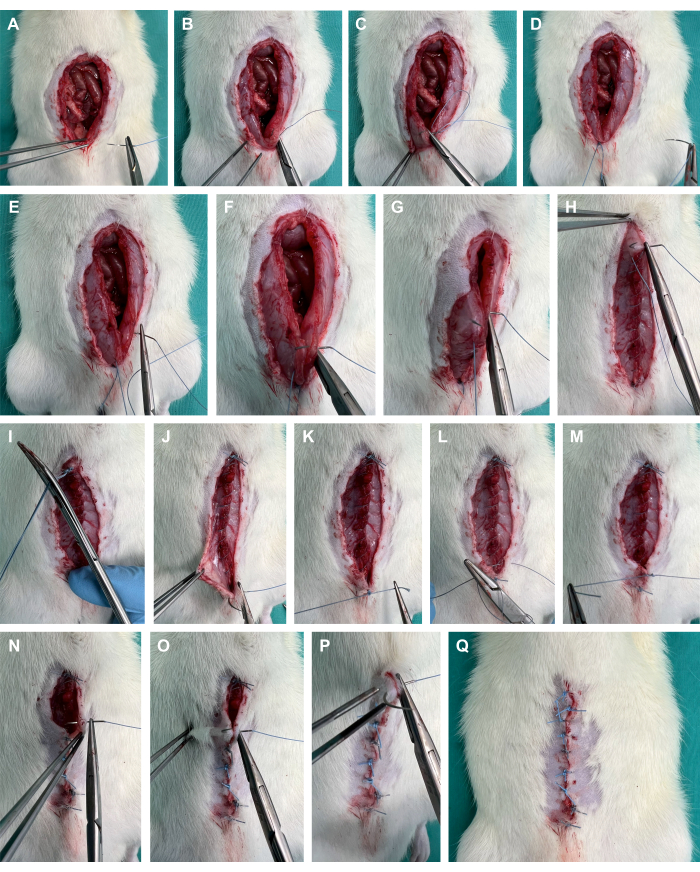
Abbildung 4: Verschluss der Bauchdecke. (A-D) Platzierung einer Ecknaht auf der Bauchfaszie mit Hilfe einer polyfilen Naht. (E-I) Laufnaht der Bauchfaszie; (J-Q) Naht der Hautschicht mit Einzelstichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Weitere Schritte
- Abhängig vom gewünschten Szenario, dem Forschungszweck und dem Grad der gewünschten Niereninsuffizienz sind Abweichungen von diesem Protokoll in Betracht zu ziehen, einschließlich einer Variation der Menge des resezierten Nierenparenchyms, z. B. einseitige totale Nephrektomie (3/6 Nephrektomie), bilaterale totale Nephrektomie (6/6 Nephrektomie), einseitige Monopolektomie (1/6 Nephrektomie), bilaterale Monopolektomie (2/6 Nephrektomie), unilaterale Bipolektomie (2/6 Nephrektomie) und bilaterale Bipolektomie (4/6 Nephrektomie).
- Im Allgemeinen wird entweder die Tiere durch scharfe Kardiektomie ohne vorherigen Bauchwandverschluss eingeschläfert, wenn es sich um Anwendungen handelt, die nicht überleben, oder es wird ein schrittweiser Bauchverschluss wie oben beschrieben bei geplanten Überlebensversuchen mit Nachuntersuchungen durchgeführt.
- Bei Überlebensanwendungen sind während der Operation stets sterile Bedingungen zu gewährleisten. Bereiten Sie die Haut vor der Operation an der Operationsstelle aseptisch vor, indem Sie sowohl ein Peeling (auf Jod- oder Chlorhexidinbasis) als auch Alkohol verwenden. Verwenden Sie für jedes Tier eine frische autoklavierte Packung Instrumente.
- Überwachen Sie das Tier nach der Operation, bis es bei Bewusstsein genug ist, um das Brustbein aufrecht zu erhalten, und isolieren Sie es, bis es sich vollständig erholt hat.
- Als postoperative Behandlung des Tieres gehören tägliche Besuche durch medizinisches Personal sowie postoperative Schmerzbehandlung mit subkutanen Injektionen von 5 mg/kg Körpergewicht Carprofen 2x täglich für 2 Tage.
- Verwenden Sie Scoresheets mit klar definierten Abbruchkriterien für die Dauer bis zur vollständigen postoperativen Genesung. Verwenden Sie die Rat Grimace Scale26 oder den Body Condition Score27 aus der zitierten Literatur. Beenden Sie das Experiment, wenn der Grimasse-Score nach der Anwendung von Carprofen 6 oder ein Body Condition Score = 1 ≥. Zusätzlich bei einer chirurgischen Komplikation wie einer postoperativen Wundinfektion oder einer Bauchwandverschlussinsuffizienz abbrechen.
Ergebnisse
Dieses Protokoll wurde an 10 männlichen Ratten (Durchschnittsgewicht 398 ± 35 g) ohne Überleben durchgeführt und der Eingriff wurde von einem chirurgischen Assistenzarzt im dritten Jahr durchgeführt. Die Erfolgsrate, die durch das Überleben über 20 Minuten nach Bauchwandverschluss definiert wurde, betrug 100%. Die mittlere Dauer des Präparats vom Hautschnitt bis zum Hautverschluss betrug 18 min 34 s ± 7 min 31 s.
Leider gibt es aufgrund des Nicht-Überlebenscharakters dieses Manuskripts keine Daten über die postoperative Nierenfunktion. Zukünftige Tierstudien mit Überlebenseinstellungen sollten den Grad des Parenchymverlusts mit Nierenfunktionsparametern in Verbindung bringen, um ein besseres Verständnis des Grades und der Variation der Niereninsuffizienz entsprechend dem Umfang der durchgeführten Nierenresektion zu erhalten.
Zur Validierung der Lebensfähigkeit des Nierenparenchymrestes wurden Indexparameter der physiologischen Niere (vor der Resektion), des perfundierten Restes sowie des resezierten Organparenchyms für die Oxygenierung (StO2) und Perfusion (NIR) mittels hyperspektraler Bildgebung (HSI) gemessen und verglichen (Abbildung 5). Die Werte wurden in beliebigen Einheiten angegeben und zeigten physiologische Werte des Rests, was auf die Lebensfähigkeit des verbleibenden Nierenparenchyms hinweist (Tabelle 1).
Die hyperspektralen Ergebnisse stimmten mit neueren Veröffentlichungen überein und deuteten darauf hin, dass die Lebensfähigkeit und Perfusion des Gewebes anhand organspezifischer HSIStO 2-Cut-off-Werte beurteilt werden können. Diese Werte stimmten mit denen in dieser Studie überein, mit Werten von 60,1 % (±7,2 %) für physiologische Perfusion und 20,9 % (±2,7 %) für malperfundiertes Nierengewebe. Da es sich um Nicht-Überlebensexperimente handelte, gibt es keine experimentellen Daten über die Langzeitergebnisse der Tiere.
| Parameter | physiologisch | physiologischer Reststoff | reseziertes Organ |
| StO2 | 60,1 % (±7,2 %) | 60,7 % (±5,2 %) | 20,9 % (±2,7 %) |
| NIR | 37,6 % (±11,2 %) | 35,5 % (±11,5 %) | 1,5 % (±1,4 %) |
Tabelle 1: Gewebeparameter. HSI, StO, 2 , Oxygenierungs- und NIR-Perfusionswerte in beliebigen Einheiten über drei verschiedene Nierengewebezustände. Abkürzungen: StO2 = Sauerstoffsättigung des Gewebes; NIR = Nahinfrarotspektroskopie; HSI = hyperspektrale Bildgebung
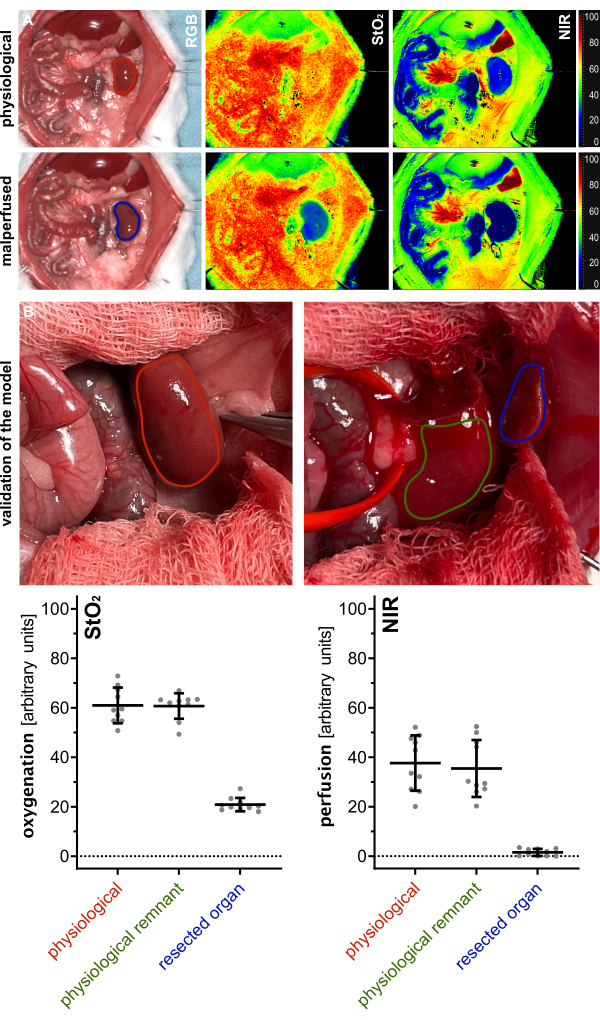
Abbildung 5: Validierung des Modells. (A) Visualisierung der physiologischen (rot) und malperfundierten (blau) Niere unter Verwendung von farbkodierten Indexbildern für die Oxygenierung (StO2) und Perfusion (NIR) aus der hyperspektralen Bildgebung. (B) RGB-Bilder der physiologischen Niere (rot), des physiologischen Nierenrests nach Polektomie (grün) und des resezierten Nierengewebes (blau) mit Quantifizierung der jeweiligen HSI-Oxygenierungs- (StO2) und Perfusionswerte (NIR) mit n = 10 Tieren. Abkürzungen: StO2 = Sauerstoffsättigung des Gewebes; NIR = Nahinfrarotspektroskopie; HSI = hyperspektrale Bildgebung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Eine CNE ist definiert als Nierenschädigung oder verminderte Nierenfunktion für mindestens 3 Monate, unabhängig von der Ursache28,29. Nierenschäden umfassen pathologische Anomalien in der nativen oder transplantierten Niere, die durch Bildgebung, Biopsie oder aus klinischen Markern wie erhöhte Albuminurie (Albumin-Kreatinin-Verhältnis > 30 mg/g oder 3,4 mg/mmol) oder Veränderungen des Harnsediments abgeleitet werden. Eine verminderte Nierenfunktion impliziert eine verminderte glomeruläre Filtrationsrate, die normalerweise anhand der Serumkonzentration von Kreatinin geschätzt wird.
Nach Angaben der US Centers for Disease Control and Prevention haben schätzungsweise ~37 Millionen Menschen allein in den Vereinigten Staaten, was ~15% der erwachsenen US-Bevölkerung entspricht, eine CKD29 , die mit erheblichen Gesundheitsausgaben verbunden ist, wobei allein die Nierenerkrankung im Endstadium über 30 Milliarden US-Dollar an Mehrkosten für Medicare-Begünstigte in den Vereinigten Staaten verursacht30.
Daher ist die Etablierung geeigneter und replizierbarer Tiermodelle unerlässlich, um aufkommende Forschungsanfragen in diesem Bereich zu bewältigen. Darüber hinaus dient die Fähigkeit, das Nierenparenchym zu verringern und eine Niereninsuffizienz auszulösen, nicht nur als grundlegende pathophysiologische Signalwege, sondern auch als wesentliche Grundlage für die Beurteilung der Wirksamkeit pharmakologischer Behandlungen, chirurgischer Methoden und bahnbrechender therapeutischer Ansätze. Durch die Nutzung dieses experimentellen Rahmens können Wissenschaftler die Umsetzung präklinischer Entdeckungen in praktische klinische Ansätze beschleunigen und so die Morbidität und Mortalität im Zusammenhang mit verschiedenen Nierenerkrankungen verringern.
Zum Beispiel können Forscher dieses Modell nutzen, um die Wirksamkeit von pharmazeutischen Verbindungen zu bewerten, die darauf abzielen, den Nierenschutz und die Regenerationswege zu verbessern, wie es bei Natrium-Glukose-Cotransporter-2 (SGLT2)-Inhibitoren wie Empagliflozin oder Dapagliflozin31, nichtsteroidalen Mineralokortikoidrezeptorantagonisten (MRAs) wie Finerenon 32,33 und Endothelinrezeptorantagonisten (ERAs) wie Sparsentan31 der Fall war oder Stabilisatoren des Hypoxie-induzierbaren Faktors (HIF)31. Darüber hinaus erleichtert dieses Modell die Bewertung neuartiger chirurgischer Ansätze, wie z.B. die Allotransplantation mit fortgeschrittenen Immunsuppressionsschemata oder neuerdings sogar die Xenotransplantation - mit der ersten erfolgreichen Transplantation genetisch veränderter Schweinenieren an hirntote menschliche Patienten im Jahr 2021 34,35,36.
Bei der Verwendung dieses 5/6-Nephrektomiemodells ist es wichtig, bewusst zu bestimmen, wie genau die partielle Nephrektomie durchgeführt werden sollte - entweder durch chirurgische Resektion der Pole, das hier vorgestellte Polektomiemodell, oder durch Ligatur der oberen und unteren segmentalen Nierenarterien oder des Parenchyms selbst, was zum Polinfarkt 7,15,16,17,18,19,20 führt.
Obwohl diese beiden Modelle (Resektion vs. Ligatur) viele gemeinsame Merkmale aufweisen, weisen sie signifikante phänotypische Variationen auf, die jeweils unterschiedliche Aspekte der menschlichen CKD erfassen. In Bezug auf phänotypische Ähnlichkeiten weisen beide Modelle allgemeine charakteristische Merkmale auf, die mit der menschlichen CKD vergleichbar sind, wie z.B. Urämie, Fibrose, Kapillarverdünnung und eine fortschreitende Verschlechterung der Nierenfunktion. Darüber hinaus kommt es bei beiden zu einer Hypertrophie des gesamten Organs, einer Hyperfiltration in funktionellen Nephronen, einer verminderten renalen Expression des vaskulären endothelialen Wachstumsfaktors, einer erhöhten renalen Expression des antiangiogenen Thrombospondin-1, einer gestörten Autoregulation der Nieren und Unregelmäßigkeiten in der Physiologie des vaskulären Stickstoffmonoxids. Daher ermöglichen beide Modelle im Allgemeinen die Untersuchung einer Vielzahl von Aspekten, einschließlich des arteriellen Blutdrucks, des Renin-Angiotensin-Aldosteron-Systems, der Autoregulation, der Dynamik von Stickstoffmonoxiden, der Physiologie einzelner Nephrons, angiogener und antiangiogener Faktoren, der Kapillarverdünnung, der Urämie, der Fibrose, der Kapillarverdünnung, der renalen Expression des vaskulären endothelialen Wachstumsfaktors, der erhöhten renalen Expression von antiangiogenem Thrombospondin-1, der gestörten renalen Autoregulation und der abnormalen vaskulären Physiologie von Stickstoffmonoxid.
Zu den regelmäßig gefundenen histologischen Merkmalen gehören tubulo-interstitielle Schäden, die sich in Entzündungen widerspiegeln, tubuläre Atrophie und Fibrose sowie fokale Glomerulosklerose, die zu einer massiven Verringerung der gesunden Glomeruli in der Restpopulation (<10 %) führt)21.
Im Gegensatz dazu ergeben sich bemerkenswerte phänotypische Unterschiede zwischen den beiden Modellen: Das Infarktmodell zeigt einen raschen Beginn einer mittelschweren bis schweren systemischen Hypertonie, während das Polektomiemodell zunächst die Normotension beibehält, bevor es zu einer leichten bis mittelschweren Hypertonie übergeht. Darüber hinaus ist bekannt, dass Ratten, die dem Infarktmodell unterzogen wurden, eine signifikant erhöhte Aktivität im Renin-Angiotensin-Aldosteron-Systemzeigten 7. Darüber hinaus wurden genotypische Unterschiede im Sinne von hoch- und herunterregulierten Genen nachgewiesen, so dass die Entscheidung, ob ein Resektions- oder ein Ligationsmodell zur Induktion der CKD verwendet werden soll, bewusst und in vollem Verständnis der biologischen Implikationen und der gewünschten Forschungsfrage getroffen werden muss37.
Während es mehrere Publikationen zur 5/6-Nephrektomie mit dorsolateralem Zugang gibt, fehlt es an wissenschaftlicher Literatur zur 5/6-Nephrektomie mittels Midline-Laparotomie und explizit an einem methodischen Protokoll. Dies ist also die Behauptung dieses Manuskripts. Zu den Einschränkungen der vorgestellten Technik gehören vor allem die Invasivität des Verfahrens und die Schwierigkeit, die korrekte Menge des resezierten Parenchyms abzuschätzen, um das gewünschte Niveau der Niereninsuffizienz zu erreichen.
Bei der Behandlung häufiger Herausforderungen, die während des Eingriffs auftreten, möchten wir die folgenden Punkte und Empfehlungen hervorheben: Sammeln Sie im Voraus gründlich Geräte und Medikamente und führen Sie die hämostatische Kontrolle durch präzise Vorbereitung und Dissektion entlang avaskulärer Ebenen sorgfältig durch. Beschränken Sie den Kontakt mit dem Nierenparenchym auf nicht-traumatische Instrumente wie angefeuchtete Wattestäbchen oder chirurgische Kompressen, die mit einer Pinzette gehandhabt werden. Beginnen Sie mit der partiellen Nephrektomie, so dass bei übermäßiger Blutung der Resektionsflächen an den Polen die Resektion in eine totale Nephrektomie zur hämostatischen Kontrolle umgewandelt und die partielle Nephrektomie auf der kontralateralen Seite durchgeführt werden kann.
Für eine noch bessere hämostatische Kontrolle konnte kurz vor der Parenchymdissektion eine Yasargil-Aneurysmaklemme auf die hilären Gefäße gelegt werden. Die vorsichtige allmähliche Freigabe dieser Yasargil-Klemme könnte die Identifizierung einzelner arterieller Bluter auf der Resektionsoberfläche erleichtern und deren präzise bipolare Elektrokauterisation ermöglichen.
Aufgrund des erhöhten Blutungsrisikos während der Gefäßpräparation ist es in der Regel ratsam, für den größten Teil der chirurgischen Vorbereitung stumpfe Überholtklemmen zu verwenden, anstatt sich auf eine scharfe Dissektion zu verlassen. Darüber hinaus ist es von Vorteil, die Instrumente und Silikongefäßschlaufen vor dem Gebrauch zu befeuchten, um die Oberflächenreibung zu minimieren.
Der gefährlichste Präparationsschritt ist die Ligatur des Nierenhilums und deren Dissektion. Eine unzureichende Gleitknotentechnik kann zu Nierenblutungen führen. Daher empfehlen wir, das Hilum über eine etwas längere Strecke zu präparieren, damit genügend Gewebe für das Umspannen und Wiedervernähen vorhanden ist.
Das Risiko für postoperative Blutungen ist relevant, daher empfehlen wir, den Bauchwandverschluss über einen längeren Zeitraum (z. B. 20 bis 30 Minuten) zu verlängern, um den Überrest über einen längeren Zeitraum zu beobachten. Die Anwendung von hypertensiven Mitteln nach anfänglicher Blutstillung, beispielsweise subkutanem Noradrenalin, zur Erhöhung des systemischen Blutdrucks und zur Identifizierung möglicher Bluter kann in Betracht gezogen werden.
Neben der Aufklärung grundlegender biomolekularer Mechanismen stellt die Fähigkeit, Nierenmalperfusion, Organresekate und Organreste bei Ratten zu induzieren, ein wertvolles Werkzeug für die Bewertung pharmakologischer Interventionen und innovativer Bildgebungsmodalitäten wie HSI 38,39,40,41,42 dar . Dieses Modell ist daher von entscheidender Bedeutung, um die biologische Gewebegrundlage für die Niereninsuffizienz zu ermitteln, die erforderlich ist, um HSI für die Gewebebewertung im urologischen Kontext der CKD vollständig zu nutzen.
Während dieses Protokoll als Schritt-für-Schritt-Anleitung für ein allgemeines Nephrektomiemodell bei Ratten gilt, kann die Menge des resezierten Nierenparenchyms entsprechend der spezifischen Forschungsfrage, wie oben beschrieben, angepasst werden. Im Falle eines bestimmten Grades an Nierenversagen, der für die Experimente erforderlich ist, kann das Ausmaß der CKD im Laufe der Zeit durch Messung von Plasmaharnstoff, systolischem Blutdruck, Proteinurie und Clearance verfolgt werden, z. B. unter Verwendung des Goldstandards Inulin und para-Aminohippursäure (PAH). Es ist allgemein anerkannt, dass sich das Nierenversagen, das durch eine Verringerung der glomerulären Filtrationsrate (GFR) definiert ist, 6 Wochen nach dem Eingriff stabilisiert hat. Um noch höhere CKD-Werte zu erreichen, kann eine Kombinationstherapie bestehend aus einer salzreichen Diät und der Anwendung einer Stickoxid-Synthase-Hemmung - unter Verwendung von NG-Nitro-L-Arginin) (L-NNA) - angewendet werden, wie zuvor in der zitierten Literaturbeschrieben 21.
Durch die Bereitstellung einer umfassenden und replizierbaren Methodik rationalisiert dieses Protokoll den Prozess der Nephrektomie und der Modellierung chronischer Nierenerkrankungen (CKD) bei Ratten. Diese Standardisierung erhöht die Zuverlässigkeit und Robustheit der Daten, fördert die Autonomie der Forscher und erleichtert die Vergleichbarkeit zukünftiger Tierversuche. Infolgedessen entwickelt es sich zu einem wesentlichen Instrument im biomedizinischen Forschungsinstrumentarium, das Licht auf die komplizierte Beziehung zwischen dem verbleibenden funktionellen Nierengewebe und den systemischen Auswirkungen von CNE wirft. Durch die Nutzung der Anpassungsfähigkeit dieses experimentellen Rahmens können Forscher neue Gebiete in der translationalen Medizin erschließen und letztendlich die Patientenergebnisse im Bereich der Nierengesundheit verbessern.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Für dieses Projekt gab es keine spezielle Förderung. Die Autorinnen und Autoren danken dem Datenspeicherungsdienst, der vom Ministerium für Wissenschaft, Forschung und Kunst Baden-Württemberg (MWK) und der Deutschen Forschungsgemeinschaft (DFG) durch die Zuwendungen INST 35/1314-1 FUGG und INST 35/1503-1 FUGG unterstützt SDS@hd. Darüber hinaus bedanken sich die Autoren für die Unterstützung durch das NCT (Nationales Centrum für Tumorerkrankungen in Heidelberg, Deutschland) durch sein strukturiertes Postdoc-Programm und das Programm Chirurgische Onkologie. Wir würdigen auch die vom Landtag Baden-Württemberg bewilligte Unterstützung aus Landesmitteln für den Innovationscampus Health + Life Science Allianz Heidelberg Mannheim aus dem strukturierten Postdoc-Programm für Alexander Studier-Fischer: Artificial Intelligence in Health (AIH) - Eine Kooperation von DKFZ, EMBL, Universität Heidelberg, Universitätsklinikum Heidelberg, Universitätsklinikum Mannheim, Zentralinstitut für Seelische Gesundheit, und das Max-Planck-Institut für medizinische Forschung. Des Weiteren bedanken wir uns für die Unterstützung durch das DKFZ Hector Krebsinstitut am Universitätsklinikum Mannheim. Für die Publikationsgebühr danken wir der Deutschen Forschungsgemeinschaft im Rahmen des Förderprogramms "Open Access Publikationskosten" sowie der Universität Heidelberg für eine finanzielle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| polyfilament suture | Covidien | CL-769 | Covidien Polysorb Braided Absorbable Suture 2-0 75 cm |
| preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| sealing hemostat patch | Baxter | 1506257 | Hemopatch Sealing Hemopatch Baxter 45 x 90 mm |
| silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Referenzen
- Kovesdy, C. P. Epidemiology of chronic kidney disease: An update 2022. Kidney Int Suppl (2011). 12 (1), 7-11 (2022).
- Sundström, J., et al. Prevalence, outcomes, and cost of chronic kidney disease in a contemporary population of 2·4 million patients from 11 countries: The careme ckd study. Lancet Reg Health Eur. 20, 100438(2022).
- Webster, A. C., Nagler, E. V., Morton, R. L., Masson, P. Chronic kidney disease. Lancet. 389 (10075), 1238-1252 (2017).
- Fassett, R. G. Current and emerging treatment options for the elderly patient with chronic kidney disease. Clin Interv Aging. 9, 191-199 (2014).
- Tarun, T., et al. Updates on new therapies for patients with ckd. Kidney Int Rep. 9 (1), 16-28 (2024).
- Dudar, I., Shifris, I., Dudar, S., Kulish, V. Current therapeutic options for the treatment of secondary hyperparathyroidism in end-stage renal disease patients treated with hemodialysis: A 12-month comparative study. Pol Merkur Lekarski. 50 (299), 294-298 (2022).
- Adam, R. J., Williams, A. C., Kriegel, A. J. Comparison of the surgical resection and infarct 5/6 nephrectomy rat models of chronic kidney disease. Am J Physiol Renal Physiol. 322 (6), F639-F654 (2022).
- Huang, Y., et al. The impact of senescence on muscle wasting in chronic kidney disease. J Cachexia Sarcopenia Muscle. 14 (1), 126-141 (2023).
- Makhloufi, C., et al. Assessment of thrombotic and bleeding tendency in two mouse models of chronic kidney disease: Adenine-diet and 5/6th nephrectomy. TH Open. 4 (2), e66-e76 (2020).
- Liu, J., Lilly, M. N., Shapiro, J. I. Targeting na/k-atpase signaling: A new approach to control oxidative stress. Curr Pharm Des. 24 (3), 359-364 (2018).
- Laget, J., et al. Cafeteria diet-induced obesity worsens experimental CKD. Nutrients. 15 (15), 3331(2023).
- Gritter, M., et al. Chronic kidney disease increases the susceptibility to negative effects of low and high potassium intake. Nephrol Dial Transplant. 39 (5), 795-807 (2024).
- Bovée, D. M., et al. Dietary salt modifies the blood pressure response to renin-angiotensin inhibition in experimental chronic kidney disease. Am J Physiol Renal Physiol. 320 (4), F654-F668 (2021).
- Vettoretti, S., et al. Renal endothelial function is associated with the anti-proteinuric effect of ace inhibition in 5/6 nephrectomized rats. Am J Physiol Renal Physiol. 310 (10), F1047-F1053 (2016).
- Zhang, Y., Kompa, A. R. A practical guide to subtotal nephrectomy in the rat with subsequent methodology for assessing renal and cardiac function. Nephrology (Carlton). 19 (9), 552-561 (2014).
- Ibrahim, H. N., Hostetter, T. H. The renin-aldosterone axis in two models of reduced renal mass in the rat. J Am Soc Nephrol. 9 (1), 72-76 (1998).
- Griffin, K. A., Picken, M., Bidani, A. K. Method of renal mass reduction is a critical modulator of subsequent hypertension and glomerular injury. J Am Soc Nephrol. 4 (12), 2023-2031 (1994).
- Garber, S. L., et al. Effect of relaxin in two models of renal mass reduction. Am J Nephrol. 23 (1), 8-12 (2003).
- Griffin, K. A., Picken, M. M., Churchill, M., Churchill, P., Bidani, A. K. Functional and structural correlates of glomerulosclerosis after renal mass reduction in the rat. J Am Soc Nephrol. 11 (3), 497-506 (2000).
- Vavrinec, P., et al. Vascular smooth muscle function of renal glomerular and interlobar arteries predicts renal damage in rats. Am J Physiol Renal Physiol. 303 (8), F1187-F1195 (2012).
- Van Koppen, A., Verhaar, M. C., Bongartz, L. G., Joles, J. A. 5/6th nephrectomy in combination with high salt diet and nitric oxide synthase inhibition to induce chronic kidney disease in the lewis rat. J Vis Exp. (77), e50398(2013).
- Wang, X., et al. A mouse 5/6th nephrectomy model that induces experimental uremic cardiomyopathy. J Vis Exp. (129), e55825(2017).
- Harvey, A. M., Malvin, R. L. Comparison of creatinine and inulin clearances in male and female rats. Am J Physiol. 209 (4), 849-852 (1965).
- Gloff, C. A., Benet, L. Z. Differential effects of the degree of renal damage on p-aminohippuric acid and inulin clearances in rats. J Pharmacokinet Biopharm. 17 (2), 169-177 (1989).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684(2024).
- Sotocinal, S. G., et al. The rat grimace scale: A partially automated method for quantifying pain in the laboratory rat via facial expressions. Mol Pain. 7, 55(2011).
- Hickman, D. L., Swan, M. Use of a body condition score technique to assess health status in a rat model of polycystic kidney disease. J Am Assoc Lab Anim Sci. 49 (2), 155-159 (2010).
- Levey, A. S., et al. Definition and classification of chronic kidney disease: A position statement from kidney disease: Improving global outcomes (kdigo). Kidney Int. 67 (6), 2089-2100 (2005).
- Wilson, S., Mone, P., Jankauskas, S. S., Gambardella, J., Santulli, G. Chronic kidney disease: Definition, updated epidemiology, staging, and mechanisms of increased cardiovascular risk. J Clin Hypertens (Greenwich). 23 (4), 831-834 (2021).
- Dobaria, V., et al. Clinical and financial impact of chronic kidney disease in emergency general surgery operations. Surg Open Sci. 10, 19-24 (2022).
- Copur, S., et al. Novel strategies in nephrology: What to expect from the future. Clin Kidney J. 16 (2), 230-244 (2022).
- Pradhan, N., Dobre, M. Emerging preventive strategies in chronic kidney disease: Recent evidence and gaps in knowledge. Curr Atheroscler Rep. 25 (12), 1047-1058 (2023).
- Dietrich, M., et al. Hyperspectral imaging for perioperative monitoring of microcirculatory tissue oxygenation and tissue water content in pancreatic surgery - an observational clinical pilot study. Perioper Med (Lond). 10 (1), 42(2021).
- Stone, L. Kidney xenotransplantation. Nat Rev Urol. 20 (11), 641-641 (2023).
- Xu, H., He, X. Developments in kidney xenotransplantation. Front Immunol. 14, 1242478(2023).
- Dos Santos, R. M. N. Kidney xenotransplantation: Are we ready for prime time. Curr Urol Rep. 24 (6), 287-297 (2023).
- Nasci, V. L., et al. Mir-21-5p regulates mitochondrial respiration and lipid content in h9c2 cells. Am J Physiol Heart Circ Physiol. 316 (3), H710-H721 (2019).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. S0748-7983 (23), 00444-00454 (2023).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488(2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Sci Data. 10 (1), 414(2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028(2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten