Method Article
5/6 Nefrectomía con bipolectomía aguda mediante laparotomía de línea media en ratas
En este artículo
Resumen
Este manuscrito presenta un protocolo estandarizado para una nefrectomía 5/6 por bipolectomía aguda mediante laparotomía de línea media en un modelo de rata, con el objetivo de inducir un estado de insuficiencia renal mediante la reducción del parénquima renal con un alto grado de precisión metódica y bajo riesgo de error técnico.
Resumen
La enfermedad renal crónica (ERC) afecta a más del 10% de la población mundial, lo que equivale a más de 800 millones de personas en todo el mundo. Los avances en el tratamiento de la ERC han tenido un impacto significativo en los resultados de los pacientes. Si bien en el pasado, la ERC a menudo se consideraba una sentencia de muerte, con muchos pacientes sucumbiendo a las complicaciones de la enfermedad renal en etapa terminal, ahora se está manejando cada vez más como una afección crónica con la disponibilidad de diálisis y trasplante de riñón, así como nuevos desarrollos farmacéuticos como los inhibidores de SGLT2 o los antagonistas de los receptores de mineralocorticoides no esteroideos.
Sin embargo, sigue habiendo una creciente demanda de más exploración de los procesos fisiopatológicos y de las posibles intervenciones terapéuticas. Los modelos biológicos fiables desempeñan un papel crucial a la hora de facilitar esta investigación. Dada la naturaleza multifacética de la enfermedad renal, que abarca no solo la biología celular, sino también la microanatomía vascular y la señalización endocrina, un modelo apropiado debe poseer un nivel de complejidad biológica que solo un modelo animal puede ofrecer, lo que hace que los roedores sean una opción obvia.
Por lo tanto, este manuscrito proporciona un protocolo intrincado y sistemático para reducir quirúrgicamente el parénquima renal a través de la laparotomía de línea media y la nefrectomía total y parcial combinada en ratas para aplicaciones de supervivencia y no supervivencia. Enfatiza el papel crítico de las técnicas quirúrgicas precisas para garantizar resultados consistentes y confiables. Los principales ejemplos de posibles aplicaciones de este modelo incluyen estudios biomoleculares y farmacéuticos, así como el desarrollo de modalidades innovadoras de imágenes intraoperatorias, como imágenes hiperespectrales, para visualizar y diferenciar objetivamente la malperfusión renal.
Introducción
La enfermedad renal crónica (ERC) es una enfermedad progresiva que afecta a una parte importante de la población mundial. Se caracteriza por la pérdida gradual de la función endocrina y filtrativa del riñón a lo largo del tiempo, lo que conduce a la acumulación de productos de desecho y líquidos en el cuerpo y a un desequilibrio en el sistema endocrino. Datos recientes sugieren que entre el 9,1% y el 13,4% de la población mundial (entre 700 millones y mil millones de personas) tiene ERC1. La prevalencia de la ERC aumenta con la edad, afectando a alrededor del 34% de las personas de 65 años o más en los Estados Unidos, en comparación con el 12% en las personas de 45 a 64 años y el 6% en las de 18 a 44 años2.
Por lo tanto, la ERC contribuye significativamente a la carga mundial de morbilidad y a las tasas de mortalidad. La detección y el tratamiento precoces de la ERC son cruciales para ralentizar su progresión y reducir el riesgo de complicaciones, como enfermedad cardiovascular, anemia y, en última instancia, enfermedad renal terminal, que requiere diálisis o trasplante renal para sobrevivir3.
Las intervenciones terapéuticas para la ERC terminal han experimentado una notable evolución en las últimas décadas. Históricamente, el tratamiento de la ERC en etapa terminal se limitaba a los cuidados de apoyo, y la diálisis surgió como una modalidad de soporte vital en la década de 1960. Desde entonces, se han realizado avances significativos en las técnicas de diálisis, incluido el desarrollo de membranas más biocompatibles, un mejor acceso vascular y el advenimiento de la diálisis peritoneal4. Además, el trasplante renal se ha convertido en el tratamiento óptimo para la ERC terminal, ya que ofrece una mejor supervivencia y calidad de vida en comparación con la diálisis5. Sin embargo, la escasez de órganos de donantes sigue siendo un desafío importante, lo que impulsa la investigación de estrategias novedosas como los xenotrasplantes y los enfoques de medicina regenerativa. Además, el manejo de las complicaciones asociadas a la ERC terminal, como el hiperparatiroidismo secundario, se ha visto potenciado por la introducción de agentes calcimiméticos como el etelcalcetida, que modulan eficazmente los niveles de hormonas paratiroideas6.
A pesar de estos avances, la búsqueda de terapias más efectivas y dirigidas continúa, impulsada por la investigación en curso sobre los mecanismos moleculares que subyacen a la progresión de la ERC en etapa terminal y las comorbilidades asociadas. Por lo tanto, la ERC persiste como una preocupación importante en la atención al paciente, lo que provoca una necesidad continua de investigación exhaustiva sobre los procesos biomédicos y los enfoques terapéuticos. Es esencial contar con modelos biológicos robustos para facilitar este tipo de investigaciones. Dada la naturaleza multifacética de la ERC, que abarca aspectos que van desde la biología celular hasta la señalización endocrina interorgánica, la anatomía funcional vascular y la reología, un modelo ideal debe poseer un nivel de complejidad biológica que solo un organismo modelo integral puede proporcionar. Por lo tanto, los roedores emergen como el modelo preferido debido a su capacidad para abarcar estas diversas dimensiones biológicas de manera efectiva.
El modelo de riñón remanente de nefrectomía 5/6 sirve como una herramienta común en la investigación de ERC para experimentos con ratas y murinos debido a su inducción estable de insuficiencia renal 7,8,9,10,11,12,13,14. Este modelo implica la extirpación de un riñón entero y 2/3 del otro. La creación del riñón remanente puede lograrse mediante la resección quirúrgica de los polos renales, denominada modelo de polectomía, o mediante la ligadura de las arterias renales segmentarias superior e inferior, lo que resulta en un infarto de polos 7,15,16,17,18,19,20.
Si bien este modelo de nefrectomía 5/6 con polectomía es una técnica establecida, solo se ha introducido como un protocolo transparente y comprensible con acceso retroperitoneal dorsolateral21. Este acceso puede ser ventajoso para un procedimiento unilateral con reducción del parénquima renal en un solo lado o para un procedimiento en dos etapas con una distancia temporal de pocos días con el fin de aumentar la supervivencia postoperatoria del animal22. Sin embargo, la utilización de un abordaje de laparotomía de línea media ofrece claras ventajas sobre la vía convencional de acceso retroperitoneal laterodorsal.
Al emplear una sola incisión abdominal en la línea media, el cirujano obtiene acceso sin obstáculos a toda la cavidad abdominal, lo que facilita una exploración y manipulación exhaustivas de los órganos intraabdominales. Este campo quirúrgico ampliado no solo agiliza el procedimiento de nefrectomía, sino que también permite la ejecución simultánea de intervenciones adicionales que pueden ser necesarias para protocolos experimentales específicos, por ejemplo, procedimientos en los uréteres, como la ligadura, la resección o la reconstrucción, que pueden ser esenciales para estudiar la fisiopatología de la uropatía obstructiva. Además, este enfoque permite la resección o manipulación simultánea de otros órganos abdominales, como el hígado, el bazo o el tracto gastrointestinal, ampliando así el alcance de las investigaciones experimentales sobre interacciones multiorgánicas o modelos de enfermedades sistémicas.
Además, el abordaje de la laparotomía de línea media facilita la construcción de un conducto de íleon o neovejiga, un procedimiento quirúrgico que implica la creación de una derivación urinaria utilizando un segmento del íleon, que es particularmente relevante en estudios que investigan la disfunción vesical o técnicas de urología reconstructiva. Esta versatilidad al combinar la nefrectomía con otras intervenciones quirúrgicas dentro del mismo campo operatorio no solo agiliza los protocolos experimentales, sino que también minimiza el trauma quirúrgico acumulativo y los riesgos asociados para los sujetos animales. Por lo tanto, en el caso de cirugía renal bilateral en un solo estadio o procedimientos intraabdominales adicionales simultáneos, el acceso ventral a través de laparotomía de línea media debe ser la opción preferida.
En la actualidad, no existe ninguna publicación o protocolo que describa esta estrategia quirúrgica. Por lo tanto, con este trabajo, nuestro objetivo es presentar una guía detallada del procedimiento para la realización de la resección renal y la inducción quirúrgica de la ERC mediante laparotomía media en ratas, aplicable tanto a estudios de supervivencia como de no supervivencia. Este modelo experimental crea un entorno regulado propicio para investigar la compleja dinámica de la ERC, imitando escenarios clínicamente significativos. Este protocolo fue diseñado específicamente para ilustrar la técnica quirúrgica. Por lo tanto, la intervención se realizó en un entorno de no supervivencia en un grupo homogéneo de 10 ratas macho. Dado que no hubo una razón significativa para la comparación con una intervención inicial o alternativa, no fue necesaria la inclusión de un grupo de control. La nefrectomía 5/6 se refiere explícitamente a la extensión de la resección del parénquima quirúrgico. Esto se traduce sin duda en una reducción funcional en el sentido de una reducción de la tasa de filtración glomerular. Sin embargo, no se puede predecir el grado funcional exacto, sino que habrá que medirlo individualmente para cada animal, por ejemplo, utilizando el aclaramiento de inulina o ácido p-aminohipúrico23,24 si es necesario.
Protocolo
Todos los procedimientos con animales descritos en este documento se llevaron a cabo dentro de instalaciones acreditadas y han recibido la aprobación del comité institucional de cuidado y uso de animales (IACUC) del Consejo Regional de Baden-Württemberg en Karlsruhe, Alemania (35-9185.81/G-62/23). Los animales de experimentación se manipularon de acuerdo con los protocolos institucionales y en cumplimiento de la legislación alemana sobre bienestar animal, además de seguir las directrices establecidas por el Consejo de la Comunidad Europea (2010/63/UE) y las directrices ARRIVE. Se utilizaron ratas Sprague Dawley macho con un peso inicial de 400 g después de un período de aclimatación de 1 semana.
1. Anestesia y analgesia
- Narcotiza el modelo de rata con los productos farmacéuticos de elección. Para seguir este protocolo, realice la inducción volátil de la sedación con isoflurano seguida de una inyección intraperitoneal de 100 mg/kg de ketamina de peso corporal para anestesia disociativa y 4 mg/kg de xilacina de peso corporal. Lograr analgesia con inyecciones subcutáneas de 5 mg/kg de peso corporal de carprofeno.
NOTA: Un protocolo detallado se puede encontrar en la literatura citada25. - Asegure una profundidad analgésica adecuada buscando reflejos de dolor durante la prueba de pinzamiento del dedo del pie con pinzas quirúrgicas y reevalúe regularmente la profundidad de la anestesia durante el procedimiento.
- Aplique lubricante oftálmico en los ojos para prevenir la desecación de la córnea.
2. Preparación del procedimiento
- Prepare el sitio de operación con todos los materiales e instrumentos necesarios, incluidas ligaduras de polifilamento, bucles de vasos de silicona, pinzas romas overholt, tijeras y pinzas de preparación fina, así como parches hemostáticos cortados en piezas de 0,8 x 0,6 cm (Figura 1A-G). Prepare el aparato de exposición quirúrgica a roedores, una almohadilla térmica y los ganchos de preparación quirúrgica como se especifica en la literatura citada25.
- Afeitar la longitud del acceso deseado, desinfectar el sitio quirúrgico alternando tres exfoliantes con hisopos de lavado a base de etanol y yodo al 70% o clorhexidina con movimientos circulares, y lograr una oxigenación adecuada mediante la inhalación de oxígeno al 100% con una mascarilla neonatal (Figura 1H-J). Cubra el resto del cuerpo fuera del sitio quirúrgico con paños para evitar la contaminación.
NOTA: El animal representativo que se utilizó para obtener las imágenes de la figura no estaba cubierto para permitir una mejor visualización de los puntos de referencia anatómicos. - Realizar una minilaparotomía mediana a través de una incisión cutánea mediana inicial sobre la longitud abdominal deseada de ~3 cm y una incisión posterior ligeramente más pequeña de la fascia a lo largo de la línea alba (Figura 1K-M).
- Lograr la exposición quirúrgica del riñón utilizando compresas quirúrgicas y ganchos de preparación quirúrgica (Figura 1N-O). Solo toque el parénquima renal con instrumentos de preparación atraumática, como un hisopo de algodón humedecido o una compresa humedecida con pinzas o pinzas romas.

Figura 1: Instrumentos experimentales, materiales y configuración. (A) Instrumentos quirúrgicos requeridos; (B) ligadura de polifilamento; (C) bucle de recipiente de silicona; (D) tijeras de preparación fina. (E-G) Parche hemostático cortado en trozos de 0,8 x 0,6 cm. (H-J) Modelo de rata afeitado y oxigenado con mascarilla. El animal representativo que se utilizó para obtener las imágenes de la figura no estaba cubierto para permitir una mejor visualización de los puntos de referencia anatómicos. (K,L) Mediana de la incisión cutánea sobre la longitud abdominal deseada de ~3 cm. (M) Mediana de la minilaparotomía; (N) exposición del riñón izquierdo usando una compresa quirúrgica, ganchos de preparación quirúrgica y un soporte de metal; (O) exposición análoga del riñón derecho y resección de la fascia de Gerota. Haga clic aquí para ver una versión más grande de esta figura.
3. Nefrectomía parcial
- Exponga el riñón respectivo, agarre la grasa perirrenal que está unida a la fascia delgada de Gerota y aplique un poco de tensión para levantar localmente la fascia del parénquima renal (Figura 2A, B.2).
- Incidir y socavar la fascia con el extremo afilado del filo de una tijera y continuar con una disección longitudinal de la fascia de la Gerota (Figura 2B).
- Realice un degloante romo de la fascia de la Gerota con unas tijeras cerradas, socavando gradualmente la fascia alrededor del parénquima y doblando la cápsula fascial medialmente, opcionalmente resecándola parcialmente (Figura 2C).
- Eslingar el hilio renal con un asa de vasos de silicona para mejorar el control vascular (Figura 2D).
- Coloque la punta de las pinzas en el espacio retroperitoneal para estabilizar el riñón y evitar un escape dorsal del riñón durante el proceso de corte y realice la polectomía renal aguda craneal de 1/3 en un solo golpe preciso con tijeras (Figura 2E).
NOTA: La línea de disección debe elegirse mediante evaluación clínica de manera que separe el órgano en 1/3 de la altura del órgano craneal y caudalmente. - Lograr la hemostasia mediante la aplicación de un parche hemostático, por compresión manual, por compresión con instrumentos contundentes o por tensión hiliar a través del asa de los vasos de silicona, reduciendo eficazmente el flujo sanguíneo hiliar (Figura 2F-J).
NOTA: La hemostasia se logró regularmente mediante la extracción simultánea del asa vascular y la aplicación del parche hemostático durante 2,5-3 min. - A continuación, se realiza una polectomía caudal aguda de 1/3 renal de forma análoga (Figura 2K-N). Para ambos golpes de tijera, apunte a un plano de disección ligeramente angulado que deje más parénquima renal en el lado hiliar y menos tejido en el lado lateral para evitar lesiones hiliares involuntarias y reducir las fugas urinarias del sistema pelvicocaliceal (Figura 2O). Si se desea una mayor estandarización de la resección precisa del parénquima 5/6, se pesa la resección de la nefrectomía total en el lado contralateral que se describe más adelante, se pesan las resecciones de la nefrectomía parcial 2/3 y se repite la disección en una técnica de "corte de salami" hasta obtener exactamente 2/3 del peso.

Figura 2: Nefrectomía parcial. (A) Exposición quirúrgica de un riñón. (B) Incisión longitudinal de la fascia de la Gerota con tijeras afiladas. (C) Desengrasado romo de la fascia de la Gerota con tijeras cerradas. (D) Eslingar el hilio renal usando un asa de silicona. (E) Polectomía aguda craneal de 1/3 con tijeras y pinzas como guía. (F) Lograr la hemostasia mediante la aplicación de un parche hemostático; (G) lograr la hemostasia por compresión manual; (H-J) logrando la hemostasia por compresión con instrumentos contundentes y la tensión hiliar a través del asa del vaso de silicona. (K-N) Polectomía caudal aguda 1/3 por analogía. (O) Representación esquemática de los planos de disección recomendados para evitar lesiones hiliares involuntarias (líneas negras). Haga clic aquí para ver una versión más grande de esta figura.
4. Nefrectomía total
- Movilice el riñón en analogía con los pasos descritos anteriormente y tunelice el hilio renal con pinzas romas (Figura 3A, B).
- Coloque el hilio renal con una ligadura de polifilamento y coloque un nudo deslizante seguro en el hilio renal un poco más cerca de los vasos abdominales para ocluir el flujo sanguíneo renal y el uréter (Figura 3C, D).
- Diseccionar bruscamente el hilio con unas tijeras y extraer el riñón (Figura 3E, F).
- Control de la hemostasia y corte de los extremos de la ligadura (Figura 3G-J).

Figura 3: Nefrectomía total. (A) Exposición quirúrgica del riñón contralateral; (B) extirpación análoga de la fascia de Gerota y tunelización del hilio renal mediante pinzas romas; (C) Eslingar el hilio con una ligadura de polifilamento. (D) Colocación de una ligadura de nudo deslizante en el hilio renal; (E,F) disección aguda del hilio con tijeras y extracción del riñón; (G-I) control de hemostasia y corte de los extremos de la ligadura. (J) Representación esquemática de la altura de ligadura recomendada (línea discontinua) y el plano de disección (línea negra). Haga clic aquí para ver una versión más grande de esta figura.
5. Cierre de la pared abdominal
- Coloque una sutura de esquina en la fascia abdominal utilizando una sutura de polifilamento (Figura 4A-D).
- Continúe suturando la fascia abdominal con una sutura corrida con ~ 2 mm de tejido agarrado con cada mordida y aproximadamente 4 mm entre las mordidas (Figura 4E-I).
- Suturar la capa cutánea con puntos individuales con ~3 mm de tejido agarrado con cada mordida y ~6 mm entre las mordidas (Figura 4J-Q).
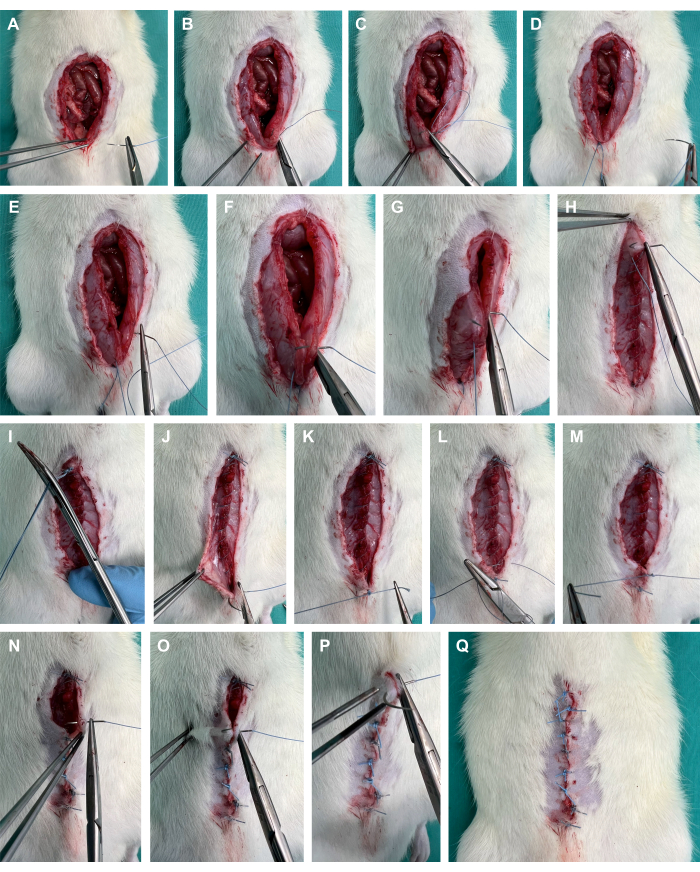
Figura 4: Cierre de la pared abdominal. (A-D) Colocación de una sutura de esquina en la fascia abdominal utilizando una sutura de polifilamento. (E-I) Sutura corrida de la fascia abdominal; (J-Q) sutura de la capa cutánea mediante puntos individuales. Haga clic aquí para ver una versión más grande de esta figura.
6. Pasos adicionales
- Dependiendo del escenario deseado, el propósito de la investigación y el grado de insuficiencia renal deseado, considere las desviaciones de este protocolo, incluida una variación en la cantidad de parénquima renal resecado, por ejemplo, nefrectomía total unilateral (nefrectomía 3/6), nefrectomía total bilateral (nefrectomía 6/6), monopolectomía unilateral (nefrectomía 1/6), monopolectomía bilateral (nefrectomía 2/6), bipolectomía unilateral (nefrectomía 2/6) y bipolectomía bilateral (nefrectomía 4/6).
- En general, se debe sacrificar a los animales mediante una cardiectomía aguda sin cierre previo de la pared abdominal para aplicaciones que no sean de supervivencia, o realizar un cierre abdominal escalonado como se describe anteriormente en caso de experimentos de supervivencia planificados con seguimiento.
- En el caso de aplicaciones de supervivencia, mantener condiciones estériles en todo momento durante la cirugía. Antes de la cirugía, prepare la piel de forma aséptica en el sitio quirúrgico con un exfoliante (a base de yodo o clorhexidina) y alcohol. Use un paquete nuevo de instrumentos esterilizados en autoclave para cada animal.
- Después de la cirugía, monitoree al animal hasta que esté lo suficientemente consciente como para mantener la decúbito esternal y aíslelo hasta que se recupere por completo.
- Como tratamiento postquirúrgico del animal, incluir visitas diarias a través del personal médico, así como tratamiento del dolor postquirúrgico mediante inyecciones subcutáneas de 5 mg/kg de carprofeno de peso corporal 2 veces al día durante 2 días.
- Utilice hojas de puntuación con criterios de terminación claramente definidos para el tiempo que transcurre hasta la recuperación postoperatoria completa. Utilice la Escala de Muecas de Rata26 o la Puntuación de Condición Corporal27 de la literatura citada. Finalice el experimento si la puntuación de mueca ≥ 6 o una puntuación de condición corporal = 1 después de la aplicación de carprofeno. Además, se termina en caso de una complicación quirúrgica como una infección de la herida postoperatoria o una insuficiencia de cierre de la pared abdominal.
Resultados
Este protocolo se llevó a cabo en 10 ratas macho (peso medio 398 ± 35 g) en un entorno de no supervivencia y el procedimiento fue realizado por un residente quirúrgico de tercer año. La tasa de éxito definida por la supervivencia a más de 20 min tras el cierre de la pared abdominal fue del 100%. La duración media de la preparación desde la incisión cutánea hasta el cierre cutáneo fue de 18 min 34 s ± 7 min 31 s.
Desafortunadamente, debido a la naturaleza no sobreviviente de este manuscrito, no hay datos sobre la función renal postoperatoria. Los estudios futuros en animales con entornos de supervivencia deben asociar el grado de pérdida del parénquima con los parámetros de la función renal para proporcionar una mejor comprensión del grado y la variación de la insuficiencia renal correspondiente a la cantidad de resección renal realizada.
Para validar la viabilidad del remanente del parénquima renal, se midieron los parámetros índice del riñón fisiológico (antes de la resección), del remanente perfundido, así como del parénquima del órgano resecado para la oxigenación (StO2) y la perfusión (NIR) mediante imágenes hiperespectrales (HSI) y se compararon (Figura 5). Los valores se proporcionaron en unidades arbitrarias y mostraron valores fisiológicos del remanente, indicando la viabilidad del parénquima renal remanente (Tabla 1).
Los resultados hiperespectrales fueron consistentes con publicaciones recientes, lo que indica que la viabilidad y la perfusión del tejido se pueden evaluar utilizando los valores de corte HSI StO2 específicos del órgano. Estos valores coincidieron con los observados en este estudio, con valores de 60,1% (±7,2%) para perfusión fisiológica y 20,9% (±2,7%) para tejido renal malperfundido. Dado que estos fueron experimentos de no supervivencia, no hay datos experimentales sobre los resultados a largo plazo de los animales.
| parámetro | fisiológico | Remanente fisiológico | Órgano resecado |
| StO2 | 60,1% (±7,2%) | 60,7% (±5,2%) | 20,9% (±2,7%) |
| NIR | 37,6% (±11,2%) | 35,5% (±11,5%) | 1,5% (±1,4%) |
Tabla 1: Parámetros tisulares. Valores de oxigenación y perfusión NIR de HSI StO2 en unidades arbitrarias en tres estados diferentes del tejido renal. Abreviaturas: StO2 = saturación de oxígeno en los tejidos; NIR = espectroscopía de infrarrojo cercano; HSI = imágenes hiperespectrales
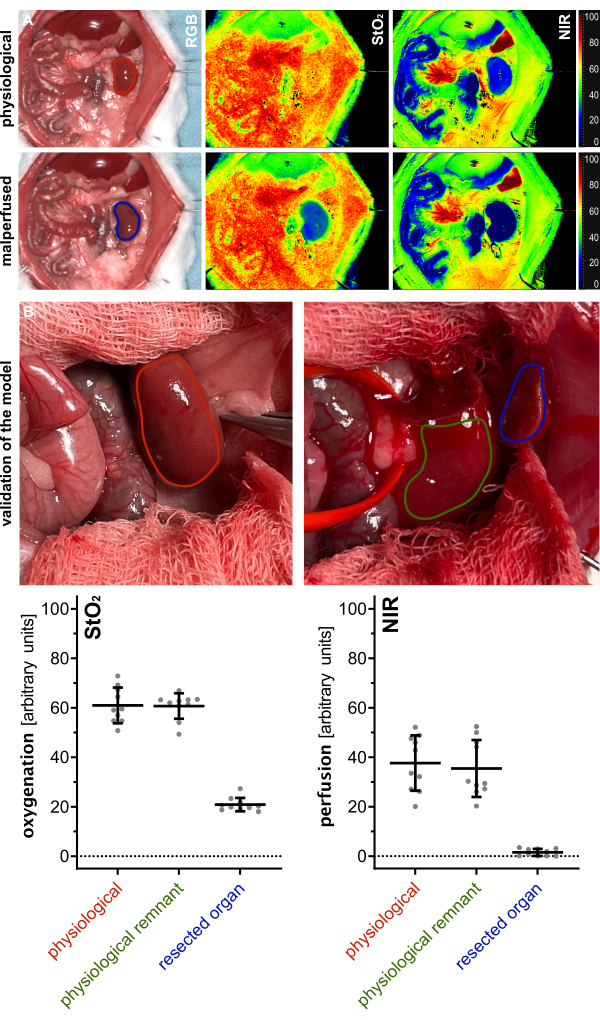
Figura 5: Validación del modelo. (A) Visualización del riñón fisiológico (rojo) y malperfundido (azul) utilizando imágenes índice codificadas por colores para la oxigenación (StO2) y la perfusión (NIR) a partir de imágenes hiperespectrales. (B) Imágenes RGB del riñón fisiológico (rojo), remanente fisiológico renal después de la polectomía (verde) y tejido renal resecado (azul) con cuantificación de los respectivos valores de oxigenación HSI (StO2) y perfusión (NIR) con n = 10 animales. Abreviaturas: StO2 = saturación de oxígeno en los tejidos; NIR = espectroscopía de infrarrojo cercano; HSI = imágenes hiperespectrales. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La ERC se define por daño renal o disminución de la función renal durante al menos 3 meses, independientemente de la causa28,29. El daño renal abarca anomalías patológicas en el riñón nativo o trasplantado, identificadas a través de imágenes, biopsias o deducidas a partir de marcadores clínicos como el aumento de la albuminuria (relación albúmina/creatinina > 30 mg/g o 3,4 mg/mmol) o alteraciones del sedimento urinario. La disminución de la función renal implica una reducción de la tasa de filtración glomerular, que generalmente se estima a partir de la concentración sérica de creatinina.
Según los Centros para el Control y la Prevención de Enfermedades de EE. UU., se estima que ~ 37 millones de personas solo en los Estados Unidos, en correlación con ~ 15% de la población adulta de los EE. UU., tienen ERC29 asociada con gastos sustanciales de atención médica, con la enfermedad renal en etapa terminal solo causando más de $ 30 mil millones en costos excesivos para los beneficiarios de Medicare en los Estados Unidos30.
Por lo tanto, el establecimiento de modelos animales adecuados y replicables es imperativo para abordar las investigaciones emergentes dentro de este dominio. Además, más allá de desentrañar las vías fisiopatológicas fundamentales, la capacidad de disminuir el parénquima renal e instigar la insuficiencia renal actúa como una base esencial para evaluar la eficacia de los tratamientos farmacológicos, las metodologías quirúrgicas y los enfoques terapéuticos pioneros. Al explotar este marco experimental, los científicos pueden acelerar la conversión de los descubrimientos preclínicos en enfoques clínicos prácticos, mitigando así la morbilidad y la mortalidad relacionadas con diversas afecciones renales.
Por ejemplo, los investigadores pueden utilizar este modelo para evaluar la eficacia de los compuestos farmacéuticos destinados a mejorar la protección renal y las vías de regeneración, como fue el caso de los inhibidores del cotransportador de sodio-glucosa 2 (SGLT2), como empagliflozina o dapagliflozina31, antagonistas de los receptores de mineralocorticoides (ARM) no esteroideos, como la finerenona 32,33, antagonistas de los receptores de endotelina (ERA), como el sparsentan31 o Estabilizadores del factor inducible por hipoxia (HIF)31. Además, este modelo facilita la evaluación de nuevos enfoques quirúrgicos, como el alotrasplante con regímenes de inmunosupresión avanzados o, recientemente, incluso el xenotrasplante, con el primer trasplante exitoso de riñones de cerdo modificados genéticamente a pacientes humanos con muerte cerebral en 2021 34,35,36.
Al utilizar este modelo de nefrectomía 5/6, es esencial determinar conscientemente cómo exactamente se debe realizar la nefrectomía parcial, ya sea mediante la resección quirúrgica de los polos, denominado modelo de polectomía como se presenta aquí, o mediante la ligadura de las arterias renales segmentarias superior e inferior o el parénquima en sí, lo que resulta en un infarto de polos 7,15,16,17,18,19,20.
Si bien comparten muchas características, estos dos modelos (resección vs. ligadura) exhiben variaciones fenotípicas significativas, cada uno de los cuales captura aspectos distintos de la ERC humana. En cuanto a las similitudes fenotípicas, ambos modelos presentan rasgos característicos generales similares a la ERC humana, como uremia, fibrosis, rarefacción capilar y disminución progresiva de la función renal. Además, ambos experimentan hipertrofia de todo el órgano, hiperfiltración en las nefronas funcionales, disminución de la expresión renal del factor de crecimiento endotelial vascular, aumento de la expresión renal del antiangiogénico trombospondina-1, alteración de la autorregulación de los riñones e irregularidades en la fisiología vascular del óxido nítrico. Por lo tanto, ambos modelos, en general, permiten el estudio de una variedad de aspectos que incluyen la presión arterial, el sistema renina-angiotensina-aldosterona, la autorregulación, la dinámica del óxido nítrico, la fisiología de una sola nefrona, los factores angiogénicos y antiangiogénicos, la rarefacción capilar, la uremia, la fibrosis, la rarefacción capilar, la expresión renal del factor de crecimiento endotelial vascular, el aumento de la expresión renal de trombospondina-1 antiangiogénica, la autorregulación renal alterada y la vascularización anormal Fisiología del óxido nítrico.
Las características histológicas encontradas regularmente incluyen daño túbulo-intersticial reflejado por inflamación, atrofia tubular y fibrosis, y glomeruloesclerosis focal que conduce a una reducción masiva de glomérulos sanos dentro de la población remanente (<10%)21.
Por el contrario, surgen notables distinciones fenotípicas entre los dos modelos: el modelo de infarto presenta un inicio rápido de hipertensión sistémica moderada a grave, mientras que el modelo de polectomía inicialmente mantiene la normotensión antes de pasar a hipertensión leve a moderada. Además, se sabe que las ratas sometidas al modelo de infarto muestran una actividad significativamente aumentada en el sistema renina-angiotensina-aldosterona7. Además, se ha demostrado que existen diferencias genotípicas en el sentido de genes regulados al alza y a la baja, por lo que la decisión de utilizar un modelo de resección o de ligadura para la inducción de la ERC debe hacerse conscientemente y en plena comprensión de las implicaciones biológicas y de la pregunta de investigación deseada37.
Si bien existen varias publicaciones sobre la nefrectomía 5/6 con acceso dorsolateral, existe una falta de literatura científica que aborde la nefrectomía 5/6 mediante laparotomía de línea media y explícitamente no existe un protocolo metódico. Esta es, por lo tanto, la afirmación de este manuscrito. Las limitaciones de la técnica presentada incluyen principalmente el carácter invasivo del procedimiento y la dificultad de estimar la cantidad correcta de parénquima resecado para alcanzar el nivel deseado de insuficiencia renal.
Al abordar los desafíos comunes encontrados durante el procedimiento, deseamos resaltar los siguientes puntos y recomendaciones: Reúna minuciosamente el equipo y los medicamentos con anticipación y ejecute meticulosamente el control hemostático a través de una preparación y disección precisas a lo largo de los planos avasculares. Limite el contacto con el parénquima renal a instrumentos no traumáticos, como hisopos de algodón humedecidos o compresas quirúrgicas manipuladas con fórceps. Comenzar con la nefrectomía parcial para que en caso de sangrado excesivo de las superficies de resección en los polos, la resección se pueda convertir en una nefrectomía total para el control hemostático y la nefrectomía parcial se pueda realizar en el lado contralateral.
Para mejorar aún más el control hemostático, se puede colocar una pinza de aneurisma de Yasargil en los vasos hiliares justo antes de la disección del parénquima. La liberación gradual y cautelosa de esta pinza de Yasargil podría facilitar la identificación de hemorragias arteriales individuales en la superficie de resección y permitir la electrocauterización bipolar precisa de estas.
Por lo general, debido al elevado riesgo de sangrado durante la preparación vascular, es aconsejable utilizar pinzas romas para la mayor parte de la preparación quirúrgica, en lugar de confiar en una disección aguda. Además, es beneficioso humedecer los instrumentos y los bucles de silicona de los recipientes antes de usarlos para minimizar la fricción de la superficie.
El paso de preparación más peligroso es la ligadura del hilio renal y su disección. Una técnica de nudo deslizante insuficiente puede causar hemorragia renal. En consecuencia, recomendamos preparar el hilio a una distancia un poco más larga para que haya suficiente tejido para reclamar y suturar.
El riesgo de sangrado postoperatorio es relevante, por lo que recomendamos prolongar el cierre de la pared abdominal durante un período prolongado (p. ej., 20 a 30 min) para observar el remanente durante un período más largo. Se puede considerar la aplicación de agentes hipertensivos después de la hemostasia inicial, por ejemplo, norepinefrina subcutánea para aumentar la presión arterial sistémica e identificar posibles hemorragias.
Más allá de esclarecer los mecanismos biomoleculares fundamentales, la capacidad de inducir malperfusión renal, resecciones de órganos y restos de órganos en ratas proporciona una herramienta valiosa para evaluar intervenciones farmacológicas y modalidades de imagen innovadoras como HSI 38,39,40,41,42. Por lo tanto, este modelo es crucial para proporcionar la verdad básica del tejido biológico detrás de la insuficiencia renal necesaria para utilizar completamente la HSI para la evaluación de tejidos en el contexto urológico de la ERC.
Si bien se cree que este protocolo es una guía paso a paso para un modelo de nefrectomía general en ratas, la cantidad de parénquima renal resecado se puede ajustar de acuerdo con la pregunta de investigación específica descrita anteriormente. En el caso de un grado específico de insuficiencia renal, que se requiere para los experimentos, el nivel de ERC se puede seguir a lo largo del tiempo midiendo la urea plasmática, la presión arterial sistólica, la proteinuria y el aclaramiento, por ejemplo, utilizando la inulina de referencia y el ácido para-aminohipúrico (HAP). En general, se reconoce que 6 semanas después del procedimiento, la insuficiencia renal, definida por una reducción de la tasa de filtración glomerular (TFG), se ha estabilizado. Para lograr niveles aún más altos de ERC, se puede aplicar una terapia combinada compuesta por una dieta alta en sal y la aplicación de inhibición de la óxido nítrico sintasa - utilizando NG-nitro-L-Arginina) (L-NNA) - como se describió previamente en la literatura citada21.
Al proporcionar una metodología completa y replicable, este protocolo agiliza el proceso de modelado de la nefrectomía y la enfermedad renal crónica (ERC) en ratas. Esta estandarización mejora la fiabilidad y la solidez de los datos, promueve la autonomía de los investigadores y facilita la comparabilidad entre futuros estudios con animales. Como resultado, emerge como un instrumento esencial en el conjunto de herramientas de investigación biomédica, arrojando luz sobre la intrincada relación entre el tejido renal funcional restante y los impactos sistémicos de la ERC. Aprovechando la adaptabilidad de este marco experimental, los investigadores pueden trazar nuevos territorios en la medicina traslacional y, en última instancia, avanzar en los resultados de los pacientes en el ámbito de la salud renal.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
No hubo fondos especiales para este proyecto. Los autores agradecen el servicio de almacenamiento de datos SDS@hd apoyado por el Ministerio de Ciencia, Investigación y Artes de Baden-Württemberg (MWK) y la Fundación Alemana de Investigación (DFG) a través de las subvenciones INST 35/1314-1 FUGG e INST 35/1503-1 FUGG. Además, los autores agradecen el apoyo del NCT (Centro Nacional de Enfermedades Tumorales de Heidelberg, Alemania) a través de su programa estructurado de postdoctorado y el programa de Oncología Quirúrgica. También reconocemos el apoyo a través de fondos estatales aprobados por el Parlamento del Estado de Baden-Württemberg para la Alianza de Ciencias de la Vida + Salud del Campus de Innovación de Heidelberg Mannheim del programa postdoctoral estructurado para Alexander Studier-Fischer: Inteligencia Artificial en la Salud (AIH) - Una colaboración de DKFZ, EMBL, Universidad de Heidelberg, Hospital Universitario de Heidelberg, Hospital Universitario de Mannheim, Instituto Central de Salud Mental, y el Instituto Max Planck de Investigación Médica. Además, agradecemos el apoyo a través del Instituto de Cáncer DKFZ Hector en el Centro Médico Universitario de Mannheim. Por la tarifa de publicación, agradecemos el apoyo financiero de la Deutsche Forschungsgemeinschaft dentro del programa de financiación "Open Access Publikationskosten", así como de la Universidad de Heidelberg.
Materiales
| Name | Company | Catalog Number | Comments |
| atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| polyfilament suture | Covidien | CL-769 | Covidien Polysorb Braided Absorbable Suture 2-0 75 cm |
| preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| sealing hemostat patch | Baxter | 1506257 | Hemopatch Sealing Hemopatch Baxter 45 x 90 mm |
| silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Referencias
- Kovesdy, C. P. Epidemiology of chronic kidney disease: An update 2022. Kidney Int Suppl (2011). 12 (1), 7-11 (2022).
- Sundström, J., et al. Prevalence, outcomes, and cost of chronic kidney disease in a contemporary population of 2·4 million patients from 11 countries: The careme ckd study. Lancet Reg Health Eur. 20, 100438(2022).
- Webster, A. C., Nagler, E. V., Morton, R. L., Masson, P. Chronic kidney disease. Lancet. 389 (10075), 1238-1252 (2017).
- Fassett, R. G. Current and emerging treatment options for the elderly patient with chronic kidney disease. Clin Interv Aging. 9, 191-199 (2014).
- Tarun, T., et al. Updates on new therapies for patients with ckd. Kidney Int Rep. 9 (1), 16-28 (2024).
- Dudar, I., Shifris, I., Dudar, S., Kulish, V. Current therapeutic options for the treatment of secondary hyperparathyroidism in end-stage renal disease patients treated with hemodialysis: A 12-month comparative study. Pol Merkur Lekarski. 50 (299), 294-298 (2022).
- Adam, R. J., Williams, A. C., Kriegel, A. J. Comparison of the surgical resection and infarct 5/6 nephrectomy rat models of chronic kidney disease. Am J Physiol Renal Physiol. 322 (6), F639-F654 (2022).
- Huang, Y., et al. The impact of senescence on muscle wasting in chronic kidney disease. J Cachexia Sarcopenia Muscle. 14 (1), 126-141 (2023).
- Makhloufi, C., et al. Assessment of thrombotic and bleeding tendency in two mouse models of chronic kidney disease: Adenine-diet and 5/6th nephrectomy. TH Open. 4 (2), e66-e76 (2020).
- Liu, J., Lilly, M. N., Shapiro, J. I. Targeting na/k-atpase signaling: A new approach to control oxidative stress. Curr Pharm Des. 24 (3), 359-364 (2018).
- Laget, J., et al. Cafeteria diet-induced obesity worsens experimental CKD. Nutrients. 15 (15), 3331(2023).
- Gritter, M., et al. Chronic kidney disease increases the susceptibility to negative effects of low and high potassium intake. Nephrol Dial Transplant. 39 (5), 795-807 (2024).
- Bovée, D. M., et al. Dietary salt modifies the blood pressure response to renin-angiotensin inhibition in experimental chronic kidney disease. Am J Physiol Renal Physiol. 320 (4), F654-F668 (2021).
- Vettoretti, S., et al. Renal endothelial function is associated with the anti-proteinuric effect of ace inhibition in 5/6 nephrectomized rats. Am J Physiol Renal Physiol. 310 (10), F1047-F1053 (2016).
- Zhang, Y., Kompa, A. R. A practical guide to subtotal nephrectomy in the rat with subsequent methodology for assessing renal and cardiac function. Nephrology (Carlton). 19 (9), 552-561 (2014).
- Ibrahim, H. N., Hostetter, T. H. The renin-aldosterone axis in two models of reduced renal mass in the rat. J Am Soc Nephrol. 9 (1), 72-76 (1998).
- Griffin, K. A., Picken, M., Bidani, A. K. Method of renal mass reduction is a critical modulator of subsequent hypertension and glomerular injury. J Am Soc Nephrol. 4 (12), 2023-2031 (1994).
- Garber, S. L., et al. Effect of relaxin in two models of renal mass reduction. Am J Nephrol. 23 (1), 8-12 (2003).
- Griffin, K. A., Picken, M. M., Churchill, M., Churchill, P., Bidani, A. K. Functional and structural correlates of glomerulosclerosis after renal mass reduction in the rat. J Am Soc Nephrol. 11 (3), 497-506 (2000).
- Vavrinec, P., et al. Vascular smooth muscle function of renal glomerular and interlobar arteries predicts renal damage in rats. Am J Physiol Renal Physiol. 303 (8), F1187-F1195 (2012).
- Van Koppen, A., Verhaar, M. C., Bongartz, L. G., Joles, J. A. 5/6th nephrectomy in combination with high salt diet and nitric oxide synthase inhibition to induce chronic kidney disease in the lewis rat. J Vis Exp. (77), e50398(2013).
- Wang, X., et al. A mouse 5/6th nephrectomy model that induces experimental uremic cardiomyopathy. J Vis Exp. (129), e55825(2017).
- Harvey, A. M., Malvin, R. L. Comparison of creatinine and inulin clearances in male and female rats. Am J Physiol. 209 (4), 849-852 (1965).
- Gloff, C. A., Benet, L. Z. Differential effects of the degree of renal damage on p-aminohippuric acid and inulin clearances in rats. J Pharmacokinet Biopharm. 17 (2), 169-177 (1989).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684(2024).
- Sotocinal, S. G., et al. The rat grimace scale: A partially automated method for quantifying pain in the laboratory rat via facial expressions. Mol Pain. 7, 55(2011).
- Hickman, D. L., Swan, M. Use of a body condition score technique to assess health status in a rat model of polycystic kidney disease. J Am Assoc Lab Anim Sci. 49 (2), 155-159 (2010).
- Levey, A. S., et al. Definition and classification of chronic kidney disease: A position statement from kidney disease: Improving global outcomes (kdigo). Kidney Int. 67 (6), 2089-2100 (2005).
- Wilson, S., Mone, P., Jankauskas, S. S., Gambardella, J., Santulli, G. Chronic kidney disease: Definition, updated epidemiology, staging, and mechanisms of increased cardiovascular risk. J Clin Hypertens (Greenwich). 23 (4), 831-834 (2021).
- Dobaria, V., et al. Clinical and financial impact of chronic kidney disease in emergency general surgery operations. Surg Open Sci. 10, 19-24 (2022).
- Copur, S., et al. Novel strategies in nephrology: What to expect from the future. Clin Kidney J. 16 (2), 230-244 (2022).
- Pradhan, N., Dobre, M. Emerging preventive strategies in chronic kidney disease: Recent evidence and gaps in knowledge. Curr Atheroscler Rep. 25 (12), 1047-1058 (2023).
- Dietrich, M., et al. Hyperspectral imaging for perioperative monitoring of microcirculatory tissue oxygenation and tissue water content in pancreatic surgery - an observational clinical pilot study. Perioper Med (Lond). 10 (1), 42(2021).
- Stone, L. Kidney xenotransplantation. Nat Rev Urol. 20 (11), 641-641 (2023).
- Xu, H., He, X. Developments in kidney xenotransplantation. Front Immunol. 14, 1242478(2023).
- Dos Santos, R. M. N. Kidney xenotransplantation: Are we ready for prime time. Curr Urol Rep. 24 (6), 287-297 (2023).
- Nasci, V. L., et al. Mir-21-5p regulates mitochondrial respiration and lipid content in h9c2 cells. Am J Physiol Heart Circ Physiol. 316 (3), H710-H721 (2019).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. S0748-7983 (23), 00444-00454 (2023).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488(2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Sci Data. 10 (1), 414(2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028(2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados