Method Article
Affrontare i problemi pratici nella microindentazione basata sulla microscopia a forza atomica su espianti di cartilagine articolare umana
In questo articolo
Riepilogo
Presentiamo un approccio passo-passo per identificare e affrontare i problemi più comuni associati alle micro-indentazioni di microscopia a forza atomica. Esemplificamo i problemi emergenti sugli espianti di cartilagine articolare umana nativa caratterizzati da vari gradi di degenerazione guidata dall'osteoartrite.
Abstract
Senza dubbio, la microscopia a forza atomica (AFM) è attualmente una delle tecniche più potenti e utili per valutare micro e persino nano-segnali in campo biologico. Tuttavia, come con qualsiasi altro approccio microscopico, possono sorgere sfide metodologiche. In particolare, le caratteristiche del campione, la preparazione del campione, il tipo di strumento e la sonda di indentazione possono portare ad artefatti indesiderati. In questo protocollo, esemplificamo questi problemi emergenti sugli espianti di cartilagine articolare sana e osteoartritica. A tal fine, mostriamo innanzitutto attraverso un approccio passo-passo come generare, classificare e classificare visivamente i dischi di cartilagine articolare ex vivo in base ai diversi stadi di degenerazione per mezzo di un grande imaging a fluorescenza a mosaico 2D dell'intero tessuto espianto. Il principale punto di forza del modello ex vivo è che comprende cartilagine umana invecchiata, nativa, che consente di studiare i cambiamenti correlati all'osteoartrite dall'esordio precoce alla progressione. Inoltre, vengono presentate anche le insidie comuni nella preparazione dei tessuti, nonché l'effettiva procedura AFM insieme alla successiva analisi dei dati. Mostriamo come le fasi di base ma cruciali come la preparazione e l'elaborazione del campione, le caratteristiche topografiche del campione causate dalla degenerazione avanzata e l'interazione campione-punta possano influire sull'acquisizione dei dati. Sottoponiamo inoltre ad esame i problemi più comuni nell'AFM e descriviamo, ove possibile, come superarli. La conoscenza di questi limiti è della massima importanza per la corretta acquisizione dei dati, l'interpretazione e, in ultima analisi, l'integrazione dei risultati in un ampio contesto scientifico.
Introduzione
A causa delle dimensioni sempre più ridotte dei dispositivi e dei sistemi elettronici, il rapido sviluppo di tecnologie e apparecchiature a base di micro e nano ha guadagnato slancio. Uno di questi dispositivi è la microscopia a forza atomica (AFM), che può scansionare superfici biologiche e recuperare informazioni topografiche o biomeccaniche su scala nanometricae micrometrica 1,2. Tra le sue vaste caratteristiche, questo strumento può essere utilizzato sia come micro che come nano-penetratore per ottenere informazioni sulle proprietà meccaniche di vari sistemi biologici 3,4,5,6. I dati vengono raccolti per contatto fisico con la superficie attraverso una sonda meccanica, che può essere piccola fino a circa 1 nm alla sua punta7. La deformazione risultante del campione viene quindi visualizzata in base alla profondità di indentazione della punta a sbalzo e alla forza applicata sul campione8.
L'osteoartrite (OA) è una malattia cronica degenerativa a lungo termine caratterizzata dal deterioramento della cartilagine articolare delle articolazioni e dei tessuti circostanti, che può portare alla completa esposizione delle superfici ossee. L'onere dell'OA è notevole; attualmente, la metà di tutte le donne e un terzo di tutti gli uomini di età pari o superiore a 65 anni soffrono di OA9. I traumi, l'obesità e la conseguente alterazione della biomeccanica dell'articolazione10 determinano la degenerazione della cartilagine articolare, che viene vista come un risultato finale comune. Lo studio pionieristico di Ganz et al. ha postulato che le prime fasi del processo OA possono coinvolgere le proprietà biomeccaniche della cartilagine11, e da allora i ricercatori hanno confermato questa ipotesi12. Allo stesso modo, è generalmente accettato che le proprietà biomeccaniche del tessuto siano funzionalmente orchestrate dall'organizzazione ultrastrutturale e dal crosstalk cellula-cellula e cellula-matrice. Qualsiasi alterazione può avere un impatto drammatico sul funzionamento biomeccanico complessivo del tessuto13. Ad oggi, la diagnosi di OA è clinica e si basa sulla radiografia a film semplice14. Questo approccio è duplice: in primo luogo, la mancanza di una soglia di cut-off degenerativa definita per formulare la diagnosi di OA rende la condizione difficile da quantificare e, in secondo luogo, i metodi di imaging mancano di sensibilità e standardizzazione e non possono rilevare danni localizzati alla cartilagine15,16,17. A tal fine, la valutazione delle proprietà meccaniche della cartilagine ha il vantaggio decisivo di descrivere un parametro che cambia durante il decorso dell'OA indipendentemente dall'eziologia della malattia e ha un'influenza diretta sulla funzionalità tissutale in una fase molto precoce. Gli strumenti di indentazione misurano la forza con cui il tessuto resiste all'indentazione. Non si tratta, infatti, di un concetto nuovo; I primi studi risalgono agli anni '80 e '90. In questo periodo, numerosi studi hanno suggerito che gli strumenti di indentazione progettati per le misurazioni artroscopiche della cartilagine articolare potrebbero essere adatti per rilevare cambiamenti degenerativi nella cartilagine. Anche 30 anni fa, alcuni studi sono stati in grado di dimostrare che gli strumenti di indentazione erano in grado di rilevare in vivo i cambiamenti nella superficie della cartilagine durante la degenerazione tissutale conducendo misurazioni della rigidità a compressione durante l'artroscopia18,19,20.
L'indentazione AFM (AFM-IT) della cartilagine articolare fornisce informazioni su una proprietà meccanica fondamentale del tessuto, vale a dire la rigidità. Si tratta di un parametro meccanico che descrive la relazione tra un carico non distruttivo applicato e la deformazione risultante dell'area del tessuto dentellata21. AFM-IT ha dimostrato di essere in grado di quantificare le modificazioni dipendenti dall'età nella rigidità nelle reti di collagene macroscopicamente non interessate, differenziando così tra i cambiamenti patologici associati all'insorgenza dell'OA (grado 0 sulla scala Outerbridge nella cartilagine articolare)22. In precedenza abbiamo dimostrato che gli AFM-IT, sulla base dell'organizzazione spaziale dei condrociti come biomarcatore basato su immagini per la degenerazione precoce della cartilagine, consentono non solo di quantificare ma anche di individuare effettivamente i primi cambiamenti meccanici degenerativi. Questi risultati sono già stati confermati da altri23,24. Quindi, AFM-IT agisce come uno strumento interessante per diagnosticare e identificare i cambiamenti degenerativi precoci. Questi cambiamenti possono essere già misurati a livello cellulare, rimodellando la comprensione del processo fisiopatologico dell'OA.
In questo protocollo, dimostriamo una procedura completa di grading istologico e biomeccanico degli espianti di cartilagine articolare, dalla preparazione dell'espianto di cartilagine nativa all'acquisizione e all'elaborazione dei dati AFM. Attraverso un approccio passo-passo, mostriamo come generare, classificare e classificare visivamente il tessuto cartilagineo articolare in base alle diverse fasi di degenerazione per mezzo di imaging a mosaico di grandi dimensioni 2D, seguito da rientranze micro-AFM.
Anche se, attualmente, l'AFM-IT è uno degli strumenti più sensibili per misurare le alterazioni biomeccaniche della cartilagine7, come ogni altra tecnica strumentale, presenta limitazioni e peculiarità pratiche25 che possono portare ad un'errata acquisizione dei dati. A tal fine, sottoponiamo ad esame i problemi più comuni che sorgono durante le misurazioni AFM degli espianti di cartilagine e descriviamo, ove possibile, come minimizzarli o superarli. Questi includono gli aspetti topografici dei campioni e le difficoltà di stabilizzarli in un ambiente compatibile con l'AFM, le peculiarità fisiche della superficie del tessuto e le conseguenti difficoltà nell'eseguire misurazioni AFM su tali superfici. Vengono anche presentati esempi di curve forza-distanza errate, sottolineando le condizioni che possono causarle. Vengono inoltre discusse ulteriori limitazioni inerenti alla geometria della punta a sbalzo e all'uso del modello Hertz per l'analisi dei dati.
Protocollo
Sono stati utilizzati condili femorali prelevati da pazienti sottoposti ad artroplastica totale del ginocchio presso l'ospedale universitario di Tubinga, in Germania. In questo studio sono stati inclusi solo campioni di cartilagine articolare di pazienti con patologie articolari degenerative e post-traumatiche. Prima dell'inizio dello studio è stata ottenuta l'approvazione del comitato etico dipartimentale, istituzionale e locale (Progetto n.674/2016BO2). Il consenso informato scritto è stato ricevuto da tutti i pazienti prima della partecipazione.
NOTA: Nella Figura 1 è riportato un diagramma di flusso delle fasi dell'esperimento in ordine cronologico.
1. Elaborazione dei tessuti e generazione di dischi cartilaginei
- Preparazione dei tessuti
- Dopo la resezione post-operatoria, posizionare i campioni di cartilagine in un contenitore riempito con il terreno di Eagle modificato di Dulbecco (DMEM) integrato con il 5% (v/v) di penicillina-streptomicina. Assicurarsi che i campioni siano completamente immersi nel terreno. La durata tra la resezione chirurgica e l'ulteriore lavorazione della cartilagine non deve superare le 24 ore. Assicurarsi che, durante l'intera lavorazione, i campioni siano completamente immersi nel terreno per evitare l'essiccazione del campione.
- Tagliare la cartilagine dall'osso usando un bisturi.
- Generazione del disco cartilagineo
- Generare dischi cartilaginei di 4 mm di diametro utilizzando un punzone per biopsia.
NOTA: È importante selezionare e resecare le aree del condilo in cui lo spessore dello strato di cartilagine supera 1 mm. Questo potrebbe essere problematico, soprattutto intorno alle zone portanti, dove lo strato di cartilagine in genere perde il suo spessore a causa di processi di usura o degenerazione. - Posizionare i dischi di cartilagine da 4 mm precedentemente generati su un dispositivo di taglio su misura e fissare e tenere stabili i dischi di cartilagine per mezzo di una spatola. Quando si posizionano i dischi di cartilagine sul dispositivo di taglio, è necessario prestare attenzione. Posizionare i campioni in modo che lo strato superiore della cartilagine (la zona superficiale della cartilagine articolare) non sia rivolto verso la lama
- Tagliare i dischi di cartilagine con una lama di rasoio. Vengono quindi generati campioni di cartilagine a forma di disco di 4 mm x 1 mm. Per evitare l'essiccazione del campione, eseguire il taglio dei tessuti il più rapidamente possibile.
- Raccogliere ogni disco con l'aiuto di una spatola e posizionare i dischi di cartilagine generati in provette da 1,5 mL contenenti 1 mL di DMEM integrato con il 5% (v/v) di penicillina-streptomicina. Mettere circa 15 dischi in una provetta.
- Generare dischi cartilaginei di 4 mm di diametro utilizzando un punzone per biopsia.
- Sezionamento criotomo dei dischi cartilaginei (per fette perpendicolari)
NOTA: Questo passaggio è facoltativo e può essere utilizzato se si desidera una visualizzazione laterale della distribuzione del pattern cellulare all'interno dei dischi cartilaginei. Può essere utilizzato come metodo di verifica in quanto la distribuzione del pattern cellulare è una caratteristica 3D della cartilagine articolare26. Possono essere utilizzati anche il sezionamento ottico e le ricostruzioni 3D dell'intero disco cartilagineo mediante microscopio confocale, eliminando così la necessità di sezionare i campioni come descritto nel protocollo.- Coprire il disco cartilagineo con un mezzo di inclusione solubile in acqua e posizionarlo sul bordo della manopola del criotomo (con la superficie del disco perpendicolare alla superficie della manopola). Nel dispositivo criotomo, il mezzo di inclusione si congela a basse temperature.
- Utilizzando un criotomo standard, sezionare il tessuto lateralmente a uno spessore di 60 μm fino a raggiungere la metà del disco (cioè quando le criosezioni raggiungono una lunghezza di 4 mm) e raccogliere le fette. Sezionando l'espianto del disco perpendicolarmente, è possibile visualizzare tutte le zone della cartilagine (superficiale, media e profonda).
- Raccogliere le sezioni su un vetrino e rimuovere il mezzo di inclusione solubile in acqua lavando tre volte con soluzione fisiologica tamponata con fosfato (PBS).
2. Ordinamento del disco cartilagineo in funzione del pattern spaziale cellulare
- Colorazione dei campioni di cartilagine a forma di disco
- Posizionare un disco di cartilagine (sezione 1.2) in ciascun pozzetto di una piastra a 96 pozzetti e aggiungere 130 μL di colorante fluorescente permeabile alle cellule a una diluizione di 1:1.000 in ciascun pozzetto.
- Ispezionare visivamente l'intera piastra e assicurarsi che in ciascun pozzetto sia posizionato un solo disco. Incubare la piastra per 30 minuti nell'incubatore standard per colture cellulari a 37 °C.
- Colorazione delle fette di cartilagine da 60 μm
- Posizionare delicatamente le sezioni del disco cartilagineo (sezione 1.3) su vetrini da microscopio con l'aiuto di una pinza.
- Coprire le sezioni della cartilagine con un mezzo di montaggio contenente controcolorazione DAPI nucleare e posizionare delicatamente i vetrini coprioggetti adatti alla microscopia a fluorescenza.
- Sigillare i bordi di ogni vetrino coprioggetto con un normale smalto trasparente e lasciare asciugare per 3 minuti.
- Smistamento e imaging della cartilagine dall'alto verso il basso e laterale
NOTA: Ogni disco deve essere esaminato al microscopio a fluorescenza. Lo scopo di questo passaggio è quello di ordinare i dischi in base al loro pattern cellulare predominante (stringhe singole, stringhe doppie, piccoli cluster, grandi cluster o diffusi).- Posizionare la piastra a 96 pozzetti sul supporto della piastra del microscopio a fluorescenza.
- Selezionare il filtro a fluorescenza appropriato di Em 495 nm/Ex 515 nm (per l'imaging dall'alto verso il basso dei dischi cartilaginei preparato nel paragrafo 2.1.) o Em 358 nm/Ex 461 nm (per l'imaging laterale delle sezioni di cartilagine preparato nel paragrafo 2.2) e l'obiettivo 10x.
NOTA: L'uso dell'obiettivo 10x consente di ispezionare l'intera circonferenza del disco e di escludere campioni con colorazioni disomogenee o improprie. Tuttavia, l'utilizzo della sola vista dall'alto verso il basso può comportare la percezione di cambiamenti nell'organizzazione cellulare come risultato dell'analisi degli strati di tessuto più profondi resi visibili all'osservazione dall'alto verso il basso dall'erosione superficiale. Ad esempio, una corda ascendente che segue le arcate del collagene potrebbe essere percepita come una singola cellula o cellule sparse (modello diffuso)26. Di conseguenza, entrambi i lati dei dischi devono essere ispezionati per garantire una corretta selezione del modello cellulare. - Determinare visivamente il modello cellulare visualizzato in ciascun disco cartilagineo. È improbabile che un disco abbia un solo tipo di pattern cellulare. Per la porzione del disco in cui la disposizione dei condrociti non corrisponde al modello di interesse, accettare i campioni solo se il modello indesiderato si trova alla periferia, dove non vengono effettuate misurazioni AFM (cioè fino a 0,5 mm dal bordo del disco) e assicurarsi che questo non superi il 10% della superficie totale del disco27, 28.
- Acquisizione di immagini dell'intero disco cartilagineo
- Selezionare l'obiettivo 10x del microscopio e posizionarlo sotto il pozzetto preselezionato contenente un singolo disco di cartilagine. Concentrati sul disco per vedere il modello cellulare.
- Selezionare la funzione Navigatore per avere una panoramica dell'intero pozzo. Utilizzate il pulsante sinistro del mouse e trascinate per spostarvi in un'altra posizione dello stage. Con la rotellina del mouse, ingrandisci e rimpicciolisci.
NOTA: A questo punto, è possibile visualizzare un'anteprima del pozzetto con l'intero campione facendo doppio clic su ciascuna area di interesse in sequenza. - Selezionare un quadrato che racchiuda l'area di interesse da scansionare; A questo punto diventeranno visibili tutte le singole tessere che compongono il mosaico.
- Regola l'esposizione/intensità della luce in modo che le celle possano essere visualizzate chiaramente dallo sfondo. A questo punto, la luminosità/contrasto dell'immagine è stata regolata per tutte le tessere e non può più essere personalizzata singolarmente per ogni riquadro.
NOTA: Poiché le celle vicine al bordo del disco spesso emettono un segnale di fluorescenza più elevato rispetto alle celle al centro, le impostazioni di esposizione/intensità della luce devono essere adattate.- Per valutare se il tempo di esposizione è appropriato per un particolare canale, esaminare la distribuzione del segnale nell'istogramma. Utilizzando il meccanismo di esposizione automatica incluso nel software di imaging del microscopio, è possibile visualizzare tutte le cellule che risiedono all'interno del disco.
- Seleziona l'opzione Punto mappa di messa a fuoco del software, quindi seleziona ogni singola tessera facendo clic con il pulsante sinistro del mouse al centro di essa.
- Selezionare l'opzione Mappa messa a fuoco. Viene visualizzata una finestra con tutti i riquadri selezionati in precedenza. Fare doppio clic su un riquadro nell'elenco per visualizzarlo e metterlo a fuoco.
- Fare clic su Imposta Z per salvare il piano focale e passare al riquadro successivo. Dopo aver regolato il piano focale per ogni singolo riquadro, iniziare l'acquisizione dell'immagine premendo Avvia scansione.
- Se la scansione visualizza barre orizzontali e/o verticali più scure, ciò potrebbe essere dovuto a un'illuminazione impropria e irregolare dei singoli fotogrammi. Per risolvere questo problema, utilizzare l'opzione Linked Shading incorporata nel software prima della scansione effettiva.
- Salvare, esportare e annotare correttamente le immagini.
3. Approccio biomeccanico degli espianti di cartilagine
- Preparazione del campione per le misurazioni AFM
- Fissare ogni disco di cartilagine preselezionato contenente un pattern cellulare (sezione 2) in piastre di Petri per mezzo di colla biocompatibile. Aggiungere una quantità sufficiente di colla campione sui lati superiore, inferiore, sinistro e destro del disco.
- Coprire i dischi con 2,5 ml di terreno L-15 di Leibovitz senza L-glutammina. Aggiungere delicatamente il terreno di Leibowitz sui campioni per evitare il distacco del campione dalla superficie a causa delle onde create dal terreno.
- Caricamento dei campioni nell'AFM
- Posizionare la capsula di Petri nel portacampioni del dispositivo AFM e accendere il riscaldatore della piastra di Petri impostato a 37 °C. Lasciare che la piastra di coltura tissutale raggiunga la temperatura desiderata. Questo viene fatto per escludere possibili artefatti causati dalla variazione di temperatura.
- Calibrazione a sbalzo AFM
- Inizializzare la configurazione del software come descritto in precedenza da Danalache et al.29.
- Selezionare un supporto a sbalzo per mattoni di vetro adatto per le misurazioni dei liquidi e posizionarlo con cura sulla testa AFM. Un meccanismo di bloccaggio fissa il mattone di vetro nella testa AFM. Assicurarsi che la superficie riflettente del mattone di vetro sia diritta e parallela al supporto AFM.
- Posizionare con cura il cantilever sulla superficie del supporto a sbalzo in mattone di vetro. Il cantilever stesso dovrebbe poggiare sul piano ottico lucido, al centro del mattone di vetro.
- Posizionare con cautela una gonna in silicone (membrana in silicone) sulla base del supporto a sbalzo per evitare la condensa media nella testa AFM.
- Abbassare il cantilever a passi di 100 μm utilizzando la funzione del motore passo-passo fino a quando non è completamente immerso nel fluido.
- Eseguire un approccio scanner con i parametri di avvicinamento descritti da Danalache et al.29. Ritrarre il cantilever di 100 μm una volta raggiunto il fondo della piastra di Petri.
- Calibrare il cantilever utilizzando i passaggi esatti ed eseguire i parametri descritti da Danalache et al.29. Al termine della calibrazione, la deflessione verticale viene salvata e visualizzata in newton (N) unità di forza anziché in volt (V), l'unità di registrazione originale dal rivelatore a fotodiodo. Negli esperimenti qui riportati, dopo la calibrazione è risultato un set point di 4,47 nN.
- Utilizzando la funzione del motore passo-passo, ritrarre il cantilever a 1.000 μm.
- Identificazione del sito di misurazione della cartilagine desiderato nell'ambito dell'AFM
NOTA: A causa dello spessore di 1 mm dei dischi cartilaginei, il cantilever non è visibile nel campo visivo durante la navigazione sul campione.- Utilizzare la telecamera CCD del microscopio per identificare il cantilever. Il cantilever AFM deve essere posizionato in un'area priva di campioni della piastra di Petri.
- Avviare un approccio scanner con il cantilever su un'area pulita e priva di campioni della capsula di Petri, utilizzando gli stessi parametri descritti da Danalache et al.29.
- Ritrarre ulteriormente il cantilever a 1.5 mm di distanza dalla parte inferiore della piastra con il comando del motore passo-passo. Questo passaggio è fondamentale per evitare una collisione diretta tra il cantilever e il campione.
- Passa dalla visualizzazione in campo chiaro a quella a fluorescenza e identifica visivamente la parte superiore del disco.
- Spostare il supporto del campione AFM esattamente di 2 mm verso il centro del disco. Questo punto è considerato il centro del disco cartilagineo.
- Eseguire un approccio scanner e, una volta raggiunta la superficie del disco cartilagineo, ritrarre il cantilever di 100 μm.
- Misure della curva forza-distanza
- Particolare delle celle posizionate nel sito di misurazione desiderato. Fare clic sul pulsante Esegui per avviare le misurazioni e la generazione di curve forza-distanza nella posizione desiderata.
- Acquisisci cinque curve forza-distanza su ciascun sito di misurazione. Ritrarre il cantilever di 500 μm e spostarlo nel punto di misurazione successivo.
NOTA: La retrazione del cantilever è un passaggio cruciale, poiché la superficie del disco cartilagineo non è omogenea e presenta irregolarità. Una collinetta alta sulla superficie del campione può provocare una collisione drammatica, con conseguenti danni indesiderati alla punta a sbalzo/al campione. Si consiglia di selezionare un minimo di cinque diversi siti di misurazione sparsi sulla superficie del disco e di acquisire un minimo di cinque curve forza-distanza in ciascun sito. - Ispezionate le curve forza-distanza e salvatele.
- Stima dei moduli di Young utilizzando il modello di adattamento di Hertz
- Aprire le curve forza-distanza generate da analizzare (file .jpk) nel software di analisi dei dati utilizzando l'opzione Apri un batch di curve di spettroscopia .
- Selezionare il modello di adattamento Hertz , quindi selezionare l'opzione Adattamento elasticità .
- L'opzione di adattamento dell'elasticità esegue automaticamente i seguenti calcoli sulla curva forza-distanza selezionata: calcola la linea di base e sottrae dall'intera curva per rimuovere l'offset della linea di base (la linea di base viene riportata a zero sull'asse y); determina il punto di contatto rilevando il punto in cui la curva forza-distanza interseca la linea di forza zero (il punto di contatto è impostato a zero sull'asse x); calcola la separazione punta-campione (viene sottratto il segnale di altezza del piezoelettrico che tiene conto della flessione del cantilever); e adatta automaticamente la curva forza-distanza al modello selezionato. Se lo si desidera, ognuno di questi passaggi può essere eseguito anche in modo indipendente.
- Adattare utilizzando i seguenti parametri di adattamento: rapporto di Poisson di 0,5 e il raggio di punta a sbalzo appropriato.
NOTA: Quando si utilizza una trave a sbalzo con una punta a sbalzo sferica, è necessario utilizzare il modello Hertz fit. Il cantilever utilizzato in questo studio aveva una punta sferica con un raggio di 5 μm. Si consiglia di adattare la curva forza-distanza fino al raggiungimento della forza massima applicata (setpoint). - Controllare visivamente l'adattamento della curva forza-distanza per garantirne la correttezza. Questo passaggio deve essere eseguito per ciascuna delle curve forza-distanza analizzate.
- Determinazione della profondità di indentazione
NOTA: A seconda dello strumento di analisi dei dati utilizzato, questo processo può variare. Lo sperimentatore può facilmente leggere la profondità di indentazione seguendo una serie di passaggi inclusi nel programma di analisi dei dati.- Aprire ciascuna delle curve forza-distanza generate nel software di analisi dei dati e selezionare il modello di adattamento di Hertz come processo di analisi.
- Applicare l'opzione Sottrai offset linea di base per azzerare l'asse di deflessione verticale (asse y) e selezionare la funzione Offset + Tilt .
- Utilizzare la funzione Trova punto di contatto per identificare automaticamente il punto di contatto , che viene automaticamente portato a una coordinata x pari a zero.
- Sottrarre la distanza tenendo conto esclusivamente della deflessione a sbalzo dall'altezza piezoelettrica grezza durante l'indentazione utilizzando la funzione Posizione punta verticale .
- Selezionare l'opzione Adattamento elasticità per visualizzare la curva forza-distanza elaborata e selezionare l'area del grafico in modo che sia allineata con il valore più negativo sull'asse di posizione verticale della punta (asse x).
- Leggere e documentare l'indentazione dalla casella X Min nella scheda dei parametri. Salvare e documentare i risultati.
4. Analisi statistica
- Aprire il software statistico. Selezionare Nuovo set di dati dal menu a discesa.
- Aprire la scheda Visualizzazione variabile dopo aver selezionato il file DataSet . Definire le variabili numeriche per ogni categoria di pattern cellulare: stringhe singole = SS, stringhe doppie = DS, piccoli cluster = SC, grandi cluster = BC, diffusi e moduli di Young.
- Nella scheda di visualizzazione dati, immettere i dati dei moduli di Young misurati per ciascuna delle categorie di pattern cellulari corrispondenti. Analizzare la distribuzione dei dati selezionando Analizza dalla barra dei menu, quindi Analisi esplorativa dei dati.
- Selezionate Moduli di Young come variabile dipendente e Pattern cellulare come elenco dei fattori. Un box plot utilizzato per la sezione dei risultati viene visualizzato tra i risultati nel file di output.
- Per eseguire un'analisi statistica, scegliere Campioni dipendenti (Dependent Samples) nella sezione test non parametrico della scheda della barra dei menu di analisi. Selezionare Young's Moduli come Test Fields e Cellular Pattern as Groups (Gruppi) nella scheda Fields.
NOTA: I risultati vengono visualizzati nel file di output. Per l'analisi statistica viene eseguito un test di Friedman. - Incorporare i valori p del test non parametrico nel box plot creato nel passaggio 4.4. Salvare i risultati facendo clic su File nella barra dei menu e selezionando Salva.
Risultati
Utilizzando un dispositivo di taglio autocostruito, siamo stati in grado di espiantare e generare piccoli dischi di cartilagine (4 mm x 1 mm) da condili umani freschi contenenti un singolo modello spaziale cellulare30 di singole stringhe (SS, Figura 2A), doppie stringhe (DS), piccoli cluster (SC), grandi cluster (BC; Figura 2A) e diffusa (Figura 2B). Un espianto di cartilagine rappresentativo è raffigurato nella Figura 3A. La selezione dei dischi che mostrano un solo tipo di pattern è stata effettuata utilizzando l'imaging a fluorescenza top-down (Figura 2). La variazione topografica del disco della superficie della cartilagine è stata ulteriormente illustrata dall'imaging laterale di sezioni spesse 60 μm generate dai dischi cartilaginei (Figura 2C). Sulla superficie dei dischi di cartilagine osteoartritica espiantati erano presenti fibrillazione superficiale e schisi della matrice (Figura 3B,C). Ciò è stato particolarmente evidente nei dischi rappresentativi della progressione avanzata dell'OA, rappresentata dalla presenza di BC (Figura 2A). Dopo lo smistamento post-fluorescenza, la rigidità dei dischi è stata valutata mediante micro-indentazioni AFM. A tal fine, i dischi cartilaginei generati sono stati fissati con successo nella capsula di Petri AFM per mezzo di colla biocompatibile (Figura 3D) per evitare la deriva del campione durante le misurazioni (Figura 3E). La quantità di colla utilizzata deve essere regolata. Una quantità insufficiente di colla provocherà l'instabilità del disco, mentre l'aggiunta di troppa colla può portare a una diffusione indesiderata della colla sotto e/o sopra il disco cartilagineo. Quest'ultimo porta ad artefatti di misurazione e a una scarsa identificazione del disco al microscopio a fluorescenza. Un'applicazione inadeguata della colla o movimenti improvvisi del campione durante la fissazione sono problemi frequenti che causano il distacco del tessuto dalla capsula di Petri e dovrebbero essere evitati.
Una riduzione graduale della rigidità rappresentativa insieme alla disposizione del pattern cellulare è mostrata nella Figura 4A. I valori di rigidezza erano più alti nei dischi contenenti SS (mediana di 2,6 kPa), rappresentativi delle aree di cartilagine guarida non compromesse. Con l'insorgenza e la progressione dell'OA, le misurazioni dell'AFM hanno mostrato una forte diminuzione graduale della rigidità del 42% in DS (1,5 kPa), del 77% in SC (0,6 kPa) e, infine, dell'88% negli stadi avanzati rappresentati da BC (0,3 kPa; Figura 4A). I dischi contenenti un pattern diffuso mostravano un'elevata elasticità con un'importante variazione dei singoli valori del modulo di Young. Per tutti i dischi cartilaginei con un'organizzazione del pattern cellulare predominante assegnata, la profondità di indentazione associata al setpoint impiegato (4,477 nN) è risultata inversamente proporzionale alla rigidità (Figura 4B). Nella Figura 4C è illustrata una curva forza-distanza generata rappresentativa, mentre nella Figura 4D è mostrato un adattamento Hertz e l'identificazione del punto di contatto.
L'adattamento corretto dipende, tra gli altri fattori, dalla corretta determinazione della linea di base. Se il rilevamento automatico della linea di base è errato (ad esempio, a causa di una linea di base turbolenta), l'adattamento può anche essere determinato manualmente e consente all'utente di selezionare una linea di base più rappresentativa per le misurazioni. Tuttavia, se la curva forza-distanza generata non consente un adattamento corretto, deve essere scartata. La Figura 5 mostra esempi di curve forza-distanza errate. Generare adeguate curve forza-distanza sugli espianti di cartilagine articolare osteoartritica può essere difficile a causa della superficie irregolare del tessuto, da un lato (gli esempi sono mostrati nella Figura 5A,B) e dell'instabilità del campione causata da una fissazione impropria del campione (esempi mostrati nella Figura 5C,D). Gli artefatti possono essere causati da più punti di contatto sonda-campione (a causa della superficie irregolare della cartilagine degenerata) o da movimenti indesiderati del tessuto (visibili attraverso cambiamenti nel piano focale). Questi artefatti possono essere visti nelle curve forza-distanza generate e sono indicativi di un contatto non ottimale tra il cantilever AFM e la superficie della cartilagine o di una fissazione impropria del campione alla piastra di Petri (vedi Figura 5A-D).

Figura 1: Diagramma di flusso della procedura sperimentale. Sintesi delle fasi sperimentali in ordine cronologico, a partire da campioni di cartilagine resecati intraoperatoriamente fino alla generazione di dischi cartilaginei di 4 mm x 1 mm, colorazione a fluorescenza e ordinamento dei dischi sulla base dell'organizzazione del pattern cellulare mediante imaging top-down e side-view e, infine, valutazione dell'elasticità mediante misure di forza atomica. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Imaging a fluorescenza di dischi cartilaginei rappresentativi. (A) Immagini 2D a mosaico e un campo esemplare ingrandito di dischi cartilaginei colorati con colorante permeabile alla membrana cellulare con ingrandimento 100x. Il disco superiore mostra un disco rappresentativo a corde singole, mentre quello inferiore è rappresentativo di un disco a cluster grande (in basso). (B) Immagine a mosaico di un disco a motivo diffuso visto dalla superficie (in alto) e lo stesso disco ripreso dalla parte inferiore (in basso). (C) Vista laterale della colorazione nucleare di fette di dischi cartilaginei da 60 μm. La barra della scala bianca rappresenta 500 μm per le immagini a mosaico (campo visivo più ampio, A [pannello di sinistra], B, C) e 100 μm per le immagini ingrandite e a fuoco (A [pannello di destra]). Fare clic qui per visualizzare una versione più grande di questa figura.
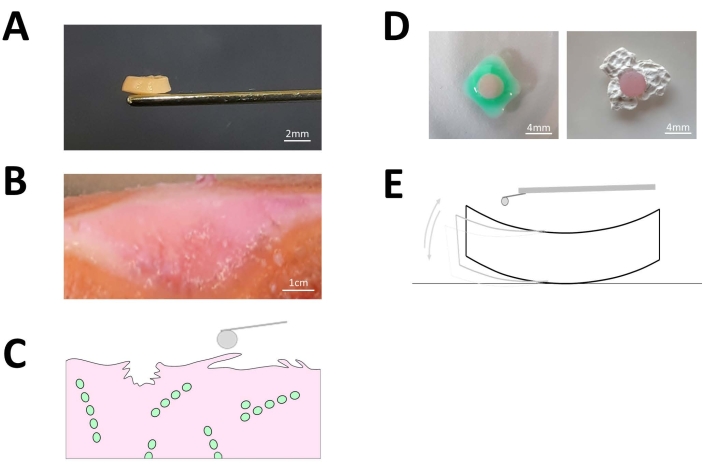
Figura 3: Dischi cartilaginei articolari espiantati. (A) Immagine rappresentativa di un espianto di disco cartilagineo di 4 mm x 1 mm generato da cartilagine articolare umana fresca. La barra della scala raffigurata in bianco rappresenta 2 mm. (B) Immagine rappresentativa della cartilagine osteoartritica nativa in cui la superficie del tessuto presenta fibrillazione superficiale e schisi macroscopicamente visibili. La barra della scala raffigurata in bianco rappresenta 1.000 mm. (C) Rappresentazione schematica della superficie della cartilagine fibrillata. (D) Prima delle misurazioni AFM, ciascuno degli espianti del disco di cartilagine è stato fissato correttamente per mezzo di colla campione biocompatibile alla superficie della piastra di Petri AFM per evitare artefatti dovuti alla deriva del campione durante le misurazioni effettive dell'indentazione come mostrato in (E). La barra della scala bianca rappresenta 4 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
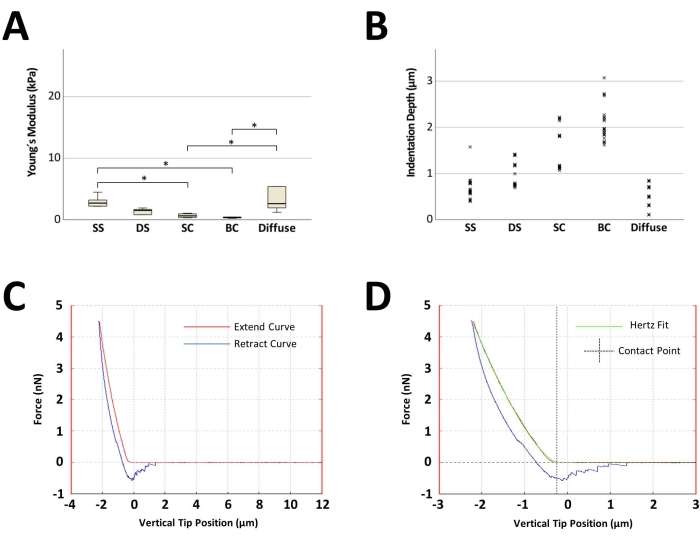
Figura 4: Risultati rappresentativi delle misurazioni al microscopio a forza atomica dei dischi cartilaginei articolari ordinati in base alla loro organizzazione del pattern cellulare predominante . (A) Boxplot che mostra la mediana dei moduli di Young calcolati di cinque dischi, uno per ogni pattern cellulare, originati da un paziente. Un totale di 25 misurazioni sono state eseguite su ciascun disco (cinque misurazioni per cinque siti di misurazione distinti). La linea nera all'interno del rettangolo rappresenta il valore mediano, gli arti inferiore e superiore del rettangolo rappresentano rispettivamente il primo e il terzo quartile e le barre di errore rappresentano i valori più bassi e più alti per ciascun gruppo. (B) Grafico a punti che raffigura i 125 punti di profondità di indentazione per ogni pattern cellulare. (C) Curve forza-distanza esemplari acquisite con l'AFM con un modulo di Young calcolato di 0,4 kPa. (D) Una determinazione rappresentativa dell'accoppiamento Hertz e del punto di contatto per la curva forza-distanza mostrata in (C). L'asse x visualizza la posizione verticale della punta (che è la distanza attraversata dal piezoelettrico, con la lunghezza che tiene conto della flessione a sbalzo che viene automaticamente sottratta dalla parte di contatto della curva forza-distanza). *p < 0,05. Per l'analisi statistica è stato utilizzato il test di Friedman. Abbreviazioni: SS = stringhe singole; DS = corde doppie; SC = piccoli grappoli; BC = grandi ammassi. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Esempi di curve forza-distanza errate. (A) La curva forza-distanza mostra una deviazione massiccia seguita da un recupero vicino al livello della linea di base prima che si osservi una rientranza continua della superficie. Questo fenomeno può essere attribuito a un ostacolo relativamente grande (ad esempio, grandi fessure superficiali che sporgono dallo strato più superficiale della cartilagine). (B) La curva forza-distanza estesa mostra più piccoli picchi. Si ritiene che queste curve siano causate da irregolarità su microscala sulla superficie della cartilagine (ad esempio, fibrillazione). Sia (C) che (D) visualizzano curve forza-distanza con andamento bifasico. Entrambe le curve forza-distanza sono rappresentative di una scarsa fissazione del campione e di una deriva del campione. È anche abbastanza comune in questi casi vedere un cambiamento improvviso nel piano focale. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Essendo una malattia progressiva e multifattoriale, l'OA innesca cambiamenti strutturali e funzionali nella cartilagine articolare. Durante il decorso dell'OA, le compromissioni delle caratteristiche meccaniche sono accompagnate da cambiamenti strutturali e biochimici sulla superficie della cartilagine articolare27,31. I primi eventi patologici che si verificano nell'OA sono la deplezione dei proteoglicani accoppiata con l'interruzione della rete di collagene32,33,34. Tali sottili cambiamenti superficiali precoci sono difficili da individuare e identificare con i test di massa, perché il comportamento meccanico è mediato sull'intera profondità del tessuto. Inoltre, una questione ancora irrisolta è se i cambiamenti funzionali a livello di organo e tessuto siano correlati a cambiamenti strutturali e funzionali su micro o nanoscala. A tal fine, l'AFM è considerato uno dei metodi più sensibili, in grado di rilevare i primi cambiamenti biomeccanici che si verificano con l'insorgenza dell'OA7. Consente di misurare la rigidezza su scala micrometrica e nanometrica in campioni nativi, fornendo informazioni sulle proprietà meccaniche della cartilagine articolare35,36. In questo protocollo, utilizzando rientranze micro-AFM, abbiamo misurato le proprietà elastiche di espianti umani sani e osteoartritici di cartilagine articolare. I risultati hanno mostrato che gli espianti di cartilagine sono altamente rappresentativi dei primi eventi locali di OA con una notevole diminuzione graduale della rigidità che si verifica negli espianti di cartilagine specifici del modello. Inoltre, i risultati sono in linea con le precedenti ricerche pubblicate che hanno mostrato una notevole diminuzione della rigidità insieme all'organizzazione del pattern cellulare23,24,27,37.
Sono attualmente necessari modelli umani nativi corroborati che imitano vari aspetti della patogenesi e della progressione dell'OA per affrontare le carenze della ricerca traslazionale e le sfide della traduzione dei dati in vitro in un contesto clinico. Ad oggi, nessun modello è in grado di rappresentare con precisione il complesso compartimento cartilagineo umano nativo, per non parlare dei tessuti articolari legati all'età che sono inclini all'OA in risposta agli stimoli che danno inizio alla malattia38. I modelli a base di espianto più comunemente utilizzati finora erano di origine bovina o bovina e applicavano un forte trattamento con citochine infiammatorie o un carico meccanico 39,40,41. Questo protocollo, d'altra parte, dimostra come generare piccoli campioni di cartilagine umana a forma di disco espiantati (4 mm x 1 mm), che sono indicativi delle singole fasi di specifici eventi di OA. Gli espianti di cartilagine vengono ordinati e assegnati allo stadio utilizzando l'organizzazione spaziale cellulare come biomarcatore basato su immagini30,42. Poiché i cambiamenti precoci nelle proprietà biomeccaniche possono essere identificati e quantificati già non appena iniziano a sorgere le doppie stringhe23,27, in una fase in cui la superficie della cartilagine appare ancora macroscopicamente intatta26, questo modello basato sull'espianto consente lo studio di un compartimento cartilagineo nativo locale e può fornire informazioni approfondite sull'OA precoce. Inoltre, questo modello di cartilagine potrebbe essere utile per studiare la risposta delle cellule e della matrice ad alterazioni meccaniche e infiammatorie in un habitat locale nativo3D 38,39. Essendo relativamente semplici e facili da generare, questi espianti di cartilagine possono essere utilizzati anche per studiare l'eterogeneità dell'OA, che è un fattore limitante nello sviluppo e nella sperimentazione di farmaci OA modificanti la malattia43. Va inoltre notato che la scalabilità e la dipendenza dai pazienti sottoposti a chirurgia sostitutiva dell'articolazione sono due dei difetti del modello.
E' noto che la cartilagine articolare presenta un comportamento peculiare a seconda del livello di scala che viene testato. Come indicato da Loparic et al., alla microscala, la cartilagine si comporta come un materiale non strutturato e uniforme35, e tale approccio fornisce un'approssimazione della rigidità complessiva della cartilagine localizzata. Per quanto riguarda il fatto che le micro- o nano-indentazioni siano più adatte, uno studio del 2004 di Stolz et al.44 ha confrontato sia le rientranze su micro che nano-scala nella valutazione delle proprietà struttura-meccaniche della cartilagine articolare. Gli autori hanno sottolineato che per l'indentazione sferica su microscala della cartilagine articolare, i componenti strutturali fini su scala nanometrica (cioè singole fibre di collagene e proteoglicani) condividono comunemente il compito di portare. In questo modo, le proprietà meccaniche dell'aggregato differiscono notevolmente da quelle dei singoli nanocomponenti. Gli stessi autori hanno proposto che una combinazione di micro- e nano-indentazioni potrebbe essere utilizzata per valutare i profili di rigidità locale complessivi della cartilagine articolare, nonché la rigidezza correlata ai componenti strutturali fini44.
Numerosi esperimenti di indentazione basati su AFM hanno utilizzato punte a sbalzo piramidali affilate (raggio = 15-20 nm)22,36,44 per valutare la meccanica della cartilagine. Sebbene le nanoindentazioni con cantilever affilati siano attualmente considerate più adatte per valutare le migliori proprietà meccaniche, le punte a sbalzo sferiche producono risultati più coerenti e più facili da modellare e interpretare quando si testano campioni biologici morbidi44,45. Inoltre, Stolz et al. hanno dimostrato che le nano-indentazioni AFM della cartilagine articolare degradata enzimaticamente (cioè elastasi) non sono possibili perché il tessuto diventa così appiccicoso che l'adesione punta-campione domina le curve forza-distanza, rendendo i dati non fattibili44.
Nelle attuali misurazioni AFM, è stato utilizzato un cantilever con una punta a sbalzo sferica di 5 μm di raggio. La scelta del cantilever è stata motivata dall'intenzione di mediare le proprietà meccaniche del tessuto su una superficie abbastanza ampia, riducendo al minimo il danno inflitto alla superficie della cartilagine. La relazione tra la forza applicata a sbalzo e l'indentazione del campione risultante è stata adattata con il modello di adattamento di Hertz. Quando si utilizzano penetratori sferici, si consiglia il modello di adattamento Hertz, trascurando le forze attrattive che agiscono tra la punta a sbalzo e la superficie del campione46. Le equazioni per il modello hertziano sono mostrate nelle Eq.1 ed Eq.2.
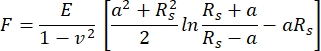 Eq.1
Eq.1
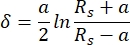 Eq.2
Eq.2
Dove F = forza; E = modulo di Young; v = Rapporto di Poisson; δ = indentazione; a = raggio del cerchio di contatto; e Rs = raggio della sfera.
Il modello calcola l'elasticità cellulare/tissutale47, formalmente espressa come modulo di Young (E). Il modello di adattamento Hertz prende in considerazione diverse caratteristiche come la forma e le dimensioni della punta, la rientranza e la deformabilità del campione. Se questi requisiti non sono idealmente soddisfatti, il modello può fornire una stima imprecisa del modulodi Young 46.
Il modello di adattamento di Hertz presuppone che la deformazione e la sollecitazione elastica dipendano linearmente dal modulo elastico, il che implica che l'indentazione nel campione rimane molto più piccola dello spessore del campione stesso46. Questa ipotesi è stata facilmente soddisfatta in questa configurazione, dove gli espianti di cartilagine avevano uno spessore di 1 mm rispetto a rientranze di pochi micrometri.
La cartilagine articolare può essere modellata come un materiale viscoelastico poroso48,49. Il comportamento viscoelastico deriva dall'attrito tra i costituenti intracellulari/citoplasmatici o di matrice come molecole, organelli e la rete collagene-proteoglicani50,51. Come suggerisce il nome, i materiali viscoelastici combinano due proprietà distinte: viscoso, il materiale si deforma lentamente se sottoposto a un carico esterno, ed elastico, il materiale ritorna alla sua configurazione iniziale una volta rimosso il carico applicato52,53. Il comportamento viscoelastico si manifesta come un'isteresi tra le curve di avvicinamento (estese) e di retrazione nelle curve forza-distanza 46,52, simili a quelle ottenute in questo studio (Figura 4C). Inoltre, una caratteristica dei materiali viscoelastici è che le loro proprietà meccaniche dipendono dalla velocità di deformazione, con la rigidità del materiale che aumenta con la velocità con cui viene applicato il carico (velocità di indentazione)54. Pertanto, selezionando diverse velocità di carico, viene generata una famiglia di curve forza-distanza, ognuna delle quali rappresenta le proprietà meccaniche del campione testato ad ogni velocità di carico52. Quindi, quando si tenta di confrontare i risultati di vari lavori, è fondamentale prendere in considerazione tutti i parametri di indentazione. Nel complesso, quando si misura su scala micrometrica (come in questo studio con una punta a sbalzo sferica da 5 μm), la cartilagine articolare si comporta come un materiale non strutturato e uniforme, generando un modulo elastico cumulativo che include contributi sia elastici che viscosi alla rigidità dovuta alla natura poroviscoelastica del tessuto35.
Un'altra ipotesi del modello hertziano è che la profondità di indentazione sia inferiore al raggio della punta sferica a sbalzo55. La profondità di indentazione rappresenta lo spostamento massimo della punta a sbalzo dopo il primo contatto con il campione. Al carico massimo, la profondità massima di indentazione è lo spostamento complessivo del campione e della punta a sbalzo. La linea guida di Bueckle afferma una profondità massima di indentazione del 10% dello spessore complessivo di un campione con la stessa struttura per56, altrimenti i risultati variano in base al rapporto profondità-spessore. Per un raggio della punta a sbalzo di 5 μm, gli espianti di cartilagine in questo studio sono stati indentati in media a 1,1 μm, con alcuni picchi di 3 μm in alcuni casi, in particolare per gli espianti di cartilagine altamente degenerati. In questo caso, si è cercato un compromesso, poiché, nell'ambito sperimentale, sono necessarie forze relativamente elevate associate a grandi rientranze per neutralizzare le irregolarità superficiali della cartilagine degenerata. Un'indentazione più lieve comporterebbe l'esame della fibrillazione superficiale e della fessurazione del collagene, entrambe caratteristiche comuni della cartilagine altamente degenerata57.
Fondamentale per il modello Hertz fit è anche la corretta identificazione del punto in cui la punta a sbalzo entra in contatto diretto con il campione, genericamente chiamato punto di contatto. Tuttavia, questo potrebbe rivelarsi problematico quando si indentano campioni troppo appiccicosi o troppo morbidi, in quanto potrebbe causare più punti di contatto sonda-campione58,59. Infatti, come ben sottolineato da A-Hassan et al., per i tessuti biologici molli, la determinazione accurata del punto di contatto è uno dei problemi più fastidiosi60. Questo effetto è stato osservato anche negli espianti di cartilagine osteoartritica nativa, in quanto, a seconda dello stadio di degenerazione, la superficie del tessuto perde le sue caratteristiche meccaniche native ed è spesso irregolare, presentando fibrillazione superficiale e schisi (Figura 3B,C). Questo fenomeno è stato osservato in particolare negli espianti di cartilagine in cui il pattern cellulare dominante era costituito da grandi ammassi (Figura 2C). Queste disomogeneità nella superficie della cartilagine potrebbero portare a più punti di contatto sonda-campione e, quindi, a risultati errati. In alcuni casi sono state osservate ampie deflessioni, seguite da un rapido recupero della linea di base prima del tratto finale della curva forza-distanza (Figura 5A). Ciò potrebbe essere attribuito a un grande ostacolo nel percorso della punta a sbalzo (ad esempio, aree di fibrillazione avanzata con cartilagine sfilacciata e spaccata). In altri casi, la pendenza finale della curva forza-distanza era disseminata di irregolarità più piccole (Figura 5B), indicando il contatto con ostacoli successivamente più piccoli (ad esempio, micro-fibrillazione del tessuto). In questi casi, il sito di misurazione deve essere rimisurato o addirittura modificato per garantire l'affidabilità e la riproducibilità dei dati. A tal fine, è anche importante ispezionare attentamente l'uscita della curva forza-distanza dell'AFM per la corretta identificazione del punto di contatto. Questo è un punto cruciale di cui essere consapevoli, poiché è stato dimostrato che un'errata identificazione del punto di contatto di 50 nm si traduce in una stima errata del valore di E di un ordine di grandezza61. Diversi studi hanno iniziato a utilizzare approcci automatizzati per determinare il punto di contatto delle curve forza-distanza, con l'obiettivo di bypassare l'input soggettivo dell'utente durante la stima del punto di contatto mediante ispezione visiva e migliorare la precisione. Ciò diventa ancora più cruciale quando si ha a che fare con un gran numero di curve forza-spostamento, come quelle generate nelle misurazioni della meccanica cellulare 47,62. Sebbene siano state proposte diverse strategie per automatizzare la determinazione del punto di contatto 47,63,64,65, la strategia ottimale dipende fortemente dalle condizioni sperimentali e da fattori quali il modello utilizzato per analizzare i dati, la forma della sonda, l'interazione meccanica (non) adesiva tra la punta a sbalzo e il campione, nonché il comportamento (non) hertziano del campione 63.
La deriva del campione è un altro problema comune che può causare artefatti e una determinazione errata del punto di contatto (Figura 3E). Fondamentalmente significa che il campione non è montato correttamente nel portacampioni (capsula di Petri) e il campione si muove durante le misurazioni AFM. L'effetto è particolarmente pronunciato quando si sposta il cantilever AFM in un nuovo sito di misurazione. Questo aspetto può essere facilmente osservato durante le misurazioni effettive da un improvviso cambiamento del piano focale. Le curve forza-distanza risultanti hanno tipicamente una pendenza bifasica estesa, con un lieve aumento all'inizio, corrispondente al restringimento dello spazio vuoto tra il fondo del disco e la capsula di Petri quando il disco viene spinto verso il basso dal cantilever (vedi Figura 3E), seguito da un'inclinazione più decisa nella seconda sezione del pendio. indicando che il disco è ulteriormente indentato, ora che è a diretto contatto con il fondo della capsula di Petri (Figura 5C,D). Per superare le distorsioni, si può cercare di fissare meglio i campioni utilizzando un adesivo adeguato (Figura 3D), mantenendo costante la temperatura spegnendo le fonti esterne di calore (luci) per evitare la deriva termica ed eseguendo misure di scansione rapida. Negli esperimenti qui riportati, abbiamo osservato una deriva di deflessione del cantilever che si è verificata entro i primi 15 minuti di immersione del cantilever nel mezzo (a causa di improvvisi cambiamenti di temperatura). Dopo questo lasso di tempo, la deriva è solitamente trascurabile. Di conseguenza, consigliamo allo sperimentatore di esaminare attentamente la linea di base dopo l'immersione a sbalzo e di iniziare a misurare una volta che si è stabilizzata. La durata di questo processo può variare notevolmente a seconda del cantilever utilizzato.
Un altro parametro critico per qualsiasi misurazione AFM è il set point, che è, semplicisticamente, una misura della forza applicata dal cantilever al campione. Per la modalità di contatto (come quella utilizzata in questo studio), il set point rappresenta una certa deflessione del cantilever. Quando si eseguono diverse scansioni o più ripetizioni del sito, come nel protocollo qui, la punta a sbalzo può assorbire particelle dalla superficie del campione, rendendo così talvolta necessario rimuovere il cantilever, pulirlo adeguatamente66 e quindi ricalibrare prima di procedere con le misurazioni.
Mentre le micro-indentazioni AFM forniscono nuove e interessanti opportunità di raccolta dati, in particolare nel contesto della cartilagine osteoartritica, la coerenza e la riproducibilità dei dati prodotti dipendono fortemente da diversi parametri, come descritto sopra. Quando si utilizza questo approccio per valutare i cambiamenti meccanici causati dalla degenerazione del tessuto cartilagineo, è necessario prima eseguire alcune misurazioni pilota su vari modelli spaziali al fine di estendere i risultati allo specifico disegno sperimentale. Le misurazioni AFM pilota devono essere eseguite con la procedura più standardizzabile prelevando un numero sufficiente di campioni (ad esempio, cinque dischi) dello stesso modello per fornire un'indicazione dell'entità della variabilità dei dati. Ciò è particolarmente importante quando si tenta di quantificare e valutare le prime variazioni rilevanti della rigidezza OA (ad esempio, tra corde singole e doppie stringhe, Figura 4A). Infatti, in uno studio precedente, utilizzando un approccio simile, abbiamo dimostrato che era necessaria una dimensione del campione di 30 campioni umani per valutare i cambiamenti biomeccanici nella matrice in funzione dell'organizzazione spaziale delle cellule37.
Inoltre, molti dei passaggi presentati in questo protocollo sono suscettibili di errore umano e dipendono fortemente dall'esperienza dell'operatore. Dati tutti i fattori che possono influenzare i risultati effettivi di AFM, i valori assoluti di E riportati in questo studio non sono generalizzabili e sono piuttosto specifici per questa configurazione sperimentale. Tuttavia, la relazione qui presentata tra i vari moduli di Young e gli espianti di cartilagine basati sul pattern cellulare (più patologico è il pattern spaziale, più basso è il modulo elastico [EM] della cartilagine) non è influenzata, poiché i risultati sono coerenti con studi precedenti che mostrano cambiamenti di rigidità in funzione dell'organizzazione del pattern cellulare23,37.
Nel complesso, questo protocollo passo-passo dimostra la funzionalità degli espianti di cartilagine articolare nativa 3D standardizzati, che non solo sono rappresentativi degli eventi di riorganizzazione cellulare guidati dall'OA che vanno dall'insorgenza alla progressione avanzata, ma sono anche associati a una graduale diminuzione della rigidità. Gli espianti possono riflettere un modello biomimetico affidabile per lo studio dell'insorgenza e della progressione dell'OA, consentendo la sperimentazione e lo sviluppo di diverse modalità di trattamento ex vivo. L'uso di un tale modello di espianto umano in combinazione con la valutazione biomeccanica basata su AFM potrebbe portare a un cambiamento di paradigma per la ricerca biomedica e l'industria farmaceutica, aprendo la strada a nuovi modi per identificare farmaci OA efficaci molto necessari.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo i chirurghi ortopedici del Dipartimento di Chirurgia Ortopedica dell'Ospedale Universitario di Tubinga per aver fornito i campioni di tessuto.
Materiali
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Darmstadt, Germany | 1397-89-3 | |
| Atomic force microscop (AFM) head | CellHesion 200, Bruker Nano GmbH, Berlin, Germany | JPK00518 | |
| Biocompatible sample glue | Bruker Nano GmbH, Berlin, Germany | H000033 | |
| Calcein AM | Cayman, Ann Arbor, Michigan, USA | 14948 | Cell membrane permeable stain, used for cartilage disc sorting- top view imaging |
| Cantilever | Bruker Nano GmbH, Berlin, Germany | SAA-SPH-5UM | Frequency Nom: 30KHz, k: 0.2N/m, lenght nom: 115μm, width nom: 40μm, geometry: rectangular, cylindrical tip with a 5μm end radius |
| Cartilage ctting device | Self-made | n/a | Cutting plastic device containing predefined wholes of 4mmx1mm |
| CDD camera integrated in the AFM | The Imaging Source Europe GmbH, Bremen, Germany | DFK 31BF03 | |
| CDD camera integrated in the fluorescence microscope | Leica Biosystems, Wetzlar, Germany | DFC3000G | |
| Cryotome | Leica Biosystems, Wetzlar, Germany | CM3050S | |
| Data Processing Software for the AFM | Bruker Nano GmbH, Berlin, Germany | n/a | Version 5.0.86, can be downloaded for free from the following website https://customers.jpk.com |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Darmstadt, Germany | 41966052 | |
| Fluorescence Microscope (Leica DMi8) | Leica Biosystems, Wetzlar, Germany | 11889113 | |
| Glass block cantiliver holder | Bruker Nano GmbH, Berlin, Germany | SP-90-05 | Extra long glass block with angled faces, designed especially for the use with the JPK PetriDishHeaterTM (Bruker). |
| Inverted phase contrast microscope (integrated in the AFM) | AxioObserver D1, Carl Zeiss Microscopy, Jena, Germany | L201306_03 | |
| Leibovitz's L-15 medium without L-glutamine | Merck KGaA, Darmstadt, Germany | F1315 | |
| Microscope glass slides | Sigma-Aldrich, St. Louis, Missouri, USA | CLS294775X50 | |
| Mounting medium With DAPI | ibidi GmbH, Gräfelfing, Germany | 50011 | Mounting media with nuclear DAPI (4′,6-diamidino-2-phenylindole) counterstaining used for cartilage discs side view imaging |
| Penicillin-Streptomycin | Sigma-Aldrich, St. Louis, Missouri, USA | P4333 | |
| Petri dish heater associated with AFM (Petri Dish Heater) | Bruker Nano GmbH, Berlin, Germany | T-05-0117 | |
| Scalpel | Feather Medical Products, Osaka, Japan | 2023-01 | |
| Silicone Skirt | Bruker Nano GmbH, Berlin, Germany | n/a | Protective silicone membrane (D55x0.25) which is placed on the basis of the base of the glas block to prevent medium condensation in the AFM head. |
| Statistical program - SPSS | IBM, Armonk, New York, USA | SPSS Statistics 22 | Vesion 280.0.0.0 (190) |
| Tissue culture dishes | TPP Techno Plastic Products AG, Trasadingen, Switzerland | TPP93040 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Alphen aan den Rijn, Netherlands | SA6255012 | Water-soluble embedding medium |
Riferimenti
- Allison, D. P., Mortensen, N. P., Sullivan, C. J., Doktycz, M. J. Atomic force microscopy of biological samples. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 2 (6), 618-634 (2010).
- Deng, X., et al. Application of atomic force microscopy in cancer research. Journal of Nanobiotechnology. 16 (1), 102 (2018).
- Radmacher, M. Studying the mechanics of cellular processes by atomic force microscopy. Methods in Cell Biology. 83, 347-372 (2007).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysical Journal. 82 (6), 2970-2981 (2002).
- Rabinovich, Y., et al. Atomic force microscopy measurement of the elastic properties of the kidney epithelial cells. Journal of Colloid and Interface Science. 285 (1), 125-135 (2005).
- Dufrêne, Y. F. Using nanotechniques to explore microbial surfaces. Nature Reviews Microbiology. 2 (6), 451-460 (2004).
- Cykowska, A., Danalache, M., Bonnaire, F. C., Feierabend, M., Hofmann, U. K. Detecting early osteoarthritis through changes in biomechanical properties - A review of recent advances in indentation technologies in a clinical arthroscopic setup. Journal of Biomechanics. 132, 110955 (2022).
- Gavara, N. A beginner's guide to atomic force microscopy probing for cell mechanics. Microscopy Research and Technique. 80 (1), 75-84 (2017).
- Fuchs, J., Kuhnert, R., Scheidt-Nave, C. 12-Monats-Prävalenz von Arthrose in Deutschland. Journal of Health Monitoring. 2, 55-60 (2017).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Ganz, R., Leunig, M., Leunig-Ganz, K., Harris, W. H. The etiology of osteoarthritis of the hip. Clinical Orthopaedics and Related Research. 466 (2), 264-272 (2008).
- Saxby, D. J., Lloyd, D. G. Osteoarthritis year in review 2016: Mechanics. Osteoarthritis and Cartilage. 25 (2), 190-198 (2017).
- Buckwalter, J. A., Mankin, H. J. Articular cartilage: Degeneration and osteoarthritis, repair, regeneration, and transplantation. Instructional Course Lectures. 47, 487-504 (1998).
- Braun, H. J., Gold, G. E. Diagnosis of osteoarthritis: Imaging. Bone. 51 (2), 278-288 (2012).
- Guermazi, A., Roemer, F. W., Burstein, D., Hayashi, D. Why radiography should no longer be considered a surrogate outcome measure for longitudinal assessment of cartilage in knee osteoarthritis. Arthritis Research & Therapy. 13 (6), 247 (2011).
- Guermazi, A., et al. Different thresholds for detecting osteophytes and joint space narrowing exist between the site investigators and the centralized reader in a multicenter knee osteoarthritis study--Data from the Osteoarthritis Initiative. Skeletal Radiology. 41 (2), 179-186 (2012).
- Bedson, J., Croft, P. R. The discordance between clinical and radiographic knee osteoarthritis: A systematic search and summary of the literature. BMC Musculoskeletal Disorders. 9 (1), 116 (2008).
- Dashefsky, J. H. Arthroscopic measurement of chondromalacia of patella cartilage using a microminiature pressure transducer. Arthroscopy. 3 (2), 80-85 (1987).
- Berkenblit, S. I., Frank, E. H., Salant, E. P., Grodzinsky, A. J. Nondestructive detection of cartilage degeneration using electromechanical surface spectroscopy. Journal of Biomechanical Engineering. 116 (4), 384-392 (1994).
- Appleyard, R. C., Swain, M. V., Khanna, S., Murrell, G. A. The accuracy and reliability of a novel handheld dynamic indentation probe for analysing articular cartilage. Physics in Medicine and Biology. 46 (2), 541-550 (2001).
- Hsieh, C. H., et al. Surface ultrastructure and mechanical property of human chondrocyte revealed by atomic force microscopy. Osteoarthritis and Cartilage. 16 (4), 480-488 (2008).
- Stolz, M., et al. Early detection of aging cartilage and osteoarthritis in mice and patient samples using atomic force microscopy. Nature Nanotechnology. 4 (3), 186-192 (2009).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Tschaikowsky, M., et al. Hybrid fluorescence-AFM explores articular surface degeneration in early osteoarthritis across length scales. Acta Biomaterialia. 126, 315-325 (2021).
- Eaton, P., Batziou, K., Santos, N. C., Carvalho, F. A. Artifacts and Practical Issues in Atomic Force Microscopy. Atomic Force Microscopy: Methods and Protocols. , 3-28 (2019).
- Danalache, M., et al. Exploration of changes in spatial chondrocyte organisation in human osteoarthritic cartilage by means of 3D imaging. Scientific Reports. 11, 9783 (2021).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organisation in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research. 38 (10), 2170-2180 (2020).
- Danalache, M., Tiwari, A., Sigwart, V., Hofmann, U. K. Application of atomic force microscopy to detect early osteoarthritis. Journal of Visualized Experiments. (159), e61041 (2020).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Wilusz, R. E., DeFrate, L. E., Guilak, F. Immunofluorescence-guided atomic force microscopy to measure the micromechanical properties of the pericellular matrix of porcine articular cartilage. Journal of The Royal Society Interface. 9 (76), 2997-3007 (2012).
- Guilak, F., Ratcliffe, A., Lane, N., Rosenwasser, M. P., Mow, V. C. Mechanical and biochemical changes in the superficial zone of articular cartilage in canine experimental osteoarthritis. Journal of Orthopaedic Research. 12 (4), 474-484 (1994).
- Billinghurst, R. C., et al. Enhanced cleavage of type II collagen by collagenases in osteoarthritic articular cartilage. The Journal of Clinical Investigation. 99 (7), 1534-1545 (1997).
- Wu, P. J., et al. Detection of proteoglycan loss from articular cartilage using Brillouin microscopy, with applications to osteoarthritis. Biomedical Optics Express. 10 (5), 2457-2466 (2019).
- Loparic, M., et al. Micro- and nanomechanical analysis of articular cartilage by indentation-type atomic force microscopy: Validation with a gel-microfiber composite. Biophysical Journal. 98 (11), 2731-2740 (2010).
- Moshtagh, P. R., Pouran, B., Weinans, H., Zadpoor, A. The elastic modulus of articular cartilage at nano-scale and micro-scale measured using indentation type atomic force microscopy. Osteoarthritis and Cartilage. 22, 359-360 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 19, 109409 (2019).
- Houtman, E., et al. Human osteochondral explants: Reliable biomimetic models to investigate disease mechanisms and develop personalized treatments for osteoarthritis. Rheumatology and Therapy. 8 (1), 499-515 (2021).
- Anderson, J. R., Phelan, M. M., Foddy, L., Clegg, P. D., Peffers, M. J. Ex vivo equine cartilage explant osteoarthritis model: A metabolomics and proteomics study. Journal of Proteome Research. 19 (9), 3652-3667 (2020).
- Chen, C. T., Torzilli, P. A., Olson, S. A., Gauilak, F. In vitro cartilage explant injury models. Post-Traumatic Arthritis: Pathogenesis, Diagnosis and Management. , 29-40 (2015).
- Thudium, C. S., Engstrom, A., Groen, S. S., Karsdal, M. A., Bay-Jensen, A. -. C. An ex vivo tissue culture model of cartilage remodeling in bovine knee explants. Journal of Visualized Experiments. (153), e59467 (2019).
- Rolauffs, B., Williams, J., Grodzinsky, A., E Kuettner, K., Cole, A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Deveza, L. A., Loeser, R. F. Is osteoarthritis one disease or a collection of many. Rheumatology. 57, 34-42 (2018).
- Stolz, M., et al. Dynamic elastic modulus of porcine articular cartilage determined at two different levels of tissue organization by indentation-type atomic force microscopy. Biophysical Journal. 86 (5), 3269-3283 (2004).
- Sicard, D., Fredenburgh, L. E., Tschumperlin, D. J. Measured pulmonary arterial tissue stiffness is highly sensitive to AFM indenter dimensions. Journal of the Mechanical Behavior of Biomedical Materials. 74, 118-127 (2017).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. 1 (1), 41-57 (2019).
- Gavara, N. Combined strategies for optimal detection of the contact point in AFM force-indentation curves obtained on thin samples and adherent cells. Scientific Reports. 6, 21267 (2016).
- Mow, V. C., Kuei, S. C., Lai, W. M., Armstrong, C. G. Biphasic creep and stress relaxation of articular cartilage in compression? Theory and experiments. Journal of Biomechanical Engineering. 102 (1), 73-84 (1980).
- Armstrong, C. G., Lai, W. M., Mow, V. C. An analysis of the unconfined compression of articular cartilage. Journal of Biomechanical Engineering. 106 (2), 165-173 (1984).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5 (8), 636-640 (2006).
- Fischer-Friedrich, E., et al. Rheology of the active cell cortex in mitosis. Biophysical Journal. 111 (3), 589-600 (2016).
- Gould, T. E., Jesunathadas, M., Nazarenko, S., Piland, S. G., Subic, A. Chapter 6 - Mouth Protection in Sports. Materials in Sports Equipment (Second Edition). , 199-231 (2019).
- Kontomaris, S. V., Malamou, A. Hertz model or Oliver & Pharr analysis? Tutorial regarding AFM nanoindentation experiments on biological samples. Materials Research Express. 7 (3), 033001 (2020).
- Guz, N., Dokukin, M., Kalaparthi, V., Sokolov, I. If cell mechanics can be described by elastic modulus: study of different models and probes used in indentation experiments. Biophysical Journal. 107 (3), 564-575 (2014).
- Wu, C. -. E., Lin, K. -. H., Juang, J. -. Y. Hertzian load-displacement relation holds for spherical indentation on soft elastic solids undergoing large deformations. Tribology International. 97, 71-76 (2016).
- Westbrook, J. H., Conrad, H. . The Science of Hardness Testing and its Research Applications. , (1973).
- Pritzker, K. P. H., et al. Osteoarthritis cartilage histopathology: Grading and staging. Osteoarthritis and Cartilage. 14 (1), 13-29 (2006).
- Stylianou, A., Kontomaris, S. V., Grant, C., Alexandratou, E. Atomic force microscopy on biological materials related to pathological conditions. Scanning. 2019, 8452851 (2019).
- Sokolov, I. Atomic force microscopy in cancer cell research. Cancer Nanotechnology. 1, 1-17 (2007).
- Emad, A., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74 (3), 1564-1578 (1998).
- Crick, S. L., Yin, F. C. Assessing micromechanical properties of cells with atomic force microscopy: Importance of the contact point. Biomechanics and Modeling in Mechanobiology. 6 (3), 199-210 (2007).
- Shoelson, B., Dimitriadis, E. K., Cai, H., Kachar, B., Chadwick, R. S. Evidence and implications of inhomogeneity in tectorial membrane elasticity. Biophysical Journal. 87 (4), 2768-2777 (2004).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis--I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2007).
- Rudoy, D., Yuen, S. G., Howe, R. D., Wolfe, P. J. Bayesian change-point analysis for atomic force microscopy and soft material indentation. Journal of the Royal Statistical Society: Series C (Applied Statistics). 59 (4), 573-593 (2010).
- Benítez, R., Moreno-Flores, S., Bolós, V. J., Toca-Herrera, J. L. A new automatic contact point detection algorithm for AFM force curves. Microscopy Research and Technique. 76 (8), 870-876 (2013).
- Timashev, P. S., et al. Cleaning of cantilevers for atomic force microscopy in supercritical carbon dioxide. Russian Journal of Physical Chemistry B. 8 (8), 1081-1086 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.