Method Article
基于原子力显微镜的人关节软骨外植体微压痕研究的实际问题
摘要
我们提出了一种循序渐进的方法来识别和解决与原子力显微镜微压痕相关的最常见问题。我们举例说明了以不同程度的骨关节炎驱动的变性为特征的天然人类关节软骨外植体的新问题。
摘要
毫无疑问,原子力显微镜(AFM)是目前评估生物领域微观甚至纳米线索的最强大和最有用的技术之一。然而,与任何其他微观方法一样,可能会出现方法学挑战。特别是,样品的特性、样品制备、仪器类型和压痕探头都可能导致不必要的伪影。在该协议中,我们举例说明了健康和骨关节炎关节软骨外植体的这些新问题。为此,我们首先通过分步方法展示如何 通过 整个组织外植体的大型 2D 镶嵌荧光成像,根据变性的不同阶段生成、分级和视觉分类离 体 关节软骨盘。 离体 模型的主要优势在于它由老化的、天然的、人类软骨组成,可以研究骨关节炎从早发到进展的相关变化。此外,还介绍了组织制备中的常见陷阱,以及实际的AFM程序以及随后的数据分析。我们展示了样品制备和处理、高级退化引起的形貌样品特性以及样品-尖端相互作用等基本但关键的步骤如何影响数据采集。我们还仔细研究了AFM中最常见的问题,并在可能的情况下描述了如何克服这些问题。了解这些局限性对于正确的数据采集、解释以及最终将研究结果嵌入到广泛的科学背景中至关重要。
引言
由于电子设备和系统的尺寸不断缩小,微纳基技术和装备的快速发展势头强劲。其中一种设备是原子力显微镜 (AFM),它可以扫描生物表面并在纳米和微米尺度上检索地形或生物力学信息1,2。在其广泛的功能中,该工具可以作为微压头和纳米压头操作,以获取有关各种生物系统的机械性能的信息3,4,5,6。数据是通过机械探针与表面的物理接触来收集的,机械探针的尖端可以小至约 1 nm7。然后根据悬臂尖端的压痕深度和施加在样品上的力8 显示样品的变形。
骨关节炎(OA)是一种长期退行性慢性疾病,其特征是关节和周围组织中的关节软骨恶化,这可能导致骨表面完全暴露。OA的负担是沉重的;目前,65岁及以上的女性中有一半和男性中有三分之一患有OA9。创伤、肥胖和由此导致的关节10 生物力学改变决定了关节软骨退化,这被视为常见的最终结果。Ganz 等人的开创性研究认为,OA 过程的早期步骤可能涉及软骨的生物力学特性11,从那时起,研究人员证实了这一假设12。同样,人们普遍认为,组织的生物力学特性在功能上是由超微结构组织以及细胞-细胞和细胞-基质串扰协调的。任何改变都会极大地影响整体组织的生物力学功能13。迄今为止,OA 诊断是临床诊断,并且基于平片 X 线照相14。这种方法是双面的:首先,缺乏明确的退行性临界阈值来制定 OA 的诊断,使得病情难以量化,其次,成像方法缺乏敏感性和标准化,无法检测局部软骨损伤15,16,17。为此,软骨机械性能的评估具有决定性的优势,即它描述了在OA过程中变化的参数,无论疾病的病因如何,并且在非常早期的阶段对组织功能有直接影响。压痕仪器测量组织抵抗压痕的力。事实上,这并不是一个新概念;最早的研究可以追溯到 1980 年代和 1990 年代。在此期间,大量研究表明,设计用于关节软骨关节镜测量的压痕仪器可能非常适合检测软骨的退行性变化。甚至在 30 年前,一些研究就能够证明压痕仪器能够通过在关节镜检查期间进行压缩刚度测量来检测组织变性过程中软骨表面的体内变化18,19,20。
关节软骨的 AFM 压痕 (AFM-IT) 提供有关组织的关键机械特性(即刚度)的信息。这是一个机械参数,描述了施加的无损载荷与缩进组织区域21的变形之间的关系。AFM-IT 已被证明能够量化宏观上未受影响的胶原网络中僵硬的年龄依赖性变化,从而区分与 OA 发病相关的病理变化(关节软骨外桥量表 0 级)22。我们之前已经证明,AFM-ITs基于空间软骨细胞组织作为早期软骨退行性变的基于图像的生物标志物,不仅可以量化,而且可以实际确定最早的退行性机械变化。这些发现已经得到其他人的证实 23,24.因此,AFM-IT是诊断和识别早期退行性变化的有趣工具。这些变化已经可以在细胞水平上测量,重塑对OA病理生理过程的理解。
在该协议中,我们展示了关节软骨外植体的完整组织学和生物力学分级程序,从天然软骨外植体制备到 AFM 数据采集和处理。通过循序渐进的方法,我们展示了如何通过二维大马赛克成像,然后进行微AFM压痕,根据变性的不同阶段对关节软骨组织进行生成、分级和视觉分类。
尽管目前,AFM-IT 是测量软骨生物力学变化的最灵敏的工具之一7,但与任何其他仪器技术一样,它具有局限性和实际特性25,可能导致错误的数据采集。为此,我们仔细研究了软骨外植体AFM测量过程中出现的最常见问题,并在可能的情况下描述了如何最大限度地减少或克服这些问题。这些因素包括样品的形貌方面和在与AFM兼容的环境中稳定它们的困难,组织表面的物理特性,以及在这些表面上进行AFM测量的困难。还给出了错误的力-距离曲线的示例,强调了可能导致它们的条件。还讨论了悬臂尖端几何形状固有的其他限制以及使用赫兹模型进行数据分析。
研究方案
使用从德国图宾根大学医院接受全膝关节置换术的患者身上采集的股骨髁。本研究仅包括来自退行性和创伤后关节病变患者的关节软骨样本。在研究开始之前,已获得部门、机构和地方伦理委员会的批准(项目编号:674/2016BO2)。在参与之前,已收到所有患者的书面知情同意书。
注:图1中给出了按时间顺序排列的实验步骤的流程 图。
1. 软骨盘的组织处理和生成
- 组织准备
- 术后切除后,将软骨样本放入装有补充有 5% (v/v) 青霉素 - 链霉素的 Dulbecco 改良 Eagle 培养基 (DMEM) 的容器中。确保样品完全浸没在培养基中。手术切除和软骨进一步处理之间的持续时间不应超过24小时。确保在整个处理过程中,样品完全浸没在介质中,以避免样品干燥。
- 用手术刀将软骨从骨头上切开。
- 软骨椎间盘生成
- 使用活检打孔器生成直径为 4 毫米的软骨盘。
注意:选择和切除软骨层厚度超过 1 毫米的髁突区域很重要。这可能是有问题的,尤其是在承重区周围,软骨层通常会因磨损过程或退化而失去厚度。 - 将先前生成的 4 毫米软骨盘放在定制的切割装置上,并用刮刀固定并保持软骨盘稳定。将软骨盘放在切割装置上时,必须小心。放置样品,使软骨的最顶层(关节软骨的浅表区域)不面向刀片
- 用剃须刀片切割软骨盘。因此,生成了 4 mm x 1 mm 的圆盘状软骨样品。为防止样品干燥,请尽快进行组织切割。
- 在刮刀的帮助下收集每个椎间盘,并将生成的软骨椎间盘放入含有1mL补充有5%(v / v)青霉素 - 链霉素的DMEM的1.5mL管中。将大约 15 个圆盘放入一个试管中。
- 使用活检打孔器生成直径为 4 毫米的软骨盘。
- 软骨盘的冷冻切片(用于垂直切片)
注意:此步骤是可选的,如果需要软骨盘内细胞模式分布的侧视图可视化,则可以使用它。它可以用作验证方法,因为细胞图案的分布是关节软骨26 的 3D 特征。也可以使用共聚焦显微镜对整个软骨盘进行光学切片和3D重建,从而消除了按照协议中描述切片样品的需要。- 用水溶性包埋介质覆盖软骨盘,并将其放在冷冻切片机旋钮的边缘(圆盘表面垂直于旋钮表面)。在冷冻切片机装置中,包埋介质在低温下冻结。
- 使用标准冷冻组,以 60 μm 的厚度横向切片组织,直到到达圆盘的中间(即,当冷冻切片达到 4 mm 的长度时)并收集切片。通过垂直切片椎间盘外植体,可以可视化软骨的所有区域(浅表、中层和深层)。
- 收集载玻片上的切片,并用磷酸盐缓冲盐水(PBS)洗涤三次,除去水溶性包埋培养基。
2. 软骨椎间盘分选作为细胞空间模式的函数
- 圆盘状软骨样本的染色
- 将一个软骨盘(第 1.2 节)放入 96 孔板的每个孔中,并向每个孔中以 1:1,000 的稀释度加入 130 μL 细胞渗透性荧光染料。
- 目视检查整个板,并确保每个孔中只放置一个圆盘。将板在37°C的标准细胞培养箱中孵育30分钟。
- 60μm软骨切片的染色
- 在镊子的帮助下,轻轻地将软骨盘切片(第1.3节)放在玻璃显微镜载玻片上。
- 用含有核DAPI复染的封固剂覆盖软骨切片,并轻轻放置适用于荧光显微镜的盖玻片。
- 用普通的透明指甲油密封每个盖玻片的边缘,并干燥3分钟。
- 自上而下和侧视图软骨分类和成像
注意:每个圆盘都必须在荧光显微镜下检查。此步骤的目的是根据光盘的主要细胞模式(单串、双串、小簇、大簇或弥散)对椎间盘进行分类。- 将96孔板放在荧光显微镜的板架上。
- 选择合适的荧光滤光片 Em 495 nm/Ex 515 nm(用于第 2.1 节中制备的软骨盘的自上而下成像)或 Em 358 nm/Ex 461 nm(用于第 2.2 节中制备的软骨切片的侧视图成像)和 10 倍物镜。
注意:使用10倍物镜可以检查圆盘的整个圆周,并且可以排除染色不均匀或不正确的样品。然而,仅使用自上而下的视图可能会导致对细胞组织变化的感知,这是由于对通过浅表侵蚀可见的更深组织层的分析而产生的。例如,跟随胶原拱廊的上升字符串可以被视为单个细胞或分散的细胞(弥散模式)26。因此,必须检查圆盘的两侧,以确保正确选择细胞模式。 - 目视确定每个软骨盘中显示的细胞模式。椎间盘不太可能只有一种类型的细胞模式。对于软骨细胞排列与目标模式不匹配的椎间盘部分,仅当不需要的图案位于未进行AFM测量的最外围(即,距椎间盘边界最多0.5毫米)时才接受样品,并确保不超过椎间盘总表面的10%27,28.
- 整个软骨椎间盘的图像采集
- 选择显微镜的 10 倍物镜,并将其放置在包含单个软骨盘的预选孔下方。将焦点放在椎间盘上以查看细胞模式。
- 选择 "导航器"功能 以获取整个油井的概览。使用鼠标左键并拖动以导航到其他舞台位置。使用鼠标滚轮放大和缩小。
注:此时,通过依次双击每个感兴趣区域,可以看到带有整个样品的孔的预览。 - 选择包含要扫描的感兴趣区域的正方形;此时,构成马赛克的所有单个图块都将变得可见。
- 调整曝光/光强度,以便可以从背景中清楚地看到细胞。此时,图片的亮度/对比度已针对所有图块进行了调整,无法再为每个图块单独自定义。
注意:由于圆盘边缘附近的细胞通常发出比中心细胞更高的荧光信号,因此必须调整曝光/光强度设置。- 要评估曝光时间是否适合特定通道,请检查直方图中信号的分布。通过使用显微镜图像软件中包含的自动曝光机制,可视化位于圆盘内的所有细胞。
- 选择软件的 "焦点映射点 "选项,然后通过左键单击每个单独的图块中心来选择它。
- 选择 选项 焦点图.将显示一个窗口,其中包含所有先前选择的磁贴。双击列表中的磁贴以显示并使其成为正确的焦点。
- 单击 "设置 Z "以保存焦点计划并继续下一个磁贴。调整每个拼贴的焦距计划后,按 开始扫描开始图像采集。
- 如果扫描显示较暗的水平和/或垂直条,这可能是由于单帧照明不当和不均匀造成的。在实际扫描之前,使用软件中包含的 "链接着色 "选项来解决此问题。
- 保存、导出和正确注释图像。
3. 软骨外植体的生物力学方法
- AFM测量的样品制备
- 通过生物相容性胶水将每个含有细胞模式(第2节)的预选软骨盘固定在培养皿中。在光盘的顶部、底部、左侧和右侧添加足够的样品胶。
- 用不含 L-谷氨酰胺的 2.5 mL Leibovitz L-15 培养基覆盖光盘。将 Leibowitz 培养基轻轻添加到样品上,以避免样品因培养基产生的波而从表面分离。
- 将样品加载到 AFM 中
- 将培养皿放置在AFM装置的样品架中,然后打开设置为37°C的培养皿加热器。 让组织培养皿达到所需温度。这样做是为了排除由温度变化引起的可能的伪影。
- 悬臂力显微镜校准
- 按照 Danalache 等人 29 之前的描述初始化软件设置。
- 选择合适的玻璃块悬臂支架进行液体测量,并小心地将其放置在 AFM 头上。锁定机构将玻璃块固定在 AFM 头中。确保玻璃块的反射表面笔直且平行于AFM支架。
- 小心地将悬臂放在玻璃块悬臂支架的表面上。悬臂本身应位于玻璃块中心的抛光光学平面上。
- 小心地将硅胶裙(硅胶膜)放在悬臂支架的底座上,以防止AFM头中出现介质冷凝。
- 使用步进电机功能以 100 μm 的步长降低悬臂,直到它完全浸没在介质中。
- 使用 Danalache 等人 29 描述的进近参数运行扫描仪进近。到达培养皿底部后,将悬臂缩回100μm。
- 使用确切的步骤校准悬臂,并运行Danalache等人描述的参数29。在校准结束时,垂直偏转被保存并以牛顿 (N) 力单位而不是伏特 (V) 显示,伏特 (V) 是光电二极管检测器的原始配准单位。在这里的实验中,校准后得到的设定点为4.47 nN。
- 使用步进电机功能,将悬臂缩回 1,000 μm。
- 在AFM下确定所需的软骨测量部位
注意:由于软骨盘的厚度为 1 毫米,因此在样品上导航时,悬臂在视野中不可见。- 使用显微镜的CCD相机识别悬臂。悬臂梁应放置在培养皿的无样品区域。
- 使用Danalache等人29描述的相同参数,在培养皿的干净,无样品区域上用悬臂开始扫描仪方法。
- 使用步进电机控制将悬臂进一步缩回距离板底部 1.5 毫米。为了避免悬臂和样品之间的直接碰撞,这一步骤至关重要。
- 从明场视图切换到荧光视图,并直观地识别光盘的顶部。
- 将 AFM 样品架向圆盘中间移动 2 毫米。这个点被认为是软骨盘的中心。
- 运行扫描仪方法,一旦到达软骨盘的表面,将悬臂缩回 100 μm。
- 力-距离曲线测量
- 将焦点放在位于所需测量部位的细胞上。单击"运行"按钮开始测量并在目标位置生成力-距离曲线。
- 在每个测量点采集五条力-距离曲线。将悬臂缩回 500 μm,然后将悬臂移动到下一个测量点。
注意:悬臂的缩回是一个关键步骤,因为软骨盘表面不均匀且不规则。样品表面的高丘会导致剧烈碰撞,导致不必要的悬臂尖端/样品损坏。我们建议选择至少五个分散在圆盘表面的不同测量点,并在每个点获取至少五个力-距离曲线。 - 检查力-距离曲线并保存它们。
- 使用赫兹拟合模型估计杨氏模量
- 在数据分析软件中,使用"打开 一批光谱 曲线"选项打开生成的要分析的力-距离曲线(.jpk 文件)。
- 选择 赫兹 拟合模型,然后选择 弹性拟合 选项。
- 弹性拟合选项会自动对选定的力-距离曲线执行以下计算:计算基线并从整个曲线中减去基线偏移(基线在 y 轴上恢复为零);通过检测力-距离曲线与零力线相交的点(接触点在x轴上设置为零)来确定接触点;计算尖端-样品分离(减去考虑悬臂弯曲的压电陶瓷的高度信号);并自动将力-距离曲线与所选模型拟合。如果需要,这些步骤中的每一个也可以独立执行。
- 使用以下拟合参数进行调整:泊松比为 0.5 和适当的悬臂尖端半径。
注意: 使用带有球形悬臂尖端的悬臂时,应使用赫兹拟合模型。本研究中使用的悬臂具有半径为 5 μm 的球形尖端。我们建议拟合力-距离曲线,直到达到最大施加力(设定值)。 - 目视检查力-距离曲线拟合以确保正确性。必须对所分析的每条力-距离曲线执行此步骤。
- 压痕深度确定
注意:根据所使用的数据分析工具,此过程可能会有所不同。实验者可以通过遵循数据分析程序中包含的一系列步骤轻松读取压痕深度。- 在数据分析软件中打开每个生成的力-距离曲线,然后选择 赫兹拟合模型 作为分析过程。
- 应用" 减去基线偏移 "选项将垂直偏转轴(y 轴)归零,然后选择 "偏移 + 倾斜 "功能。
- 使用"查找接触点"功能自动识别接触点,该 接触点 将自动设为 x 坐标为零。
- 使用 垂直尖端位置 功能从压痕期间从原始压电陶瓷高度减去仅考虑悬臂挠度的距离。
- 选择 "弹性拟合 "选项以显示已处理的力-距离曲线,并选择图形的区域,使其与 垂直尖端位置轴 (x 轴)上的最大负值对齐。
- 从参数选项卡中的"X Min"框中读取并记录缩进。保存并记录结果。
4. 统计分析
- 打开统计软件。从下拉菜单中选择 新建数据集 。
- 选择数据集文件后,打开"变量视图"选项卡。定义每个细胞模式类别的数值变量:单串 = SS、双串 = DS、小簇 = SC、大簇 = BC、扩散和杨氏模量。
- 在数据视图选项卡中,输入每个相应细胞模式类别的测量杨氏模量数据。通过从菜单栏中选择"分析",然后选择" 探索性数据分析"来分析数据分布。
- 选择 Young's Moduli 作为因变量,选择 Cellular Pattern 作为因子列表。用于结果部分的箱形图显示在输出文件中的结果中。
- 要进行统计分析,请在分析菜单栏选项卡的非参数检验部分中选择 "相关样本 "。在字段选项卡下选择 Young 's Moduli 作为 Test Fields ,将 Cellular Pattern 选择为 Groups 。 按 Run(运行)。
注意:结果显示在输出文件中。对于统计分析,执行弗里德曼检验。 - 将非参数检验的 p 值合并到步骤 4.4 中创建的箱形图中。通过单击菜单栏中的"文件"并选择 " 保存"来 保存结果。
结果
使用自制的切割装置,我们能够从新鲜的人髁突中取出并生成小(4 mm x 1 mm)软骨盘,其中包含单细胞空间模式30,包括单串(SS,图2A),双串(DS),小簇(SC),大簇(BC;图2A)和漫反射(图2B)。具有代表性的软骨外植体如图3A所示。使用自上而下的荧光成像选择仅显示一种类型图案的圆盘(图2)。软骨表面椎间盘的形貌变化通过软骨盘产生的60μm厚切片的侧视图成像进一步说明(图2C)。在外植的骨关节炎软骨盘表面,存在浅表纤维颤动和基质裂隙(图3B,C)。这在代表晚期OA进展的椎间盘中尤为明显,以BC的存在为代表(图2A)。荧光后分选后,通过AFM微压痕评估圆盘的刚度。为此,通过生物相容性胶水(图3D)成功地将生成的软骨盘固定在AFM培养皿中,以避免测量过程中的样品漂移(图3E)。必须调整胶水的使用量。胶水量不足会导致椎间盘不稳定,而添加过多的胶水可能会导致胶水在软骨椎间盘下方和/或上方不必要的扩散。后者会导致测量伪影和荧光显微镜下对圆盘的识别不良。胶水应用不当或样品在固定过程中突然移动是导致组织从培养皿上脱落的常见问题,应避免。
图4A显示了与蜂窝图案排列一起逐渐降低的具有代表性的刚度降低。含有SS(中位数为2.6 kPa)的椎间盘的刚度值较高,代表未受损的健康软骨区域。随着 OA 的发生和进展,AFM 测量显示 DS (1.5 kPa) 的刚度急剧下降 42%,SC (0.6 kPa) 的硬度下降 77%,最终以 BC (0.3 kPa;图4A)。含有漫反射图案的圆盘表现出更高的弹性,杨氏模量单一值有重要变化。对于所有具有指定主要细胞模式组织的软骨盘,发现与所采用的设定点(4.477 nN)相关的压痕深度与刚度成反比(图4B)。图4C显示了具有代表性的力-距离曲线,图4D显示了赫兹拟合以及接触点的识别。
除其他因素外,正确的拟合取决于基线的正确确定。如果自动基线检测是错误的(例如,由于基线湍流),也可以手动确定拟合,它允许用户为测量选择更具代表性的基线。但是,如果生成的力-距离曲线不允许适当的拟合,则必须将其丢弃。图 5 显示了不正确的力-距离曲线示例。一方面,由于组织的不规则表面(示例如图5A,B所示),以及由于样品固定不当导致样品的不稳定性(示例如图5C,D所示),因此很难在骨关节炎关节软骨外植体上生成合适的力-距离曲线。伪影可能是由多个探针-样品接触点(由于退化软骨表面不平整)或不需要的组织运动(通过焦平面的变化可见)引起的。这些伪影可以在生成的力-距离曲线中看到,表明悬臂梁和软骨表面之间的接触不理想,或者样品与培养皿的固定不当(见图5A-D)。

图1:实验程序流程图。按时间顺序总结实验步骤,从术中切除的软骨样本开始,到生成 4 mm x 1 mm 软骨盘,通过自上而下和侧视成像根据细胞模式组织对椎间盘进行荧光染色和分选,最后通过原子力测量进行弹性评估。请点击这里查看此图的较大版本.

图 2:代表性软骨盘的荧光成像。 (A) 马赛克 2D 图像和用细胞膜渗透性染料在 100 倍放大倍率下染色的软骨盘的放大示例区域。顶部圆盘显示具有代表性的单弦圆盘,而下方圆盘代表大簇圆盘(底部)。(B) 从表面(顶部)看到的漫反射图案圆盘的马赛克图像,以及从底部(底部)成像的同一圆盘的马赛克图像。(C) 60 μm 软骨盘切片核染色的侧视图。白色比例尺表示 500 μm 用于马赛克图片(较大的视场,A [左面板],B、C)和 100 μm 用于放大、聚焦的图片(A[右面板])。请点击这里查看此图的较大版本.
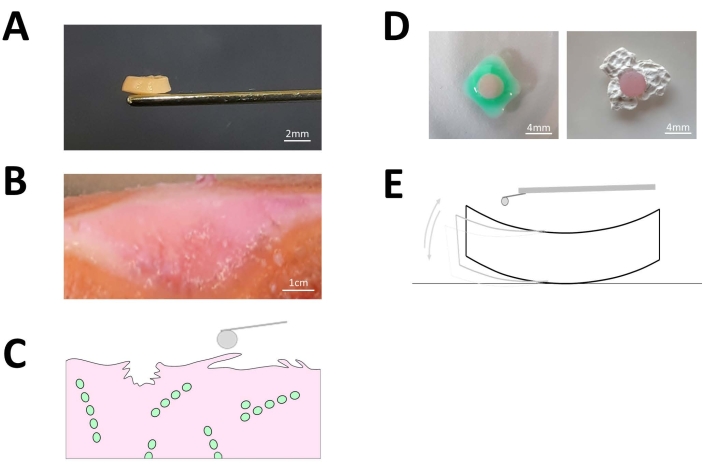
图 3:外植的关节软骨盘。 (A) 从新鲜的人类关节软骨生成的 4mm x 1mm 软骨盘外植体的代表性图像。白色描绘的比例尺代表 2 毫米。 (B) 天然骨关节炎软骨的代表性图像,其中组织表面呈现肉眼可见的浅表颤动和裂隙。白色比例尺表示 1,000 毫米。 (C) 纤化软骨表面的示意图。(D)在AFM测量之前,通过生物相容性样品胶将每个软骨盘外植体正确固定到AFM培养皿的表面,以避免在实际压痕测量过程中由于样品漂移而产生伪影,如(E)所示。白色比例尺表示 4 mm。 请点击这里查看此图的较大版本.
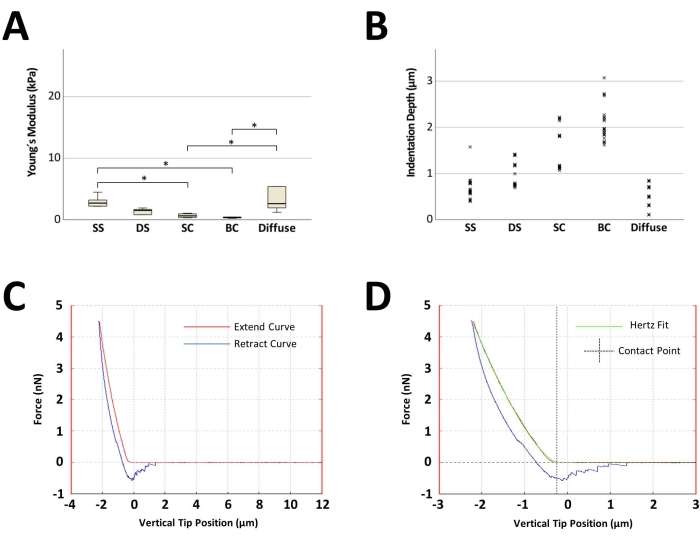
图 4:根据关节软骨盘的主要细胞模式组织进行分类的原子力显微镜测量的代表性结果。 (A) 箱线图显示计算出的五个圆盘的杨氏模量的中位数,每个圆盘对应一个细胞模式,源自一名患者。每个圆盘总共进行了 25 次测量(五个不同测量点的 5 次测量)。矩形内的黑线表示中值,矩形的下肢和上肢分别表示第一和第三四分位数,误差线表示每组的最低值和最高值。(B) 描绘每个细胞图案的 125 个压痕深度点的点图。(C) 使用AFM获得的示例力-距离曲线,计算出的杨氏模量为0.4 kPa。(D) (C) 中所示的力-距离曲线的代表性赫兹拟合点和接触点确定。x 轴显示垂直尖端位置(即压电陶瓷穿过的距离,从力-距离曲线的接触部分自动减去考虑悬臂弯曲的长度)。*p < 0.05。对于统计分析,使用Friedman检验。缩写:SS = 单弦;DS = 双弦;SC = 小簇;BC = 大集群。请点击这里查看此图的较大版本.

图 5:错误的力-距离曲线示例。 (A) 力-距离曲线显示一个巨大的偏差,然后在观察到表面的连续压痕之前恢复到接近基线水平。这种现象可归因于相对较大的障碍物(例如,从软骨最顶层突出的大表面裂隙)。(B)延伸的力-距离曲线显示多个小峰。这些曲线被认为是由软骨表面的微尺度不规则性(例如纤维性颤动)引起的。(C) 和 (D) 都显示具有双相路线的力-距离曲线。两种力-距离曲线都代表了样品固定不良和样品漂移。在这些情况下,看到焦平面的突然变化也很常见。请点击这里查看此图的较大版本.
讨论
作为一种进行性和多因素疾病,OA会引发关节软骨的结构和功能变化。在整个 OA 过程中,机械特征的损伤伴随着关节软骨表面的结构和生化变化27,31。OA中最早发生的病理事件是蛋白多糖耗竭伴胶原网络破坏32,33,34。这种早期的细微表面变化很难通过批量测试来精确定位和识别,因为机械行为是在整个组织深度上平均的。此外,一个尚未解决的问题是器官和组织水平的功能变化是否与微米或纳米尺度的结构和功能变化有关。为此,AFM 被认为是最灵敏的方法之一,能够检测 OA 发病时发生的最早生物力学变化7。它允许在天然样品中进行微米和纳米尺度的刚度测量,提供有关关节软骨机械性能的信息35,36。在该协议中,使用微AFM压痕,我们测量了健康和骨关节炎关节软骨人外植体的弹性特性。结果表明,软骨外植体高度代表了早期局部OA事件,在模式特异性软骨外植体中,硬度明显逐渐降低。此外,结果与先前发表的研究一致,该研究显示,随着细胞模式组织23,24,27,37 的刚度显着降低。
目前需要模拟OA发病机制和进展各个方面的经证实的原生人类模型来解决转化研究的不足以及将体外数据转化为临床环境的挑战。迄今为止,还没有模型能够准确表示复杂的天然人类软骨室,更不用说与年龄相关的关节组织了,这些关节组织在疾病引发刺激下容易发生OA38。迄今为止,最常用的基于外植体的模型是牛或牛来源的,并应用强炎性细胞因子治疗或机械负荷39,40,41。另一方面,该协议演示了如何生成小(4 mm x 1 mm)外植的圆盘状人软骨样本,这些样本指示特定OA事件的各个阶段。使用细胞空间组织作为基于图像的生物标志物对软骨外植体进行分类和分期30,42。由于生物力学特性的早期变化可以在双弦开始出现时立即识别和量化23,27,在软骨表面仍然看起来宏观完整的阶段 26,这种基于外植体的模型允许研究局部天然软骨隔室,并可能提供有关早期 OA 的有见地的信息。此外,该软骨模型可用于研究 3D 原生局部栖息地38,39 中细胞和基质对机械和炎症改变的反应。这些软骨外植体相对简单且易于生成,也可用于研究 OA 异质性,这是开发和测试疾病修饰 OA 药物的限制因素43。还必须注意的是,可扩展性和对接受关节置换手术的患者的依赖性是该模型的两个缺点。
众所周知,关节软骨根据测试的鳞片水平呈现出一种特殊的行为。正如 Loparic 等人所指出的,在微观尺度上,软骨表现为非结构化和均匀的材料35,并且这种方法给出了局部整体软骨刚度的近似值。关于微缩痕或纳米压痕是否更适合,Stolz 等人 2004 年的一项研究 44 比较了微米和纳米尺度压痕在评估关节软骨结构机械性能方面的效果。作者强调,对于关节软骨的微尺度球形压痕,纳米级精细结构成分(即单个胶原纤维和蛋白聚糖)通常分担承重任务。在这种情况下,聚集体的机械性能与单个纳米组分的机械性能明显不同。同一作者提出,微缩痕和纳米压痕的组合可用于评估关节软骨的整体局部刚度曲线,以及与精细结构部件相关的刚度44。
许多基于 AFM 的压痕实验使用锋利的锥体悬臂尖端(半径 = 15-20 nm)22,36,44 来评估软骨力学。尽管目前认为具有锋利悬臂的纳米压痕更适合评估最精细的机械性能,但在测试软生物样品时,球形悬臂尖端产生的结果更一致,更易于建模和解释44,45。此外,Stolz 等人证明,酶促(即弹性蛋白酶)降解的关节软骨的 AFM 纳米压痕是不可能的,因为组织变得如此粘稠,以至于尖端-样品粘附主导力-距离曲线,使数据不可行44。
在本AFM测量中,使用了具有半径为5 μm的球形悬臂尖端的悬臂。选择悬臂的动机是打算在相当大的表面上平均组织的机械性能,同时最大限度地减少对软骨表面造成的损害。悬臂施加的力与得到的样品压痕之间的关系用赫兹拟合模型拟合。使用球面压头时,建议使用赫兹拟合模型,忽略悬臂尖端和样品表面之间的吸引力46。赫兹模型的方程如方程1和方程2所示。
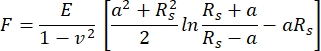 式1
式1
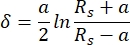 式2
式2
其中 F = 力; E = 杨氏模量; v = 泊松比;δ = 缩进; a = 接触圆半径; Rs = 球体半径。
该模型最终计算了细胞/组织弹性47,正式表示为杨氏模量 (E)。赫兹拟合模型考虑了几个特征,例如尖端形状和大小、压痕和样品变形能力。如果不能理想地满足这些要求,模型可能会提供不准确的杨氏模量46 估计值。
赫兹拟合模型假设应变和弹性应力线性取决于弹性模量,这意味着样品中的压痕仍然比样品本身的厚度小得多46。在这种设置中,这个假设很容易得到满足,其中软骨外植体的厚度为1毫米,而压痕只有几微米。
关节软骨可以建模为多孔粘弹性材料48,49。粘弹性行为是由细胞内/细胞质或基质成分(如分子、细胞器和胶原蛋白-蛋白多糖网络)之间的摩擦引起的50,51。顾名思义,粘弹性材料结合了两种不同的特性:粘性材料(材料在承受外部载荷时缓慢变形)和弹性材料(一旦施加的载荷被移除,材料就会恢复到其初始配置52,53)。粘弹性行为表现为力-距离曲线46,52 中的接近(延伸)和回缩曲线之间的滞后,类似于本研究中获得的滞后(图 4C)。此外,粘弹性材料的一个特点是其机械性能取决于变形率,材料的刚度随着施加载荷的速率(压痕速度)而增加54。因此,通过选择不同的加载速率,生成一系列力-距离曲线,每条曲线表示被测样品在每个加载速率52下的机械性能。因此,在尝试比较各种工作的结果时,考虑所有压痕参数至关重要。总体而言,当在微米尺度上测量时(如本研究使用 5 μm 球形悬臂尖端),关节软骨表现为一种非结构化且均匀的材料,产生累积弹性模量,其中包括由于组织的多孔粘弹性质而对刚度的弹性和粘性贡献35。
赫兹模型的另一个假设是压痕深度小于球形悬臂尖端55 的半径。压痕深度表示悬臂尖端在首次与样品接触后的最大位移。在最大载荷下,最大压痕深度是样品和悬臂尖端的总位移。Bueckle的指南规定,在整个56中,具有相同结构的样品的最大压痕深度为总厚度的10%,否则,结果会根据深度厚度比而变化。对于5 μm的悬臂尖端半径,本研究中的软骨外植体平均缩进1.1 μm,少数情况下有几个3 μm的峰值,特别是对于高度退化的软骨外植体。在这种情况下,寻求折衷方案,因为在实验环境中,需要与大压痕相关的相对较高的力来中和退化软骨的表面不规则性。较轻微的压痕将导致检查浅表颤动和胶原裂缝,这两者都是高度退化的软骨的共同特征57。
对于赫兹拟合模型来说,正确识别悬臂尖端与样品直接接触的点(通常称为接触点)也至关重要。然而,当压入太粘或太软的样品时,这可能会带来问题,因为它可能导致多个探针-样品接触点58,59。事实上,正如 A-Hassan 等人所强调的那样,对于软生物组织,接触点的准确测定是最棘手的问题之一60.在天然骨关节炎软骨外植体中也观察到这种效应,因为根据变性阶段,组织表面失去其天然的机械特性并且通常不均匀,呈现浅表纤维颤动和裂隙(图3B,C)。这种现象在软骨外植体中尤为明显,其中主要的细胞模式是大簇(图2C)。软骨表面的这些不均匀性可能导致多个探针与样品接触点,从而产生错误的结果。在某些情况下观察到巨大的偏转,然后在力-距离曲线的最后拉伸之前快速恢复基线(图5A)。这可能归因于悬臂尖端路径中的大障碍物(例如,软骨磨损和分裂的晚期纤维性颤动区域)。在其他情况下,力-距离曲线的最终斜率散布着较小的不规则性(图5B),表明与连续较小的障碍物(例如,组织的微纤维性颤动)接触。在这种情况下,必须重新测量甚至更改测量地点,以确保数据的可靠性和可重复性。为此,仔细检查AFM输出的力-距离曲线以正确识别接触点也很重要。这是一个需要注意的关键点,因为已经表明,错误地识别 50 nm 的接触点会导致错误地估计 E 的值61 个数量级。一些研究已经开始使用自动化方法来确定力-距离曲线的接触点,目的是在通过目视检查估计接触点时绕过主观用户输入并提高准确性。当处理大量的力-位移曲线时,这一点变得更加重要,例如在细胞力学测量中产生的曲线47,62。尽管已经提出了几种策略来自动确定接触点47,63,64,65,但最佳策略高度依赖于实验条件和因素,例如用于分析数据的模型,探针的形状,悬臂尖端和样品之间的(非)粘附力机械相互作用,以及样品63的(非)赫兹行为。
样品漂移是另一个可能导致伪影和接触点测定错误的常见问题(图3E)。这基本上意味着样品没有正确安装在样品架(培养皿)中,并且样品在AFM测量期间正在移动。当将悬臂梁移动到新的测量位置时,这种效果尤为明显。在实际测量过程中,通过焦平面的突然变化可以很容易地观察到这一方面。由此产生的力-距离曲线通常具有双相延伸斜率,起初温和上升,对应于圆盘底部和培养皿之间的空隙变窄,因为圆盘被悬臂向下推(见图3E),随后在斜坡的第二部分更牢固的倾斜, 表明圆盘现在与培养皿底部直接接触后进一步缩进(图5C,D)。为了克服变形,可以尝试通过使用足够的样品粘合剂(图3D)来更好地固定样品,通过关闭外部热源(灯)来保持温度恒定以避免热漂移,并进行快速扫描测量。在这里的实验中,我们观察到悬臂浸入介质的前 15 分钟内发生的悬臂偏转漂移(由于温度的突然变化)。经过这段时间的流逝,漂移通常可以忽略不计。因此,我们建议实验者在悬臂浸泡后仔细检查基线,并在稳定后开始测量。该过程的持续时间可能会因所使用的悬臂而有很大差异。
任何AFM测量的另一个关键参数是设定点,简单地说,它是悬臂施加在样品上的力的量度。对于接触模式(如本研究所述),设定点表示悬臂的一定偏转。当执行多次扫描或多次重复现场时,如此处的协议所示,悬臂尖端可以从样品表面吸附颗粒,因此有时需要卸下悬臂,正确清洁它66,然后在继续测量之前重新校准。
虽然AFM微压痕提供了新的和有趣的数据收集机会,特别是在骨关节炎软骨的背景下,但如上所述,所产生数据的一致性和可重复性在很大程度上取决于几个参数。当使用这种方法评估软骨组织变性引起的机械变化时,必须首先对各种空间模式进行一些初步测量,以便将结果扩大到特定的实验设计。中试AFM测量应采用最标准化的程序进行,采集足够多的相同模式的样本(例如,五个圆盘),以指示数据变异的程度。当试图量化和评估最早的相关OA刚度变化时(即,在单弦和双弦之间, 图4A),这一点尤为重要。事实上,在之前的一项研究中,使用类似的方法,我们发现需要 30 个人类标本的样本量来评估基质中的生物力学变化作为细胞空间组织的函数37。
此外,该协议中提出的许多步骤容易受到人为错误的影响,并且严重依赖操作员的经验。考虑到所有可能影响实际AFM结果的因素,本研究中报告的绝对E值是不可推广的,并且特定于该实验设置。然而,这里介绍的各种杨氏模量与基于细胞模式的软骨外植体之间的关系(空间模式越病理,软骨的弹性模量 [EM] 越低)不受影响,因为研究结果与先前的研究一致,显示刚度变化是细胞模式组织的函数23,37。
总体而言,该分步方案展示了标准化 3D 天然关节软骨外植体的功能,其不仅代表了 OA 驱动的细胞重组事件,从发病到晚期进展,而且还与硬度的逐渐降低有关。外植体可能反映了用于研究OA发生和进展的可靠仿生模型,允许 在体外测试和开发不同的治疗方式。将这种人类外植体模型与基于AFM的生物力学评估相结合,可以导致生物医学研究和制药行业的范式转变,为识别急需的有效OA药物的新方法铺平道路。
披露声明
作者没有什么可透露的。
致谢
我们感谢图宾根大学医院骨科的骨科医生提供组织样本。
材料
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Darmstadt, Germany | 1397-89-3 | |
| Atomic force microscop (AFM) head | CellHesion 200, Bruker Nano GmbH, Berlin, Germany | JPK00518 | |
| Biocompatible sample glue | Bruker Nano GmbH, Berlin, Germany | H000033 | |
| Calcein AM | Cayman, Ann Arbor, Michigan, USA | 14948 | Cell membrane permeable stain, used for cartilage disc sorting- top view imaging |
| Cantilever | Bruker Nano GmbH, Berlin, Germany | SAA-SPH-5UM | Frequency Nom: 30KHz, k: 0.2N/m, lenght nom: 115μm, width nom: 40μm, geometry: rectangular, cylindrical tip with a 5μm end radius |
| Cartilage ctting device | Self-made | n/a | Cutting plastic device containing predefined wholes of 4mmx1mm |
| CDD camera integrated in the AFM | The Imaging Source Europe GmbH, Bremen, Germany | DFK 31BF03 | |
| CDD camera integrated in the fluorescence microscope | Leica Biosystems, Wetzlar, Germany | DFC3000G | |
| Cryotome | Leica Biosystems, Wetzlar, Germany | CM3050S | |
| Data Processing Software for the AFM | Bruker Nano GmbH, Berlin, Germany | n/a | Version 5.0.86, can be downloaded for free from the following website https://customers.jpk.com |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Darmstadt, Germany | 41966052 | |
| Fluorescence Microscope (Leica DMi8) | Leica Biosystems, Wetzlar, Germany | 11889113 | |
| Glass block cantiliver holder | Bruker Nano GmbH, Berlin, Germany | SP-90-05 | Extra long glass block with angled faces, designed especially for the use with the JPK PetriDishHeaterTM (Bruker). |
| Inverted phase contrast microscope (integrated in the AFM) | AxioObserver D1, Carl Zeiss Microscopy, Jena, Germany | L201306_03 | |
| Leibovitz's L-15 medium without L-glutamine | Merck KGaA, Darmstadt, Germany | F1315 | |
| Microscope glass slides | Sigma-Aldrich, St. Louis, Missouri, USA | CLS294775X50 | |
| Mounting medium With DAPI | ibidi GmbH, Gräfelfing, Germany | 50011 | Mounting media with nuclear DAPI (4′,6-diamidino-2-phenylindole) counterstaining used for cartilage discs side view imaging |
| Penicillin-Streptomycin | Sigma-Aldrich, St. Louis, Missouri, USA | P4333 | |
| Petri dish heater associated with AFM (Petri Dish Heater) | Bruker Nano GmbH, Berlin, Germany | T-05-0117 | |
| Scalpel | Feather Medical Products, Osaka, Japan | 2023-01 | |
| Silicone Skirt | Bruker Nano GmbH, Berlin, Germany | n/a | Protective silicone membrane (D55x0.25) which is placed on the basis of the base of the glas block to prevent medium condensation in the AFM head. |
| Statistical program - SPSS | IBM, Armonk, New York, USA | SPSS Statistics 22 | Vesion 280.0.0.0 (190) |
| Tissue culture dishes | TPP Techno Plastic Products AG, Trasadingen, Switzerland | TPP93040 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Alphen aan den Rijn, Netherlands | SA6255012 | Water-soluble embedding medium |
参考文献
- Allison, D. P., Mortensen, N. P., Sullivan, C. J., Doktycz, M. J. Atomic force microscopy of biological samples. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 2 (6), 618-634 (2010).
- Deng, X., et al. Application of atomic force microscopy in cancer research. Journal of Nanobiotechnology. 16 (1), 102(2018).
- Radmacher, M. Studying the mechanics of cellular processes by atomic force microscopy. Methods in Cell Biology. 83, 347-372 (2007).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysical Journal. 82 (6), 2970-2981 (2002).
- Rabinovich, Y., et al. Atomic force microscopy measurement of the elastic properties of the kidney epithelial cells. Journal of Colloid and Interface Science. 285 (1), 125-135 (2005).
- Dufrêne, Y. F. Using nanotechniques to explore microbial surfaces. Nature Reviews Microbiology. 2 (6), 451-460 (2004).
- Cykowska, A., Danalache, M., Bonnaire, F. C., Feierabend, M., Hofmann, U. K. Detecting early osteoarthritis through changes in biomechanical properties - A review of recent advances in indentation technologies in a clinical arthroscopic setup. Journal of Biomechanics. 132, 110955(2022).
- Gavara, N. A beginner's guide to atomic force microscopy probing for cell mechanics. Microscopy Research and Technique. 80 (1), 75-84 (2017).
- Fuchs, J., Kuhnert, R., Scheidt-Nave, C. 12-Monats-Prävalenz von Arthrose in Deutschland. Journal of Health Monitoring. 2, 55-60 (2017).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Ganz, R., Leunig, M., Leunig-Ganz, K., Harris, W. H. The etiology of osteoarthritis of the hip. Clinical Orthopaedics and Related Research. 466 (2), 264-272 (2008).
- Saxby, D. J., Lloyd, D. G. Osteoarthritis year in review 2016: Mechanics. Osteoarthritis and Cartilage. 25 (2), 190-198 (2017).
- Buckwalter, J. A., Mankin, H. J. Articular cartilage: Degeneration and osteoarthritis, repair, regeneration, and transplantation. Instructional Course Lectures. 47, 487-504 (1998).
- Braun, H. J., Gold, G. E. Diagnosis of osteoarthritis: Imaging. Bone. 51 (2), 278-288 (2012).
- Guermazi, A., Roemer, F. W., Burstein, D., Hayashi, D. Why radiography should no longer be considered a surrogate outcome measure for longitudinal assessment of cartilage in knee osteoarthritis. Arthritis Research & Therapy. 13 (6), 247(2011).
- Guermazi, A., et al. Different thresholds for detecting osteophytes and joint space narrowing exist between the site investigators and the centralized reader in a multicenter knee osteoarthritis study--Data from the Osteoarthritis Initiative. Skeletal Radiology. 41 (2), 179-186 (2012).
- Bedson, J., Croft, P. R. The discordance between clinical and radiographic knee osteoarthritis: A systematic search and summary of the literature. BMC Musculoskeletal Disorders. 9 (1), 116(2008).
- Dashefsky, J. H. Arthroscopic measurement of chondromalacia of patella cartilage using a microminiature pressure transducer. Arthroscopy. 3 (2), 80-85 (1987).
- Berkenblit, S. I., Frank, E. H., Salant, E. P., Grodzinsky, A. J. Nondestructive detection of cartilage degeneration using electromechanical surface spectroscopy. Journal of Biomechanical Engineering. 116 (4), 384-392 (1994).
- Appleyard, R. C., Swain, M. V., Khanna, S., Murrell, G. A. The accuracy and reliability of a novel handheld dynamic indentation probe for analysing articular cartilage. Physics in Medicine and Biology. 46 (2), 541-550 (2001).
- Hsieh, C. H., et al. Surface ultrastructure and mechanical property of human chondrocyte revealed by atomic force microscopy. Osteoarthritis and Cartilage. 16 (4), 480-488 (2008).
- Stolz, M., et al. Early detection of aging cartilage and osteoarthritis in mice and patient samples using atomic force microscopy. Nature Nanotechnology. 4 (3), 186-192 (2009).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Tschaikowsky, M., et al. Hybrid fluorescence-AFM explores articular surface degeneration in early osteoarthritis across length scales. Acta Biomaterialia. 126, 315-325 (2021).
- Eaton, P., Batziou, K. Artifacts and Practical Issues in Atomic Force Microscopy. Atomic Force Microscopy: Methods and Protocols. Santos, N. C., Carvalho, F. A. , Springer. New York, NY. 3-28 (2019).
- Danalache, M., et al. Exploration of changes in spatial chondrocyte organisation in human osteoarthritic cartilage by means of 3D imaging. Scientific Reports. 11, 9783(2021).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organisation in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research. 38 (10), 2170-2180 (2020).
- Danalache, M., Tiwari, A., Sigwart, V., Hofmann, U. K. Application of atomic force microscopy to detect early osteoarthritis. Journal of Visualized Experiments. (159), e61041(2020).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Wilusz, R. E., DeFrate, L. E., Guilak, F. Immunofluorescence-guided atomic force microscopy to measure the micromechanical properties of the pericellular matrix of porcine articular cartilage. Journal of The Royal Society Interface. 9 (76), 2997-3007 (2012).
- Guilak, F., Ratcliffe, A., Lane, N., Rosenwasser, M. P., Mow, V. C. Mechanical and biochemical changes in the superficial zone of articular cartilage in canine experimental osteoarthritis. Journal of Orthopaedic Research. 12 (4), 474-484 (1994).
- Billinghurst, R. C., et al. Enhanced cleavage of type II collagen by collagenases in osteoarthritic articular cartilage. The Journal of Clinical Investigation. 99 (7), 1534-1545 (1997).
- Wu, P. J., et al. Detection of proteoglycan loss from articular cartilage using Brillouin microscopy, with applications to osteoarthritis. Biomedical Optics Express. 10 (5), 2457-2466 (2019).
- Loparic, M., et al. Micro- and nanomechanical analysis of articular cartilage by indentation-type atomic force microscopy: Validation with a gel-microfiber composite. Biophysical Journal. 98 (11), 2731-2740 (2010).
- Moshtagh, P. R., Pouran, B., Weinans, H., Zadpoor, A. The elastic modulus of articular cartilage at nano-scale and micro-scale measured using indentation type atomic force microscopy. Osteoarthritis and Cartilage. 22, 359-360 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 19, 109409(2019).
- Houtman, E., et al. Human osteochondral explants: Reliable biomimetic models to investigate disease mechanisms and develop personalized treatments for osteoarthritis. Rheumatology and Therapy. 8 (1), 499-515 (2021).
- Anderson, J. R., Phelan, M. M., Foddy, L., Clegg, P. D., Peffers, M. J. Ex vivo equine cartilage explant osteoarthritis model: A metabolomics and proteomics study. Journal of Proteome Research. 19 (9), 3652-3667 (2020).
- Chen, C. T., Torzilli, P. A. In vitro cartilage explant injury models. Post-Traumatic Arthritis: Pathogenesis, Diagnosis and Management. Olson, S. A., Gauilak, F. , Springer. New York, NY. 29-40 (2015).
- Thudium, C. S., Engstrom, A., Groen, S. S., Karsdal, M. A., Bay-Jensen, A. -C. An ex vivo tissue culture model of cartilage remodeling in bovine knee explants. Journal of Visualized Experiments. (153), e59467(2019).
- Rolauffs, B., Williams, J., Grodzinsky, A., E Kuettner, K., Cole, A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Deveza, L. A., Loeser, R. F. Is osteoarthritis one disease or a collection of many. Rheumatology. 57, 34-42 (2018).
- Stolz, M., et al. Dynamic elastic modulus of porcine articular cartilage determined at two different levels of tissue organization by indentation-type atomic force microscopy. Biophysical Journal. 86 (5), 3269-3283 (2004).
- Sicard, D., Fredenburgh, L. E., Tschumperlin, D. J. Measured pulmonary arterial tissue stiffness is highly sensitive to AFM indenter dimensions. Journal of the Mechanical Behavior of Biomedical Materials. 74, 118-127 (2017).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. 1 (1), 41-57 (2019).
- Gavara, N. Combined strategies for optimal detection of the contact point in AFM force-indentation curves obtained on thin samples and adherent cells. Scientific Reports. 6, 21267(2016).
- Mow, V. C., Kuei, S. C., Lai, W. M., Armstrong, C. G. Biphasic creep and stress relaxation of articular cartilage in compression? Theory and experiments. Journal of Biomechanical Engineering. 102 (1), 73-84 (1980).
- Armstrong, C. G., Lai, W. M., Mow, V. C. An analysis of the unconfined compression of articular cartilage. Journal of Biomechanical Engineering. 106 (2), 165-173 (1984).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5 (8), 636-640 (2006).
- Fischer-Friedrich, E., et al. Rheology of the active cell cortex in mitosis. Biophysical Journal. 111 (3), 589-600 (2016).
- Gould, T. E., Jesunathadas, M., Nazarenko, S., Piland, S. G. Chapter 6 - Mouth Protection in Sports. Materials in Sports Equipment (Second Edition). Subic, A. , Woodhead Publishing. Sawston, Cambridge. 199-231 (2019).
- Kontomaris, S. V., Malamou, A. Hertz model or Oliver & Pharr analysis? Tutorial regarding AFM nanoindentation experiments on biological samples. Materials Research Express. 7 (3), 033001(2020).
- Guz, N., Dokukin, M., Kalaparthi, V., Sokolov, I. If cell mechanics can be described by elastic modulus: study of different models and probes used in indentation experiments. Biophysical Journal. 107 (3), 564-575 (2014).
- Wu, C. -E., Lin, K. -H., Juang, J. -Y. Hertzian load-displacement relation holds for spherical indentation on soft elastic solids undergoing large deformations. Tribology International. 97, 71-76 (2016).
- Westbrook, J. H., Conrad, H. The Science of Hardness Testing and its Research Applications. , American Society for Metal. Metals Park, Ohio. (1973).
- Pritzker, K. P. H., et al. Osteoarthritis cartilage histopathology: Grading and staging. Osteoarthritis and Cartilage. 14 (1), 13-29 (2006).
- Stylianou, A., Kontomaris, S. V., Grant, C., Alexandratou, E. Atomic force microscopy on biological materials related to pathological conditions. Scanning. 2019, 8452851(2019).
- Sokolov, I. Atomic force microscopy in cancer cell research. Cancer Nanotechnology. 1, 1-17 (2007).
- Emad, A., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74 (3), 1564-1578 (1998).
- Crick, S. L., Yin, F. C. Assessing micromechanical properties of cells with atomic force microscopy: Importance of the contact point. Biomechanics and Modeling in Mechanobiology. 6 (3), 199-210 (2007).
- Shoelson, B., Dimitriadis, E. K., Cai, H., Kachar, B., Chadwick, R. S. Evidence and implications of inhomogeneity in tectorial membrane elasticity. Biophysical Journal. 87 (4), 2768-2777 (2004).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis--I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2007).
- Rudoy, D., Yuen, S. G., Howe, R. D., Wolfe, P. J. Bayesian change-point analysis for atomic force microscopy and soft material indentation. Journal of the Royal Statistical Society: Series C (Applied Statistics). 59 (4), 573-593 (2010).
- Benítez, R., Moreno-Flores, S., Bolós, V. J., Toca-Herrera, J. L. A new automatic contact point detection algorithm for AFM force curves. Microscopy Research and Technique. 76 (8), 870-876 (2013).
- Timashev, P. S., et al. Cleaning of cantilevers for atomic force microscopy in supercritical carbon dioxide. Russian Journal of Physical Chemistry B. 8 (8), 1081-1086 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。