Method Article
Condizioni sperimentali modificate per la perdita dell'udito indotta dal rumore nei topi e valutazione della funzione uditiva e del danno esterno delle cellule ciliate
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per un modello murino di perdita dell'udito indotta dal rumore (NIHL). Per indurre NIHL, abbiamo sviluppato un nuovo e semplice dispositivo utilizzando plastica ondulata, una gabbia trappola per topi e un altoparlante. La risposta uditiva del tronco cerebrale e l'imaging immunofluorescenza sono stati impiegati per valutare rispettivamente la funzione uditiva e il danno esterno delle cellule ciliate.
Abstract
Un modello animale di perdita dell'udito indotta dal rumore (NIHL) è utile per patologi, terapisti, farmacologi e ricercatori dell'udito per comprendere a fondo il meccanismo della NIHL e successivamente ottimizzare le strategie di trattamento corrispondenti. Questo studio mira a creare un protocollo migliorato per lo sviluppo di un modello murino di NIHL. In questo studio sono stati utilizzati topi maschi C57BL / 6J. I topi non anestetizzati sono stati esposti a rumori forti (1 e 6 kHz, presentati simultaneamente a 115-125 dB SPL-A) continuamente per 6 ore al giorno per 5 giorni consecutivi. La funzione uditiva è stata valutata 1 giorno e 1 settimana dopo l'esposizione al rumore, utilizzando la risposta uditiva del tronco cerebrale (ABR). Dopo la misurazione ABR, i topi sono stati sacrificati e i loro organi di Corti sono stati raccolti per la colorazione con immunofluorescenza. Dalle misurazioni della risposta uditiva del tronco cerebrale (ABR), è stata osservata una significativa perdita dell'udito 1 giorno dopo l'esposizione al rumore. Dopo 1 settimana, le soglie uditive dei topi sperimentali sono diminuite a ~ 80 dB SPL, che era ancora un livello significativamente più alto rispetto ai topi di controllo (~ 40 dB SPL). Dai risultati dell'imaging a immunofluorescenza, le cellule ciliate esterne (OHC) hanno dimostrato di essere danneggiate. In sintesi, abbiamo creato un modello di NIHL utilizzando topi maschi C57BL / 6J. Un nuovo e semplice dispositivo per generare e fornire rumore a tono puro è stato sviluppato e poi impiegato. Le misurazioni quantitative delle soglie uditive e la conferma morfologica del danno OHC hanno entrambe dimostrato che il rumore applicato ha indotto con successo una perdita uditiva attesa.
Introduzione
Circa 1,3 miliardi di persone in tutto il mondo soffrono di perdita dell'udito a causa dell'esposizione al rumore1. In questo studio, abbiamo mirato a stabilire un chiaro processo passo-passo per indurre e confermare la perdita dell'udito indotta dal rumore (NIHL). La NIHL deriva da una degenerazione/distruzione delle cellule ciliate (HC) e dei neuroni gangliari spiralati (SGN), danni alle stereociglia HC e/o perdita di sinapsi tra gli HC interni cocleari e gli SGN. Tali anomalie possono anche causare acufene e alterata percezione del linguaggio (specialmente in un ambiente acustico complesso) oltre alla NIHL. Le funzioni sociali, psicologiche e cognitive possono essere sequenzialmente influenzate da queste carenze fisiologiche 2,3,4,5,6.
Negli studi preclinici correlati alla NIHL basati sui topi, i ceppi murini più popolari sono CBA/CaJ 2,3,6,7 e C57BL/6 4,5,8. I topi maschi 3,4,7, inoltre, sono più comunemente usati di quelli femminili, poiché gli estrogeni hanno un effetto protettivo sull'udito. Pertanto, abbiamo usato solo topi maschi in questo studio9. Dopo aver fatto riferimento alla letteratura, abbiamo scelto 1 kHz e 6 kHz come frequenze del rumore applicato. L'intensità del rumore applicato era di 115 dB SPL-A (che circonda la gabbia) a 125 dB SPL-A (al centro della gabbia). Dopo aver esposto i topi sperimentali al rumore continuamente per 6 ore al giorno, per 5 giorni consecutivi, un aumento ottimale della soglia uditiva ha indicato che è stata generata un'estensione ottimale di NIHL nei topi sperimentali. Le operazioni per la manipolazione degli animali, la costruzione della configurazione sperimentale e l'induzione del rumore sono tutte chiaramente descritte passo dopo passo nel protocollo fornito.
Protocollo
Gli esperimenti sugli animali in questo studio sono stati approvati dal Comitato per la cura degli animali del Mackay Medical College. Topi maschi C57BL / 6J di otto settimane sono stati acquistati dal National Laboratory Animal Center (New Taipei City, Taiwan). Tutti i topi sono stati allevati e alloggiati in conformità con il protocollo standard sugli animali.
1. Induzione della NIHL nei topi
- Preparare la gabbia per i topi sperimentali
- Per fare ciò, utilizzare una gabbia trappola per topi con dimensioni di 14 cm × 17 cm × 24 cm. Tagliare quattro pezzi di pannelli di plastica ondulata in dimensioni appropriate, facendoli entrare nella gabbia (13 cm × 23 cm e 13 cm × 16 cm).
- Per evitare che i topi vengano tagliati con i piedi dalla griglia della rete, posizionare due dei pezzi rispettivamente sul lato inferiore e sul lato posteriore. Posizionare gli altri due pezzi perpendicolarmente incastrati tra loro, per dividere lo spazio all'interno della gabbia in quarti.
- Esegui questo studio in una scatola insonorizzata. Posizionare un altoparlante di 8,5 cm davanti alla gabbia e posizionare sia l'altoparlante che la gabbia in una scatola insonorizzata.
- Aprire il software applicativo CLIO
- Spostare il cursore sull'icona dell'altoparlante, quindi fare clic su TwoSin. Immettere e modificare il valore di Freq 1 a 1000 Hz, Freq 2 a 6000 Hz e fare clic su OK per avviare la riproduzione del suono.
- Nella scheda Leq, modificare dBV in dBSPL. Dopo aver impostato l'ora sull'interfaccia del software, fare clic sul pulsante triangolo verde per riprodurre il suono.
- Posizionare un microfono davanti all'altoparlante a una distanza di 8,5 cm per calibrare il livello di rumore (vedere File supplementare 1). Regolare il livello di rumore a 125 dB SPL-A e monitorare continuamente per non meno di 3 minuti per garantire che il livello di rumore sia sufficientemente stabile. Utilizzare un generatore, un analizzatore e un amplificatore per creare e controllare il rumore. (Figura 1)
NOTA: Eseguire questo passaggio in una scatola insonorizzata per evitare danni all'udito dell'operatore. - Posizionare quattro topi maschi C57BL / 6J nella gabbia (uno per ogni trimestre) per l'esposizione al rumore. Assegna in modo casuale i topi in ogni trimestre durante l'esposizione al rumore. Posizionare un microfono sulla parte superiore della gabbia per monitorare il livello di rumore durante l'esposizione al rumore (Figura 2).
NOTA: Eseguire questo passaggio in una scatola insonorizzata per evitare danni all'udito dell'operatore. - Esporre i mouse al rumore a frequenze di 1 kHz e 6 kHz continuamente per 6 ore al giorno, per 5 giorni consecutivi.
- Misurare le soglie uditive dei topi 1 giorno dopo l'esposizione al rumore (cioè il 6 ° giorno) misurando l'ABR. Ripetere nuovamente queste misurazioni ABR 1 settimana dopo l'esposizione al rumore (cioè il 13° giorno). Dopo le misurazioni ABR, sacrificare tutti i topi coinvolti e raccogliere le loro coclee (Figura 3).
2. Valutazione della soglia uditiva basata sulla risposta del tronco encefalico (ABR)
- Utilizzare un sistema di test ABR commerciale specificamente progettato per animali di piccola taglia10.
- Iniettare per via intraperitoneale una miscela di tiletamina e zolazepam (40 mg/kg) e xilazina (9,3 mg/kg) nei topi per l'anestesia generale.
NOTA: la valutazione ABR richiede ~ 2 ore. Assicurati di fornire supporto termico tramite una piastra riscaldante e applica un unguento per gli occhi per prevenire la secchezza mentre il mouse è sotto anestesia. - Misurare l'ABR nel topo in anestesia generale. Posizionare elettrodi ad ago sottocutanei (12 mm) al vertice, dietro il padiglione auricolare sinistro e indietro vicino alla coda per misurare la soglia uditiva.
- Presentare stimoli acustici utilizzando un altoparlante posto a 1 cm dall'orecchio sinistro dell'animale.
- Utilizzare un oscilloscopio per controllare gli stimoli acustici. Scegli Onda sinusoidale per gli stimoli e 10 k per la scala della finestra. Ruotare la manopola Frequenza per ottenere la frequenza desiderata degli stimoli acustici.
- Regolare l'intensità dello stimolo ruotando la manopola AMLP sul generatore di funzioni. Ottenere l'intensità dello stimolo desiderata ruotando la manopola AMLP su una tensione adeguata, calcolata dalla calibrazione.
- Raccogli le misurazioni ABR sotto una serie di intensità di stimolo, da 10 dB SPL a 100 dB SPL, con una dimensione del passo di 10 dB.
NOTA: Misurare la soglia uditiva in una scatola insonorizzata. Il livello minimo di intensità dello stimolo che potrebbe dare origine a un'onda V visibile nel segnale raccolto è stato assunto come la soglia ABR10,11 (Figura 4). Dopo la valutazione ABR, monitorare l'animale fino a quando non si riprende dall'anestesia (~1 h).
3. Esame microscopico
- Fissaggio del tessuto raccolto
- Dopo le misurazioni ABR, sacrificare il topo iniettando per via intraperitoneale una miscela di tiletamina e zolazepam (100 mg/kg) e xilazina (23,25 mg/kg) per l'esame microscopico.
- Raccogliere le coclee dal topo e immergerle immediatamente in formaldeide (FA) al 10% per la fissazione (due coclee/ml) per almeno 8 ore a 4 °C.
- Dopo la fissazione, sostituire la soluzione di FA con una soluzione di acido etilendiamminotetraacetico (EDTA) al 10% per la decalcificazione per 3-4 giorni a 4 °C. Quindi, controllare ogni coclea con una pinzetta per confermare che le coclee siano sufficientemente ammorbidite.
- Posizionare le coclee in una capsula di Petri riempita con soluzione salina tamponata con fosfato (PBS) e tagliare l'organo a forma di spirale di Corti (OC) (ogni coclea decalcificata) in tre sezioni - la svolta basale, la svolta centrale e la svolta apicale - per la colorazione dei tessuti.
- Al microscopio da dissezione (ingrandimento: 8x-35x), rimuovere le strutture ossee (scala vestiboli, scala tympani e modiolus) delle coclee decalcificate e ottenere i tessuti molli, compreso l'OC (spessore: circa 40 μm).
- Colorazione con immunofluorescenza coclea
- Preparazione del tampone bloccante: preparare il 2% di sieroalbumina bovina (BSA) e lo 0,2% di soluzioni di Triton X-100 in PBS.
- Trasferire il tessuto da colorare dalla capsula di Petri in una provetta per microcentrifuga e immergere il tessuto in 0,1 ml del tampone bloccante per 2 ore a temperatura ambiente (RT).
- Preparazione del tampone anticorpale primario Myo7A: diluire l'anticorpo primario Myo7A nel tampone bloccante con un rapporto di volume di 1:200.
- Trattare il tessuto nella provetta della microcentrifuga con 100 μL di tampone anticorpale primario Myo7A per 2 ore a RT.
- Risciacquare il tessuto tre volte in PBS per 5 minuti ciascuno.
- Preparazione dell'anticorpo secondario Myo7A (Myo7A-Rb-488) e dell'anticorpo falloidina (falloidina-594): diluire l'anticorpo secondario Myo7A (1:400) e l'anticorpo falloidina (1:200) nel tampone bloccante.
- Trattare il tessuto con 100 μL di anticorpo secondario Myo7A e tampone anticorpale falloidina per 2 ore a RT.
- Dopo il trattamento con anticorpi anticorpo + falloidina, sciacquare il tessuto in PBS tre volte, per 5 minuti ciascuna.
- Trasferire il tessuto risciacquato dalla provetta della microcentrifuga a una capsula di Petri riempita con PBS utilizzando una pipetta di trasferimento di plastica da 1 mL con punta tagliata.
- Per prepararsi all'esame microscopico, aprire il tessuto, posizionarlo su un vetrino e aggiungere 15 μL di mezzo 4',6-diamidino-2-fenilindolo (DAPI) fluoromount sul tessuto per coprirlo completamente. Posizionare delicatamente un coprivetro sul tessuto. Lasciare lo scivolo durante la notte a RT prima di sigillarlo con lo smalto.
- Acquisizione di immagini
- Acquisisci immagini 2D utilizzando un microscopio a fluorescenza verticale e un software di acquisizione delle immagini.
- Prima di eseguire l'esame microscopico, centrare il tessuto nel campo visivo e regolare la sensibilità a ISO 100. Regolare inizialmente il tempo di esposizione facendo clic sul pulsante Modalità automatica del software, quindi regolare manualmente facendo clic sul pulsante Regola per ottimizzare il rapporto segnale-rumore.
- Regolare la lunghezza d'onda della luce incidente per eccitare i fluorofori ruotando il cubo di fluorescenza. Pseudo colori sono stati utilizzati per contrassegnare l'emissione da diverse etichette fluorescenti (luce blu: DAPI; luce verde: Myo7A; luce rossa: falloidina).
- Scansionando il campione di tessuto, generare e raccogliere i dati di imaging come file di immagine .tif e .jpg.
Risultati
Uno spostamento della soglia uditiva ABR
La soglia uditiva dei topi è stata misurata utilizzando ABR tone-burst 1 giorno o 1 settimana dopo l'esposizione al rumore. È stato osservato un aumento significativo della soglia uditiva a tutte e tre le frequenze testate (12 kHz: 84,29 ± 2,77 dB SPL; 24 kHz: 91,43 ± 0,92 dB SPL; 32 kHz: 98,57 ± 1,43 dB SPL) 1 giorno dopo l'esposizione al rumore (cioè il 6° giorno). Il recupero parziale dell'udito si è verificato 1 settimana dopo l'esposizione al rumore (cioè il 13° giorno), ma le soglie uditive erano ancora elevate di oltre 30 dB a tutte le frequenze (12 kHz: 72,86 ± 2,86 dB SPL; 24 kHz: 84,29 ± 2,77 dB SPL; 32 kHz: 87,14 ± 4,21 dB SPL) rispetto ai gruppi di controllo (12 kHz: 41 ± 0 dB SPL; 24 kHz: 51 ± 0 dB SPL; 32 kHz: 51 ± 0 dB SPL). In questo studio, l'udito era più danneggiato alle alte frequenze (Figura 5). Per l'analisi è stato utilizzato un test ANOVA bidirezionale e per i post-test è stata utilizzata la correzione Bonferroni. Una differenza significativa (p < 0,001) è stata osservata tra il gruppo di controllo e quello sperimentale sia al 6° che al 13° giorno. Il confronto tra le soglie uditive misurate al 6° e al 13° giorno ha mostrato una differenza significativa (p < 0,05) alle frequenze di 12 kHze 32 kHz.
Perdita di cellule ciliate esterne
Una perdita di OHC è stata costantemente osservata nelle immagini microscopiche acquisite dai topi NIHL, rispetto a quelle dei topi di controllo. Al contrario, le cellule ciliate interne sono state osservate intatte in tutte le immagini. Inoltre, gli OHC nelle curve basali e medie dell'organo di Corti sono stati danneggiati più gravemente, mentre gli OHC nella curva apicale erano quasi intatti (Figura 6).

Figura 1: Impostazione dell'esposizione al rumore. Un microfono è stato posizionato davanti all'altoparlante a una distanza di 8,5 cm per calibrare il livello di rumore. Il livello di rumore è stato regolato a 125 dB SPL-A, che è simile al livello di una sirena vicina. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: La gabbia trappola per topi adattata a questo studio. Tre topi maschi C57BL / 6J sono stati assegnati in modo casuale a ciascun trimestre durante l'esposizione al rumore. Il microfono è stato attaccato alla parte superiore della gabbia per monitorare i livelli di rumore durante l'esposizione al rumore. Il livello di pressione sonora è stato misurato più volte in più posizioni. Queste posizioni sono segnate nella figura. Fare clic qui per visualizzare una versione ingrandita di questa figura.
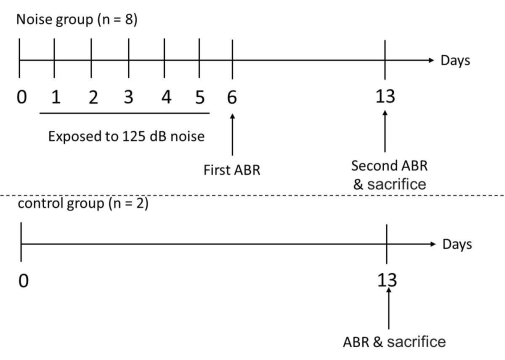
Figura 3: Sequenza temporale sperimentale per i gruppi di test e di controllo. I topi sono stati esposti al rumore alle frequenze di 1 e 6 kHz ininterrottamente per 6 ore al giorno, per 5 giorni. Dopo 5 giorni consecutivi di esposizione al rumore, le soglie uditive dei topi sperimentali sono state misurate con ABR il 6° giorno. La misurazione ABR è stata eseguita nuovamente nei topi sperimentali e nei topi di controllo il 13° giorno, seguita dal sacrificio di tutti i topi coinvolti per raccogliere le loro coclee. Fare clic qui per visualizzare una versione ingrandita di questa figura.
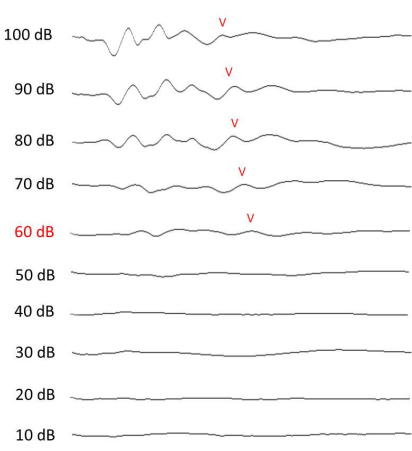
Figura 4: Misurazione ABR dell'udito. Risultati ABR rappresentativi a 12 kHz, raccolti il 13° giorno (1 settimana dopo l'esposizione al rumore). L'onda V ad ogni intensità è etichettata se distinguibile. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Soglie uditive misurate al 6° e al 13° giorno. La soglia uditiva alle frequenze di (A) 12 kHz, (B) 24 kHz e (C) 32 kHz. Per l'analisi è stato utilizzato un test ANOVA bidirezionale, seguito dalla correzione Bonferroni. *p < 0,05, ***p < 0,001. Fare clic qui per visualizzare una versione ingrandita di questa figura.
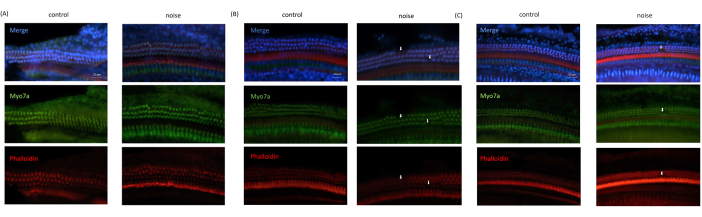
Figura 6: Risultati dell'imaging a immunofluorescenza ottenuti da OC . (A) Immagine ottenuta dalla svolta apicale della coclea. (B) Immagine ottenuta dal giro medio della coclea. (C) Immagine ottenuta dal giro di base della coclea. Blu: nuclei cellulari colorati con DAPI; Verde: cellule ciliate colorate con Myo7A; Rosso: citoscheletro colorato con falloidina. Le frecce indicano la perdita di OHC. Barra di scala = 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
File supplementare 1: Calcolo della tensione dalla taratura. Per ogni frequenza specifica, il valore della tensione selezionata (asse orizzontale) verrà inserito nella curva di calibrazione per ottenere il livello sonoro corrispondente (asse verticale). Clicca qui per scaricare questo file.
Discussione
La NIHL può essere suddivisa in due tipi: NIHL temporanea, che mostra uno spostamento temporale della soglia uditiva, e NIHL permanente, che è caratterizzata da uno spostamento permanente della soglia uditiva. Si ritiene che la perdita dell'udito che abbiamo osservato il 6° giorno (1 giorno dopo l'esposizione al rumore) sia una combinazione di questi due tipi. In questo caso, la soglia uditiva mostrerebbe un recupero graduale nel tempo a causa della componente temporale della perdita dell'udito. Nei nostri studi sperimentali preliminari, i risultati acquisiti con la stessa configurazione e animali, la perdita dell'udito generata dall'esposizione al rumore di 2 giorni completamente recuperata in 2 settimane, indicando che la NIHL permanente non è stata effettivamente generata. Al contrario, in questo studio, si suggerisce che la perdita dell'udito generata dall'esposizione al rumore di 5 giorni includa una componente permanente, poiché la soglia uditiva era ancora significativamente più alta del livello di controllo il 13° giorno (1 settimana dopo l'esposizione al rumore).
Uno dei limiti del protocollo attuale è che abbiamo utilizzato la soglia uditiva rilevata a 12 kHz per rappresentare la soglia uditiva a bassa frequenza dei topi, che corrisponde alla svolta apicale della coclea. A rigor di termini, la rotazione apicale della coclea è più sensibile al suono a 4 kHz a 8 kHz12. Tuttavia, questa limitazione difficilmente riduce il valore di questo studio e protocollo, poiché il protocollo presentato fornisce ogni dettaglio delle fasi operative e impiega dispositivi coinvolti nella creazione del modello. La maggior parte dei parametri presentati, come la durata dell'esposizione al rumore, le frequenze del rumore, le frequenze di stimolo per ABR e quando eseguire i test ABR e il sacrificio animale, possono essere modificati e ulteriormente ottimizzati per scopi diversi in studi futuri.
Divulgazioni
Nessun conflitto di interessi da divulgare.
Riconoscimenti
Ringraziamo le sovvenzioni del Ministero della Scienza e della Tecnologia (MOST) del governo di Taiwan (MOST 110-2314-B-715-005, MOST 111-2314-B-715-009-MY3) e le borse di ricerca intramurali del Mackay Medical College (MMC-RD-110-1B-P030, MMC-RD-111-CF-G002-03).
Materiali
| Name | Company | Catalog Number | Comments |
| 1/4" CCP Free-field Standard Microphone Set | GRAS | 428158 | For noise exposure |
| Amplifier Input Module, AMI100D | BIOPAC | For auditory brainstem response | |
| Bio-amplifier, BIO100C | BIOPAC | For auditory brainstem response | |
| Bovine Serum Albumin | SIGMA | A9647 | Immunofluorescence staining |
| Cellsens software | Olympus life science | Image acquisition | |
| Corrugated plastic | |||
| DAPI fluoromount | SouthernBiotech | 0100-20 | Immunofluorescence staining |
| Ethylenediaminetetraacetic acid | SIGMA | E5134 | Decalcification |
| Evoked Response Amplifier, ERS100C | BIOPAC | For auditory brainstem response | |
| Formaldehyde | APLHA | F030410 | Fixation of cochlear |
| High Performance Data Acquisition System, MP160 | BIOPAC | For auditory brainstem response | |
| Modular Extension Cable, MEC110C | BIOPAC | For auditory brainstem response | |
| Myo7A primary antibody | Proteus | 25-6790 | Immunofluorescence staining |
| Myo7A secondary antibody | Jackson immunoresearch | 711-545-152 | Immunofluorescence staining |
| Needle Electrode, Unipolar 12 mmTp, EL452 | BIOPAC | For auditory brainstem response | |
| phalloidin antibody | Alexa Fluor | A12381 | Immunofluorescence staining |
| phosphate-buffered saline | SIGMA | P4417 | |
| Rat trap cage | 14 cm x 17 cm x 24cm | ||
| ROMPUN- xylazine injection, solution | Bayer HealthCare, LLC | ||
| Sound amplifier, MT-1000 | unika | For noise exposure | |
| Sound generator/analyzer/miscellaneous, FW-02 | CLIO | 620300719 | For noise exposure |
| Soundproof chamber | IEA Electro-Acoustic Technology | For noise exposure and ABR | |
| Speaker | IEA Electro-Acoustic Technology | For noise exposure | |
| Stimulator Module, STM100C | BIOPAC | For auditory brainstem response | |
| Triton X-100 | SIGMA | T8787 | Immunofluorescence staining |
| Tubephone Set, OUT101 | BIOPAC | For auditory brainstem response | |
| Upright Microscope, BX53 | Olympus | Image acquisition | |
| Zoletil | Virbac |
Riferimenti
- World Report on Hearing. World Health Organization Available from: https://www.who.int/publications/i/item/9789240020481 (2021)
- Fernandez, K. A., et al. Noise-induced cochlear synaptopathy with and without sensory cell loss. Neuroscience. 427, 43-57 (2020).
- Kujawa, S. G., Liberman, M. C. Adding insult to injury: cochlear nerve degeneration after "temporary" noise-induced hearing loss. The Journal of Neuroscience. 29 (45), 14077-14085 (2009).
- Wang, J., et al. Overexpression of X-linked inhibitor of apoptosis protein protects against noise-induced hearing loss in mice. Gene Therapy. 18 (6), 560-568 (2011).
- Takeda, S., Mannström, P., Dash-Wagh, S., Yoshida, T., Ulfendahl, M. Effects of aging and noise exposure on auditory brainstem responses and number of presynaptic ribbons in inner hair cells of C57BL/6J mice. Neurophysiology. 49 (5), 316-326 (2017).
- Rouse, S. L., Matthews, I. R., Li, J., Sherr, E. H., Chan, D. K. Integrated stress response inhibition provides sex-dependent protection against noise-induced cochlear synaptopathy. Scientific Reports. 10 (1), 18063 (2020).
- Amanipour, R. M., et al. Noise-induced hearing loss in mice: Effects of high and low levels of noise trauma in CBA mice. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2018, 1210-1213 (2018).
- Edderkaoui, B., Sargsyan, L., Hetrick, A., Li, H. Deficiency of duffy antigen receptor for chemokines ameliorated cochlear damage from noise exposure. Frontiers in Molecular Neuroscience. 11, 173 (2018).
- Hultcrantz, M., Simonoska, R., Stenberg, A. E. Estrogen and hearing: a summary of recent investigations. Acta Oto-laryngologica. 126 (1), 10-14 (2006).
- Tsai, S. C. -. S., et al. The intravenous administration of skin-derived mesenchymal stem cells ameliorates hearing loss and preserves cochlear hair cells in cisplatin-injected mice: SMSCs ameliorate hearing loss and preserve outer hair cells in mice. Hearing Research. 413, 108254 (2022).
- Choi, M. Y., Yeo, S. W., Park, K. H. Hearing restoration in a deaf animal model with intravenous transplantation of mesenchymal stem cells derived from human umbilical cord blood. Biochemical and Biophysical Research Communications. 427 (3), 629-636 (2012).
- Yu, S. -. K., et al. Morphological and functional evaluation of ribbon synapses at specific frequency regions of the mouse cochlea. Journal of Visualized Experiments. (147), e59189 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon