Method Article
תנאי ניסוי מותאמים לאובדן שמיעה כתוצאה מרעש בעכברים והערכת תפקוד השמיעה ונזק לתאי השערה החיצוניים
In This Article
Summary
כאן, אנו מציגים פרוטוקול עבור מודל עכבר של ליקוי שמיעה הנגרם על ידי רעש (NIHL). כדי ליצור את NIHL, פיתחנו מכשיר חדש ופשוט העשוי מפלסטיק גלי, כלוב מלכודת חולדות ורמקול. תגובת גזע המוח השמיעתי והדמיית אימונופלואורסצנטיות שימשו להערכת תפקוד השמיעה והנזק לתאי השערה החיצוניים, בהתאמה.
Abstract
מודל בעל חיים של ליקוי שמיעה הנגרם מרעש (NIHL) שימושי עבור פתולוגים, מטפלים, פרמקולוגים וחוקרי שמיעה כדי להבין לעומק את המנגנון של NIHL, ולאחר מכן לייעל את אסטרטגיות הטיפול המתאימות. מחקר זה נועד ליצור פרוטוקול משופר לפיתוח מודל עכבר של NIHL. במחקר זה נעשה שימוש בעכברי C57BL/6J זכרים. עכברים לא מורדמים נחשפו לרעשים חזקים (1 ו -6 קילוהרץ, שהוצגו בו זמנית ב 115-125 dB SPL-A) ברציפות במשך 6 שעות ביום במשך 5 ימים רצופים. תפקוד השמיעה הוערך יום ושבוע לאחר החשיפה לרעש, באמצעות תגובת גזע המוח השמיעתית (ABR). לאחר מדידת ABR, העכברים הוקרבו, ואיבריהם של קורטי נאספו עבור צביעה immunofluorescence. ממדידות התגובה השמיעתית של גזע המוח (ABR), נצפה ליקוי שמיעה משמעותי יום אחד לאחר החשיפה לרעש. לאחר שבוע אחד, סף השמיעה של עכברי הניסוי ירד ל~80 dB SPL, שעדיין היה רמה גבוהה משמעותית מעכברי הביקורת (~ 40 dB SPL). מתוצאות ההדמיה האימונופלואורסצנטית, תאי השערה החיצוניים (OHC) הוכחו כפגומים. לסיכום, יצרנו מודל של NIHL באמצעות עכברי C57BL/6J זכרים. מכשיר חדש ופשוט ליצירה והעברה של רעש צליל טהור פותח ולאחר מכן נעשה בו שימוש. מדידות כמותיות של ספי שמיעה ואישור מורפולוגי של נזקי OHC הראו שניהם כי הרעש המופעל גרם בהצלחה לאובדן שמיעה צפוי.
Introduction
כ-1.3 מיליארד אנשים ברחבי העולם סובלים מאובדן שמיעה כתוצאה מחשיפה לרעש1. במחקר זה, שאפנו לבסס תהליך ברור שלב אחר שלב לגרימת ואישור אובדן שמיעה הנגרם על ידי רעש (NIHL). NIHL נובע מניוון/הרס של תאי השערה (HCs) ונוירוני גנגליון ספירליים (SGNs), נזק בסטריאוסיליה של HC ו/או אובדן סינפסות בין HCs פנימיים של השבלול לבין SGNs. חריגות כאלה עלולות לגרום גם לטינטון ולפגיעה בתפיסת הדיבור (במיוחד בסביבה אקוסטית מורכבת) מלבד NIHL. תפקודים חברתיים, פסיכולוגיים וקוגניטיביים עשויים להיות מושפעים ברצף מליקויים פיזיולוגיים אלה 2,3,4,5,6.
במחקרים פרה-קליניים הקשורים ל-NIHL המבוססים על עכברים, זני העכבר הפופולריים ביותר הם CBA/CaJ 2,3,6,7 ו-C57BL/6 4,5,8. יתר על כן, העכברים הזכרים 3,4,7 נפוצים יותר מהנקבות, שכן לאסטרוגן יש השפעה מגנה על השמיעה. לכן, במחקר הזה השתמשנו רק בעכברים זכרים9. לאחר התייחסות לספרות, בחרנו 1 קילוהרץ ו 6 קילוהרץ כתדרים של הרעש המופעל. עוצמת הרעש שהופעל הייתה 115 dB SPL-A (המקיף את הכלוב) עד 125 dB SPL-A (במרכז הכלוב). לאחר חשיפת עכברי הניסוי לרעש ברציפות במשך 6 שעות ביום, במשך 5 ימים רצופים, עלייה אופטימלית בסף השמיעה הצביעה על היקף אופטימלי של NIHL שנוצר בעכברי הניסוי. הפעולות לטיפול בבעלי החיים, בניית מערך הניסוי וגרימת רעש מתוארות בבירור שלב אחר שלב בפרוטוקול שסופק.
Protocol
ניסויים בבעלי חיים במחקר זה אושרו על ידי הוועדה לטיפול בבעלי חיים של Mackay Medical College. עכברי C57BL/6J זכרים בני שמונה שבועות נרכשו ממרכז חיות המעבדה הלאומי (העיר טאיפיי החדשה, טייוואן). כל העכברים גודלו ושוכנו בהתאם לפרוטוקול הסטנדרטי של בעלי חיים.
1. השראת NIHL בעכברים
- הכינו את הכלוב לעכברי הניסוי
- לשם כך, השתמשו בכלוב מלכודת חולדות במידות של 14 ס"מ × 17 ס"מ ×-24 ס"מ. חתכו ארבע חתיכות של לוחות פלסטיק גלי לגדלים מתאימים, כך שיתאימו לכלוב (13 ס"מ × 23 ס"מ ו-13 ס"מ × 16 ס"מ).
- כדי למנוע מהעכברים לחתוך את רגליהם על ידי רשת הרשת, הניחו שתיים מהחתיכות בחלק התחתון ובצד האחורי, בהתאמה. הניחו את שני החלקים האחרים בניצב זה לזה, כדי לחלק את החלל בתוך הכלוב לרבעים.
- בצע מחקר זה בתיבה אטומה לרעש. הניחו רמקול 8.5 ס"מ לפני הכלוב, והניחו גם את הרמקול וגם את הכלוב בקופסה אטומה לרעש.
- פתח את תוכנת היישום CLIO
- העבר את הסמן לסמל הרמקול ולאחר מכן לחץ על TwoSin. הזן ושנה את הערך של Freq 1 עד 1000 Hz, Freq 2 עד 6000 Hz, ולחץ על אישור כדי להתחיל להשמיע את הצליל.
- תחת הכרטיסיה Leq, שנה את dBV ל- dBSPL. לאחר הגדרת השעה בממשק התוכנה, לחץ על כפתור המשולש הירוק כדי להשמיע את הצליל.
- מקם מיקרופון מול הרמקול במרחק של 8.5 ס"מ כדי לכייל את עוצמת הרעש (ראה קובץ משלים 1). כוונן את רמת הרעש ל- 125 dB SPL-A ונטר ברציפות במשך לא פחות מ -3 דקות כדי להבטיח שרמת הרעש יציבה מספיק. השתמש בגנרטור, אנלייזר ומגבר כדי ליצור ולשלוט ברעש. (איור 1)
הערה: בצע שלב זה בתיבה אטומה לרעש כדי למנוע נזק לשמיעה של המפעיל. - הכניסו לכלוב ארבעה עכברי C57BL/6J זכרים (אחד לכל רבע) לחשיפה לרעש. הקצו באופן אקראי את העכברים בכל רבעון במהלך החשיפה לרעש. הניחו מיקרופון על החלק העליון של הכלוב כדי לנטר את רמת הרעש במהלך החשיפה לרעש (איור 2).
הערה: בצע שלב זה בתיבה אטומה לרעש כדי למנוע נזק לשמיעה של המפעיל. - חשוף את העכברים לרעש בתדרים של 1 קילוהרץ ו-6 קילוהרץ ברציפות במשך 6 שעות ביום, במשך 5 ימים רצופים.
- מדוד את ספי השמיעה של העכברים יום אחד לאחר החשיפה לרעש (כלומר, ביוםהשישי ) על ידי מדידת ABR. חזור על מדידות ABR אלה שוב שבוע לאחר החשיפה לרעש (כלומר, ביום ה- 13). לאחר מדידות ABR, הקריבו את כל העכברים המעורבים וקצרו את השבלול שלהם (איור 3).
2. הערכה מבוססת תגובה שמיעתית בגזע המוח (ABR) של סף השמיעה
- השתמש במערכת בדיקת ABR מסחרית שתוכננה במיוחד עבור בעלי חיים קטנים10.
- הזרקה תוך-צפקית תערובת של טילטמין וזולאזפאם (40 מ"ג/ק"ג) וקסילזין (9.3 מ"ג/ק"ג) לעכברים להרדמה כללית.
הערה: הערכת ABR אורכת ~ 2 שעות. הקפידו לספק תמיכה תרמית באמצעות כרית חימום ומרחו משחת עיניים למניעת יובש בזמן שהעכבר נמצא תחת הרדמה. - למדוד את ABR בעכבר תחת הרדמה כללית. הניחו אלקטרודות מחט תת-עורית (12 מ"מ) בקודקוד, מאחורי הפינה של האוזן השמאלית, ובחזרה ליד הזנב כדי למדוד את סף השמיעה.
- הציגו גירויים אקוסטיים באמצעות רמקול הממוקם במרחק של 1 ס"מ מאוזן שמאל של החיה.
- השתמש באוסילוסקופ כדי לשלוט בגירויים האקוסטיים. בחר Sine Wave עבור הגירויים ו- 10 k עבור קנה המידה של החלון. סובב את ידית התדר כדי לקבל את התדר הרצוי של הגירויים האקוסטיים.
- התאם את עוצמת הגירוי על ידי סיבוב ידית AMLP על מחולל הפונקציות. השג את עוצמת הגירוי הרצויה על ידי סיבוב ידית AMLP למתח מתאים, המחושב מכיול.
- אסוף את מדידות ABR תחת סדרה של עוצמות גירוי, מ 10 dB SPL ל 100 dB SPL, עם גודל צעד 10 dB.
הערה: מדוד את סף השמיעה בתיבה אטומה לרעש. רמת עוצמת הגירוי המינימלית שיכולה ליצור גל V שניתן להבחין בו באות שנאסף הונחה כסף ABR10,11 (איור 4). לאחר הערכת ABR, עקוב אחר בעל החיים עד שהוא מתאושש מהרדמה (~ 1 שעות).
3. בדיקה מיקרוסקופית
- תיקון הרקמה שנקטפה
- לאחר מדידות ABR, להקריב את העכבר על ידי הזרקה תוך צפקית תערובת של tiletamine ו zolazepam (100 מ"ג / ק"ג) ו xylazine (23.25 מ"ג / ק"ג) עבור הבדיקה המיקרוסקופית.
- קצרו את השבלול מהעכבר וטבלו אותו מיד בפורמלדהיד 10% (FA) לקיבוע (שני שבלול/מ"ל) למשך 8 שעות לפחות ב-4°C.
- לאחר הקיבוע, החלף את תמיסת FA בתמיסת חומצה אתילאנדיאמין-טטראצטית (EDTA) 10% להסתיידות למשך 3-4 ימים ב-4°C. לאחר מכן, בדקו כל שבלול בפינצטה כדי לוודא שהשבלול מרוכך מספיק.
- הניחו את השבלול בצלחת פטרי מלאה במי מלח חוצצי פוספט (PBS), וחתכו את האיבר בצורת ספירלה של קורטי (OC) (כל שבלול מסויד) לשלושה חלקים - הסיבוב הבסיסי, הסיבוב האמצעי, והתור האפי - לצביעת רקמות.
- תחת מיקרוסקופ מנתח (הגדלה: 8x-35x), להסיר את המבנים הגרמיים (scala vestibuli, scala tympani, ו modiolus) של שבלול decalcified ולקבל את הרקמה הרכה, כולל OC (עובי: כ 40 מיקרומטר).
- צביעת שבלול אימונופלואורסנציה
- הכנת המאגר החוסם: הכינו תמיסות אלבומין 2% בסרום בקר (BSA) ו-0.2% טריטון X-100 ב-PBS.
- מעבירים את הרקמה המוכתמת מצלחת הפטרי לצינור מיקרוצנטריפוגה, וטובלים את הרקמה ב-0.1 מ"ל של החיץ החוסם למשך שעתיים בטמפרטורת החדר (RT).
- הכנת מאגר הנוגדנים הראשוני Myo7A: יש לדלל את הנוגדן הראשוני Myo7A במאגר החוסם ביחס נפח של 1:200.
- טפל ברקמה בצינור המיקרוצנטריפוגה עם 100 μL של מאגר נוגדנים ראשוני Myo7A למשך שעתיים ב- RT.
- שטפו את הרקמה שלוש פעמים ב-PBS במשך 5 דקות כל אחת.
- הכנת נוגדן משני Myo7A (Myo7A-Rb-488) ונוגדן פאלואדין (phalloidin-594) חוצץ: נוגדן משני מדולל Myo7A (1:400) ונוגדן פאלואדין (1:200) במאגר החסימה.
- טפל ברקמה עם 100 μL של נוגדן משני Myo7A וחיץ נוגדנים phalloidin במשך 2 שעות ב RT.
- לאחר טיפול בנוגדנים + פלואדין יש לשטוף את הרקמה ב-PBS שלוש פעמים, למשך 5 דקות כל אחת.
- מעבירים את הרקמה שטופה מצינור המיקרוצנטריפוגה לצלחת פטרי מלאה PBS באמצעות פיפטת העברת פלסטיק 1 מ"ל עם קצה חתוך.
- כדי להתכונן לבדיקה המיקרוסקופית, פתחו את הרקמה, הניחו אותה על מגלשת זכוכית והוסיפו 15 μL של מדיום פלואורומאונט 4',6-diamidino-2-phenylindole (DAPI) על הרקמה כדי לכסות אותה במלואה. הניחו כיסוי זכוכית בעדינות על הרקמה. השאירו את המגלשה למשך הלילה ב-RT לפני שתאטמו אותה בלק.
- רכישת תמונות
- קבל תמונות דו-ממדיות באמצעות מיקרוסקופ פלואורסצנטי זקוף ותוכנה לרכישת תמונות.
- לפני ביצוע הבדיקה המיקרוסקופית יש לרכז את הרקמה בשדה הראייה ולהתאים את הרגישות ל-ISO 100. התאם את זמן החשיפה בתחילה על ידי לחיצה על כפתור המצב האוטומטי של התוכנה, ולאחר מכן כוונן ידנית על ידי לחיצה על כפתור התאם כדי למטב את יחס האות לרעש.
- התאם את אורך הגל של אור האירוע כדי לעורר את הפלואורופורים על ידי סיבוב קוביית הפלואורסצנטיות. צבעים מדומים שימשו לסימון הפליטה מתוויות פלואורסצנטיות שונות (אור כחול: DAPI; אור ירוק: Myo7A; אור אדום: phalloidin).
- על ידי סריקת דגימת הרקמה, צור ואסוף את נתוני ההדמיה כקבצי תמונה .tif ו- .jpg.
תוצאות
שינוי בסף השמיעה של ABR
סף השמיעה של העכברים נמדד באמצעות ABR מתפרץ טון יום אחד או שבוע לאחר החשיפה לרעש. נצפתה עלייה משמעותית בסף השמיעה בכל שלושת התדרים שנבדקו (12 קילוהרץ: 84.29 ± 2.77 dB SPL; 24 קילוהרץ: 91.43 ± 0.92 dB SPL; 32 קילוהרץ: 98.57 ± 1.43 dB SPL) יום אחד לאחר החשיפה לרעש (כלומר, היום השישי). התאוששות שמיעה חלקית התרחשה שבוע לאחר החשיפה לרעש (כלומר, היום ה-13), אך ספי השמיעה עדיין היו גבוהים ביותרמ-30 dB בכל התדרים (12 kHz: 72.86 ± 2.86 dB SPL; 24 kHz: 84.29 ± 2.77 dB SPL; 32 kHz: 87.14 ± 4.21 dB SPL) בהשוואה לקבוצות הביקורת (12 kHz: 41 ± 0 dB SPL; 24 kHz: 51 ± 0 dB SPL; 32 קילוהרץ: 51 ± 0 dB SPL). במחקר זה, השמיעה נפגעה יותר בתדרים גבוהים (איור 5). מבחן ANOVA דו-כיווני שימש לניתוח, ותיקון בונפרוני שימש לבדיקות שלאחר מכן. הבדל משמעותי (p < 0.001) נצפה בין קבוצת הביקורת לבין קבוצת הניסוי הן ביוםה-6 והן ביוםה-13 . השוואה בין ספי השמיעה שנמדדו ביוםהשישי וה-13 הראתה הבדל משמעותי (p < 0.05) בתדרים של 12 קילוהרץ ו-32 קילוהרץ.
נשירת תאי שיער חיצוניים
אובדן של OHCs נצפה באופן עקבי בתמונות המיקרוסקופיות שהתקבלו מעכברי NIHL, בהשוואה לאלה של עכברי הביקורת. לעומת זאת, תאי השערה הפנימיים נצפו שלמים בכל התמונות. נוסף על כך, ה-OHCs בסיבובים הבסיסיים והאמצעיים של איבר קורטי ניזוקו בצורה חמורה יותר, בעוד שה-OHCs בסיבוב האפי היו כמעט שלמים (איור 6).

איור 1: הגדרת חשיפה לרעש. מיקרופון הוצב לפני הרמקול במרחק של 8.5 ס"מ כדי לכייל את עוצמת הרעש. רמת הרעש הותאמה ל-125 dB SPL-A, בדומה לרמת סירנה סמוכה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: כלוב מלכודת החולדות המותאם למחקר הזה. שלושה עכברי C57BL/6J זכרים חולקו באופן אקראי לכל רבעון במהלך החשיפה לרעש. המיקרופון היה דבוק לחלק העליון של הכלוב כדי לנטר את רמות הרעש במהלך חשיפה לרעש. רמת לחץ הקול נמדדה מספר פעמים במספר עמדות. עמדות אלה מסומנות באיור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
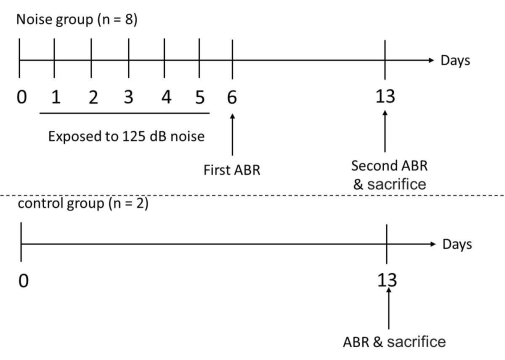
איור 3: ציר הזמן של הניסוי עבור קבוצות הבדיקה והביקורת. העכברים נחשפו לרעש בתדרים של 1 ו-6 קילוהרץ ברציפות במשך 6 שעות ביום, במשך 5 ימים. לאחר 5 ימים רצופים של חשיפה לרעש, ספי השמיעה של עכברי הניסוי נמדדו עם ABR ביוםהשישי . מדידת ABR בוצעה שוב בעכברי הניסוי ובעכברי הביקורת ביוםה-13 , ולאחר מכן הקריבו את כל העכברים המעורבים כדי לקצור את השבלול שלהם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
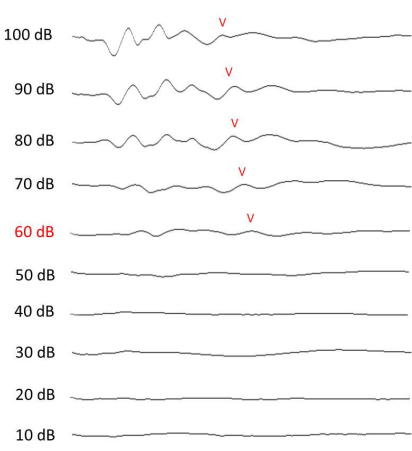
איור 4: מדידת ABR של שמיעה. תוצאות ABR מייצגות של 12 קילוהרץ, שנאספו ביוםה-13 (שבוע לאחר החשיפה לרעש). גל V בכל עוצמה מסומן אם ניתן להבחין בו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

תרשים 5: ספי שמיעה שנמדדו בימים ה-6וה-13. סף השמיעה בתדרים (A) 12 kHz, (B) 24 kHz ו-(C) 32 kHz. מבחן ANOVA דו-כיווני שימש לניתוח, ואחריו תיקון בונפרוני. *p < 0.05, ***p < 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
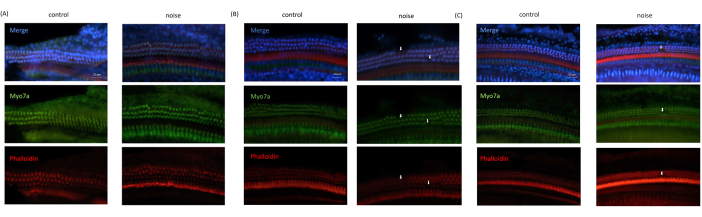
איור 6: תוצאות הדמיה אימונופלואורסצנטית שהתקבלו מ-OC . (A) תמונה שהתקבלה מהסיבוב האפי של השבלול. (B) תמונה שהתקבלה מהסיבוב האמצעי של השבלול. (C) תמונה המתקבלת מסיבוב הבסיס של השבלול. כחול: גרעיני תאים מוכתמים ב-DAPI; ירוק: תאי שיער מוכתמים ב- Myo7A; אדום: שלד ציטו-שלד מוכתם בפלואידין. חצים מציינים אובדן של OHCs. סרגל קנה מידה = 20 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
קובץ משלים 1: חישוב מתח מכיול. עבור כל תדר ספציפי, ערך המתח שנבחר (ציר אופקי) יוזן לעקומת הכיול לקבלת רמת הצליל המתאימה (ציר אנכי). אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
ניתן לחלק את NIHL לשני סוגים: NIHL זמני, אשר מראה שינוי זמני של סף השמיעה, ו- NIHL קבוע, אשר מתבטא בשינוי סף שמיעה קבוע. ליקוי השמיעה שראינו ביוםהשישי (יום אחד לאחר החשיפה לרעש) הוא ככל הנראה שילוב של שני סוגים אלה. במקרה זה, סף השמיעה יראה התאוששות הדרגתית לאורך זמן בשל המרכיב הזמני של ליקוי שמיעה. במחקרים הניסיוניים הראשוניים שלנו, התוצאות שהתקבלו עם אותו מערך ובעלי חיים, ליקוי השמיעה שנוצר על ידי חשיפה לרעש של יומיים התאושש לחלוטין תוך שבועיים, מה שמצביע על כך ש- NIHL קבוע לא נוצר בפועל. להיפך, במחקר זה, ליקוי השמיעה שנוצר כתוצאה מחשיפה לרעש במשך 5 ימים מוצע לכלול רכיב קבוע, שכן סף השמיעה עדיין היה גבוה משמעותית מרמת הבקרה ביום ה- 13 (שבוע לאחר החשיפה לרעש).
אחת המגבלות של הפרוטוקול הנוכחי היא שהשתמשנו בסף השמיעה שזוהה ב-12 קילוהרץ כדי לייצג את סף השמיעה בתדר נמוך של העכברים, המתאים לסיבוב האפי של השבלול. למען הדיוק, הסיבוב האפי של השבלול רגיש יותר לצליל ב 4 קילוהרץ עד 8 קילוהרץ12. עם זאת, מגבלה זו כמעט ולא מפחיתה את הערך של מחקר ופרוטוקול זה, שכן הפרוטוקול המוצג מספק כל פרט של שלבי הפעולה ומעסיק מכשירים המעורבים ביצירת המודל. רוב הפרמטרים המוצגים, כגון משכי חשיפה לרעש, תדרי רעש, תדרי גירוי עבור ABR, ומתי לבצע את בדיקות ABR והקרבת בעלי חיים, ניתנים לשינוי ולאופטימיזציה נוספת למטרות שונות במחקרים עתידיים.
Disclosures
אין ניגוד עניינים לחשוף.
Acknowledgements
אנו מודים למענקים ממשרד המדע והטכנולוגיה (MOST) של ממשלת טייוואן (MOST 110-2314-B-715-005, MOST 111-2314-B-715-009-MY3), ולמענקי מחקר פנימיים מהמכללה הרפואית Mackay (MMC-RD-110-1B-P030, MMC-RD-111-CF-G002-03).
Materials
| Name | Company | Catalog Number | Comments |
| 1/4" CCP Free-field Standard Microphone Set | GRAS | 428158 | For noise exposure |
| Amplifier Input Module, AMI100D | BIOPAC | For auditory brainstem response | |
| Bio-amplifier, BIO100C | BIOPAC | For auditory brainstem response | |
| Bovine Serum Albumin | SIGMA | A9647 | Immunofluorescence staining |
| Cellsens software | Olympus life science | Image acquisition | |
| Corrugated plastic | |||
| DAPI fluoromount | SouthernBiotech | 0100-20 | Immunofluorescence staining |
| Ethylenediaminetetraacetic acid | SIGMA | E5134 | Decalcification |
| Evoked Response Amplifier, ERS100C | BIOPAC | For auditory brainstem response | |
| Formaldehyde | APLHA | F030410 | Fixation of cochlear |
| High Performance Data Acquisition System, MP160 | BIOPAC | For auditory brainstem response | |
| Modular Extension Cable, MEC110C | BIOPAC | For auditory brainstem response | |
| Myo7A primary antibody | Proteus | 25-6790 | Immunofluorescence staining |
| Myo7A secondary antibody | Jackson immunoresearch | 711-545-152 | Immunofluorescence staining |
| Needle Electrode, Unipolar 12 mmTp, EL452 | BIOPAC | For auditory brainstem response | |
| phalloidin antibody | Alexa Fluor | A12381 | Immunofluorescence staining |
| phosphate-buffered saline | SIGMA | P4417 | |
| Rat trap cage | 14 cm x 17 cm x 24cm | ||
| ROMPUN- xylazine injection, solution | Bayer HealthCare, LLC | ||
| Sound amplifier, MT-1000 | unika | For noise exposure | |
| Sound generator/analyzer/miscellaneous, FW-02 | CLIO | 620300719 | For noise exposure |
| Soundproof chamber | IEA Electro-Acoustic Technology | For noise exposure and ABR | |
| Speaker | IEA Electro-Acoustic Technology | For noise exposure | |
| Stimulator Module, STM100C | BIOPAC | For auditory brainstem response | |
| Triton X-100 | SIGMA | T8787 | Immunofluorescence staining |
| Tubephone Set, OUT101 | BIOPAC | For auditory brainstem response | |
| Upright Microscope, BX53 | Olympus | Image acquisition | |
| Zoletil | Virbac |
References
- World Report on Hearing. World Health Organization Available from: https://www.who.int/publications/i/item/9789240020481 (2021)
- Fernandez, K. A., et al. Noise-induced cochlear synaptopathy with and without sensory cell loss. Neuroscience. 427, 43-57 (2020).
- Kujawa, S. G., Liberman, M. C. Adding insult to injury: cochlear nerve degeneration after "temporary" noise-induced hearing loss. The Journal of Neuroscience. 29 (45), 14077-14085 (2009).
- Wang, J., et al. Overexpression of X-linked inhibitor of apoptosis protein protects against noise-induced hearing loss in mice. Gene Therapy. 18 (6), 560-568 (2011).
- Takeda, S., Mannström, P., Dash-Wagh, S., Yoshida, T., Ulfendahl, M. Effects of aging and noise exposure on auditory brainstem responses and number of presynaptic ribbons in inner hair cells of C57BL/6J mice. Neurophysiology. 49 (5), 316-326 (2017).
- Rouse, S. L., Matthews, I. R., Li, J., Sherr, E. H., Chan, D. K. Integrated stress response inhibition provides sex-dependent protection against noise-induced cochlear synaptopathy. Scientific Reports. 10 (1), 18063 (2020).
- Amanipour, R. M., et al. Noise-induced hearing loss in mice: Effects of high and low levels of noise trauma in CBA mice. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2018, 1210-1213 (2018).
- Edderkaoui, B., Sargsyan, L., Hetrick, A., Li, H. Deficiency of duffy antigen receptor for chemokines ameliorated cochlear damage from noise exposure. Frontiers in Molecular Neuroscience. 11, 173 (2018).
- Hultcrantz, M., Simonoska, R., Stenberg, A. E. Estrogen and hearing: a summary of recent investigations. Acta Oto-laryngologica. 126 (1), 10-14 (2006).
- Tsai, S. C. -. S., et al. The intravenous administration of skin-derived mesenchymal stem cells ameliorates hearing loss and preserves cochlear hair cells in cisplatin-injected mice: SMSCs ameliorate hearing loss and preserve outer hair cells in mice. Hearing Research. 413, 108254 (2022).
- Choi, M. Y., Yeo, S. W., Park, K. H. Hearing restoration in a deaf animal model with intravenous transplantation of mesenchymal stem cells derived from human umbilical cord blood. Biochemical and Biophysical Research Communications. 427 (3), 629-636 (2012).
- Yu, S. -. K., et al. Morphological and functional evaluation of ribbon synapses at specific frequency regions of the mouse cochlea. Journal of Visualized Experiments. (147), e59189 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved