Method Article
Conditions expérimentales modifiées pour la perte auditive induite par le bruit chez la souris et évaluation de la fonction auditive et des lésions des cellules ciliées externes
Dans cet article
Résumé
Ici, nous présentons un protocole pour un modèle murin de perte auditive induite par le bruit (NIHL). Pour induire le NIHL, nous avons développé un nouveau dispositif simple utilisant du plastique ondulé, une cage de piège à rats et un haut-parleur. La réponse auditive du tronc cérébral et l’imagerie par immunofluorescence ont été utilisées pour évaluer la fonction auditive et les dommages aux cellules ciliées externes, respectivement.
Résumé
Un modèle animal de perte auditive induite par le bruit (NIHL) est utile aux pathologistes, thérapeutes, pharmacologues et chercheurs en audition pour bien comprendre le mécanisme du NIHL et ensuite optimiser les stratégies de traitement correspondantes. Cette étude vise à créer un protocole amélioré pour le développement d’un modèle murin de NIHL. Des souris mâles C57BL/6J ont été utilisées dans cette étude. Les souris non anesthésiées ont été exposées à des bruits forts (1 et 6 kHz, présentés simultanément à 115-125 dB SPL-A) en continu pendant 6 heures par jour pendant 5 jours consécutifs. La fonction auditive a été évaluée 1 jour et 1 semaine après l’exposition au bruit, en utilisant la réponse auditive du tronc cérébral (ABR). Après la mesure ABR, les souris ont été sacrifiées et leurs organes de Corti ont été collectés pour la coloration par immunofluorescence. À partir des mesures de la réponse auditive du tronc cérébral (ABR), une perte auditive importante a été observée 1 jour après l’exposition au bruit. Après 1 semaine, les seuils d’audition des souris expérimentales ont diminué à ~80 dB SPL, ce qui était encore un niveau significativement plus élevé que les souris témoins (~40 dB SPL). D’après les résultats de l’imagerie par immunofluorescence, les cellules ciliées externes (OHC) se sont révélées endommagées. En résumé, nous avons créé un modèle de NIHL en utilisant des souris mâles C57BL/6J. Un nouveau dispositif simple pour générer et délivrer un bruit sonore pur a été développé puis utilisé. Les mesures quantitatives des seuils auditifs et la confirmation morphologique des dommages causés par l’OHC ont toutes deux démontré que le bruit appliqué induisait avec succès une perte auditive attendue.
Introduction
Environ 1,3 milliard de personnes dans le monde souffrent d’une perte auditive due à l’exposition au bruit1. Dans cette étude, nous avons cherché à établir un processus clair étape par étape pour induire et confirmer la perte auditive induite par le bruit (NIHL). Le NIHL résulte d’une dégénérescence/destruction des cellules ciliées (HC) et des neurones ganglionnaires spiralés (SGN), de lésions des stéréocils HC et/ou d’une perte de synapses entre les HC internes cochléaires et les SGN. De telles anomalies peuvent également causer des acouphènes et une altération de la perception de la parole (en particulier dans un environnement acoustique complexe) en plus du NIHL. Les fonctions sociales, psychologiques et cognitives peuvent être affectées séquentiellement par ces carences physiologiques 2,3,4,5,6.
Dans les études précliniques liées au NIHL basées sur des souris, les souches de souris les plus populaires sont CBA/CaJ 2,3,6,7 et C57BL/6 4,5,8. Les souris mâles 3,4,7, en outre, sont plus couramment utilisées que les femelles, car l’œstrogène a un effet protecteur sur l’audition. Par conséquent, nous n’avons utilisé que des souris mâles dans cette étude9. Après nous être référés à la littérature, nous avons choisi 1 kHz et 6 kHz comme fréquences du bruit appliqué. L’intensité du bruit appliqué était de 115 dB SPL-A (entourant la cage) à 125 dB SPL-A (au centre de la cage). Après avoir exposé les souris expérimentales au bruit en continu pendant 6 heures par jour, pendant 5 jours consécutifs, une augmentation optimale du seuil auditif indiquait qu’une étendue optimale de NIHL avait été générée chez les souris expérimentales. Les opérations de manipulation des animaux, de construction de l’installation expérimentale et d’induction du bruit sont toutes clairement décrites étape par étape dans le protocole fourni.
Protocole
Les expériences sur les animaux dans cette étude ont été approuvées par le Comité de protection des animaux du Mackay Medical College. Des souris mâles C57BL/6J âgées de huit semaines ont été achetées au National Laboratory Animal Center (New Taipei City, Taïwan). Toutes les souris ont été élevées et logées conformément au protocole animal standard.
1. Induction du NIHL chez la souris
- Préparer la cage pour les souris expérimentales
- Pour ce faire, utilisez une cage piège à rats de dimensions de 14 cm × 17 cm × 24 cm. Coupez quatre morceaux de planches de plastique ondulé dans des tailles appropriées, en les faisant tenir dans la cage (13 cm × 23 cm et 13 cm × 16 cm).
- Pour éviter que les souris ne se fassent couper les pieds par la grille en maille, placez deux des morceaux en bas et à l’arrière, respectivement. Placez les deux autres pièces perpendiculairement imbriquées l’une avec l’autre, pour diviser l’espace à l’intérieur de la cage en quartiers.
- Réalisez cette étude dans une boîte insonorisée. Placez un haut-parleur à 8,5 cm devant la cage et placez le haut-parleur et la cage dans une boîte insonorisée.
- Ouvrez le logiciel d’application CLIO
- Déplacez le curseur sur l’icône du haut-parleur, puis cliquez sur TwoSin. Entrez et modifiez la valeur de Freq 1 à 1000 Hz, Freq 2 à 6000 Hz, puis cliquez sur OK pour commencer à jouer le son.
- Sous l’onglet Leq, remplacez dBV par dBSPL. Après avoir réglé l’heure sur l’interface du logiciel, cliquez sur le bouton triangle vert pour lire le son.
- Placez un microphone devant l’enceinte à une distance de 8,5 cm pour calibrer le niveau de bruit (voir le dossier supplémentaire 1). Ajustez le niveau sonore à 125 dB SPL-A et surveillez en continu pendant au moins 3 minutes pour vous assurer que le niveau sonore est suffisamment stable. Utilisez un générateur, un analyseur et un amplificateur pour créer et contrôler le bruit. (Figure 1)
REMARQUE: Faites cette étape dans une boîte insonorisée pour éviter d’endommager l’ouïe de l’opérateur. - Placez quatre souris C57BL/6J mâles dans la cage (une pour chaque quartier) pour l’exposition au bruit. Assignez au hasard les souris dans chaque quartier pendant l’exposition au bruit. Placez un microphone sur le dessus de la cage pour surveiller le niveau de bruit pendant l’exposition au bruit (Figure 2).
REMARQUE: Faites cette étape dans une boîte insonorisée pour éviter d’endommager l’ouïe de l’opérateur. - Exposez les souris au bruit à des fréquences de 1 kHz et 6 kHz en continu pendant 6 h par jour, pendant 5 jours consécutifs.
- Mesurer les seuils d’audition des souris 1 jour après l’exposition au bruit (c.-à-d. le 6 e jour) en mesurant l’ABR. Répétez ces mesures ABR 1 semaine après l’exposition au bruit (c.-à-d. le 13e jour). Après les mesures ABR, sacrifiez toutes les souris impliquées et récoltez leurs cochlées (Figure 3).
2. Évaluation du seuil auditif basée sur la réponse du tronc cérébral (ABR)
- Utiliser un système commercial d’essai ABR spécialement conçu pour les petits animaux10.
- Injecter par voie intrapéritonéale un mélange de tilétamine et de zolazépam (40 mg / kg) et de xylazine (9,3 mg / kg) aux souris pour l’anesthésie générale.
REMARQUE: L’évaluation ABR prend ~2 h. Assurez-vous de fournir un support thermique via un coussin chauffant et appliquez une pommade oculaire pour prévenir la sécheresse pendant que la souris est sous anesthésie. - Mesurer l’ABR chez la souris sous anesthésie générale. Placez des électrodes à aiguille sous-cutanée (12 mm) au sommet, derrière le pavillon de l’oreille gauche et de retour près de la queue pour mesurer le seuil auditif.
- Présentez des stimuli acoustiques à l’aide d’un haut-parleur placé à 1 cm de l’oreille gauche de l’animal.
- Utilisez un oscilloscope pour contrôler les stimuli acoustiques. Choisissez Sine Wave pour les stimuli et 10 k pour l’échelle de fenêtre. Tournez le bouton de fréquence pour obtenir la fréquence souhaitée des stimuli acoustiques.
- Ajustez l’intensité du stimulus en tournant le bouton AMLP sur le générateur de fonctions. Obtenez l’intensité de stimulus souhaitée en tournant le bouton AMLP à une tension appropriée, calculée à partir de l’étalonnage.
- Recueillir les mesures ABR sous une série d’intensités de stimulus, de 10 dB SPL à 100 dB SPL, avec une taille de pas de 10 dB.
REMARQUE : Mesurez le seuil auditif dans un boîtier insonorisé. Le niveau minimal d’intensité de stimulus qui pourrait donner lieu à une onde V discernable dans le signal recueilli a été supposé être le seuil ABR10,11 (figure 4). Après l’évaluation ABR, surveiller l’animal jusqu’à ce qu’il se rétablisse de l’anesthésie (~1 h).
3. Examen microscopique
- Fixation du tissu prélevé
- Après les mesures ABR, sacrifier la souris en injectant par voie intrapéritonéale un mélange de tilétamine et de zolazépam (100 mg/kg) et de xylazine (23,25 mg/kg) pour l’examen microscopique.
- Prélever les cochlées sur la souris et les immerger immédiatement dans du formaldéhyde (FA) à 10 % pour les fixer (deux cochlées/mL) pendant au moins 8 h à 4 °C.
- Après fixation, remplacer la solution d’acide FA par une solution d’acide éthylènediaminetétraacétique (EDTA) à 10 % pour décalcification pendant 3-4 jours à 4 °C. Ensuite, vérifiez chaque cochlée avec une pince à épiler pour confirmer que les cochlées sont suffisamment ramollies.
- Placez les cochlées dans une boîte de Petri remplie de solution saline tamponnée au phosphate (PBS) et coupez l’organe en forme de spirale de Corti (OC) (chaque cochlée décalcifiée) en trois sections - le tour basal, le tour du milieu et le tour apical - pour la coloration des tissus.
- Au microscope à dissection (grossissement : 8x-35x), enlever les structures osseuses (scala vestibuli, scala tympani, et modiolus) des cochlées décalcifiées et obtenir les tissus mous, y compris le CO (épaisseur : environ 40 μm).
- Coloration par immunofluorescence de la cochlée
- Préparation du tampon de blocage: Préparer des solutions d’albumine sérique bovine (BSA) à 2% et de Triton X-100 à 0,2% dans du PBS.
- Transférer le tissu à colorer de la boîte de Petri dans un tube microcentrifuge et immerger le tissu dans 0,1 mL du tampon de blocage pendant 2 h à température ambiante (RT).
- Préparation du tampon d’anticorps primaire Myo7A : Diluer l’anticorps primaire Myo7A dans le tampon bloquant à un rapport volumique de 1:200.
- Traiter le tissu dans le tube de microcentrifugation avec 100 μL de tampon d’anticorps primaires Myo7A pendant 2 h à TA.
- Rincer le mouchoir trois fois dans PBS pendant 5 minutes chacun.
- Préparation du tampon de l’anticorps secondaire Myo7A (Myo7A-Rb-488) et de l’anticorps phalloïdine (phalloïdine-594): anticorps secondaire Myo7A dilué (1:400) et anticorps phalloïdine (1:200) dans le tampon bloquant.
- Traiter le tissu avec 100 μL d’anticorps secondaire Myo7A et un tampon d’anticorps de phalloïdine pendant 2 h à TA.
- Après le traitement anticorps + anticorps phalloïdine, rincer le tissu dans PBS trois fois, pendant 5 minutes chacun.
- Transférer le tissu rincé du tube microcentrifuge dans une boîte de Petri remplie de PBS à l’aide d’une pipette de transfert en plastique de 1 ml munie d’une pointe coupée.
- Pour vous préparer à l’examen microscopique, dépliez le tissu, placez-le sur une lame de verre et ajoutez 15 μL de milieu fluoromount 4',6-diamidino-2-phénylindole (DAPI) sur le tissu pour le recouvrir complètement. Placez doucement une lamelle de verre sur le mouchoir. Laissez la lame toute la nuit chez RT avant de la sceller avec du vernis à ongles.
- Acquisition d’images
- Acquérir des images 2D à l’aide d’un microscope à fluorescence verticale et d’un logiciel d’acquisition d’images.
- Avant d’effectuer l’examen microscopique, centrez le tissu dans le champ de vision et ajustez la sensibilité à ISO 100. Ajustez d’abord le temps d’exposition en cliquant sur le bouton Mode automatique du logiciel, puis affinez manuellement en cliquant sur le bouton Ajuster pour optimiser le rapport signal sur bruit.
- Ajustez la longueur d’onde de la lumière incidente pour exciter les fluorophores en faisant tourner le cube de fluorescence. Des pseudo-couleurs ont été utilisées pour marquer l’émission de différentes étiquettes fluorescentes (lumière bleue : DAPI ; lumière verte : Myo7A ; lumière rouge : phalloïdine).
- En scannant l’échantillon de tissu, générez et collectez les données d’imagerie sous forme de fichiers .tif et .jpg image.
Résultats
Un changement dans le seuil d’audition ABR
Le seuil d’audition des souris a été mesuré à l’aide de l’ABR à éclatement de tonalité 1 jour ou 1 semaine après l’exposition au bruit. Une augmentation significative du seuil auditif aux trois fréquences testées a été observée (12 kHz : 84,29 ± 2,77 dB SPL ; 24 kHz : 91,43 ± 0,92 dB SPL ; 32 kHz : 98,57 ± 1,43 dB SPL) 1 jour après l’exposition au bruit (c.-à-d. le 6e jour). La récupération partielle de l’audition a eu lieu 1 semaine après l’exposition au bruit (c.-à-d. le 13e jour), mais les seuils auditifs étaient toujours élevés de plus de 30 dB à toutes les fréquences (12 kHz : 72,86 ± 2,86 dB SPL ; 24 kHz : 84,29 ± 2,77 dB SPL ; 32 kHz : 87,14 ± 4,21 dB SPL) par rapport aux groupes témoins (12 kHz : 41 ± 0 dB SPL ; 24 kHz : 51 ± 0 dB SPL; 32 kHz : 51 ± 0 dB SPL). Dans cette étude, l’audition était plus endommagée aux hautes fréquences (Figure 5). Un test ANOVA bidirectionnel a été utilisé pour l’analyse, et la correction de Bonferroni a été utilisée pour les post-tests. Une différence significative (p < 0,001) a été observée entre le groupe témoin et le groupe expérimental les 6et 13e jours. La comparaison entre les seuils d’audition mesurés les 6et 13e jours a montré une différence significative (p < 0,05) aux fréquences de 12 kHz et 32 kHz.
Perte de cellules ciliées externes
Une perte d’OHC a été systématiquement observée dans les images microscopiques acquises des souris NIHL, par rapport à celles des souris témoins. En revanche, les cellules ciliées internes ont été observées comme étant intactes dans toutes les images. De plus, les OHC dans les spires basale et médiane de l’organe de Corti ont été endommagées plus sévèrement, tandis que les OHC dans le tour apical étaient presque intactes (Figure 6).

Figure 1 : Configuration de l’exposition au bruit. Un microphone a été placé devant l’enceinte à une distance de 8,5 cm pour calibrer le niveau de bruit. Le niveau sonore a été ajusté à 125 dB SPL-A, ce qui est similaire au niveau d’une sirène à proximité. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : La cage piège à rats adaptée à cette étude. Trois souris C57BL/6J mâles ont été assignées au hasard à chaque quartier pendant l’exposition au bruit. Le microphone était collé au sommet de la cage pour surveiller les niveaux de bruit pendant l’exposition au bruit. Le niveau de pression acoustique a été mesuré plusieurs fois à plusieurs endroits. Ces positions sont indiquées dans la figure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
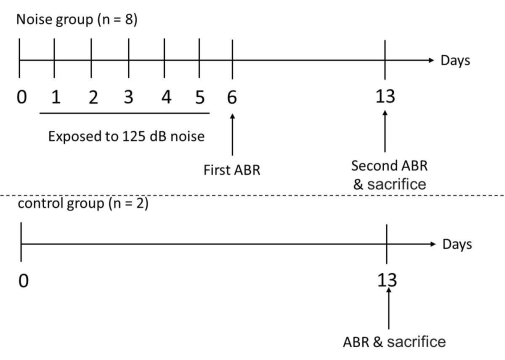
Figure 3 : Chronologie expérimentale pour les groupes d’essai et de contrôle. Les souris ont été exposées au bruit aux fréquences de 1 et 6 kHz en continu pendant 6 heures par jour, pendant 5 jours. Après 5 jours consécutifs d’exposition au bruit, les seuils d’audition des souris expérimentales ont été mesurés avec ABR le6ème jour. La mesure ABR a été effectuée à nouveau chez les souris expérimentales et chez les souris témoins le 13ème jour, suivie du sacrifice de toutes les souris impliquées pour récolter leurs cochlées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
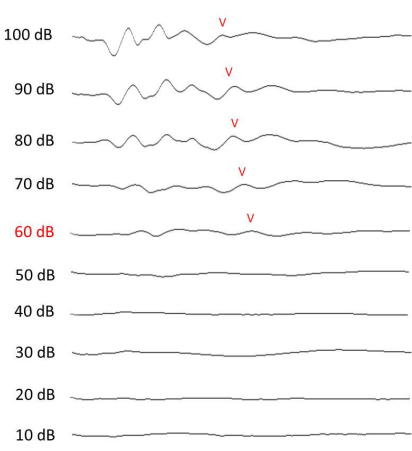
Figure 4 : Mesure ABR de l’audition. Résultats ABR représentatifs à 12 kHz, recueillis le 13e jour (1 semaine après l’exposition au bruit). La vague V à chaque intensité est étiquetée si elle est discernable. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Seuils d’audition mesurés les 6 e et 13e jours. Le seuil d’audition aux fréquences (A) 12 kHz, (B) 24 kHz et (C) 32 kHz. Un test ANOVA bidirectionnel a été utilisé pour l’analyse, suivi d’une correction de Bonferroni. *p < 0,05, ***p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
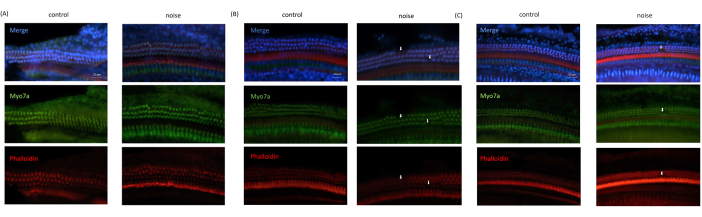
Figure 6 : Résultats d’imagerie par immunofluorescence obtenus à partir de CO. (A) Image obtenue à partir du tour apical de la cochlée. (B) Image obtenue à partir du tour médian de la cochlée. (C) Image obtenue à partir du tour de base de la cochlée. Bleu : noyaux cellulaires colorés au DAPI ; Vert : cellules ciliées colorées avec Myo7A ; Rouge : cytosquelette coloré à la phalloïdine. Les flèches indiquent la perte d’OHC. Barre d’échelle = 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Calcul de tension à partir de l’étalonnage. Pour chaque fréquence spécifique, la valeur de la tension sélectionnée (axe horizontal) sera entrée dans la courbe d’étalonnage pour obtenir le niveau sonore correspondant (axe vertical). Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le NIHL peut être divisé en deux types: le NIHL temporaire, qui montre un décalage temporel du seuil d’audition, et le NIHL permanent, qui se caractérise par un déplacement permanent du seuil auditif. La perte auditive que nous avons observée le 6ème jour (1 jour après l’exposition au bruit) serait une combinaison de ces deux types. Dans ce cas, le seuil auditif montrerait une reprise progressive au fil du temps en raison de la composante temporelle de la perte auditive. Dans nos études expérimentales préliminaires, les résultats obtenus avec la même configuration et les mêmes animaux, la perte auditive générée par l’exposition au bruit de 2 jours a complètement récupéré en 2 semaines, indiquant que le NIHL permanent n’a pas été réellement généré. Au contraire, dans cette étude, il est suggéré que la perte auditive générée par l’exposition au bruit de 5 jours comprenne une composante permanente, car le seuil auditif était encore significativement plus élevé que le niveau de contrôle le 13e jour (1 semaine après l’exposition au bruit).
L’une des limites du protocole actuel est que nous avons utilisé le seuil d’audition détecté à 12 kHz pour représenter le seuil d’audition à basse fréquence des souris, qui correspond au tour apical de la cochlée. Strictement parlant, le tour apical de la cochlée est plus sensible au son à 4 kHz à 8 kHz12. Cependant, cette limitation ne réduit guère la valeur de cette étude et de ce protocole, car le protocole présenté fournit tous les détails des étapes de fonctionnement et utilise des dispositifs impliqués dans la création du modèle. La plupart des paramètres présentés, tels que les durées d’exposition au bruit, les fréquences de bruit, les fréquences de stimulus pour ABR et le moment d’effectuer les tests ABR et les sacrifices d’animaux, peuvent être modifiés et optimisés à des fins différentes dans des études futures.
Déclarations de divulgation
Aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions les subventions du ministère de la Science et de la Technologie (MOST) du gouvernement de Taïwan (MOST 110-2314-B-715-005, MOST 111-2314-B-715-009-MY3) et les subventions de recherche intra-muros du Mackay Medical College (MMC-RD-110-1B-P030, MMC-RD-111-CF-G002-03).
matériels
| Name | Company | Catalog Number | Comments |
| 1/4" CCP Free-field Standard Microphone Set | GRAS | 428158 | For noise exposure |
| Amplifier Input Module, AMI100D | BIOPAC | For auditory brainstem response | |
| Bio-amplifier, BIO100C | BIOPAC | For auditory brainstem response | |
| Bovine Serum Albumin | SIGMA | A9647 | Immunofluorescence staining |
| Cellsens software | Olympus life science | Image acquisition | |
| Corrugated plastic | |||
| DAPI fluoromount | SouthernBiotech | 0100-20 | Immunofluorescence staining |
| Ethylenediaminetetraacetic acid | SIGMA | E5134 | Decalcification |
| Evoked Response Amplifier, ERS100C | BIOPAC | For auditory brainstem response | |
| Formaldehyde | APLHA | F030410 | Fixation of cochlear |
| High Performance Data Acquisition System, MP160 | BIOPAC | For auditory brainstem response | |
| Modular Extension Cable, MEC110C | BIOPAC | For auditory brainstem response | |
| Myo7A primary antibody | Proteus | 25-6790 | Immunofluorescence staining |
| Myo7A secondary antibody | Jackson immunoresearch | 711-545-152 | Immunofluorescence staining |
| Needle Electrode, Unipolar 12 mmTp, EL452 | BIOPAC | For auditory brainstem response | |
| phalloidin antibody | Alexa Fluor | A12381 | Immunofluorescence staining |
| phosphate-buffered saline | SIGMA | P4417 | |
| Rat trap cage | 14 cm x 17 cm x 24cm | ||
| ROMPUN- xylazine injection, solution | Bayer HealthCare, LLC | ||
| Sound amplifier, MT-1000 | unika | For noise exposure | |
| Sound generator/analyzer/miscellaneous, FW-02 | CLIO | 620300719 | For noise exposure |
| Soundproof chamber | IEA Electro-Acoustic Technology | For noise exposure and ABR | |
| Speaker | IEA Electro-Acoustic Technology | For noise exposure | |
| Stimulator Module, STM100C | BIOPAC | For auditory brainstem response | |
| Triton X-100 | SIGMA | T8787 | Immunofluorescence staining |
| Tubephone Set, OUT101 | BIOPAC | For auditory brainstem response | |
| Upright Microscope, BX53 | Olympus | Image acquisition | |
| Zoletil | Virbac |
Références
- World Report on Hearing. World Health Organization Available from: https://www.who.int/publications/i/item/9789240020481 (2021)
- Fernandez, K. A., et al. Noise-induced cochlear synaptopathy with and without sensory cell loss. Neuroscience. 427, 43-57 (2020).
- Kujawa, S. G., Liberman, M. C. Adding insult to injury: cochlear nerve degeneration after "temporary" noise-induced hearing loss. The Journal of Neuroscience. 29 (45), 14077-14085 (2009).
- Wang, J., et al. Overexpression of X-linked inhibitor of apoptosis protein protects against noise-induced hearing loss in mice. Gene Therapy. 18 (6), 560-568 (2011).
- Takeda, S., Mannström, P., Dash-Wagh, S., Yoshida, T., Ulfendahl, M. Effects of aging and noise exposure on auditory brainstem responses and number of presynaptic ribbons in inner hair cells of C57BL/6J mice. Neurophysiology. 49 (5), 316-326 (2017).
- Rouse, S. L., Matthews, I. R., Li, J., Sherr, E. H., Chan, D. K. Integrated stress response inhibition provides sex-dependent protection against noise-induced cochlear synaptopathy. Scientific Reports. 10 (1), 18063 (2020).
- Amanipour, R. M., et al. Noise-induced hearing loss in mice: Effects of high and low levels of noise trauma in CBA mice. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2018, 1210-1213 (2018).
- Edderkaoui, B., Sargsyan, L., Hetrick, A., Li, H. Deficiency of duffy antigen receptor for chemokines ameliorated cochlear damage from noise exposure. Frontiers in Molecular Neuroscience. 11, 173 (2018).
- Hultcrantz, M., Simonoska, R., Stenberg, A. E. Estrogen and hearing: a summary of recent investigations. Acta Oto-laryngologica. 126 (1), 10-14 (2006).
- Tsai, S. C. -. S., et al. The intravenous administration of skin-derived mesenchymal stem cells ameliorates hearing loss and preserves cochlear hair cells in cisplatin-injected mice: SMSCs ameliorate hearing loss and preserve outer hair cells in mice. Hearing Research. 413, 108254 (2022).
- Choi, M. Y., Yeo, S. W., Park, K. H. Hearing restoration in a deaf animal model with intravenous transplantation of mesenchymal stem cells derived from human umbilical cord blood. Biochemical and Biophysical Research Communications. 427 (3), 629-636 (2012).
- Yu, S. -. K., et al. Morphological and functional evaluation of ribbon synapses at specific frequency regions of the mouse cochlea. Journal of Visualized Experiments. (147), e59189 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon