Method Article
Modifizierte Versuchsbedingungen für lärminduzierten Hörverlust bei Mäusen und Beurteilung der Hörfunktion und der Schädigung der äußeren Haarzellen
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir ein Protokoll für ein Mausmodell des lärminduzierten Hörverlusts (NIHL) vor. Um NIHL zu induzieren, haben wir ein neues und einfaches Gerät aus gewelltem Kunststoff, einem Rattenfallenkäfig und einem Lautsprecher entwickelt. Die auditorische Hirnstammantwort und die Immunfluoreszenzbildgebung wurden eingesetzt, um die Hörfunktion bzw. die Schädigung der äußeren Haarzellen zu beurteilen.
Zusammenfassung
Ein Tiermodell für lärminduzierten Hörverlust (NIHL) ist für Pathologen, Therapeuten, Pharmakologen und Hörforscher nützlich, um den Mechanismus von NIHL gründlich zu verstehen und anschließend die entsprechenden Behandlungsstrategien zu optimieren. Diese Studie zielt darauf ab, ein verbessertes Protokoll für die Entwicklung eines Mausmodells von NIHL zu erstellen. In dieser Studie wurden männliche C57BL/6J-Mäuse verwendet. Nicht anästhesierte Mäuse wurden an 5 aufeinanderfolgenden Tagen kontinuierlich für 6 h pro Tag bei lauten Geräuschen (1 und 6 kHz, gleichzeitig mit 115-125 dB SPL-A) exponiert. Die Hörfunktion wurde 1 Tag und 1 Woche nach der Lärmexposition unter Verwendung der auditorischen Hirnstammantwort (ABR) beurteilt. Nach der ABR-Messung wurden die Mäuse getötet und ihre Corti-Organe für die Immunfluoreszenzfärbung entnommen. Bei den Messungen der auditorischen Hirnstammreaktion (ABR) wurde 1 Tag nach der Lärmexposition ein signifikanter Hörverlust beobachtet. Nach 1 Woche sanken die Hörschwellen der Versuchsmäuse auf ~80 dB SPL, was immer noch ein signifikant höherer Wert war als bei den Kontrollmäusen (~40 dB SPL). Aus den Ergebnissen der Immunfluoreszenz-Bildgebung ging hervor, dass die äußeren Haarzellen (OHCs) geschädigt sind. Zusammenfassend lässt sich sagen, dass wir ein NIHL-Modell mit männlichen C57BL/6J-Mäusen erstellt haben. Ein neues und einfaches Gerät zur Erzeugung und Wiedergabe von Reintongeräuschen wurde entwickelt und anschließend eingesetzt. Quantitative Messungen der Hörschwellen und die morphologische Bestätigung der OHC-Schädigung zeigten, dass der angewendete Lärm erfolgreich einen erwarteten Hörverlust induzierte.
Einleitung
Weltweit leiden etwa 1,3 Milliarden Menschen an Hörverlust aufgrund von Lärmbelastung1. In dieser Studie haben wir uns zum Ziel gesetzt, einen klaren Schritt-für-Schritt-Prozess zur Induktion und Bestätigung von lärminduziertem Hörverlust (NIHL) zu etablieren. NIHL resultiert aus einer Degeneration/Zerstörung der Haarzellen (HCs) und Spiralganglienneuronen (SGNs), einer Schädigung der HC-Stereozilien und/oder dem Verlust von Synapsen zwischen den inneren HCs und SGNs der Cochlea. Solche Anomalien können neben NIHL auch Tinnitus und eine beeinträchtigte Sprachwahrnehmung (insbesondere in einer komplexen akustischen Umgebung) verursachen. Soziale, psychologische und kognitive Funktionen können nacheinander durch diese physiologischen Defizite beeinträchtigt werden 2,3,4,5,6.
In NIHL-bezogenen präklinischen Studien an Mäusen sind die beliebtesten Mausstämme CBA/CaJ 2,3,6,7 und C57BL/6 4,5,8. Die männlichen 3,4,7 Mäuse werden außerdem häufiger verwendet als die weiblichen, da Östrogen eine schützende Wirkung auf das Gehör hat. Daher haben wir in dieser Studie nur männliche Mäuse verwendet9. Nach Bezugnahme auf die Literatur wählten wir 1 kHz und 6 kHz als Frequenzen des angelegten Rauschens. Die Intensität des angelegten Lärms betrug 115 dB SPL-A (um den Käfig herum) bis 125 dB SPL-A (in der Mitte des Käfigs). Nachdem die Versuchsmäuse an 5 aufeinanderfolgenden Tagen kontinuierlich 6 Stunden pro Tag dem Lärm ausgesetzt wurden, deutete ein optimaler Anstieg der Hörschwelle darauf hin, dass bei den Versuchsmäusen ein optimales Ausmaß an NIHL erzeugt wurde. Die Vorgänge für den Umgang mit den Tieren, den Aufbau des Versuchsaufbaus und die Geräuscherzeugung sind im mitgelieferten Protokoll Schritt für Schritt klar beschrieben.
Protokoll
Die Tierversuche in dieser Studie wurden vom Animal Care Committee des Mackay Medical College genehmigt. Acht Wochen alte männliche C57BL/6J-Mäuse wurden vom National Laboratory Animal Center (New Taipei City, Taiwan) gekauft. Alle Mäuse wurden nach dem Standard-Tierprotokoll gezüchtet und untergebracht.
1. Induktion von NIHL bei Mäusen
- Bereiten Sie den Käfig für die Versuchsmäuse vor
- Verwenden Sie dazu einen Rattenfangkäfig mit den Maßen 14 cm × 17 cm × 24 cm. Schneiden Sie vier Stücke Wellpappe in die passende Größe zu, so dass sie in den Käfig passen (13 cm × 23 cm und 13 cm × 16 cm).
- Um zu verhindern, dass die Mäuse ihre Füße durch das Gitter schneiden, platzieren Sie zwei der Stücke unten bzw. auf der Rückseite. Lege die anderen beiden Teile senkrecht ineinander, um den Raum im Käfig in Viertel zu teilen.
- Führen Sie diese Studie in einer schalldichten Box durch. Stellen Sie einen Lautsprecher 8,5 cm vor den Käfig und stellen Sie sowohl den Lautsprecher als auch den Käfig in eine schalldichte Box.
- Öffnen Sie die CLIO-Anwendungssoftware
- Bewegen Sie den Cursor auf das Lautsprechersymbol und klicken Sie dann auf TwoSin. Geben Sie den Wert von Freq 1 bis 1000 Hz, Freq 2 bis 6000 Hz ein und ändern Sie ihn, und klicken Sie auf OK, um die Wiedergabe des Tons zu starten.
- Ändern Sie auf der Registerkarte Leq dBV in dBSPL. Nachdem Sie die Uhrzeit auf der Softwareoberfläche eingestellt haben, klicken Sie auf die grüne Dreiecksschaltfläche, um den Ton abzuspielen.
- Platzieren Sie ein Mikrofon in einem Abstand von 8,5 cm vor dem Lautsprecher, um den Geräuschpegel zu kalibrieren (siehe Zusatzdatei 1). Stellen Sie den Geräuschpegel auf 125 dB SPL-A ein und überwachen Sie ihn kontinuierlich für mindestens 3 Minuten, um sicherzustellen, dass der Geräuschpegel ausreichend stabil ist. Verwenden Sie einen Generator, einen Analysator und einen Verstärker, um das Rauschen zu erzeugen und zu kontrollieren. (Abbildung 1)
HINWEIS: Führen Sie diesen Schritt in einer schalldichten Box durch, um eine Schädigung des Gehörs des Bedieners zu vermeiden. - Setzen Sie vier männliche C57BL/6J-Mäuse in den Käfig (eine für jedes Viertel), um sie dem Lärm auszusetzen. Ordnen Sie die Mäuse während der Lärmbelastung in jedem Quartal nach dem Zufallsprinzip zu. Platzieren Sie ein Mikrofon auf der Oberseite des Käfigs, um den Geräuschpegel während der Lärmexposition zu überwachen (Abbildung 2).
HINWEIS: Führen Sie diesen Schritt in einer schalldichten Box durch, um eine Schädigung des Gehörs des Bedieners zu vermeiden. - Setzen Sie die Mäuse dem Rauschen mit Frequenzen von 1 kHz und 6 kHz kontinuierlich für 6 Stunden pro Tag an 5 aufeinanderfolgenden Tagen aus.
- Messen Sie die Hörschwellen der Mäuse 1 Tag nach der Lärmexposition (d.h. am 6. Tag) durch Messung des ABR. Wiederholen Sie diese ABR-Messungen 1 Woche nach der Lärmexposition (d.h. am 13. Tag). Nach den ABR-Messungen werden alle beteiligten Mäuse geopfert und ihre Cochleae entnommen (Abbildung 3).
2. Auditorische Hirnstammantwort (ABR) Bewertung der Hörschwelle
- Verwenden Sie ein kommerzielles ABR-Testsystem, das speziell für Kleintiere entwickelt wurde10.
- Intraperitoneal injizieren Sie den Mäusen eine Mischung aus Tiletamin und Zolazepam (40 mg/kg) und Xylazin (9,3 mg/kg) zur Vollnarkose.
HINWEIS: Die ABR-Bewertung dauert ~2 Stunden. Stellen Sie sicher, dass Sie die Maus mit einem Heizkissen wärmen und tragen Sie Augensalbe auf, um Trockenheit zu vermeiden, während die Maus unter Narkose steht. - Messen Sie die ABR in der Maus unter Vollnarkose. Platzieren Sie subdermale Nadelelektroden (12 mm) am Scheitelpunkt, hinter der Ohrmuschel des linken Ohrs und zurück in der Nähe des Schwanzes, um die Hörschwelle zu messen.
- Präsentieren Sie akustische Reize mit einem Lautsprecher, der 1 cm vom linken Ohr des Tieres entfernt ist.
- Verwenden Sie ein Oszilloskop, um die akustischen Reize zu steuern. Wählen Sie Sinuswelle für die Stimuli und 10 k für die Fensterskala. Drehen Sie den Frequenzregler , um die gewünschte Frequenz der akustischen Reize zu erhalten.
- Stellen Sie die Reizintensität ein, indem Sie den AMLP-Knopf am Funktionsgenerator drehen. Erhalten Sie die gewünschte Stimulusintensität, indem Sie den AMLP-Knopf auf eine geeignete Spannung drehen, die aus der Kalibrierung berechnet wird.
- Erfassen Sie die ABR-Messungen unter einer Reihe von Stimulusintensitäten von 10 dB SPL bis 100 dB SPL mit einer Schrittweite von 10 dB.
HINWEIS: Messen Sie die Hörschwelle in einem schalldichten Kasten. Als minimale Stimulusintensität, die zu einer erkennbaren Welle V im gesammelten Signal führen könnte, wurde die ABR-Schwelle10,11 angenommen (Abbildung 4). Überwachen Sie das Tier nach der ABR-Beurteilung, bis es sich von der Narkose erholt hat (~1 h).
3. Mikroskopische Untersuchung
- Fixierung des entnommenen Gewebes
- Nach den ABR-Messungen wird die Maus geopfert, indem eine Mischung aus Tiletamin und Zolazepam (100 mg/kg) und Xylazin (23,25 mg/kg) für die mikroskopische Untersuchung intraperitoneal injiziert wird.
- Entnehmen Sie die Cochleae von der Maus und tauchen Sie sie sofort in 10 % Formaldehyd (FA) zur Fixierung (zwei Cochlea/ml) für mindestens 8 Stunden bei 4 °C.
- Nach der Fixierung wird die FA-Lösung durch eine 10%ige Ethylendiamintetraessigsäure (EDTA)-Lösung zur Entkalkung für 3-4 Tage bei 4 °C ersetzt. Überprüfen Sie dann jede Cochlea mit einer Pinzette, um sicherzustellen, dass die Cochleae ausreichend aufgeweicht ist.
- Legen Sie die Cochleae in eine Petrischale, die mit phosphatgepufferter Kochsalzlösung (PBS) gefüllt ist, und schneiden Sie das spiralförmige Corti-Organ (OC) (jede entkalkte Cochlea) in drei Abschnitte - die basale Drehung, die mittlere Drehung und die apikale Drehung - für die Gewebefärbung.
- Unter dem Präpariermikroskop (Vergrößerung: 8x-35x) werden die knöchernen Strukturen (Scala vestibuli, Scala tympani und Modiolus) der entkalkten Cochleae entfernt und das Weichgewebe einschließlich des OC (Dicke: ca. 40 μm) gewonnen.
- Cochlea-Immunfluoreszenzfärbung
- Herstellung des Blockierungspuffers: 2 % Rinderserumalbumin (BSA) und 0,2 % Triton X-100-Lösungen in PBS herstellen.
- Das zu färbende Gewebe wird aus der Petrischale in ein Mikrozentrifugenröhrchen überführt und das Gewebe 2 h lang bei Raumtemperatur (RT) in 0,1 ml des Blockierungspuffers getaucht.
- Herstellung des Myo7A-Primärantikörperpuffers: Verdünnen Sie den Myo7A-Primärantikörper im Blockierungspuffer in einem Volumenverhältnis von 1:200.
- Behandeln Sie das Gewebe im Mikrozentrifugenröhrchen mit 100 μl Myo7A-Primärantikörperpuffer für 2 h bei RT.
- Spülen Sie das Gewebe dreimal in PBS für jeweils 5 Minuten.
- Herstellung des Myo7A-Sekundärantikörpers (Myo7A-Rb-488) und des Phalloidin-Antikörper-Puffers (Phalloidin-594): Verdünnen Sie den Myo7A-Sekundärantikörper (1:400) und den Phalloidin-Antikörper (1:200) im Blockierungspuffer.
- Behandeln Sie das Gewebe mit 100 μl Myo7A-Sekundärantikörper und Phalloidin-Antikörperpuffer für 2 Stunden bei RT.
- Nach der Behandlung mit Antikörpern + Phalloidin-Antikörpern wird das Gewebe dreimal für jeweils 5 Minuten in PBS gespült.
- Übertragen Sie das gespülte Gewebe aus dem Mikrozentrifugenröhrchen mit einer 1-ml-Kunststoff-Transferpipette mit abgeschnittener Spitze in eine mit PBS gefüllte Petrischale.
- Um sich auf die mikroskopische Untersuchung vorzubereiten, falten Sie das Gewebe auseinander, legen Sie es auf einen Objektträger und geben Sie 15 μl 4',6-Diamidino-2-phenylindol (DAPI)-Fluoromount-Medium auf das Gewebe, um es vollständig zu bedecken. Legen Sie ein Deckglas vorsichtig auf das Taschentuch. Lassen Sie den Objektträger über Nacht bei RT, bevor Sie ihn mit Nagellack versiegeln.
- Bildaufnahme
- Erfassen Sie 2D-Bilder mit einem aufrechten Fluoreszenzmikroskop und einer Bilderfassungssoftware.
- Zentrieren Sie vor der mikroskopischen Untersuchung das Gewebe im Sichtfeld und stellen Sie die Empfindlichkeit auf ISO 100 ein. Passen Sie die Belichtungszeit zunächst an, indem Sie auf die Schaltfläche Automatikmodus der Software klicken, und nehmen Sie dann manuell die Feinabstimmung vor, indem Sie auf die Schaltfläche Anpassen klicken, um das Signal-Rausch-Verhältnis zu optimieren.
- Stellen Sie die Wellenlänge des einfallenden Lichts ein, um die Fluorophore anzuregen, indem Sie den Fluoreszenzwürfel drehen. Pseudofarben wurden verwendet, um die Emission verschiedener fluoreszierender Markierungen zu markieren (blaues Licht: DAPI; grünes Licht: Myo7A; rotes Licht: Phalloidin).
- Generieren und sammeln Sie durch Scannen der Gewebeprobe die Bilddaten als .tif und .jpg Bilddateien.
Ergebnisse
Eine Verschiebung der ABR-Hörschwelle
Die Hörschwelle der Mäuse wurde entweder 1 Tag oder 1 Woche nach der Lärmexposition mittels Ton-Burst-ABR gemessen. Bei allen drei getesteten Frequenzen wurde 1 Tag nach der Lärmexposition (d.h. am 6. Tag) ein signifikanter Anstieg der Hörschwelle bei allen drei getesteten Frequenzen beobachtet (12 kHz: 84,29 ± 2,77 dB SPL; 24 kHz: 91,43 ± 0,92 dB SPL; 32 kHz: 98,57 ± 1,43 dB SPL). 1 Woche nach der Lärmexposition (d.h. am 13. Tag) kam es zu einer teilweisen Erholung des Gehörs, aber die Hörschwellen waren bei allen Frequenzen (12 kHz: 72,86 ± 2,86 dB SPL; 24 kHz: 84,29 ± 2,77 dB SPL; 32 kHz: 87,14 ± 4,21 dB SPL) im Vergleich zu den Kontrollgruppen (12 kHz: 41 ± 0 dB SPL; 24 kHz: 51 ± 0 dB Schalldruck; 32 kHz: 51 ± 0 dB SPL). In dieser Studie war das Gehör bei hohen Frequenzen stärker geschädigt (Abbildung 5). Für die Analyse wurde ein Zwei-Wege-ANOVA-Test verwendet, und für die Nachtests wurde eine Bonferroni-Korrektur verwendet. Ein signifikanter Unterschied (p < 0,001) wurde sowohl am 6. als auch am 13. Tag zwischen der Kontroll- und der Experimentalgruppe beobachtet. Der Vergleich zwischen den am 6. und 13. Tag gemessenen Hörschwellen zeigte einen signifikanten Unterschied (p < 0,05) bei den Frequenzen 12 kHz und 32 kHz.
Verlust äußerer Haarzellen
In den mikroskopischen Bildern, die von den NIHL-Mäusen aufgenommen wurden, wurde im Vergleich zu denen der Kontrollmäuse durchweg ein Verlust von OHCs beobachtet. Im Gegensatz dazu waren die inneren Haarzellen in allen Bildern intakt. Darüber hinaus waren die OHCs in den basalen und mittleren Windungen des Corti-Organs stärker geschädigt, während die OHCs in der apikalen Wendung nahezu intakt waren (Abbildung 6).

Abbildung 1: Einrichtung der Lärmbelastung. Ein Mikrofon wurde in einem Abstand von 8,5 cm vor dem Lautsprecher platziert, um den Geräuschpegel zu kalibrieren. Der Geräuschpegel wurde auf 125 dB SPL-A eingestellt, was dem Pegel einer Sirene in der Nähe entspricht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Der Rattenfallenkäfig, der an diese Studie angepasst wurde. Drei männliche C57BL/6J-Mäuse wurden während der Lärmexposition nach dem Zufallsprinzip jedem Quartal zugeteilt. Das Mikrofon wurde oben auf den Käfig geklebt, um den Geräuschpegel während der Lärmbelastung zu überwachen. Der Schalldruckpegel wurde mehrfach an mehreren Stellen gemessen. Diese Positionen sind in der Abbildung markiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
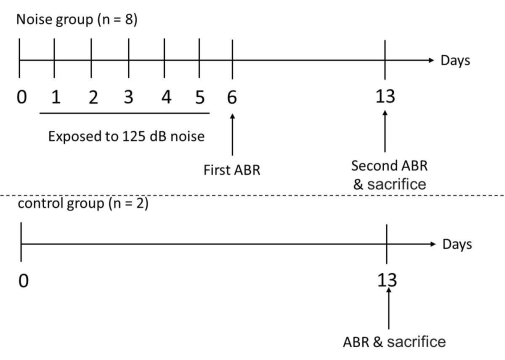
Abbildung 3: Experimenteller Ablauf für die Test- und Kontrollgruppe. Die Mäuse wurden dem Rauschen bei den Frequenzen von 1 und 6 kHz kontinuierlich für 6 Stunden pro Tag ausgesetzt, 5 Tage lang. Nach 5 aufeinanderfolgenden Tagen Lärmexposition wurden die Hörschwellen der Versuchsmäuse am 6. Tag mit ABR gemessen. Die ABR-Messung wurde erneut bei den Versuchsmäusen und am 13. Tag bei den Kontrollmäusen durchgeführt, gefolgt von der Opferung aller beteiligten Mäuse zur Entnahme ihrer Cochleae. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
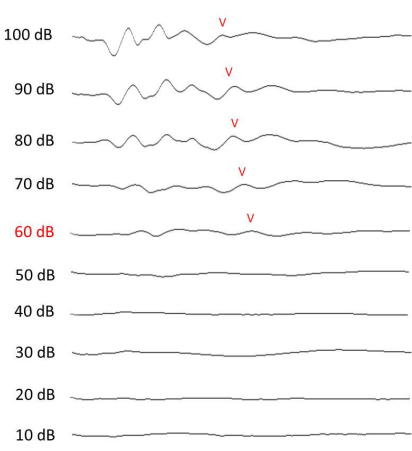
Abbildung 4: ABR-Messung des Gehörs. Repräsentative ABR-Ergebnisse bei 12 kHz, erhoben am 13. Tag (1 Woche nach der Lärmexposition). Die Welle V ist bei jeder Intensität beschriftet, wenn sie erkennbar ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Hörschwellen gemessen am 6. und 13. Tag. Die Hörschwelle bei Frequenzen von (A) 12 kHz, (B) 24 kHz und (C) 32 kHz. Für die Analyse wurde ein Zwei-Wege-ANOVA-Test verwendet, gefolgt von einer Bonferroni-Korrektur. *p < 0,05, ***p < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
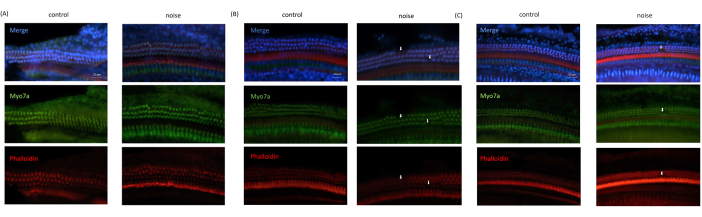
Abbildung 6: Ergebnisse der Immunfluoreszenz-Bildgebung aus OC . (A) Bild aus der apikalen Drehung der Cochlea. (B) Bild aus der mittleren Windung der Cochlea. (C) Bild von der Basisdrehung der Cochlea. Blau: mit DAPI gefärbte Zellkerne; Grün: Haarzellen, die mit Myo7A gefärbt sind; Rot: Zytoskelett mit Phalloidin gefärbt. Pfeile zeigen den Verlust von OHCs an. Maßstabsleiste = 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzungsdatei 1: Spannungsberechnung aus der Kalibrierung. Für jede spezifische Frequenz wird der Wert der ausgewählten Spannung (horizontale Achse) in die Kalibrierungskurve eingegeben, um den entsprechenden Schallpegel (vertikale Achse) zu erhalten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die NIHL kann in zwei Arten unterteilt werden: die temporäre NIHL, die eine zeitliche Verschiebung der Hörschwelle zeigt, und die permanente NIHL, die durch eine permanente Verschiebung der Hörschwelle gekennzeichnet ist. Es wird angenommen, dass der Hörverlust, den wir am 6. Tag (1 Tag nach der Lärmexposition) beobachtet haben, eine Kombination dieser beiden Arten ist. In diesem Fall würde sich die Hörschwelle aufgrund der zeitlichen Komponente des Hörverlusts im Laufe der Zeit allmählich erholen. In unseren vorläufigen experimentellen Studien, den Ergebnissen, die mit dem gleichen Aufbau und den gleichen Tieren erzielt wurden, erholte sich der Hörverlust, der durch die 2-tägige Lärmexposition verursacht wurde, innerhalb von 2 Wochen vollständig, was darauf hindeutet, dass kein dauerhaftes NIHL tatsächlich erzeugt wurde. Im Gegenteil, in dieser Studie wird vorgeschlagen, dass der durch die 5-tägige Lärmexposition verursachte Hörverlust eine dauerhafte Komponente enthält, da die Hörschwelle am 13. Tag (1 Woche nach der Lärmexposition) immer noch signifikant höher war als der Kontrollpegel.
Eine der Einschränkungen des aktuellen Protokolls besteht darin, dass wir die bei 12 kHz detektierte Hörschwelle verwendet haben, um die tieffrequente Hörschwelle der Mäuse darzustellen, die der apikalen Drehung der Cochlea entspricht. Streng genommen ist die apikale Drehung der Cochlea bei 4 kHz bis 8 kHz schallempfindlicher12. Diese Einschränkung schmälert jedoch den Wert dieser Studie und dieses Protokolls kaum, da das vorgestellte Protokoll jedes Detail der Operationsschritte enthält und Geräte verwendet, die an der Modellerstellung beteiligt sind. Die meisten der vorgestellten Parameter, wie z.B. Lärmexpositionsdauer, Lärmfrequenzen, Stimulusfrequenzen für ABR und Zeitpunkt der Durchführung der ABR-Tests und Tieropfer, können in zukünftigen Studien für verschiedene Zwecke verändert und weiter optimiert werden.
Offenlegungen
Kein Interessenkonflikt offenzulegen.
Danksagungen
Wir danken den Zuschüssen des Ministeriums für Wissenschaft und Technologie (MOST) der taiwanesischen Regierung (MOST 110-2314-B-715-005, MOST 111-2314-B-715-009-MY3) und den internen Forschungszuschüssen des Mackay Medical College (MMC-RD-110-1B-P030, MMC-RD-111-CF-G002-03).
Materialien
| Name | Company | Catalog Number | Comments |
| 1/4" CCP Free-field Standard Microphone Set | GRAS | 428158 | For noise exposure |
| Amplifier Input Module, AMI100D | BIOPAC | For auditory brainstem response | |
| Bio-amplifier, BIO100C | BIOPAC | For auditory brainstem response | |
| Bovine Serum Albumin | SIGMA | A9647 | Immunofluorescence staining |
| Cellsens software | Olympus life science | Image acquisition | |
| Corrugated plastic | |||
| DAPI fluoromount | SouthernBiotech | 0100-20 | Immunofluorescence staining |
| Ethylenediaminetetraacetic acid | SIGMA | E5134 | Decalcification |
| Evoked Response Amplifier, ERS100C | BIOPAC | For auditory brainstem response | |
| Formaldehyde | APLHA | F030410 | Fixation of cochlear |
| High Performance Data Acquisition System, MP160 | BIOPAC | For auditory brainstem response | |
| Modular Extension Cable, MEC110C | BIOPAC | For auditory brainstem response | |
| Myo7A primary antibody | Proteus | 25-6790 | Immunofluorescence staining |
| Myo7A secondary antibody | Jackson immunoresearch | 711-545-152 | Immunofluorescence staining |
| Needle Electrode, Unipolar 12 mmTp, EL452 | BIOPAC | For auditory brainstem response | |
| phalloidin antibody | Alexa Fluor | A12381 | Immunofluorescence staining |
| phosphate-buffered saline | SIGMA | P4417 | |
| Rat trap cage | 14 cm x 17 cm x 24cm | ||
| ROMPUN- xylazine injection, solution | Bayer HealthCare, LLC | ||
| Sound amplifier, MT-1000 | unika | For noise exposure | |
| Sound generator/analyzer/miscellaneous, FW-02 | CLIO | 620300719 | For noise exposure |
| Soundproof chamber | IEA Electro-Acoustic Technology | For noise exposure and ABR | |
| Speaker | IEA Electro-Acoustic Technology | For noise exposure | |
| Stimulator Module, STM100C | BIOPAC | For auditory brainstem response | |
| Triton X-100 | SIGMA | T8787 | Immunofluorescence staining |
| Tubephone Set, OUT101 | BIOPAC | For auditory brainstem response | |
| Upright Microscope, BX53 | Olympus | Image acquisition | |
| Zoletil | Virbac |
Referenzen
- World Report on Hearing. World Health Organization Available from: https://www.who.int/publications/i/item/9789240020481 (2021)
- Fernandez, K. A., et al. Noise-induced cochlear synaptopathy with and without sensory cell loss. Neuroscience. 427, 43-57 (2020).
- Kujawa, S. G., Liberman, M. C. Adding insult to injury: cochlear nerve degeneration after "temporary" noise-induced hearing loss. The Journal of Neuroscience. 29 (45), 14077-14085 (2009).
- Wang, J., et al. Overexpression of X-linked inhibitor of apoptosis protein protects against noise-induced hearing loss in mice. Gene Therapy. 18 (6), 560-568 (2011).
- Takeda, S., Mannström, P., Dash-Wagh, S., Yoshida, T., Ulfendahl, M. Effects of aging and noise exposure on auditory brainstem responses and number of presynaptic ribbons in inner hair cells of C57BL/6J mice. Neurophysiology. 49 (5), 316-326 (2017).
- Rouse, S. L., Matthews, I. R., Li, J., Sherr, E. H., Chan, D. K. Integrated stress response inhibition provides sex-dependent protection against noise-induced cochlear synaptopathy. Scientific Reports. 10 (1), 18063 (2020).
- Amanipour, R. M., et al. Noise-induced hearing loss in mice: Effects of high and low levels of noise trauma in CBA mice. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2018, 1210-1213 (2018).
- Edderkaoui, B., Sargsyan, L., Hetrick, A., Li, H. Deficiency of duffy antigen receptor for chemokines ameliorated cochlear damage from noise exposure. Frontiers in Molecular Neuroscience. 11, 173 (2018).
- Hultcrantz, M., Simonoska, R., Stenberg, A. E. Estrogen and hearing: a summary of recent investigations. Acta Oto-laryngologica. 126 (1), 10-14 (2006).
- Tsai, S. C. -. S., et al. The intravenous administration of skin-derived mesenchymal stem cells ameliorates hearing loss and preserves cochlear hair cells in cisplatin-injected mice: SMSCs ameliorate hearing loss and preserve outer hair cells in mice. Hearing Research. 413, 108254 (2022).
- Choi, M. Y., Yeo, S. W., Park, K. H. Hearing restoration in a deaf animal model with intravenous transplantation of mesenchymal stem cells derived from human umbilical cord blood. Biochemical and Biophysical Research Communications. 427 (3), 629-636 (2012).
- Yu, S. -. K., et al. Morphological and functional evaluation of ribbon synapses at specific frequency regions of the mouse cochlea. Journal of Visualized Experiments. (147), e59189 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten