Method Article
Test CAM-Delam per valutare le proprietà metastatiche quantificando la capacità di delaminazione e invasione delle cellule tumorali
In questo articolo
Riepilogo
Il test CAM-Delam per valutare la capacità metastatica delle cellule tumorali è relativamente veloce, facile ed economico. Il metodo può essere utilizzato per svelare i meccanismi molecolari che regolano la formazione di metastasi e per lo screening farmacologico. Un test ottimizzato per l'analisi di campioni di tumore umano potrebbe essere un metodo clinico per il trattamento personalizzato del cancro.
Abstract
La principale causa di decessi correlati al cancro è la formazione di metastasi (cioè, quando le cellule tumorali si diffondono dal tumore primario agli organi distanti e formano tumori secondari). La delaminazione, definita come la degradazione della lamina basale e della membrana basale, è il processo iniziale che facilita la trasmigrazione e la diffusione delle cellule tumorali ad altri tessuti e organi. Il punteggio della capacità di delaminazione delle cellule tumorali indicherebbe il potenziale metastatico di queste cellule.
Abbiamo sviluppato un metodo standardizzato, il test ex ovo CAM-Delam, per visualizzare e quantificare la capacità delle cellule tumorali di delaminato e invadere, potendo così valutare l'aggressività metastatica. In breve, il metodo CAM-Delam include la semina di cellule tumorali in anelli di silicone sulla membrana corioallantoica del pulcino (CAM) al giorno embrionale 10, seguita dall'incubazione da ore a pochi giorni. Il test CAM-Delam include l'uso di una camera interna umidificata durante l'incubazione dell'embrione di pulcino. Questo nuovo approccio ha aumentato la sopravvivenza degli embrioni dal 10% -50% all'80% -90%, che ha risolto precedenti problemi tecnici con bassi tassi di sopravvivenza degli embrioni in diversi test CAM.
Successivamente, i campioni CAM con cluster di cellule tumorali associati sono stati isolati, fissati e congelati. Infine, i campioni a sezione criostata sono stati visualizzati e analizzati per danni alla membrana basale e invasione delle cellule tumorali utilizzando l'immunoistochimica. Valutando varie linee cellulari tumorali metastatiche e non metastatiche note progettate per esprimere la proteina fluorescente verde (GFP), i risultati quantitativi CAM-Delam hanno mostrato che i modelli di capacità di delaminazione riflettono l'aggressività metastatica e possono essere valutati in quattro categorie. L'uso futuro di questo test, oltre a quantificare la capacità di delaminazione come indicazione dell'aggressività metastatica, è quello di svelare i meccanismi molecolari che controllano la delaminazione, l'invasione, la formazione di micrometastasi e i cambiamenti nel microambiente tumorale.
Introduzione
Circa il 90% della mortalità nei pazienti oncologici è causata dalle conseguenze delle metastasi tumorali, che è la formazione di tumori secondari in altre parti del corpo da dove il cancro ha originariamente avuto origine1. È quindi importante identificare meccanismi correlati alla metastatica per trovare potenziali bersagli per sopprimere la formazione di metastasi tumorali. Successivamente, vi è la necessità di sistemi modello in cui il processo metastatico può essere valutato.
Durante le metastasi, le cellule tumorali subiscono la transizione epiteliale-mesenchimale (EMT), un normale processo cellulare in cui le cellule epiteliali perdono le loro proprietà di aderenza e polarità e acquisiscono invece un carattere mesenchimale invasivo2. La delaminazione fa parte del processo EMT e comporta la degradazione della laminina nella membrana basale, che è un prerequisito per le cellule tumorali per lasciare il tumore primario e invadere altri tessuti. I principali fattori che sono sovraregolati durante la formazione di metastasi includono metalloproteinasi della matrice (MMP), ADAM (una disintergina e metalloproteinasi), ADAMTS (ADAM con motivi trombospoponidina) e MMP di tipo membrana (MT-MMP)3,4. Questi fattori degradano molecole come la laminina, che è espressa in tutte le membrane basali, per facilitare la migrazione e l'invasione cellulare.
La membrana corioallantoica (CAM) di un uovo di pulcino fecondato è un tipo di membrana basale. Le uova di pulcino fecondate sono state utilizzate come modelli metastatici, in cui le cellule tumorali sono state seminate sulla CAM extraembrionale e successivamente sulla formazione di metastasi osservata negli embrioni di pulcino5. Inoltre, vengono spesso utilizzati modelli metastatici murini in vivo , in cui le cellule tumorali vengono impiantate nei topi e vengono analizzate le metastasi in vari organi6. Questo approccio richiede tempo, è costoso e può causare disagio agli animali. Per risolvere questo problema, abbiamo sviluppato il test CAM-Delam, un modello più veloce ed economico per valutare l'aggressività metastatica delle cellule tumorali. In questo modello, la capacità delle cellule tumorali di degradare il CAM del pulcino (ad esempio, la capacità di delaminazione) è combinata con la potenziale invasione delle cellule tumorali nel mesenchima e utilizzata come misura dell'aggressività metastatica.
Il presente articolo, basato su una precedente pubblicazione7, descrive il test CAM-Delam in dettaglio, dalla manipolazione delle uova di pulcino fecondato, alla coltura e semina delle cellule tumorali, alla dissezione e alle analisi dei campioni CAM, al punteggio della capacità di delaminazione delle cellule tumorali in quattro categorie: intatte, alterate, danneggiate e invasione. Forniamo anche esempi di come questo test può essere utilizzato per determinare i meccanismi molecolari che regolano il processo di delaminazione.
Protocollo
In breve, la Figura 1 riassume i passaggi generali del test CAM-Delam. Il protocollo sottostante si basa su 30 uova di gallina fecondate in coltura e sull'uso di due diverse linee cellulari tumorali seminate separatamente in tre anelli / uovo e analizzate in quattro punti temporali.
1. Incubazione delle uova
- Utilizzare uova di pulcino fecondate da un incubatoio locale, che garantiscono oltre il 90% di fecondazione
NOTA: Le uova non devono essere state conservate per più di 4 giorni a temperatura ambiente (RT). In Svezia, il permesso etico per l'uso sperimentale di polli embrionali è richiesto solo a partire dal giorno embrionale (E) 14 e oltre. - Se necessario, pulire accuratamente meccanicamente lo sporco o le piume sulle uova usando un tovagliolo di carta asciutto o bagnato in acqua.
- Pulire e sterilizzare l'incubatrice per uova con il 70% di etanolo prima dell'uso (ogni volta).
- Posizionare il numero desiderato di uova in vassoi per uova e incubare le uova di pulcino orizzontalmente in un'incubatrice per uova a 37,5-38 °C con il 70% di umidità. Considera questo come il giorno di incubazione 0 (Figura 1A).
2. Preparazione di barche di pesatura, scatole di plastica e strumenti di dissezione
- Utilizzare il 70% di etanolo per sterilizzare 30 barche pesate e 30 piccole scatole di plastica (~ 0,4 L) con tappi trasparenti.
- Asciugare le barche e le scatole di pesatura in una cappa laminare durante la notte (ON) e conservare in una scatola di plastica chiusa fino a un ulteriore utilizzo il giorno di incubazione 3.
- Sterilizzare 2 L di H2O distillati o deionizzati per 30 uova incubate.
- Sterilizzare due paia di forbici e tre paia di pinze spruzzando il 70% di etanolo. Asciugare all'aria gli strumenti e poi conservarli in una scatola sterilizzata fino al giorno di incubazione 3.
NOTA: queste azioni (passaggi 2.1-2.4) possono essere eseguite qualsiasi giorno prima del giorno di incubazione 3. Utilizzare guanti per evitare la contaminazione.
3. Apertura delle uova e trasferimento nella camera interna umidificata
NOTA: utilizzare guanti e una mascherina per evitare contaminazioni.
- Aggiungere circa 50 ml di H2O sterilizzato alle scatole di plastica sterilizzate. Tenere le scatole piene d'acqua con coperchi chiusi, per evitare contaminazioni, a RT fino all'uso.
- Il giorno 3 dell'incubazione, rompere il guscio d'uovo usando la parte affilata delle forbici e tagliare un'apertura diritta nel guscio.
- Rompere manualmente il guscio d'uovo su una barca di pesatura e raccogliere l'albume, il tuorlo e il suo embrione sano attaccato nella barca di pesatura (Figura 1B). Cerca un embrione intatto con un cuore pulsante, un tuorlo intatto e vasi sanguigni sviluppati per l'esperimento (>95% delle uova incubate). Scartare le uova con un embrione malformato, un embrione senza un cuore pulsante, un tuorlo d'uovo rotto o vasi sanguigni del tuorlo danneggiati.
- Trasferire delicatamente la barca di pesatura in una camera interna umidificata.
NOTA: per i passaggi 3.2.-3.4., lavorare il più velocemente possibile per evitare la contaminazione e, se possibile, utilizzare una cappa laminare. - Incubare la camera interna umidificata nell'incubatrice delle uova (Figura 1C).
- Coltivate le uova senza guscio dal giorno 3 al giorno 10 nell'incubatrice prima di essere utilizzate (vedere il punto 3.6.) e, se necessario, aggiungere acqua all'incubatrice per mantenere il 70% di umidità.
- Controllare ogni giorno le camere interne umidificate attraverso il coperchio di plastica trasparente per embrioni morti o uova contaminate senza guscio e rimuoverle dall'incubatrice.
4. Preparazione di anelli in silicone
- Per preparare anelli in silicone, tagliare un tubo di silicone con un diametro interno ed esterno di 4 mm e 5 mm, rispettivamente, in ~ 1 mm di spessore, preferibilmente utilizzando un tagliacarte (Figura 1D).
- Trasferire gli anelli di silicone in piccole bottiglie di vetro (Figura 1D), coprire con un foglio di metallo e sterilizzarli con un'autoclave o simile.
NOTA: Evitare ripetute autoclavi di anelli di silicone inutilizzati che potrebbero essere contaminati, poiché tale trattamento riduce la capacità degli anelli in silicone di attaccarsi alla membrana, con successiva perdita della soluzione di cellule tumorali / collagene / RPMI al di fuori degli anelli. - Conservare gli anelli in silicone sterile a RT.
NOTA: questo passaggio può essere eseguito in qualsiasi giorno prima del giorno di incubazione 10.
5. Preparazione delle cellule tumorali
NOTA: soluzioni come il terreno di coltura cellulare, la tripsina e 1x PBS vengono conservate a 4 °C e devono essere riscaldate a 37 °C a bagnomaria prima di aggiungerle alle cellule. Dopo il riscaldamento, sciacquare le bottiglie con etanolo al 70% e asciugarle prima dell'uso.
- Coltivare le linee cellulari tumorali di interesse nel relativo terreno di coltura in un incubatore di colture cellulari a 37 °C in presenza del 5% (v/v) di CO2.
NOTA: Qui, le cellule di glioblastoma U251-GFP e PC-3U-GFP del cancro alla prostata sono state coltivate in mezzo RPMI medio-RPMI completo integrato con il 10% (v / v) di siero bovino fetale (FBS) e l'1% (v / v) di penicillina-streptomicina (PS). - Pianificare la coltura delle cellule tumorali in modo che circa 50 × 106 cellule tumorali siano pronte per la raccolta il giorno di incubazione 10 del test CAM-Delam.
- Cambiare il terreno di coltura cellulare ogni 2-3 giorni, o quando il colore medio cambia da rosa ad arancione/giallo.
- Facoltativo: Indurre l'ipossia trattando le cellule tumorali con CoCl2 per studiare gli effetti meccanicistici molecolari sulla delaminazione 1 giorno prima della raccolta cellulare.
ATTENZIONE: CoCl2 ha una tossicità moderata. Maneggiare con cura in una cappa aspirante e seguire le istruzioni del produttore.- Preparare una soluzione madre fresca di CoCl2 da 20 mM sciogliendo 0,0258 g in 10 ml di H20 distillato sterilizzato in un tubo conico da 15 mL avvolto con un foglio di alluminio per proteggere dalla luce.
- In un tubo conico da 50 mL, miscelare 250 μL della soluzione madre CoCl2 da 20 mM in 25 mL di mezzo RPMI integrato con l'1% (v/v) PS (ma senza FBS) per una piattaforma di coltura cellulare di 15 cm di diametro. Vortice delicatamente.
- Rimuovere il mezzo RPMI completo dalle piastre di coltura cellulare.
- Lavare le cellule con 1x PBS 2x sterilizzato.
- Aggiungere 25 mL di mezzo RPMI con tripsinizzazione a 2 celle CoCl2 da 200 μM (vedere Passaggio 5.6).
- Il giorno 10 dell'incubazione delle uova, preparare 1 mL di una miscela collagene/RPMI (rapporto 1:3), contenente 250 μL di collagene di tipo I (5 mg/mL) e 750 μL di terreno di coltura cellulare RPMI integrato con il 10% di FBS e l'1% (v/v) di PS. Mantenere la miscela di collagene/RPMI sul ghiaccio.
- Tripsinizzare le cellule tumorali per isolare le cellule rimuovendo prima il terreno di coltura cellulare e lavare 2x con 1x PBS.
- Aggiungere 3 ml di soluzione di tripsina (0,05%) per piatto di coltura cellulare di 15 cm di diametro e incubare per 2-3 minuti in un incubatore di colture cellulari fino a quando le cellule si staccano. Utilizzare un microscopio invertito da tavolo per vedere le cellule staccate. Se necessario, picchiettare delicatamente il lato del pallone per rimuovere le cellule raggruppate o attaccate rimanenti.
- Inattivare la tripsina aggiungendo 5 ml di mezzo RPMI completo a ciascun piatto di coltura cellulare e raccogliere la sospensione cellulare da tutte le piastre di coltura cellulare in un tubo da 50 ml.
- Conta le cellule tumorali con il metodo di esclusione Trypan Blue per distinguere le cellule vive da quelle morte usando un contatore di cellule. Aggiungere 10 μL della sospensione cellulare a 10 μL di colorazione blu tripano allo 0,4%. Mescolare il campione tubando su e giù alcune volte, quindi caricare 10 μL della miscela cellulare per camera nel vetrino del campione nel contatore cellulare. Ripetere il conteggio delle celle 3 volte per verificare il numero di cella/ml.
- Calcolare e centrifugare la sospensione di coltura cellulare di volume corretto contenente 50 x 106 cellule tumorali vive in un tubo da 50 ml a 500 × g per 5 minuti.
- Scartare il surnatante e mescolare il pellet cellulare con 1 mL della miscela di collagene/RPMI. Poiché il collagene è un materiale gelatinoso, mescolare le cellule molto lentamente e con attenzione con una pipetta da 1 mL per evitare di perdere cellule nella formazione di bolle.
- Mantenere la sospensione cellulare preparata sul ghiaccio e portarla nell'area di lavoro delle uova.
NOTA: Evitare di mantenere le cellule tumorali preparate sul ghiaccio per troppo tempo. Le cellule tumorali preparate devono essere posizionate sul CAM entro 15-25 minuti.
6. Semina delle cellule tumorali sul CAM
NOTA: utilizzare guanti e una mascherina per evitare contaminazioni.
- Al giorno di incubazione 10, estrarre le camere interne umidificate con le uova incubate senza guscio dall'incubatrice.
NOTA: Circa il 90% del numero iniziale di uova incubate può essere utilizzato; vedere la Figura 2. - Aprire la camera interna umidificata e posizionare fino a sei anelli in silicone sul CAM utilizzando una pinza sterilizzata.
NOTA: Evitare di posizionare gli anelli di silicone l'uno vicino all'altro o vicino a vasi sanguigni più grandi. - Mescolare la sospensione delle cellule tumorali mediante pipettaggio per ottenere una distribuzione uniforme delle cellule tumorali e aggiungere 20 μL (1 × 106 cellule) della sospensione di cellule tumorali preparata all'interno di un anello di silicone (Figura 1E). Quando si aggiungono le celle, tenere la punta della pipetta sopra il CAM per assicurarsi di non danneggiare la membrana.
NOTA: Secondo i risultati precedenti7, diverse cellule tumorali possono essere seminate in anelli separati sullo stesso CAM. - Chiudere la camera interna umidificata e metterla nell'incubatrice delle uova.
7. Isolamento della CAM con cellule tumorali associate
- Dopo 14 ore, 1,5 giorni, 2,5 giorni e 3,5 giorni di incubazione, estrarre circa sette camere interne umidificate e aprire i coperchi uno alla volta.
- Con un paio di forbici, sezionare le cellule tumorali in coltura attaccate al CAM (i cosiddetti campioni CAM-Delam) tagliando all'esterno dell'anello di silicone (Figura 1F).
- Trasferire immediatamente il campione ISOLATO CAM-Delam utilizzando una pinza al 4% di paraformaldeide (PFA) in tampone fosfato (PB) da 0,1 M in una capsula di Petri per la fissazione del tessuto. Tenere sul ghiaccio o a 4 °C per 1 ora.
NOTA: Conservare la soluzione di PFA al 4% a 4 °C per un massimo di 5 giorni. ATTENZIONE: il PFA è tossico. Quando si maneggiano polveri pfa e soluzioni PFA, utilizzare una cappa aspirante e indossare una maschera facciale e guanti. Evitare di inalare polvere o vapori di soluzione. Seguire le istruzioni del produttore. - Decapitare gli embrioni di pollo e scartarli come rifiuti biologici in appositi contenitori.
- Rimuovere la soluzione di PFA al 4% e aggiungere il 30% di saccarosio in 0,1 M PB ai campioni CAM-Delam ed equilibrare a 4 °C per 1 ora.
- Al microscopio di dissezione, rimuovere con attenzione l'anello di silicone usando una pinza. Con un paio di forbici, tagliare il campione CAM-Delam in una forma rettangolare con le cellule tumorali al centro (Figura 1G).
- Con un paio di pinze, trasferire i campioni CAM-Delam su un mezzo di sezione congelato in una capsula di Petri per rimuovere il saccarosio in eccesso e quindi incorporare stampi in un mezzo di sezione congelato.
- Al microscopio a dissezione, posizionare il campione CAM-Delam a forma di U in direzione verticale negli stampi di incorporamento utilizzando qualsiasi strumento aghiforme (Figura 1G).
- Congelare e conservare i campioni CAM-Delam a -80 °C.
8. Sezionamento di campioni CAM-Delam
- Sezionare i campioni CAM-Delam congelati a 10 μm su 5-6 vetrini consecutivi utilizzando la criosezione.
- Conservare i vetrini con sezioni a -80 °C o utilizzare direttamente per la colorazione immunoistochimica.
9. Colorazione immunoistochimica
- Portare i vetrini da -80 °C a RT per 5 minuti prima di iniziare l'immunoprotocollo.
- Crea una linea con un marcatore idrofobo sulle diapositive dove terminano le sezioni. Lasciateli asciugare per qualche minuto.
- Posizionare i vetrini in una camera umidificata (H2O) e coprire le sezioni con ~ 200-500 μL di soluzione bloccante (10% siero fetale per vitello e 0,1% sodio azide in soluzione salina tris-tamponata con 0,1% Triton X-100 [TBST]) e incubare per 15-30 minuti.
NOTA: Da questo passaggio in poi, non lasciare asciugare le diapositive in nessun momento. - Versare la soluzione bloccante e sostituirla con 100-150 μL dell'anticorpo primario di interesse diluito nella soluzione bloccante e incubare ON a 4 °C. Utilizzare preferibilmente l'anticorpo anti-laminina-111 di coniglio per definire la lamina basale insieme a un marcatore di cellule tumorali, se non si utilizza GFP o altre linee cellulari tumorali con tag fluorescenti.
NOTA: Qui, un coniglio anti-von Willebrand Factor è stato utilizzato anche per rilevare i vasi sanguigni nel CAM. - Preparare tre cuvette di vetro riempite con tampone TBST.
- Versare la soluzione anticorpale primaria, trasferire i vetrini nelle cuvette di vetro e lavare almeno 3 volte per 5 minuti ciascuno in TBST.
- Rimuovere il TBST in eccesso dal vetrino e dall'area della barriera idrofoba con un fazzoletto di carta morbida.
- Coprire il vetrino con 100-150 μL di un anticorpo fluorescente secondario adatto diluito in soluzione bloccante combinato con 4',6-diamidino-2-fenilindolo, dicloridrato (DAPI) e incubare al buio a RT per 1 ora.
- Versare la soluzione anticorpale secondaria, trasferire i vetrini nelle cuvette di vetro e lavare almeno 3 volte per 5 minuti ciascuno in TBST.
- Rimuovere il TBST in eccesso dal vetrino e dall'area della barriera idrofoba con un fazzoletto di carta morbida.
- Montare le diapositive mettendo 1-2 gocce di mezzo di montaggio fluorescente sulla diapositiva e posizionare delicatamente una copertura di vetro, evitando bolle d'aria.
- Lasciare asciugare i vetrini per almeno 1 ora a 4 °C prima dell'analisi e conservare i vetrini a 4 °C.
10. Imaging al microscopio e punteggio di delaminazione
- Fotografare le sezioni utilizzando un microscopio a epifluorescenza dotato di fotocamera digitale, preferibilmente con ingrandimento 10x (Figura 1H).
- Analizzare le sezioni utilizzando le seguenti categorie di punteggio CAM-Delam (Figura 3):
- Cerca la lamina basale intatta senza alterazioni visibili.
- Cerca la lamina basale alterata ma non danneggiata.
- Cerca lamina basale danneggiata senza invasione cellulare.
- Cerca lamina basale danneggiata con invasione cellulare.
Risultati
La Figura 1 presenta i passaggi chiave del test CAM-Delam7. L'uso di camere interne umidificate (Figura 1C) ha migliorato significativamente il tasso di sopravvivenza degli embrioni di pulcino dal <50% fino al 90% al giorno di incubazione 10 e dal ~ 15% fino all'80% al giorno di incubazione 13 (Figura 2).
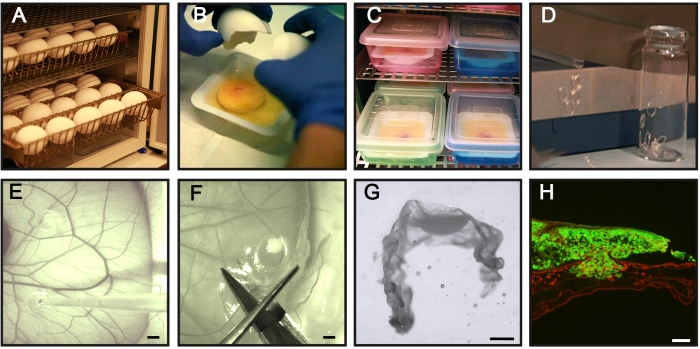
Figura 1: Fasi chiave del test CAM-Delam. (A) Incubare le uova di gallina fecondate orizzontalmente senza rotazione. (B,C) Il giorno 3 dell'incubazione, rompere le uova e metterle in barche sterili (B), e posizionare le barche in una camera interna umidificata per un'ulteriore incubazione (C). (D) Preparare anelli in silicone. (E) Il giorno 10 dell'incubazione, posizionare gli anelli di silicone sul CAM e seminare 1 x 106 cellule tumorali all'interno degli anelli usando una pipetta. (F,G) In diversi punti temporali (da ore a giorni), sezionare il CAM con cellule tumorali attaccate, (F) fissare in PFA, trattare con saccarosio, posizione in mezzo di sezione congelato, (G) e congelare in -80 ° C. (H) Un esempio di CAM sezionato con cellule tumorali GFP + associate (verde) e colorazione immunoistochimica della laminina (rosso). Barre di scala = 2 mm (E,F), 1 mm (G) e 100 μm (H). Questa cifra è tratta da Palaniappan et al.7. Abbreviazioni: CAM = membrana corioallantoica; PFA = paraformaldeide; GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Sopravvivenza dell'embrione di pollo in relazione al metodo di incubazione. (A,B) Al giorno di incubazione 10, la sopravvivenza dell'embrione di pollo negli HC interni è raddoppiata (valore medio 89,33; N = 105) rispetto all'incubazione in piastre di Petri (A; valore medio 40; N = 64) e camere non umidificate (B; valore medio 48,67; N = 46). (C,D) Il giorno di incubazione 13, un alto tasso di sopravvivenza è stato ancora osservato utilizzando HC (valore medio 81,67; N = 105), mentre una forte diminuzione della sopravvivenza embrionale è stata osservata utilizzando PD (C; valore medio 11,33; N = 64) e N-HC (D; valore medio 18,33; N = 46). La significatività statistica è stata testata utilizzando un t-test a due code spaiato. Le barre di errore indicano la deviazione standard. *p < 0,05, **p < 0,01, ***p < 0,001. Questa cifra è stata modificata da Palaniappan et al.7. Abbreviazioni: HC = camera umidificata; PD = piastre di Petri; N-HC = camera non umidificata; E X = Giorno di incubazione X. Fare clic qui per visualizzare una versione più grande di questa figura.
Le analisi di diverse linee cellulari tumorali che esprimono GFP (glioblastoma U251, prostata PC-3U, colon SW620 e polmone A549) utilizzando questo protocollo sono state riportate in precedenza da Palaniappan et al.7. I risultati del test CAM-Delam includono differenze nella morfologia della lamina basale, rilevate dalla laminina, e l'invasione delle cellule tumorali, definite come cellule che hanno attraversato lo strato di lamina basale del pulcino nello strato mesodermico del pulcino (Figura 3). Questi risultati mostrano che la capacità delle cellule tumorali di degradare la lamina basale e invadere il mesenchima può essere valutata in una delle quattro categorie: 1) lamina basale intatta senza alterazioni visibili (Figura 3B), 2) lamina basale alterata ma non danneggiata (Figura 3C), 3) lamina basale danneggiata senza invasione cellulare (Figura 3D) e 4) lamina basale danneggiata con invasione cellulare (Figura 3E). ). Un'altra osservazione è stata che, quando le cellule tumorali hanno causato una lamina basale alterata o danneggiata, la CAM è stata anche ispessita con un aumento della formazione dei vasi sanguigni, definita dalla colorazione anticorpale contro il fattore di von Willebrand, che è sintetizzato nei vasi sanguigni8 (Figura 4C-H). Questi due fenotipi, una CAM ispessita e una maggiore formazione di vasi sanguigni, non sono stati osservati quando la CAM era intatta (Figura 4A,B).

Figura 3: Punteggio CAM-Delam. (A-E) Un esempio di punteggio CAM-Delam basato sull'integrità della lamina basale CAM, visualizzata dall'anti-laminina (rosso) e dalla potenziale invasione delle cellule tumorali che esprimono GFP (verde). (A) Controllo CAM senza cellule tumorali. (B-E) Nelle risposte alle cellule tumorali, si possono segnare quattro categorie che descrivono la morfologia della lamina basale: (B) laminina intatta, (C) laminina alterata ma non danneggiata (indicata da un asterisco), (D) laminina danneggiata ma senza invasione delle cellule tumorali (frecce), laminina danneggiata con invasione cellulare (punte di freccia). Barra di scala = 100 μm (A-E). Questa cifra è tratta da Palaniappan et al.7. Abbreviazioni: CAM = membrana corioallantoica; GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Valutazione dell'ispessimento della CAM e della formazione dei vasi sanguigni. (A-H) Un esempio di visualizzazione dell'ispessimento cam e della formazione dei vasi sanguigni, rilevato dal fattore anti-Von Willebrand (rosso), in risposta alla lamina di vari tipi di cellule tumorali. (A,B) Controlla CAM senza cellule tumorali. (C,D) In risposta a una linea cellulare tumorale non metastatica (valutata come intatta), non è stato rilevato alcun evidente ispessimento del mesenchima o aumento della formazione dei vasi sanguigni. (E-H) In risposta alle cellule tumorali metastatiche con conseguente laminina alterata o danneggiata, il mesenchima è stato ispessito (indicato da doppie punte di freccia) ed è stato osservato un aumento della formazione dei vasi sanguigni (indicato da frecce). Barra della scala = 100 μm. Questa cifra è stata modificata da Palaniappan et al.7. Abbreviazioni: CAM = membrana corioallantoica; GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione più grande di questa figura.
Il glioblastoma U251 e le cellule tumorali della prostata PC-3U sono due esempi di linee cellulari tumorali con capacità di delaminazione completamente diverse (Figura 5). Le cellule PC-3U hanno indotto laminina danneggiata dopo 1,5 giorni, con chiara invasione dopo 2,5 giorni (Figura 5A). Al contrario, le cellule U251 hanno indotto solo lievi alterazioni della laminina dopo 1,5-3,5 giorni, ma non hanno mai causato alcun danno visibile alla laminina (Figura 5B).
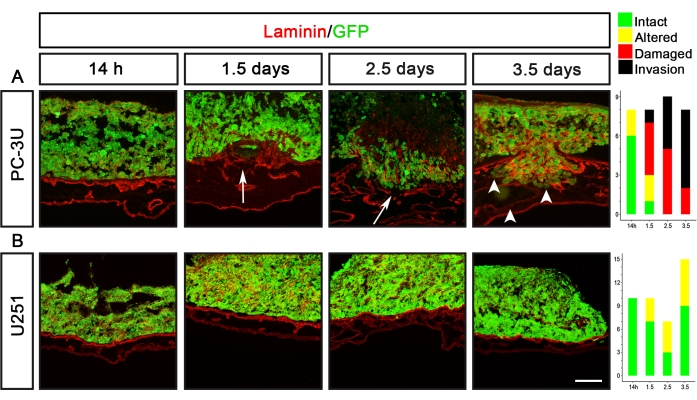
Figura 5: Visualizzazione della capacità di delaminazione delle cellule tumorali della prostata (PC-3U) e del glioblastoma (U251). (A) Le cellule PC-3U hanno indotto un'alterazione minore della laminina dopo 14 ore, il danno della laminina dopo 1,5 giorni (freccia) e l'inizio dell'invasione dopo 2,5 giorni, che è stata aumentata dopo 3,5 giorni (punte di freccia). (B) Le cellule U251 hanno causato una lieve alterazione della laminina dopo 1,5-3,5 giorni. I pannelli di destra mostrano grafici che rappresentano il punteggio CAM-Delam. L'asse y indica il numero di campioni e l'asse x indica i punti temporali della cultura. Barra di scala = 100 μm (A,B). Questa cifra è stata modificata da Palaniappan et al.7. Abbreviazioni: CAM = membrana corioallantoica; GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione più grande di questa figura.
Il test CAM-Delam può essere utilizzato per definire i meccanismi molecolari che regolano il processo di delaminazione. Un esempio è l'uso del trattamento con CoCl2 per indurre ipossia con o senza la combinazione di metalloproteinasi della matrice inibitoria (MMP) utilizzando l'ampio inibitore MMP GM6001 (Figura 6). Dopo il trattamento con CoCl2 , le cellule tumorali non metastatiche U251 hanno acquisito la capacità di indurre delaminazione e cellule invasive, che è stata soppressa quando il trattamento con CoCl2 è stato combinato con l'inibitore MMP GM6001 (Figura 6). Pertanto, il test CAM-Delam può essere utile quando si definiscono molecole e percorsi molecolari che influenzano il processo di delaminazione.

Figura 6: Modelli di delaminazione in risposta a cellule U251 esposte a CoCl2 da sole o insieme a un inibitore MMP. (A-C) Cellule U251 coltivate per 3,5 giorni sul CAM durante varie condizioni. (A) Le cellule U251 coltivate da sole non hanno indotto alcun danno alla laminina. (B) Cellule U251 coltivate preesposte a CoCl2 (24 ore) prima del lavaggio e della semina cellulare sul danno da laminina indotta dalla CAM e sull'invasione cellulare. (C) Il pretrattamento con un inibitore MMP ad ampio spettro GM6001 (per 1 ora), seguito dall'esposizione a CoCl2 (24 ore) prima del lavaggio e della semina delle cellule U251 sul CAM, ha soppresso l'effetto del trattamento con CoCl2 e non è stato rilevato alcun danno evidente alla laminina o invasione delle cellule tumorali. Barra della scala = 100 μm (A-C). I pannelli (B) e (C) sono di Palaniappan et al.7. Abbreviazioni: CAM = membrana corioallantoica; GFP = proteina fluorescente verde; CoCl2 = cloruro di cobalto; MMP = metalloproteinasi della matrice. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo articolo descrive il test CAM-Delam per valutare l'aggressività metastatica delle cellule tumorali, determinata dal punteggio delle modulazioni della lamina basale e della potenziale invasione cellulare nel mesenchima entro un periodo di ore o pochi giorni. Un precedente problema tecnico per vari test CAM è stata la bassa sopravvivenza degli embrioni di pulcino. Questo problema è stato risolto introducendo l'uso di una camera interna umidificata durante l'incubazione dell'embrione, che ha aumentato la sopravvivenza dell'embrione dal 10% -50% all'80%-90%7. L'uso di una camera umidificata interna può quindi essere utile nei saggi CAM in generale, così come in altri esperimenti ex ovo chick.
I punti di tempo di punteggio presentati a 14 ore, 1,5 giorni, 2,5 giorni e 3,5 giorni dopo la semina di 1 x 106 cellule tumorali sul CAM si basano su uno sviluppo rigoroso del metodo che utilizza sei diverse linee cellulari tumorali e sono sufficienti per distinguere l'intervallo dalle capacità non delaminate a quelle delaminanti con invasione delle linee cellulari tumorali. Si suggerisce un uso minimo di quattro uova con tre anelli ciascuno per punto temporale e per linea cellulare, e questo dovrebbe essere ripetuto almeno una volta o secondo i disegni sperimentali e i requisiti statistici. Un vantaggio del test CAM-Delam è l'ottenimento di risultati informativi sulla capacità di delaminazione delle cellule tumorali entro pochi giorni per stimare l'aggressività delle cellule tumorali e il potenziale rischio di formazione di metastasi. La rapida consegna dei risultati è facilitata dal monitoraggio della degradazione della lamina basale dovuta all'invasione delle cellule tumorali e delle successive microtumorali/gemme tumorali e metastasi d'organo. Tradizionalmente, i modelli CAM sono stati utilizzati per analizzare la formazione di metastasi d'organo, che richiede circa 2 settimane per essere determinata9. Utilizzando sette diverse linee cellulari tumorali, abbiamo precedentemente verificato7 che il punteggio di delaminazione è legato alla capacità delle cellule tumorali di formare metastasi nei modelli di roditori 10,11,12,13,14, che supporta il valore predittivo del test CAM-Delam. Inoltre, i modelli murini richiedono un tempo ancora più lungo, diverse settimane fino a mesi, prima che le metastasi possano essere esaminate15,16. In breve, questo test CAM-Delam sviluppato, focalizzato sulla capacità di delaminazione del punteggio e non sull'esame della successiva formazione tumorale nell'embrione di pulcino, è, quindi, un buon complemento all'invasione CAM di pollo esistente e ai modelli tumorali murini.
Una limitazione nel test CAM-Delam può essere la visualizzazione poco chiara della lamina basale se le cellule tumorali stesse esprimono laminina. In tal caso, altri marcatori che indicano la lamina basale, come E-caderina, potrebbero essere utilizzati7. Altri studi di invasione CAM hanno utilizzato il collagene di tipo IV per visualizzare la CAM e la pan-citocheratina e la vimentina per identificare le cellule tumorali invasori e la formazione di microtumori / gemme tumorali17,18.
La delaminazione è un normale processo cellulare, sia durante lo sviluppo che più tardi nella vita, che consente alle cellule di lasciare un epitelio e migrare verso altri tessuti. Esempi di cellule delaminate durante lo sviluppo sono la cresta neurale e i neuroni pionieri olfattivi19,20; più tardi nella vita, la guarigione delle ferite dipende dalla delaminazione21. Durante il cancro, questo processo è sovraregolato nelle cellule sbagliate e / o nel momento sbagliato. Pertanto, il metodo CAM-Delam può essere utile per svelare i meccanismi molecolari che regolano la delaminazione, che sarebbe importante sia per le conoscenze biologiche di base che per le malattie. Tali studi di delaminazione includerebbero l'aggiunta di fattori di interesse per le cellule tumorali seminate sul CAM o lo studio di cellule tumorali geneticamente modificate. Un esempio qui presentato è il pretrattamento CoCl2 della linea cellulare non metastatica U251 per indurre ipossia, che porta all'induzione di una capacità aggressiva metastatica che potrebbe essere soppressa da un inibitore MMP ad ampio spettro. Pertanto, trovare molecole chiave che controllano la delaminazione aumenta la possibilità di progettare inibitori per sopprimere questo processo. In relazione a questo, un altro potenziale utilizzo del protocollo CAM-Delam è nello screening farmacologico per la soppressione della delaminazione e dell'invasione cellulare. Inoltre, nella clinica, la valutazione della gravità del cancro è una componente critica per la diagnosi, la pianificazione del trattamento e la cura. Attualmente, il sistema di stadiazione TNM (T, dimensione del tumore; N, nodo-se il cancro si è diffuso ai linfonodi; M, metastasi a distanza) è usato per valutare la gravità del cancro22. Il test CAM-Delam definisce un approccio innovativo per valutare l'aggressività delle cellule tumorali e il potenziale rischio di formazione di metastasi e potrebbe essere un utile complemento al sistema di stadiazione TNM. Notevole è che la stadiazione TNM si basa sulle analisi di campioni di tessuto fissi, mentre un potenziale approccio clinico CAM-Delam esaminerebbe il tessuto fresco o fresco congelato in combinazione con tecniche per far rivivere le cellule congelate23.
Divulgazioni
Gli autori non hanno interessi concorrenti da divulgare.
Riconoscimenti
Ringraziamo i seguenti ricercatori dell'Università di Umeå per il loro aiuto con linee cellulari e anticorpi tumorali rilevanti: L. Carlsson (anticorpo von Willebrand Factor), J. Gilthorpe (U251) e M. Landström (PC-3U). Ringraziamo anche Hauke Holthusen nel laboratorio Gilthorpe per la generazione della linea cellulare stabile HEK293-TLR-AAVS1. Il lavoro nel laboratorio di Gunhaga è stato sostenuto dalla Swedish Cancer Foundation (18 0463), dall'Umeå Biotech Incubator, dal Norrlands Cancerforskningsfond, dallo Swedish Research Council (2017-01430) e dalla Facoltà di Medicina dell'Università di Umeå.
Materiali
| Name | Company | Catalog Number | Comments |
| EQUIPMENT | |||
| Centrifuge | Rotanta 480 R, Hettich zentrifugen | ||
| Countess II FL Automated Cell Counter | Invitrogen | ||
| Cryostat | HM 505 E, Microm | ||
| Digital camera | Nikon DS-Ri1 | ||
| Dissection Microscope | Leica M10 | For CAM-sample dissection and positioning in molds | |
| Egg incubator | Fiem | Many other sources are available. Must be cleaned and sterilized with 70 % ethanol before each use | |
| Epifluorescence microscope | Nikon Eclipse, E800 | Equiped with a digital camera, for scoring delamination and cell invasion. | |
| Fine forceps | Many sources are available | Must be sterilized before use | |
| Freezer -80 °C | Thermo Fisher Scientific | 8600 Series | Model 817CV |
| Inverted microscope | Nikon Eclipse TS100 | For cell culture work | |
| Scissors (small) | Many sources are available | Must be sterilized before use | |
| MATERIALS | |||
| anti-Laminin-111 | Sigma-Aldrich | L9393 | Primary anti-rabbit antibody (1:400) |
| anti-rabbit Cy3 | Jackson Immuno Research | 111-165-003 | Secondary antibody (1:400) |
| anti-von Willebrand Factor | DAKO | P0226 | Primary antibody (1:100) |
Cobalt(II) chloride | Sigma-Aldrich | 232696-5G | CAUTION: moderate toxicity chemical. Handle with care only in fume hood. Follow manufacturers instructions |
| DAPI | Sigma-Aldrich | D9542-10MG | 4',6-diamidino-2-phenylindole, dihydrochloride (1:400) |
| Fertilized chicken eggs | Strömbäcks Ägg, Vännäs, Sweden | Any local egg supplyer | |
| Fetal bovine serum | Life Technologies | 10500-064 | |
| Fluorescence mounting medium | Allent Technologie | S302380-2 | Avoid bubble formation when mounting. Allow to dry at +4 °C |
| Glass chambers for silicon rings | Many sources are available | We used 15 mL glass chambers. Around 20 silicon rings fit in one chamber. Avoid crowding, since the rings may stick together and aggravate work. | |
| Glass coverslips | VWR International | 631-0165 | |
| GM6001 MMP Inhibitor | Sigma-Aldrich | CC1010 | |
| Microscope slides for immunohistochemistry | Fisher Scientific | 10149870 | |
| NEG-50 frozen medium | Cellab | 6506 | |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | CAUTION: highly toxic. Handle with care only in fume hood, follow manufacturers instructions. Use all protective clothing. |
Peel-A-Way Embedding Molds | Polysciences | 18985 | |
| Penicillin–streptomycin | Gibco | 15070063 | |
| Petri dishes | Sarstedt | 83.3903 | 15 cm in diameter for cell culture |
| Plastic box | Esclain | ||
| PureCol EZ Gel Collagen | Cellsystems | 5074-35ML | 5 mg/mL. Gelatinous material. Pipette very slowly and carefully to avoid cells being lost in the bubble formations. |
| RPMI medium | Thermo Fisher Scientific | 21875034 | |
| Silicon rings | VWR International | 228-1580 | Inner/outer diameter: 4/5 mm. Should be sterilized before use. Avoid repeated autoclaving of unused rings. |
| Trypan blue | Fisher Scientific | T10282 | |
| Trypsin | Life Technologi | 15400054 | 0.50% |
| Weighing boats | VWR International | 611-0094 | |
| SOLUTIONS | |||
| Collagen-RPMI media mixture (1 mL) | Compelete RPMI Media 750 µL | ||
| PureCol EZ Gel Collagen 250 µL | |||
| Mix and use immediately | |||
| Complete RPMI media (500 mL) | RPMI Media 445 mL | ||
| FBS 50 mL | |||
| Penicillin–streptomycin 5mL | |||
| Store at 4 °C | |||
| PB (0.2 M; 1 000 mL) | Na2HPO4 (MW 141.76) 21.9 g | ||
| NaH2PO4 (MW 137.99) 6.4 g | |||
| add deionized water up to final volume of 1000ml | |||
| Store in RT | |||
| PFA (4 %) in 0.1 M PB (100 mL) | Deionized water 50 mL | ||
| 0.2 M PB 50 mL | |||
| Paraformaldehyde (PFA) 4g | |||
| heat to 60 °C in water bath | |||
| add 5 M NaOH 25 µL | |||
| Stir to dissolve the PFA powder | |||
| Store at 4 °C | |||
| TBST (1 000 mL) | 50mM Tris pH 7,4 50 mL | ||
| 150mM NaCI 30 mL | |||
| 0,1% Triton X-100 10 mL | |||
| H2O (MQ) 900 mL | |||
| Trypsin (0.05 %; 10 mL) | 1x PBS 9 mL | ||
| 10x Trypsin (0.5 %) 1 mL | |||
| 10 mL in total, Store at 4 °C |
Riferimenti
- Vasantharajan, S. S., et al. The epigenetic landscape of circulating tumour cells. Biochimica et Biophysica Acta - Reviews on Cancer. 1875 (2), 188514 (2021).
- Acloque, H., Adams, M. S., Fishwick, K., Bronner-Fraser, M., Nieto, M. A. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. Journal of Clinical Investigation. 119 (6), 1438-1449 (2009).
- Itoh, Y. Membrane-type matrix metalloproteinases: their functions and regulations. Matrix Biology. 44-46, 207-223 (2015).
- Przemyslaw, L., Boguslaw, H. A., Elzbieta, S., Malgorzata, S. M. ADAM and ADAMTS family proteins and their role in the colorectal cancer etiopathogenesis. BMB Reports. 46 (3), 139-150 (2013).
- Chu, P. Y., Koh, A. P., Antony, J., Huang, R. Y. Applications of the chick chorioallantoic membrane as an alternative model for cancer studies. Cells Tissues Organs. 211 (2), 222-237 (2021).
- MacDonald, I. C., Groom, A. C., Chambers, A. F. Cancer spread and micrometastasis development: quantitative approaches for in vivo models. Bioessays. 24 (10), 885-893 (2002).
- Palaniappan, T. K., Slekiene, L., Jonasson, A. K., Gilthorpe, J., Gunhaga, L. CAM-Delam: an in vivo approach to visualize and quantify the delamination and invasion capacity of human cancer cells. Scientific Reports. 10 (1), 10472 (2020).
- Carrillo, M., Kim, S., Rajpurohit, S. K., Kulkarni, V., Jagadeeswaran, P. Zebrafish von Willebrand factor. Blood Cells, Molecules and Diseases. 45 (4), 326-333 (2010).
- Leupold, J. H., Patil, N., Allgayer, H. The chicken egg chorioallantoic membrane (CAM) model as an in vivo method for the investigation of the invasion and metastasis cascade of malignant tumor cells. Methods in Molecular Biology. 2294, 17-26 (2021).
- Jia, Y., et al. Recombinant human endostatin endostar inhibits tumor growth and metastasis in a mouse xenograft model of colon cancer. Pathology and Oncology Research. 18 (2), 315-323 (2012).
- Liu, B., et al. RNAi-mediated inhibition of presenilin 2 inhibits glioma cell growth and invasion and is involved in the regulation of Nrg1/ErbB signaling. Neuro-Oncology. 14 (8), 994-1006 (2012).
- Qin, T., et al. Tumor necrosis factor superfamily 15 promotes lymphatic metastasis via upregulation of vascular endothelial growth factor-C in a mouse model of lung cancer. Cancer Science. 109 (8), 2469-2478 (2018).
- Ren, L., et al. Characterization of the metastatic phenotype of a panel of established osteosarcoma cells. Oncotarget. 6 (30), 29469-29481 (2015).
- Zang, G., Mu, Y., Gao, L., Bergh, A., Landstrom, M. PKCzeta facilitates lymphatic metastatic spread of prostate cancer cells in a mice xenograft model. Oncogene. 38 (22), 4215-4231 (2019).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nature Reviews Cancer. 11 (2), 135-141 (2011).
- Jung, J. Human tumor xenograft models for preclinical assessment of anticancer drug development. Toxicology Research. 30 (1), 1-5 (2014).
- Liu, M., et al. The histone methyltransferase EZH2 mediates tumor progression on the chick chorioallantoic membrane assay, a novel model of head and neck squamous cell carcinoma. Translational Oncology. 6 (3), 273-281 (2013).
- Steinmann, S., et al. DAPK1 loss triggers tumor invasion in colorectal tumor cells. Cell Death & Disease. 10 (12), 895 (2019).
- Andrieu, C., et al. MMP14 is required for delamination of chick neural crest cells independently of its catalytic activity. Development. 147 (7), (2020).
- Palaniappan, T. K., Slekiene, L., Gunhaga, L., Patthey, C. Extensive apoptosis during the formation of the terminal nerve ganglion by olfactory placode-derived cells with distinct molecular markers. Differentiation. 110, 8-16 (2019).
- Thiery, J. P., Acloque, H., Huang, R. Y., Nieto, M. A. Epithelial-mesenchymal transitions in development and disease. Cell. 139 (5), 871-890 (2009).
- Pineros, M., et al. Essential TNM: a registry tool to reduce gaps in cancer staging information. The Lancet Oncology. 20 (2), 103-111 (2019).
- Walsh, A. J., Cook, R. S., Sanders, M. E., Arteaga, C. L., Skala, M. C. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon