Method Article
CAM-Delam测定通过量化癌细胞的分层和侵袭能力来评分转移特性
摘要
评估癌细胞转移能力的CAM-Delam测定相对快速,简单且便宜。该方法可用于解开调节转移形成的分子机制和药物筛选。用于分析人类肿瘤样本的优化测定可能是个性化癌症治疗的临床方法。
摘要
癌症相关死亡的主要原因是转移形成(即,当癌细胞从原发性肿瘤扩散到远处器官并形成继发性肿瘤时)。分层,定义为基底层和基底膜的降解,是促进癌细胞向其他组织和器官的迁移和扩散的初始过程。对癌细胞的分层能力进行评分将表明这些细胞的转移潜力。
我们已经开发了一种标准化的方法, 即前ovo CAM-Delam测定,以可视化和量化癌细胞分层和侵入的能力,从而能够评估转移侵袭性。简而言之,CAM-Delam方法包括在胚胎第10天将癌细胞接种在雏鸡绒毛膜(CAM)上的硅胶环中,然后从数小时到几天孵育。CAM-Delam测定包括在雏鸡胚胎孵化期间使用内部加湿室。这种新颖的方法将胚胎存活率从10%-50%提高到80%-90%,解决了以前在不同CAM测定中胚胎存活率低的技术问题。
接下来,分离,固定和冷冻具有相关癌细胞簇的CAM样品。最后,使用免疫组织化学对冷冻切片样品进行可视化分析,以检测基底膜损伤和癌细胞侵袭。通过评估各种已知的旨在表达绿色荧光蛋白(GFP)的转移性和非转移性癌细胞系,CAM-Delam定量结果表明,分层能力模式反映了转移侵袭性,可以分为四类。该测定法的未来使用,除了量化分层能力作为转移侵袭性的指标外,还解开控制分层,侵袭,微转移形成和肿瘤微环境变化的分子机制。
引言
癌症患者中大约90%的死亡率是由癌症转移的后果引起的,癌症转移是在癌症最初起源的身体其他部位形成继发性肿瘤1。因此,确定转移相关机制以找到抑制肿瘤转移形成的潜在靶点非常重要。随后,需要一种可以评估转移过程的模型系统。
在转移过程中,癌细胞经历上皮到间充质的转变(EMT),这是一种正常的细胞过程,其中上皮细胞失去其粘附性和极性特性,而是获得侵袭性间充质特征2。分层是EMT过程的一部分,涉及基底膜中层粘连蛋白的降解,这是癌细胞离开原发肿瘤并侵入其他组织的先决条件。转移形成过程中上调的主要因素包括基质金属蛋白酶 (MMPs)、ADAM(一种脱嵌素和金属蛋白酶)、ADAMTS(具有血栓自旋基序的 ADAM)和膜型 MMP (MT-MMPs)3,4。这些因素降解分子,如层粘连蛋白,其表达在所有基底膜中,以促进细胞迁移和侵袭。
受精雏鸡卵的绒毛膜兰导管(CAM)是一种基底膜。受精雏鸡卵已被用作转移模型,其中癌细胞已接种在胚外CAM上,随后在雏鸡胚胎中观察到转移形成5。此外,经常使用 体内 小鼠转移模型,其中癌细胞植入小鼠并分析各种器官中的转移6。这种方法耗时,昂贵,并可能引起动物不适。为了解决这个问题,我们开发了CAM-Delam测定,这是一种更快,更便宜的模型,用于评估癌细胞的转移侵袭性。在该模型中,癌细胞降解雏鸡CAM的能力(例如,分层能力)与潜在的癌细胞侵入间充质并用作转移侵袭性的测量相结合。
本文基于先前的出版物7,详细描述了CAM-Delam测定,从受精雏鸡卵处理,癌细胞培养和播种,解剖以及CAM样品的分析,到癌细胞分层能力的评分分为四类:完整,改变,损伤和侵袭。我们还给出了如何使用该测定法来确定调节分层过程的分子机制的示例。
研究方案
简而言之, 图1 总结了CAM-Delam测定的总体步骤。以下方案基于30个培养的受精鸡蛋和使用两种不同的癌细胞系分别接种在三个环/鸡蛋中并在四个时间点进行分析。
1. 种蛋孵化
- 使用来自当地孵化场的受精雏鸡卵,保证超过90%的受精率
注意:卵子在室温(RT)下储存的时间不应超过4天。在瑞典,实验性使用胚胎鸡的道德许可仅从胚胎第14天(E)开始及以后。 - 如果需要,使用干纸巾或湿水小心地机械擦去鸡蛋上的任何污垢或羽毛。
- 使用前(每次)用70%乙醇清洁并消毒鸡蛋孵化器。
- 将所需数量的蛋放入蛋盘中,并在湿度为70%的37.5-38°C的蛋孵化器中水平孵化雏鸡蛋。将其视为孵育日0(图1A)。
2.称重船,塑料盒和解剖仪器的准备
- 使用70%乙醇对30个称重船和30个带透明盖的小塑料盒(约0.4升)进行灭菌。
- 在层流罩中干燥称量管和盒子过夜(ON),并存放在封闭的塑料盒中,直到在孵育第3天进一步使用。
- 每30个孵化的鸡蛋灭菌2升蒸馏或去离子H2O。
- 通过喷洒70%乙醇对两把剪刀和三对镊子进行灭菌。将器械风干,然后将其存放在灭菌盒中,直到孵育第3天。
注意:这些操作(步骤 2.1-2.4)可以在孵化第 3 天之前的任何一天完成。戴上手套以避免污染。
3.打开鸡蛋并转移到内部加湿室
注意:使用手套和口罩以避免污染。
- 向灭菌塑料盒中加入约50毫升灭菌的H2O。将装满水的盒子盖上盖子,以避免污染,在室温下直到使用。
- 在孵化第3天,使用剪刀的锋利部分破解蛋壳,并在壳上切出一个直开的口。
- 在称量船上手动打开蛋壳,并在称量船上收集蛋清,蛋黄及其附着的健康胚胎(图1B)。寻找一个完整的胚胎,心脏跳动,卵黄完整,并发育的血管用于实验(>95%的孵化卵)。丢弃胚胎畸形、没有心脏跳动的胚胎、蛋黄破裂或蛋黄血管受损的卵子。
- 轻轻地将称重船转移到内部加湿室中。
注:对于步骤3.2.-3.4.,请尽可能快地工作以避免污染,如果可能,请使用层流罩。 - 在种蛋孵化器中孵育内部加湿室(图1C)。
- 使用前,从第3天到第10天在鸡蛋孵化器中培养无壳鸡蛋(参见步骤3.6.),并在需要时向培养箱中加水以保持70%的湿度。
- 每天通过透明塑料盖检查内部加湿室是否有死亡胚胎或受污染的无壳蛋,并将其从孵化器中取出。
4. 硅胶环的制备
- 为了制备硅胶环,最好使用切纸机切割内径和外径分别为4 mm和5 mm的约1 mm厚度的硅胶管(图1D)。
- 将硅胶环转移到小玻璃瓶上(图1D),用金属箔覆盖,并使用高压灭菌器或类似物对其进行灭菌。
注意:避免重复高压灭菌可能被污染的未使用的硅胶环,因为这种处理会降低硅胶环附着在膜上的能力,随后癌细胞/胶原蛋白/ RPMI溶液泄漏到环外。 - 将无菌硅胶环存放在室温处。
注意:此步骤可以在孵化第10天之前的任何一天完成。
5. 癌细胞的制备
注意:细胞培养基,胰蛋白酶和1x PBS等溶液储存在4°C下,在加入细胞之前应在水浴中加热至37°C。加热后,用70%乙醇冲洗瓶子并在使用前干燥。
- 在37°C的细胞培养箱中,在5%(v / v)CO 2存在下,在相关培养基中培养感兴趣的癌细胞系。
注意:在这里,U251-GFP胶质母细胞瘤和PC-3U-GFP前列腺癌细胞在补充了10%(v / v)胎牛血清(FBS)和1%(v / v)青霉素 - 链霉素(PS)的完整RPMI培养基中培养。 - 计划癌细胞的培养,以便在CAM-Delam测定的孵化第10天准备收获大约50×106 个癌细胞。
- 每2-3天更换一次细胞培养基,或者当培养基颜色从粉红色变为橙色/黄色时。
- 可选:通过用CoCl2 处理癌细胞来诱导缺氧,以研究细胞收获前1天的分子机制对分层的影响。
注意:氯化钴2 具有中度毒性。小心处理通风橱,并按照制造商的说明进行操作。- 通过将0.0258g溶解在10 mL灭菌蒸馏H2 0中,在用铝箔包裹的15 mL锥形管中以避光,制备新鲜的20mM CoCl 2储备溶液。
- 在50 mL锥形管中,将250μL的20mM CoCl2 储备溶液与25mLRPMI培养基混合,补充每15cm直径细胞培养皿1%(v / v)PS(但没有FBS)。轻轻地涡旋。
- 从细胞培养皿中取出完整的RPMI培养基。
- 用灭菌的1x PBS 2x洗涤细胞。
- 加入25mLRPMI培养基与200μM CoCl2 细胞胰蛋白酶消化(参见步骤5.6)。
- 在卵子孵化第10天,准备1毫升胶原蛋白/ RPMI混合物(比例1:3),含有250μLI型胶原蛋白(5mg / mL)和750μL细胞培养RPMI培养基,补充10%FBS和1%(v / v)PS. 将胶原蛋白/ RPMI混合物保存在冰上。
- 胰蛋白酶消化癌细胞以分离细胞,方法是首先除去细胞培养基并用1x PBS洗涤2x。
- 每15cm直径细胞培养皿加入3mL胰蛋白酶溶液(0.05%),并在细胞培养箱中孵育2-3分钟,直到细胞分离。使用桌面倒置显微镜观察分离的细胞。如果需要,轻轻敲击烧瓶的侧面以清除剩余的簇状或附着的细胞。
- 通过将5mL完整的RPMI培养基添加到每个细胞培养皿中来灭活胰蛋白酶,并将所有细胞培养皿中的细胞悬浮液收集到50 mL管中。
- 使用台盼蓝排除法对癌细胞进行计数,以使用细胞计数器区分活细胞和死细胞。将10μL细胞悬浮液加入10μL0.4%台盼蓝染色剂中。通过上下移液几次来混合样品,然后将每个腔室的10μL细胞混合物加载到细胞计数器中的样品载玻片中。重复细胞计数3x以验证细胞数/ mL。
- 计算并在50mL管中以500×g离心含有50 x 106活癌细胞的正确体积细胞培养悬浮液5分钟。
- 弃去上清液,将细胞沉淀与1mL胶原蛋白/ RPMI混合物混合。由于胶原蛋白是一种凝胶状物质,因此用1 mL移液管非常缓慢和仔细地混合细胞,以避免在形成气泡时失去细胞。
- 将准备好的细胞悬浮液保存在冰上,并将其带到鸡蛋工作区域。
注意:避免将准备好的癌细胞保存在冰上太长时间。制备的癌细胞必须在15-25分钟内放置在CAM上。
6. 在 CAM 上接种癌细胞
注意:使用手套和口罩以避免污染。
- 在孵化日10,从孵化器中取出内部加湿室和孵化的无壳蛋。
注意:大约可以使用孵化种蛋初始数量的90%;参见 图2。 - 打开内部加湿室,并使用灭菌镊子在CAM上放置最多六个硅胶环。
注意:避免将硅胶环彼此靠近或靠近较大的血管。 - 通过移液混合癌细胞悬浮液以获得均匀分布的癌细胞,并在硅氧环内加入20μL(1×106 个细胞)制备的癌细胞悬浮液(图1E)。添加细胞时,将移液器尖端保持在CAM上方,以确保不会损坏膜。
注意:根据先前的发现7,不同的癌细胞可以在同一CAM上接种在单独的环中。 - 关闭内部加湿室并将其放入种蛋孵化器中。
7. 与相关癌细胞分离 CAM
- 孵育14小时,1.5天,2.5天和3.5天后,取出约七个内部加湿室,一次打开一个盖子。
- 用一把剪刀,通过切割硅胶环外来解剖附着在CAM上的培养的癌细胞(所谓的CAM-Delam样品)(图1F)。
- 立即使用镊子将分离的CAM-Delam样品转移到培养皿中0.1M磷酸盐缓冲液(PB)中的4%多聚甲醛(PFA)中,以固定组织。保持在冰上或在4°C下保存1小时。
注意:在4°C下储存4%PFA溶液最多5天。注意:PFA是有毒的。处理PFA粉末和PFA溶液时,请使用通风橱并戴上口罩和手套。避免吸入粉末或溶液蒸气。按照制造商的说明进行操作。 - 将鸡胚斩首,并作为生物废物丢弃在特定的垃圾箱中。
- 除去4%PFA溶液,并在0.1M PB中加入30%蔗糖到CAM-Delam样品中,并在4°C下平衡1小时。
- 在解剖显微镜下,使用镊子小心地取下硅胶环。用一把剪刀将CAM-Delam样品切成矩形,中间是癌细胞(图1G)。
- 用一对镊子将CAM-Delam样品转移到培养皿中的冷冻切片培养基中以除去多余的蔗糖,然后将模具嵌入冷冻切片培养基中。
- 在解剖显微镜下,使用任何针状仪器将CAM-Delam样品垂直方向定位在包埋模具中的U形(图1G)。
- 冷冻并将CAM-Delam样品储存在-80°C。
8. 切块 CAM-Delam 样品
- 使用冷冻切片将冷冻的CAM-Delam样品在5-6个连续载玻片上以10μm切片。
- 将载玻片与切片一起储存在-80°C或直接用于免疫组化染色。
9. 免疫组化染色
- 将载玻片从-80°C带到室温5分钟,然后开始免疫原体。
- 在切片结束的载玻片上用疏水标记做一条线。让它们干燥几分钟。
- 将载玻片置于加湿的(H2O)室中,并用〜200-500μL封闭溶液(10%胎牛血清和0.1%叠氮化钠在Tris缓冲盐水中用0.1%Triton X-100 [TBST])覆盖切片,并孵育15-30分钟。
注意:从此步骤开始,请勿在任何时候让载玻片干燥。 - 倒出封闭溶液,用100-150μL在封闭溶液中稀释的靶向一抗代替,并在4°C下孵育。 优选使用兔抗层粘连蛋白-111抗体来定义基底层与癌细胞标记物一起,如果不使用GFP或其它荧光标记的癌细胞系。
注意:在这里,兔子抗血管性血友病因子也用于检测CAM中的血管。 - 准备三个装满TBST缓冲液的玻璃比色皿。
- 倒出一抗溶液,将载玻片转移到玻璃比色皿中,并在TBST中洗涤至少3次,每次5分钟。
- 用软纸巾从载玻片和疏水屏障区域去除多余的TBST。
- 用100-150μL合适的二次荧光抗体覆盖载玻片,该抗体在封闭溶液中稀释与4',6-二脒基-2-苯基吲哚,二盐酸盐(DAPI)在黑暗中孵育1小时。
- 倒出二抗溶液,将载玻片转移到玻璃比色皿中,并在TBST中洗涤至少3次,每次5分钟。
- 用软纸巾从载玻片和疏水屏障区域去除多余的TBST。
- 通过在载玻片上滴1-2滴荧光安装介质来安装载玻片,并轻轻放置玻璃盖玻片,避免气泡。
- 在分析之前,让载玻片在4°C下干燥至少1小时,并将载玻片储存在4°C。
10. 显微镜成像和分层评分
- 使用配备数码相机的落射荧光显微镜拍摄切片,优选以10倍放大倍率拍摄(图1H)。
- 使用以下 CAM-Delam 评分类别分析各部分(图 3):
- 寻找完整的基底板,没有明显的改变。
- 寻找改变但未受损的基底板。
- 寻找受损的基底层,不进行细胞侵袭。
- 寻找受损的基底层,伴有细胞侵袭。
结果
图1 显示了CAM-Delam测定7中的关键步骤。使用内部加湿室(图1C)显着提高了雏鸡胚胎的存活率,从孵育第10天的<50%提高到90%,在孵育第13天从~15%提高到80%(图2)。
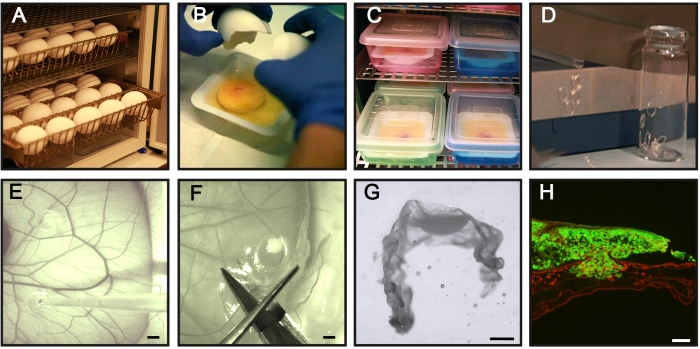
图1:CAM-Delam测定的关键步骤。(A)水平孵育受精鸡蛋而不旋转。(乙、丙)在孵化的第3天,将卵打碎并将它们放在无菌称重船(B)中,并将船放置在内部加湿室中以进行进一步孵化(C)。(四)准备硅胶环。(E)在孵育的第10天,将硅胶环放在CAM上,并使用移液管在环内接种1×106癌细胞。(F,G)在不同的时间点(数小时至数天),解剖带有附着的癌细胞的CAM,(F)固定在PFA中,用蔗糖处理,在冷冻切片培养基中的位置,(G)并在-80°C中冷冻。比例尺 = 2 毫米 (E,F)、1 毫米 (G) 和 100 微米 (H)。这个数字来自Palaniappan等人7。缩写:CAM =绒毛膜软骨膜;PFA = 多聚甲醛;GFP = 绿色荧光蛋白。请点击此处查看此图的大图。

图2:与孵化方法相关的鸡胚存活率(A,B)在孵化第10天,鸡胚在内部HC中的存活率翻了一番(平均值89.33;N = 105)与培养皿中的孵育相比(A;平均值40;N = 64)和非加湿室(B;平均值48.67;N = 46)。(C,D)在孵育第13天,使用HC仍然观察到高存活率(平均值81.67;N = 105),而使用PD注意到胚胎存活率显着下降(C;平均值11.33;N = 64)和N-HC(D;平均值18.33;N = 46)。使用不成对的双尾 t 检验测试统计显著性。误差线表示标准偏差。*p < 0.05, **p < 0.01, ***p < 0.001。这个数字是从Palaniappan等人7修改而来的。缩写:HC =加湿室;PD = 培养皿;N-HC = 非加湿室;E X = 孵化日 X.请点击此处查看此图的大图。
Palaniappan等人先前报告了使用该协议表达GFP的不同癌细胞系(U251胶质母细胞瘤,PC-3U前列腺,SW620结肠和A549肺)的分析。CAM-Delam测定的结果包括基底层形态的差异(由层粘连蛋白检测到)和癌细胞侵袭(定义为穿过雏鸡基底层进入雏鸡中胚层的细胞)的差异(图3)。这些结果表明,癌细胞降解基底层和侵入间充质的能力可以分为四类:1)完整的基底层无可见改变(图3B),2)改变但未受损的基底层(图3C),3)受损的基底层无细胞侵袭(图3D),以及4)受损的基底层伴细胞侵袭(图3E)).另一个观察结果是,当癌细胞引起基底层改变或受损时,CAM也会随着血管形成的增加而增厚,这由针对血管中合成的von Willebrand因子的抗体染色来定义(图4C-H)。当CAM完整时,没有观察到这两种表型,即增厚的CAM和增加的血管形成(图4A,B)。

图3:CAM-Delam评分(A-E)基于CAM基底层完整性的CAM-Delam评分示例,通过抗层粘连蛋白(红色)可视化,以及表达GFP的癌细胞的潜在侵袭(绿色)。(A)控制无癌细胞的CAM。(B-E)在对癌细胞的反应中,可以对描述基底层形态的四类进行评分:(B)完整的层粘连蛋白,(C)改变但未受损的层粘连蛋白(用星号表示),(D)受损的层粘连蛋白但没有癌细胞侵袭(箭头),受损的层粘连蛋白伴细胞侵袭(箭头)。比例尺 = 100 μm (A-E)。这个数字来自Palaniappan等人7。缩写:CAM =绒毛膜软骨膜;GFP = 绿色荧光蛋白。请点击此处查看此图的大图。

图4:CAM增厚和血管形成的评估。 (A-H)CAM增厚和血管形成的可视化示例,通过抗血管性血友病因子(红色)检测,以响应各种癌细胞类型的薄层。(A,B)控制无癌细胞的CAM。(C,D)作为对非转移性癌细胞系(评分为完整)的反应,未检测到间充质明显增厚或血管形成增加。(E-H)为了响应导致Lamin改变或受损的转移性癌细胞,间充质增厚(由双箭头表示)并观察到血管形成增加(由箭头表示)。比例尺 = 100 μm。这个数字是从Palaniappan等人7修改而来的。缩写:CAM =绒毛膜软骨膜;GFP = 绿色荧光蛋白。请点击此处查看此图的大图。
U251胶质母细胞瘤和PC-3U前列腺癌细胞是具有完全不同分层能力的癌细胞系的两个例子(图5)。PC-3U细胞在1.5天后诱导损伤的层粘连蛋白,2.5天后诱导透明浸润(图5A)。相比之下,U251细胞仅在1.5-3.5天后诱导层粘连蛋白的微小改变,但从未对层粘连蛋白造成任何可见的损伤(图5B)。
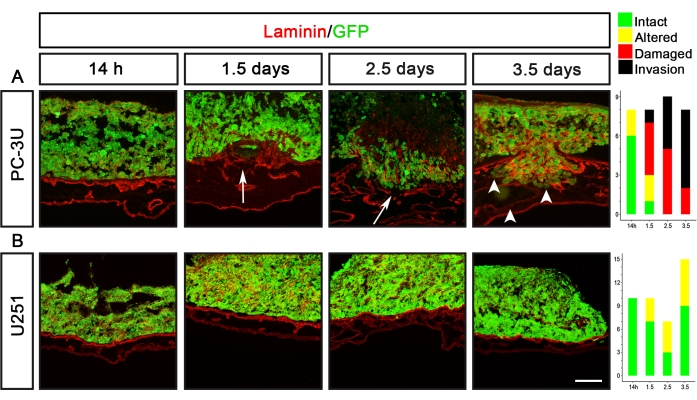
图5:前列腺(PC-3U)和胶质母细胞瘤(U251)癌细胞分层能力的可视化。 (A)PC-3U细胞在14小时后诱导层粘连蛋白的轻微改变,1.5天后层粘连蛋白的损伤(箭头),2.5天后开始侵袭,3.5天后增加(箭头)。(B)U251细胞在1.5-3.5天后引起层粘连蛋白的轻微改变。右侧面板显示了表示 CAM-Delam 评分的图形。y 轴表示样本数,x 轴表示培养的时间点。比例尺 = 100 μm (A,B)。这个数字是从Palaniappan等人7修改而来的。缩写:CAM =绒毛膜软骨膜;GFP = 绿色荧光蛋白。 请点击此处查看此图的大图。
CAM-Delam测定可用于确定调节分层过程的分子机制。一个例子是使用CoCl2 处理来诱导缺氧,使用或不使用抑制基质金属蛋白酶(MMP)的组合,使用广泛的MMP抑制剂GM6001(图6)。CoCl2 治疗后,U251非转移性癌细胞获得了诱导分层和侵袭细胞的能力,当CoCl2 治疗与MMP抑制剂GM6001联合使用时,其受到抑制(图6)。因此,CAM-Delam测定在定义影响分层过程的分子和分子途径时非常有用。

图6:响应于单独暴露于CoCl 2或与MMP抑制剂一起暴露于CoCl 2的U251细胞的分层模式。 (A-C)U251细胞在各种条件下在CAM上培养3.5天。(一)单独培养的U251细胞不会诱导对层粘连蛋白的任何损伤。(B)培养的U251细胞预暴露于CoCl2(24小时)之前,在CAM诱导的层粘连蛋白损伤和细胞侵袭的细胞接种之前进行洗涤和细胞接种。(C)用广谱MMP抑制剂GM6001预处理(1 h),然后在CAM上洗涤接种U251细胞之前暴露于CoCl 2(24 h),抑制了CoCl2治疗的效果,未检测到明显的层粘连蛋白损伤或癌细胞侵袭。比例尺 = 100 μm (A-C)。面板(B)和(C)来自Palaniappan等人7。缩写:CAM =绒毛膜软骨膜;GFP = 绿色荧光蛋白;氯化钴2=氯化钴;MMP = 基质金属蛋白酶。请点击此处查看此图的大图。
讨论
本文描述了CAM-Delam测定法,以评估癌细胞的转移侵袭性,通过在数小时至数天内对基底层调节和潜在细胞侵入间充质进行评分来确定。以前各种CAM测定的技术问题是雏鸡胚胎的存活率低。通过在胚胎孵化期间引入内部加湿室解决了这个问题,该加湿室将胚胎存活率从10%-50%提高到80%-90%7。因此,使用内部加湿室在一般的CAM测定以及其他 前卵 雏鸡实验中可能是有价值的。
在CAM上接种1×106癌细胞后14小时,1.5天,2.5天和3.5天的评分时间点基于使用6种不同癌细胞系的严格方法开发,足以区分癌细胞系从非分层到分层侵袭能力的范围。建议每个时间点和每个细胞系至少使用四个具有三个环的卵子,并且应至少重复一次或根据实验设计和统计要求。CAM-Delam测定的一个优点是在几天内获得有关癌细胞分层能力的信息性结果,以估计癌细胞的侵袭性和转移形成的潜在风险。通过监测由于侵入的癌细胞以及随后的微肿瘤/肿瘤芽和器官转移引起的基底层的降解,促进结果的快速传递。传统上,CAM模型已被用于分析器官转移的形成,这需要大约2周的时间才能确定9。通过使用七种不同的癌细胞系,我们之前已经验证了7,分层评分与啮齿动物模型10,11,12,13,14中癌细胞形成转移的能力有关,这支持CAM-Delam测定的预测值。此外,小鼠模型需要更长的时间,几周到几个月,然后才能检查转移15,16。简而言之,这种开发的CAM-Delam测定法专注于评分分层能力,而不是检查雏鸡胚胎中后期的肿瘤形成,因此,它是对现有鸡CAM侵袭和小鼠肿瘤模型的良好补充。
CAM-Delam测定的局限性可能是如果癌细胞本身表达层粘连蛋白,则基底层的可视化不清楚。如果是这样,可以使用指示基底层的其他标记物,例如E-钙粘蛋白7。其他CAM侵袭研究已使用IV型胶原蛋白来可视化CAM和泛细胞角蛋白和维门汀,以鉴定入侵的癌细胞和微肿瘤/肿瘤芽的形成17,18。
分层是一个正常的细胞过程,无论是在发育过程中还是在生命的后期,这使得细胞有可能离开上皮并迁移到其他组织。发育过程中分层细胞的例子是神经嵴和嗅觉先驱神经元19,20;在以后的生活中,伤口愈合依赖于分层21。在癌症期间,这个过程在错误的细胞和/或在错误的时间上调。因此,CAM-Delam方法可用于解开调节分层的分子机制,这对于基本的生物学和疾病知识都很重要。这种分层研究将包括向接种在CAM上的癌细胞添加感兴趣的因子或研究转基因癌细胞。这里介绍的一个例子是CoCl2 预处理非转移性细胞系U251以诱导缺氧,这导致诱导转移性侵袭能力,该能力可由广谱MMP抑制剂抑制。因此,找到控制分层的关键分子增加了设计抑制剂来抑制这一过程的可能性。与此相关,CAM-Delam方案的另一个潜在用途是用于抑制分层和细胞侵袭的药物筛选。此外,在临床上,癌症严重程度的评估是诊断,计划治疗和护理的关键组成部分。目前,TNM分期系统(T,肿瘤大小;N,淋巴结 - 癌症是否已扩散到淋巴结;M,远处转移)用于评估癌症的严重程度22。CAM-Delam测定定义了一种评估癌细胞侵袭性和转移形成潜在风险的创新方法,可能是TNM分期系统的有用补充。值得注意的是,TNM分期基于对固定组织样本的分析,而潜在的临床CAM-Delam方法将结合恢复冷冻细胞的技术来检查新鲜或新鲜冷冻的组织23。
披露声明
作者没有竞争利益需要披露。
致谢
我们感谢于默奥大学的以下研究人员在相关癌细胞系和抗体方面的帮助:L. Carlsson(von Willebrand因子抗体),J. Gilthorpe(U251)和M. Landström(PC-3U)。我们还感谢Gilthorpe实验室的Hauke Holthusen产生HEK293-TLR-AAVS1稳定细胞系。Gunhaga实验室的工作得到了瑞典癌症基金会(18 0463),于默奥生物技术孵化器,Norrlands Cancerforskningsfond,瑞典研究委员会(2017-01430)和于默奥大学医学院的支持。
材料
| Name | Company | Catalog Number | Comments |
| EQUIPMENT | |||
| Centrifuge | Rotanta 480 R, Hettich zentrifugen | ||
| Countess II FL Automated Cell Counter | Invitrogen | ||
| Cryostat | HM 505 E, Microm | ||
| Digital camera | Nikon DS-Ri1 | ||
| Dissection Microscope | Leica M10 | For CAM-sample dissection and positioning in molds | |
| Egg incubator | Fiem | Many other sources are available. Must be cleaned and sterilized with 70 % ethanol before each use | |
| Epifluorescence microscope | Nikon Eclipse, E800 | Equiped with a digital camera, for scoring delamination and cell invasion. | |
| Fine forceps | Many sources are available | Must be sterilized before use | |
| Freezer -80 °C | Thermo Fisher Scientific | 8600 Series | Model 817CV |
| Inverted microscope | Nikon Eclipse TS100 | For cell culture work | |
| Scissors (small) | Many sources are available | Must be sterilized before use | |
| MATERIALS | |||
| anti-Laminin-111 | Sigma-Aldrich | L9393 | Primary anti-rabbit antibody (1:400) |
| anti-rabbit Cy3 | Jackson Immuno Research | 111-165-003 | Secondary antibody (1:400) |
| anti-von Willebrand Factor | DAKO | P0226 | Primary antibody (1:100) |
Cobalt(II) chloride | Sigma-Aldrich | 232696-5G | CAUTION: moderate toxicity chemical. Handle with care only in fume hood. Follow manufacturers instructions |
| DAPI | Sigma-Aldrich | D9542-10MG | 4',6-diamidino-2-phenylindole, dihydrochloride (1:400) |
| Fertilized chicken eggs | Strömbäcks Ägg, Vännäs, Sweden | Any local egg supplyer | |
| Fetal bovine serum | Life Technologies | 10500-064 | |
| Fluorescence mounting medium | Allent Technologie | S302380-2 | Avoid bubble formation when mounting. Allow to dry at +4 °C |
| Glass chambers for silicon rings | Many sources are available | We used 15 mL glass chambers. Around 20 silicon rings fit in one chamber. Avoid crowding, since the rings may stick together and aggravate work. | |
| Glass coverslips | VWR International | 631-0165 | |
| GM6001 MMP Inhibitor | Sigma-Aldrich | CC1010 | |
| Microscope slides for immunohistochemistry | Fisher Scientific | 10149870 | |
| NEG-50 frozen medium | Cellab | 6506 | |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | CAUTION: highly toxic. Handle with care only in fume hood, follow manufacturers instructions. Use all protective clothing. |
Peel-A-Way Embedding Molds | Polysciences | 18985 | |
| Penicillin–streptomycin | Gibco | 15070063 | |
| Petri dishes | Sarstedt | 83.3903 | 15 cm in diameter for cell culture |
| Plastic box | Esclain | ||
| PureCol EZ Gel Collagen | Cellsystems | 5074-35ML | 5 mg/mL. Gelatinous material. Pipette very slowly and carefully to avoid cells being lost in the bubble formations. |
| RPMI medium | Thermo Fisher Scientific | 21875034 | |
| Silicon rings | VWR International | 228-1580 | Inner/outer diameter: 4/5 mm. Should be sterilized before use. Avoid repeated autoclaving of unused rings. |
| Trypan blue | Fisher Scientific | T10282 | |
| Trypsin | Life Technologi | 15400054 | 0.50% |
| Weighing boats | VWR International | 611-0094 | |
| SOLUTIONS | |||
| Collagen-RPMI media mixture (1 mL) | Compelete RPMI Media 750 µL | ||
| PureCol EZ Gel Collagen 250 µL | |||
| Mix and use immediately | |||
| Complete RPMI media (500 mL) | RPMI Media 445 mL | ||
| FBS 50 mL | |||
| Penicillin–streptomycin 5mL | |||
| Store at 4 °C | |||
| PB (0.2 M; 1 000 mL) | Na2HPO4 (MW 141.76) 21.9 g | ||
| NaH2PO4 (MW 137.99) 6.4 g | |||
| add deionized water up to final volume of 1000ml | |||
| Store in RT | |||
| PFA (4 %) in 0.1 M PB (100 mL) | Deionized water 50 mL | ||
| 0.2 M PB 50 mL | |||
| Paraformaldehyde (PFA) 4g | |||
| heat to 60 °C in water bath | |||
| add 5 M NaOH 25 µL | |||
| Stir to dissolve the PFA powder | |||
| Store at 4 °C | |||
| TBST (1 000 mL) | 50mM Tris pH 7,4 50 mL | ||
| 150mM NaCI 30 mL | |||
| 0,1% Triton X-100 10 mL | |||
| H2O (MQ) 900 mL | |||
| Trypsin (0.05 %; 10 mL) | 1x PBS 9 mL | ||
| 10x Trypsin (0.5 %) 1 mL | |||
| 10 mL in total, Store at 4 °C |
参考文献
- Vasantharajan, S. S., et al. The epigenetic landscape of circulating tumour cells. Biochimica et Biophysica Acta - Reviews on Cancer. 1875 (2), 188514 (2021).
- Acloque, H., Adams, M. S., Fishwick, K., Bronner-Fraser, M., Nieto, M. A. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. Journal of Clinical Investigation. 119 (6), 1438-1449 (2009).
- Itoh, Y. Membrane-type matrix metalloproteinases: their functions and regulations. Matrix Biology. 44-46, 207-223 (2015).
- Przemyslaw, L., Boguslaw, H. A., Elzbieta, S., Malgorzata, S. M. ADAM and ADAMTS family proteins and their role in the colorectal cancer etiopathogenesis. BMB Reports. 46 (3), 139-150 (2013).
- Chu, P. Y., Koh, A. P., Antony, J., Huang, R. Y. Applications of the chick chorioallantoic membrane as an alternative model for cancer studies. Cells Tissues Organs. 211 (2), 222-237 (2021).
- MacDonald, I. C., Groom, A. C., Chambers, A. F. Cancer spread and micrometastasis development: quantitative approaches for in vivo models. Bioessays. 24 (10), 885-893 (2002).
- Palaniappan, T. K., Slekiene, L., Jonasson, A. K., Gilthorpe, J., Gunhaga, L. CAM-Delam: an in vivo approach to visualize and quantify the delamination and invasion capacity of human cancer cells. Scientific Reports. 10 (1), 10472 (2020).
- Carrillo, M., Kim, S., Rajpurohit, S. K., Kulkarni, V., Jagadeeswaran, P. Zebrafish von Willebrand factor. Blood Cells, Molecules and Diseases. 45 (4), 326-333 (2010).
- Leupold, J. H., Patil, N., Allgayer, H. The chicken egg chorioallantoic membrane (CAM) model as an in vivo method for the investigation of the invasion and metastasis cascade of malignant tumor cells. Methods in Molecular Biology. 2294, 17-26 (2021).
- Jia, Y., et al. Recombinant human endostatin endostar inhibits tumor growth and metastasis in a mouse xenograft model of colon cancer. Pathology and Oncology Research. 18 (2), 315-323 (2012).
- Liu, B., et al. RNAi-mediated inhibition of presenilin 2 inhibits glioma cell growth and invasion and is involved in the regulation of Nrg1/ErbB signaling. Neuro-Oncology. 14 (8), 994-1006 (2012).
- Qin, T., et al. Tumor necrosis factor superfamily 15 promotes lymphatic metastasis via upregulation of vascular endothelial growth factor-C in a mouse model of lung cancer. Cancer Science. 109 (8), 2469-2478 (2018).
- Ren, L., et al. Characterization of the metastatic phenotype of a panel of established osteosarcoma cells. Oncotarget. 6 (30), 29469-29481 (2015).
- Zang, G., Mu, Y., Gao, L., Bergh, A., Landstrom, M. PKCzeta facilitates lymphatic metastatic spread of prostate cancer cells in a mice xenograft model. Oncogene. 38 (22), 4215-4231 (2019).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nature Reviews Cancer. 11 (2), 135-141 (2011).
- Jung, J. Human tumor xenograft models for preclinical assessment of anticancer drug development. Toxicology Research. 30 (1), 1-5 (2014).
- Liu, M., et al. The histone methyltransferase EZH2 mediates tumor progression on the chick chorioallantoic membrane assay, a novel model of head and neck squamous cell carcinoma. Translational Oncology. 6 (3), 273-281 (2013).
- Steinmann, S., et al. DAPK1 loss triggers tumor invasion in colorectal tumor cells. Cell Death & Disease. 10 (12), 895 (2019).
- Andrieu, C., et al. MMP14 is required for delamination of chick neural crest cells independently of its catalytic activity. Development. 147 (7), (2020).
- Palaniappan, T. K., Slekiene, L., Gunhaga, L., Patthey, C. Extensive apoptosis during the formation of the terminal nerve ganglion by olfactory placode-derived cells with distinct molecular markers. Differentiation. 110, 8-16 (2019).
- Thiery, J. P., Acloque, H., Huang, R. Y., Nieto, M. A. Epithelial-mesenchymal transitions in development and disease. Cell. 139 (5), 871-890 (2009).
- Pineros, M., et al. Essential TNM: a registry tool to reduce gaps in cancer staging information. The Lancet Oncology. 20 (2), 103-111 (2019).
- Walsh, A. J., Cook, R. S., Sanders, M. E., Arteaga, C. L., Skala, M. C. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。