Method Article
Test CAM-Delam pour évaluer les propriétés métastatiques en quantifiant la capacité de délamination et d’invasion des cellules cancéreuses
Dans cet article
Résumé
Le test CAM-Delam pour évaluer la capacité métastatique des cellules cancéreuses est relativement rapide, facile et bon marché. La méthode peut être utilisée pour démêler les mécanismes moléculaires régulant la formation de métastases et pour le dépistage des médicaments. Un test optimisé pour l’analyse d’échantillons de tumeurs humaines pourrait être une méthode clinique pour le traitement personnalisé du cancer.
Résumé
La principale cause de décès liés au cancer est la formation de métastases (c’est-à-dire lorsque les cellules cancéreuses se propagent de la tumeur primaire à des organes distants et forment des tumeurs secondaires). Le délaminage, défini comme la dégradation de la lame basale et de la membrane basale, est le processus initial qui facilite la transmigration et la propagation des cellules cancéreuses à d’autres tissus et organes. Marquer la capacité de délamination des cellules cancéreuses indiquerait le potentiel métastatique de ces cellules.
Nous avons développé une méthode standardisée, le test ex ovo CAM-Delam, pour visualiser et quantifier la capacité des cellules cancéreuses à délaminer et à envahir, permettant ainsi d’évaluer l’agressivité métastatique. En bref, la méthode CAM-Delam comprend l’ensemencement de cellules cancéreuses dans des anneaux de silicone sur la membrane chorioallantoïque du poussin (CAM) au jour embryonnaire 10, suivie d’une incubation de quelques heures à quelques jours. Le test CAM-Delam comprend l’utilisation d’une chambre humidifiée interne pendant l’incubation d’embryons de poussins. Cette nouvelle approche a augmenté la survie des embryons de 10% à 50% à 80% -90%, ce qui a résolu des problèmes techniques antérieurs avec de faibles taux de survie des embryons dans différents tests CAM.
Ensuite, les échantillons CAM avec les grappes de cellules cancéreuses associées ont été isolés, fixés et congelés. Enfin, des échantillons sectionnés par cryostat ont été visualisés et analysés pour détecter les dommages à la membrane basale et l’invasion des cellules cancéreuses à l’aide de l’immunohistochimie. En évaluant diverses lignées cellulaires cancéreuses métastatiques et non métastatiques connues conçues pour exprimer la protéine fluorescente verte (GFP), les résultats quantitatifs de CAM-Delam ont montré que les modèles de capacité de délamination reflètent l’agressivité métastatique et peuvent être classés en quatre catégories. L’utilisation future de ce test, en plus de quantifier la capacité de délamination comme indication de l’agressivité métastatique, consiste à démêler les mécanismes moléculaires qui contrôlent la délamination, l’invasion, la formation de micrométastases et les changements dans le microenvironnement tumoral.
Introduction
Environ 90% de la mortalité chez les patients cancéreux est causée par les conséquences des métastases cancéreuses, qui sont la formation de tumeurs secondaires dans d’autres parties du corps d’où provient le cancer à l’origine1. Il est donc important d’identifier les mécanismes liés à la métastatique pour trouver des cibles potentielles pour supprimer la formation de métastases tumorales. Par la suite, il existe un besoin de systèmes modèles dans lesquels le processus métastatique peut être évalué.
Au cours des métastases, les cellules cancéreuses subissent une transition épithéliale-mésenchymateuse (EMT), un processus cellulaire normal dans lequel les cellules épithéliales perdent leurs propriétés d’adhérence et de polarité et acquièrent plutôt un caractère mésenchymateux invasif2. La délamination fait partie du processus EMT et implique la dégradation de la laminine dans la membrane basale, ce qui est une condition préalable pour que les cellules cancéreuses quittent la tumeur primaire et envahissent d’autres tissus. Les principaux facteurs qui sont régulés à la hausse lors de la formation de métastases comprennent les métalloprotéinases matricielles (MMP), l’ADAM (une disintergin et une métalloprotéinase), l’ADAMTS (ADAM avec des motifs de thrombospondine) et les MMP de type membranaire (MT-MMP)3,4. Ces facteurs dégradent des molécules telles que la laminine, qui est exprimée dans toutes les membranes basales, pour faciliter la migration et l’invasion cellulaires.
La membrane chorioallantoïque (CAM) d’un œuf de poussin fécondé est un type de membrane basale. Les œufs de poussins fécondés ont été utilisés comme modèles métastatiques, dans lesquels des cellules cancéreuses ont été ensemencées sur la CAM extraembryonnaire et la formation ultérieure de métastases observée dans les embryons de poussins5. De plus, des modèles métastatiques de souris in vivo sont fréquemment utilisés, dans lesquels des cellules cancéreuses sont implantées chez les souris et des métastases dans divers organes sont analysées6. Cette approche prend du temps, coûte cher et peut causer de l’inconfort aux animaux. Pour y remédier, nous avons développé le test CAM-Delam, un modèle plus rapide et moins coûteux pour évaluer l’agressivité métastatique des cellules cancéreuses. Dans ce modèle, la capacité des cellules cancéreuses à dégrader le CAM du poussin (p. ex., la capacité de délamination) est combinée à une invasion potentielle des cellules cancéreuses dans le mésenchyme et utilisée comme mesure de l’agressivité métastatique.
Le présent article, basé sur une publication précédente7, décrit en détail le test CAM-Delam, de la manipulation des œufs de poussin fécondés, de la culture et de l’ensemencement de cellules cancéreuses, de la dissection et des analyses d’échantillons CAM, à la notation de la capacité de délamination des cellules cancéreuses en quatre catégories: intactes, altérées, endommagées et invasion. Nous donnons également des exemples de la façon dont ce test peut être utilisé pour déterminer les mécanismes moléculaires régulant le processus de délamination.
Protocole
En bref, la figure 1 résume les étapes globales du test CAM-Delam. Le protocole ci-dessous est basé sur 30 œufs de poule fécondés en culture et l’utilisation de deux lignées cellulaires cancéreuses différentes ensemencées séparément en trois anneaux / œuf et analysées à quatre moments.
1. Incubation d’œufs
- Utilisez des œufs de poussins fécondés provenant d’un couvoir local, qui garantissent une fécondation de plus de 90%
REMARQUE: Les œufs ne doivent pas avoir été conservés pendant plus de 4 jours à température ambiante (RT). En Suède, l’autorisation éthique pour l’utilisation expérimentale de poulets embryonnaires n’est requise qu’à partir du jour embryonnaire (E) 14 et au-delà. - Si nécessaire, essuyez soigneusement mécaniquement toute saleté ou plume sur les œufs à l’aide d’une serviette en papier sec ou humide dans l’eau.
- Nettoyez et stérilisez l’incubateur à œufs avec 70% d’éthanol avant utilisation (à chaque fois).
- Placez le nombre d’œufs souhaité dans des plateaux à œufs et incubez les œufs de poussin horizontalement dans un incubateur à œufs à 37,5-38 ° C avec 70% d’humidité. Considérez-le comme le jour d’incubation 0 (Figure 1A).
2. Préparation du bateau de pesage, des boîtes en plastique et des instruments de dissection
- Utilisez 70% d’éthanol pour stériliser 30 bateaux de pesage et 30 petites boîtes en plastique (~ 0,4 L) avec des bouchons transparents.
- Sécher les bateaux et les boîtes de pesage dans une hotte laminaire pendant la nuit (ON) et les conserver dans une boîte en plastique fermée jusqu’à ce qu’ils soient utilisés le jour 3 de l’incubation.
- Stériliser 2 L deH2O distillé ou désionisé pour 30 œufs incubés.
- Stériliser deux paires de ciseaux et trois paires de pinces en pulvérisant 70% d’éthanol. Séchez les instruments à l’air libre, puis conservez-les dans une boîte stérilisée jusqu’au jour d’incubation 3.
REMARQUE: Ces actions (étapes 2.1 à 2.4) peuvent être effectuées n’importe quel jour avant le jour d’incubation 3. Utilisez des gants pour éviter la contamination.
3. Ouverture des œufs et transfert dans la chambre humidifiée interne
REMARQUE: Utilisez des gants et un masque facial pour éviter la contamination.
- Ajouter environ 50 mL de H2O stérilisé aux boîtes en plastique stérilisées. Gardez les boîtes remplies d’eau avec des couvercles fermés, pour éviter toute contamination, à RT jusqu’à utilisation.
- Le jour d’incubation 3, craquez la coquille d’œuf à l’aide de la partie tranchante des ciseaux et coupez une ouverture droite dans la coquille.
- Ouvrez manuellement la coquille d’œuf au-dessus d’un bateau de pesée et collectez le blanc d’œuf, le jaune et l’embryon sain qui y est attaché dans le bateau de pesage (Figure 1B). Recherchez un embryon intact avec un cœur battant, un jaune intact et des vaisseaux sanguins développés pour l’expérience (>95% des œufs incubés). Jetez les œufs avec un embryon malformé, un embryon sans cœur battant, un jaune d’œuf cassé ou des vaisseaux sanguins jaunes endommagés.
- Transférez doucement le bateau de pesage dans une chambre interne humidifiée.
REMARQUE: Pour les étapes 3.2.-3.4., travaillez le plus rapidement possible pour éviter la contamination et, si possible, utilisez une hotte laminaire. - Incuber la chambre humidifiée interne dans l’incubateur à œufs (Figure 1C).
- Cultivez les œufs sans coquille du jour 3 au jour 10 dans l’incubateur à œufs avant de les utiliser (voir l’étape 3.6.), et au besoin, ajoutez de l’eau à l’incubateur pour maintenir 70% d’humidité.
- Vérifiez tous les jours les chambres internes humidifiées à travers le couvercle en plastique transparent les embryons morts ou les œufs contaminés sans coquille et retirez-les de l’incubateur.
4. Préparation des anneaux en silicone
- Pour préparer des bagues en silicone, coupez un tube en silicone d’un diamètre intérieur et extérieur de 4 mm et 5 mm, respectivement, en ~1 mm d’épaisseur, de préférence à l’aide d’un coupe-papier (Figure 1D).
- Transférer les anneaux de silicone dans de petites bouteilles en verre (Figure 1D), les recouvrir d’une feuille de métal et les stériliser à l’aide d’un autoclave ou similaire.
REMARQUE: Évitez l’autoclavage répété des anneaux de silicone inutilisés qui pourraient être contaminés, car un tel traitement diminue la capacité des anneaux de silicone à se fixer à la membrane, avec fuite ultérieure de la solution de cellule cancéreuse / collagène / RPMI à l’extérieur des anneaux. - Conservez les anneaux en silicone stériles à RT.
REMARQUE: Cette étape peut être effectuée n’importe quel jour avant le jour d’incubation 10.
5. Préparation des cellules cancéreuses
REMARQUE: Les solutions telles que le milieu de culture cellulaire, la trypsine et 1x PBS sont stockées à 4 ° C et doivent être chauffées à 37 ° C dans un bain-marie avant d’être ajoutées aux cellules. Après chauffage, rincer les bouteilles dans de l’éthanol à 70% et sécher avant utilisation.
- Cultiver les lignées cellulaires cancéreuses d’intérêt dans le milieu de culture concerné dans un incubateur de culture cellulaire à 37 °C en présence de 5 % (v/v) de CO2.
REMARQUE: Ici, le glioblastome U251-GFP et les cellules cancéreuses de la prostate PC-3U-GFP ont été cultivés dans un milieu RPMI moyen-RPMI complet complété par 10% (v / v) sérum fœtal bovin (FBS) et 1% (v / v) pénicilline-streptomycine (PS). - Planifiez la culture de cellules cancéreuses de sorte qu’environ 50 × 106 cellules cancéreuses soient prêtes à être récoltées le jour 10 de l’incubation du test CAM-Delam.
- Changez le milieu de culture cellulaire tous les 2-3 jours, ou lorsque la couleur moyenne passe du rose à l’orange/jaune.
- Facultatif: Induire l’hypoxie en traitant les cellules cancéreuses avec CoCl2 pour étudier les effets mécanistes moléculaires sur la délamination 1 jour avant le prélèvement cellulaire.
ATTENTION : La CoCl2 a une toxicité modérée. Manipulez avec soin dans une hotte et suivez les instructions du fabricant.- Préparer une solution mère fraîche de CoCl2 de 20 mM en dissolvant 0,0258 g dans 10 mL deH20 distillé stérilisé dans un tube conique de 15 mL enveloppé de papier d’aluminium pour le protéger de la lumière.
- Dans un tube conique de 50 mL, mélanger 250 μL de la solution mère de CoCl2 de 20 mM dans 25 mL de milieu RPMI complété par 1 % (v/v) de PS (mais sans FBS) par boîte de culture cellulaire de 15 cm de diamètre. Vortex doucement.
- Retirez le milieu RPMI complet des boîtes de culture cellulaire.
- Lavez les cellules avec 1x PBS 2x stérilisé.
- Ajouter 25 mL de milieu RPMI avec une trypsinisation à 2 cellules CoCl2 de μM (voir l’étape 5.6).
- Le jour 10 de l’incubation des œufs, préparer 1 mL d’un mélange collagène/RPMI (rapport 1:3), contenant 250 μL de collagène de type I (5 mg/mL) et 750 μL de milieu RPMI de culture cellulaire complété par 10 % de FBS et 1 % (v/v) PS. Conservez le mélange collagène/RPMI sur glace.
- Trypsiniser les cellules cancéreuses pour isoler les cellules en retirant d’abord le milieu de culture cellulaire et laver 2x avec 1x PBS.
- Ajouter 3 mL de solution de trypsine (0,05%) par boîte de culture cellulaire de 15 cm de diamètre et incuber pendant 2-3 min dans un incubateur de culture cellulaire jusqu’à ce que les cellules se détachent. Utilisez un microscope inversé sur table pour voir les cellules détachées. Si nécessaire, tapotez doucement le côté de la fiole pour déloger les cellules restantes regroupées ou attachées.
- Inactiver la trypsine en ajoutant 5 mL de milieu RPMI complet à chaque boîte de culture cellulaire et recueillir la suspension cellulaire de toutes les boîtes de culture cellulaire dans un tube de 50 mL.
- Compter les cellules cancéreuses par la méthode d’exclusion Trypan Blue pour distinguer les cellules vivantes des cellules mortes à l’aide d’un compteur de cellules. Ajouter 10 μL de la suspension cellulaire à 10 μL de tache bleu trypan à 0,4 %. Mélangez l’échantillon en pipetant de haut en bas plusieurs fois, puis chargez 10 μL du mélange cellulaire par chambre dans la lame d’échantillon dans le compteur de cellules. Répétez le comptage des cellules 3x pour vérifier le nombre de cellules/mL.
- Calculer et centrifuger la suspension de culture cellulaire volumique correcte contenant 50 x 106 cellules cancéreuses vivantes dans un tube de 50 mL à 500 × g pendant 5 min.
- Jeter le surnageant et mélanger la pastille cellulaire avec 1 mL du mélange collagène/RPMI. Comme le collagène est un matériau gélatineux, mélangez les cellules très lentement et soigneusement avec une pipette de 1 mL pour éviter de perdre des cellules dans la formation de bulles.
- Gardez la suspension cellulaire préparée sur de la glace et apportez-la à la zone de travail des œufs.
REMARQUE: Évitez de garder les cellules cancéreuses préparées sur la glace trop longtemps. Les cellules cancéreuses préparées doivent être placées sur le CAM dans les 15 à 25 minutes.
6. Ensemencement des cellules cancéreuses sur le CAM
REMARQUE: Utilisez des gants et un masque facial pour éviter la contamination.
- Au jour d’incubation 10, sortez les chambres humidifiées internes avec les œufs incubés sans coquille de l’incubateur.
REMARQUE: Environ 90% du nombre initial d’œufs incubés peuvent être utilisés; voir la figure 2. - Ouvrez la chambre humidifiée interne et placez jusqu’à six anneaux en silicone sur le CAM à l’aide de pinces stérilisées.
REMARQUE: Évitez de placer les anneaux de silicone près les uns des autres ou près de plus gros vaisseaux sanguins. - Mélanger la suspension de cellules cancéreuses par pipetage pour obtenir une distribution uniforme des cellules cancéreuses et ajouter 20 μL (1 × 106 cellules) de la suspension de cellules cancéreuses préparée à l’intérieur d’un anneau de silicone (Figure 1E). Lors de l’ajout des cellules, gardez l’embout de la pipette au-dessus du CAM pour vous assurer de ne pas endommager la membrane.
REMARQUE: Selon les résultats précédents7, différentes cellules cancéreuses peuvent être ensemencées dans des anneaux séparés sur le même CAM. - Fermez la chambre interne humidifiée et mettez-la dans l’incubateur à œufs.
7. Isolement du CAM avec les cellules cancéreuses associées
- Après 14 h, 1,5 jour, 2,5 jours et 3,5 jours d’incubation, sortez environ sept chambres internes humidifiées et ouvrez les couvercles un à la fois.
- À l’aide d’une paire de ciseaux, disséquez les cellules cancéreuses cultivées attachées au CAM (échantillons CAM-Delam) en coupant à l’extérieur de l’anneau de silicone (Figure 1F).
- Transférer immédiatement l’échantillon isolé de CAM-Delam à l’aide de pinces à 4 % de paraformaldéhyde (PFA) dans un tampon phosphate (PB) de 0,1 M dans une boîte de Pétri pour la fixation du tissu. Conserver sur la glace ou à 4 °C pendant 1 h.
REMARQUE: Conserver la solution de PFA à 4% à 4 °C pendant un maximum de 5 jours. ATTENTION : Le PFA est toxique. Lorsque vous manipulez de la poudre de PFA et des solutions de PFA, utilisez une hotte et portez un masque facial et des gants. Évitez d’inhaler de la poudre ou des vapeurs de solution. Suivez les instructions du fabricant. - Décapiter les embryons de poulet et les jeter comme déchets biologiques dans des bacs spécifiques.
- Retirer la solution de PFA à 4 % et ajouter 30 % de saccharose dans 0,1 M PB aux échantillons CAM-Delam et équilibrer à 4 °C pendant 1 h.
- Sous un microscope à dissection, retirez soigneusement l’anneau en silicone à l’aide d’une pince. À l’aide d’une paire de ciseaux, coupez l’échantillon CAM-Delam de forme rectangulaire avec les cellules cancéreuses au milieu (Figure 1G).
- À l’aide d’une pince, transférer les échantillons CAM-Delam dans un milieu de section congelé dans une boîte de Pétri pour éliminer l’excès de saccharose, puis pour incorporer des moules dans un milieu de section congelé.
- Sous un microscope à dissection, positionnez l’échantillon CAM-Delam en forme de U dans une direction verticale dans les moules d’encastrement à l’aide de n’importe quel instrument en forme d’aiguille (Figure 1G).
- Congeler et conserver les échantillons CAM-Delam à −80 °C.
8. Sectionnement des échantillons CAM-Delam
- Découper les échantillons CAM-Delam congelés à 10 μm sur 5 à 6 lames consécutives en utilisant la cryosection.
- Conservez les lames avec des sections à −80 °C ou utilisez-les directement pour la coloration immunohistochimique.
9. Coloration immunohistochimique
- Porter les lames de −80 °C à RT pendant 5 min avant de commencer l’immunoprotocole.
- Faites une ligne avec un marqueur hydrophobe sur les diapositives où les sections se terminent. Laissez-les sécher pendant quelques minutes.
- Placez les lames dans une chambre humidifiée (H2O) et couvrez les sections avec ~200-500 μL de solution bloquante (10% de sérum de veau fœtal et 0,1% d’azoture de sodium dans une solution saline tamponnée Tris avec 0,1% de Triton X-100 [TBST]) et incubérez pendant 15-30 min.
REMARQUE: À partir de cette étape, ne laissez pas les lames sécher à tout moment. - Verser la solution bloquante et la remplacer par 100-150 μL de l’anticorps primaire d’intérêt dilué dans la solution bloquante et incuber ON à 4 °C. Utilisez de préférence un anticorps anti-laminine-111 de lapin pour définir la lame basale avec un marqueur de cellules cancéreuses, si vous n’utilisez pas de GFP ou d’autres lignées cellulaires cancéreuses marquées par fluorescence.
REMARQUE: Ici, un facteur anti-von Willebrand de lapin a également été utilisé pour détecter les vaisseaux sanguins dans le CAM. - Préparez trois cuvettes en verre remplies de tampon TBST.
- Versez la solution d’anticorps primaire, transférez les lames dans les cuvettes en verre et lavez au moins 3 fois pendant 5 minutes chacune dans tbST.
- Retirez l’excès de TBST de la glissière et de la zone de barrière hydrophobe avec un mouchoir en papier souple.
- Couvrir la lame avec 100-150 μL d’un anticorps fluorescent secondaire approprié dilué dans une solution bloquante combinée avec du 4',6-diamidino-2-phénylindole, du dichlorhydrate (DAPI) et incuber dans l’obscurité à RT pendant 1 h.
- Versez la solution d’anticorps secondaire, transférez les lames dans les cuvettes en verre et lavez au moins 3 fois pendant 5 minutes chacune dans tbST.
- Retirez l’excès de TBST de la glissière et de la zone de barrière hydrophobe avec un mouchoir en papier souple.
- Montez les glissières en mettant 1 à 2 gouttes de support de montage fluorescent sur la glissière et placez doucement un couvercle en verre, en évitant les bulles d’air.
- Laissez sécher les lames pendant au moins 1 h à 4 °C avant l’analyse et conservez les lames à 4 °C.
10. Imagerie microscopique et notation de délamination
- Photographiez les sections à l’aide d’un microscope à épifluorescence équipé d’un appareil photo numérique, de préférence à un grossissement de 10x (Figure 1H).
- Analysez les sections à l’aide des catégories de notation CAM-Delam suivantes (Figure 3) :
- Recherchez une lame basale intacte sans altérations visibles.
- Recherchez une lame basale altérée mais non endommagée.
- Recherchez une lame basale endommagée sans invasion cellulaire.
- Recherchez la lame basale endommagée avec invasion cellulaire.
Résultats
La figure 1 présente les étapes clés du test CAM-Delam7. L’utilisation de chambres humidifiées internes (Figure 1C) a significativement amélioré le taux de survie des embryons de poussins de <50 % à 90 % au jour d’incubation 10 et d’environ 15 % à 80 % au jour d’incubation 13 (Figure 2).
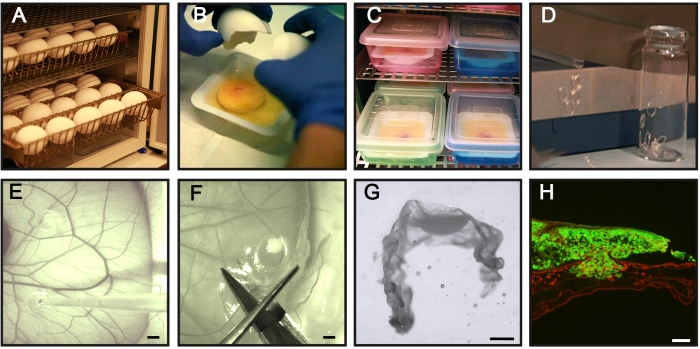
Figure 1 : Étapes clés du test CAM-Delam. (A) Incuber les œufs de poule fécondés horizontalement sans rotation. (B,C) Le jour 3 de l’incubation, craquez les œufs et placez-les dans des bateaux de pesage stériles (B), puis placez les bateaux dans une chambre interne humidifiée pour une incubation ultérieure (C). (D) Préparer des anneaux en silicone. (E) Le jour 10 de l’incubation, placez les anneaux de silicone sur le CAM et ensemencez 1 x 106 cellules cancéreuses à l’intérieur des anneaux à l’aide d’une pipette. (F,G) À différents moments (heures à jours), disséquez le CAM avec des cellules cancéreuses attachées, (F) fixez-le dans pfa, traitez avec du saccharose, positionnez-le dans un milieu de section congelé, (G) et congelez-le à −80 ° C. (H) Un exemple de CAM sectionné avec des cellules cancéreuses GFP+ associées (vert) et une coloration immunohistochimique de la laminine (rouge). Barres d’échelle = 2 mm (E,F), 1 mm (G) et 100 μm (H). Ce chiffre est tiré de Palaniappan et al.7. Abréviations : CAM = membrane chorioallantoïque; PFA = paraformaldéhyde; GFP = protéine fluorescente verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Survie de l’embryon de poulet par rapport à la méthode d’incubation. (A,B) Le jour d’incubation 10, la survie de l’embryon de poulet dans les HC internes a doublé (valeur moyenne 89,33; N = 105) par rapport à l’incubation dans les boîtes de Pétri (A; valeur moyenne 40; N = 64) et chambres non humidifiées (B; valeur moyenne 48,67; N = 46). (C,D) Au jour d’incubation 13, un taux de survie élevé a encore été observé en utilisant HC (valeur moyenne 81,67; N = 105), alors qu’une diminution importante de la survie des embryons a été observée à l’aide de la MP (C; valeur moyenne 11,33; N = 64) et N-HC (D; valeur moyenne 18,33; N = 46). La signification statistique a été testée à l’aide d’un test t à deux queues non apparié. Les barres d’erreur indiquent l’écart-type. *p < 0,05, **p < 0,01, ***p < 0,001. Ce chiffre a été modifié à partir de Palaniappan et al.7. Abréviations : HC = chambre humidifiée; = boîtes de Pétri; N-HC = chambre non humidifiée; E X = Jour d’incubation X. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Des analyses de différentes lignées cellulaires cancéreuses exprimant le GFP (glioblastome U251, prostate PC-3U, côlon SW620 et poumon A549) à l’aide de ce protocole ont été rapportées précédemment par Palaniappan et al.7. Les résultats du test CAM-Delam comprennent des différences dans la morphologie de la lame basale, détectée par la laminine, et l’invasion des cellules cancéreuses, définies comme des cellules qui ont traversé la couche de lame basale du poussin dans la couche mésodermique du poussin (figure 3). Ces résultats montrent que la capacité des cellules cancéreuses à dégrader la lame basale et à envahir le mésenchyme peut être classée dans l’une des quatre catégories suivantes : 1) lame basale intacte sans altérations visibles (Figure 3B), 2) lame basale altérée mais non endommagée (Figure 3C), 3) lame basale endommagée sans invasion cellulaire (Figure 3D), et 4) lame basale endommagée avec invasion cellulaire (Figure 3E ). Une autre observation était que, lorsque les cellules cancéreuses provoquaient une lame basale altérée ou endommagée, la CAM était également épaissie avec une augmentation de la formation de vaisseaux sanguins, définie par une coloration d’anticorps contre le facteur de von Willebrand, qui est synthétisé dans les vaisseaux sanguins8 (Figure 4C-H). Ces deux phénotypes, un CAM épaissi et une formation accrue de vaisseaux sanguins, n’ont pas été observés lorsque le CAM était intact (Figure 4A,B).

Figure 3 : Score CAM-Delam. (A-E) Un exemple de notation CAM-Delam basé sur l’intégrité de la lame basale CAM, visualisée par anti-laminine (rouge), et l’invasion potentielle de cellules cancéreuses exprimant la GFP (vert). (A) Contrôler la CAM sans cellules cancéreuses. (B-E) Dans les réponses aux cellules cancéreuses, quatre catégories décrivant la morphologie de la lame basale peuvent être marquées: (B) laminine intacte, (C) laminine altérée mais non endommagée (indiquée par un astérisque), (D) laminine endommagée mais sans invasion de cellules cancéreuses (flèches), laminine endommagée avec invasion cellulaire (pointes de flèche). Barre d’échelle = 100 μm (A-E). Ce chiffre est tiré de Palaniappan et al.7. Abréviations : CAM = membrane chorioallantoïque; GFP = protéine fluorescente verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Évaluation de l’épaississement du CAM et de la formation des vaisseaux sanguins. (A-H) Un exemple de visualisation de l’épaississement CAM et de la formation de vaisseaux sanguins, détecté par le facteur anti-Von Willebrand (rouge), en réponse à la lame de divers types de cellules cancéreuses. (A,B) Contrôlez la CAM sans cellules cancéreuses. (C,D) En réponse à une lignée cellulaire cancéreuse non métastatique (notée Intacte), aucun épaississement évident du mésenchyme ou augmentation de la formation de vaisseaux sanguins n’a été détecté. (E-H) En réponse à des cellules cancéreuses métastatiques entraînant une altération ou un endommagement de la laminine, le mésenchyme a été épaissi (indiqué par des pointes de flèche doubles) et une formation accrue de vaisseaux sanguins a été observée (indiquée par des flèches). Barre d’échelle = 100 μm. Ce chiffre a été modifié à partir de Palaniappan et al.7. Abréviations : CAM = membrane chorioallantoïque; GFP = protéine fluorescente verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le glioblastome U251 et les cellules cancéreuses de la prostate PC-3U sont deux exemples de lignées cellulaires cancéreuses ayant des capacités de délamination complètement différentes (figure 5). Les cellules PC-3U ont induit une laminine endommagée après 1,5 jour, avec une invasion claire après 2,5 jours (Figure 5A). En revanche, les cellules U251 n’ont induit que des altérations mineures de la laminine après 1,5 à 3,5 jours, mais n’ont jamais causé de dommages visibles à la laminine (Figure 5B).
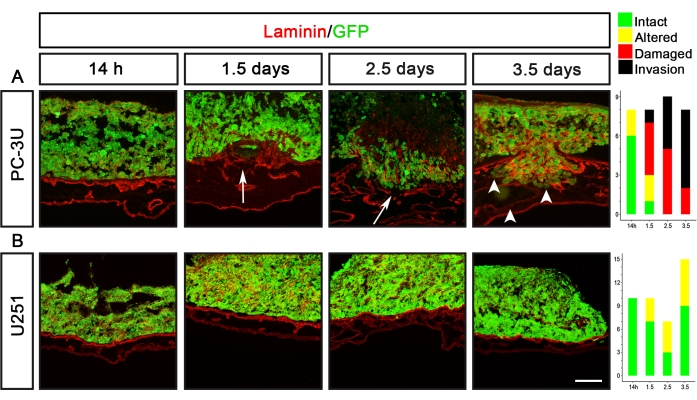
Figure 5 : Visualisation de la capacité de délamination des cellules cancéreuses de la prostate (PC-3U) et du glioblastome (U251). (A) Les cellules PC-3U ont induit une altération mineure de la laminine après 14 h, des dommages à la laminine après 1,5 jour (flèche) et le début de l’invasion après 2,5 jours, qui a augmenté après 3,5 jours (pointes de flèche). (B) Les cellules U251 ont provoqué une altération mineure de la laminine après 1,5 à 3,5 jours. Les panneaux de droite montrent des graphiques représentant la notation CAM-Delam. L’axe des y indique le nombre d’échantillons et l’axe des x indique les points temporels de la culture. Barre d’échelle = 100 μm (A,B). Ce chiffre a été modifié à partir de Palaniappan et al.7. Abréviations : CAM = membrane chorioallantoïque; GFP = protéine fluorescente verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le test CAM-Delam peut être utilisé pour définir les mécanismes moléculaires qui régulent le processus de délamination. Un exemple est l’utilisation du traitement CoCl2 pour induire une hypoxie avec ou sans la combinaison de métalloprotéinases matricielles inhibitrices (MMP) en utilisant le large inhibiteur MMP GM6001 (Figure 6). Après le traitement par CoCl2 , les cellules cancéreuses non métastatiques U251 ont acquis la capacité d’induire la délamination et les cellules invasives, qui a été supprimée lorsque le traitement par CoCl2 a été combiné avec l’inhibiteur MMP GM6001 (Figure 6). Ainsi, le test CAM-Delam peut être utile pour définir les molécules et les voies moléculaires qui affectent le processus de délamination.

Figure 6 : Schémas de délamination en réponse aux cellules U251 exposées à coCl2 seules ou associées à un inhibiteur de la MMP. (A-C) Cellules U251 cultivées pendant 3,5 jours sur le CAM dans diverses conditions. (A) Les cellules U251 cultivées seules n’ont induit aucun dommage à la laminine. (B) Cellules U251 cultivées préexposées à la CoCl2 (24 h) avant le lavage et l’ensemencement cellulaire sur les dommages causés par la laminine induite par la CAM et l’invasion cellulaire. (C) Le prétraitement avec un inhibiteur MMP à large spectre GM6001 (pendant 1 h), suivi d’une exposition au CoCl2 (24 h) avant le lavage et l’ensemencement des cellules U251 sur le CAM, a supprimé l’effet du traitement par CoCl2, et aucun dommage évident à la laminine ou invasion de cellules cancéreuses n’a été détecté. Barre d’échelle = 100 μm (A-C). Les panneaux (B) et (C) proviennent de Palaniappan et al.7. Abréviations : CAM = membrane chorioallantoïque; GFP = protéine fluorescente verte; CoCl2 = chlorure de cobalt; MMP = métalloprotéinase matricielle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cet article décrit le test CAM-Delam pour évaluer l’agressivité métastatique des cellules cancéreuses, déterminée en marquant les modulations de la lame basale et l’invasion cellulaire potentielle dans le mésenchyme dans une période de quelques heures à quelques jours. Un problème technique antérieur pour divers tests CAM a été la faible survie des embryons de poussins. Ce problème a été résolu en introduisant l’utilisation d’une chambre humidifiée interne pendant l’incubation de l’embryon, ce qui a augmenté la survie de l’embryon de 10% -50% à 80% -90%7. L’utilisation d’une chambre humidifiée interne peut donc être utile dans les tests CAM en général, ainsi que dans d’autres expériences ex ovo poussin.
Les points de temps de notation présentés à 14 h, 1,5 jour, 2,5 jours et 3,5 jours après l’ensemencement de 1 x 106 cellules cancéreuses sur le CAM sont basés sur un développement rigoureux de méthodes utilisant six lignées cellulaires cancéreuses différentes et sont suffisants pour distinguer la gamme des capacités de non-délaminage à délaminage avec invasion des lignées cellulaires cancéreuses. Une utilisation minimale de quatre œufs avec trois anneaux par point temporel et par lignée cellulaire est suggérée, et cela devrait être répété au moins une fois ou selon les plans expérimentaux et les exigences statistiques. L’un des avantages du test CAM-Delam est d’obtenir des résultats informatifs concernant la capacité de délamination des cellules cancéreuses en quelques jours afin d’estimer l’agressivité des cellules cancéreuses et le risque potentiel de formation de métastases. L’obtention rapide des résultats est facilitée par la surveillance de la dégradation de la lame basale due à l’invasion des cellules cancéreuses et aux microtumes / bourgeons tumoraux et métastases d’organes qui en résultent. Traditionnellement, les modèles CAM ont été utilisés pour analyser la formation de métastases d’organes, ce qui prend environ 2 semaines pour être déterminé9. En utilisant sept lignées cellulaires cancéreuses différentes, nous avons précédemment vérifié7 que le score de délamination est lié à la capacité des cellules cancéreuses à former des métastases dans les modèles de rongeurs 10,11,12,13,14, ce qui soutient la valeur prédictive du test CAM-Delam. De plus, les modèles murins nécessitent un temps encore plus long, de plusieurs semaines à plusieurs mois, avant que les métastases puissent être examinées15,16. En bref, ce test CAM-Delam développé, axé sur la notation de la capacité de délamination et non sur l’examen de la formation ultérieure de tumeurs dans l’embryon de poussin, est donc un bon complément aux modèles existants d’invasion CAM de poulet et de tumeur de souris.
Une limitation dans le test CAM-Delam peut être la visualisation peu claire de la lame basale si les cellules cancéreuses elles-mêmes expriment la laminine. Si c’est le cas, d’autres marqueurs indiquant la lame basale, tels que l’E-cadhérine, pourraient être utilisés7. D’autres études d’invasion CAM ont utilisé le collagène de type IV pour visualiser la CAM et la pan-cytokératine et la vimentine afin d’identifier les cellules cancéreuses envahissantes et la formation de microtumeurs / bourgeons tumoraux17,18.
La délamination est un processus cellulaire normal, à la fois pendant le développement et plus tard dans la vie, qui permet aux cellules de quitter un épithélium et de migrer vers d’autres tissus. Des exemples de cellules délaminantes au cours du développement sont la crête neurale et les neurones pionniersolfactifs 19,20; plus tard dans la vie, la cicatrisation des plaies dépend de la délamination21. Pendant le cancer, ce processus est régulé à la hausse dans les mauvaises cellules et / ou au mauvais moment. Ainsi, la méthode CAM-Delam peut être utile pour démêler les mécanismes moléculaires qui régulent la délamination, ce qui serait important pour les connaissances biologiques et de base sur les maladies. De telles études de délamination incluraient l’ajout de facteurs d’intérêt pour les cellules cancéreuses ensemencées sur le CAM ou l’étude de cellules cancéreuses génétiquement modifiées. Un exemple présenté ici est le prétraitement CoCl2 de la lignée cellulaire non métastatique U251 pour induire une hypoxie, ce qui conduit à l’induction d’une capacité agressive métastatique qui pourrait être supprimée par un inhibiteur MMP à large spectre. Ainsi, trouver des molécules clés qui contrôlent la délamination augmente la possibilité de concevoir des inhibiteurs pour supprimer ce processus. À cet égard, une autre utilisation potentielle du protocole CAM-Delam est le dépistage des drogues pour la suppression du délaminage et de l’invasion cellulaire. De plus, en clinique, l’évaluation de la gravité du cancer est un élément essentiel pour le diagnostic, la planification du traitement et les soins. Actuellement, le système de stadification TNM (T, taille de la tumeur; N, ganglion-si le cancer s’est propagé aux ganglions lymphatiques; M, métastase à distance) est utilisé pour évaluer la gravité du cancer22. Le test CAM-Delam définit une approche innovante pour évaluer l’agressivité des cellules cancéreuses et le risque potentiel de formation de métastases et pourrait être un complément utile au système de stadification TNM. Il est à noter que la stadification du TNM est basée sur l’analyse d’échantillons de tissus fixes, alors qu’une approche clinique potentielle cam-delam examinerait les tissus frais ou fraîchement congelés en combinaison avec des techniques permettant de faire revivre les cellules congelées23.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts concurrents à divulguer.
Remerciements
Nous remercions les chercheurs suivants de l’Université d’Umeå pour leur aide avec les lignées cellulaires et les anticorps anticancéreux pertinents: L. Carlsson (anticorps von Willebrand Factor), J. Gilthorpe (U251) et M. Landström (PC-3U). Nous remercions également Hauke Holthusen du laboratoire de Gilthorpe pour la génération de la lignée cellulaire stable HEK293-TLR-AAVS1. Les travaux du laboratoire Gunhaga ont été soutenus par la Fondation suédoise contre le cancer (18 0463), l’incubateur Umeå Biotech, le Norrlands Cancerforskningsfond, le Conseil suédois de la recherche (2017-01430) et la faculté de médecine de l’Université d’Umeå.
matériels
| Name | Company | Catalog Number | Comments |
| EQUIPMENT | |||
| Centrifuge | Rotanta 480 R, Hettich zentrifugen | ||
| Countess II FL Automated Cell Counter | Invitrogen | ||
| Cryostat | HM 505 E, Microm | ||
| Digital camera | Nikon DS-Ri1 | ||
| Dissection Microscope | Leica M10 | For CAM-sample dissection and positioning in molds | |
| Egg incubator | Fiem | Many other sources are available. Must be cleaned and sterilized with 70 % ethanol before each use | |
| Epifluorescence microscope | Nikon Eclipse, E800 | Equiped with a digital camera, for scoring delamination and cell invasion. | |
| Fine forceps | Many sources are available | Must be sterilized before use | |
| Freezer -80 °C | Thermo Fisher Scientific | 8600 Series | Model 817CV |
| Inverted microscope | Nikon Eclipse TS100 | For cell culture work | |
| Scissors (small) | Many sources are available | Must be sterilized before use | |
| MATERIALS | |||
| anti-Laminin-111 | Sigma-Aldrich | L9393 | Primary anti-rabbit antibody (1:400) |
| anti-rabbit Cy3 | Jackson Immuno Research | 111-165-003 | Secondary antibody (1:400) |
| anti-von Willebrand Factor | DAKO | P0226 | Primary antibody (1:100) |
Cobalt(II) chloride | Sigma-Aldrich | 232696-5G | CAUTION: moderate toxicity chemical. Handle with care only in fume hood. Follow manufacturers instructions |
| DAPI | Sigma-Aldrich | D9542-10MG | 4',6-diamidino-2-phenylindole, dihydrochloride (1:400) |
| Fertilized chicken eggs | Strömbäcks Ägg, Vännäs, Sweden | Any local egg supplyer | |
| Fetal bovine serum | Life Technologies | 10500-064 | |
| Fluorescence mounting medium | Allent Technologie | S302380-2 | Avoid bubble formation when mounting. Allow to dry at +4 °C |
| Glass chambers for silicon rings | Many sources are available | We used 15 mL glass chambers. Around 20 silicon rings fit in one chamber. Avoid crowding, since the rings may stick together and aggravate work. | |
| Glass coverslips | VWR International | 631-0165 | |
| GM6001 MMP Inhibitor | Sigma-Aldrich | CC1010 | |
| Microscope slides for immunohistochemistry | Fisher Scientific | 10149870 | |
| NEG-50 frozen medium | Cellab | 6506 | |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | CAUTION: highly toxic. Handle with care only in fume hood, follow manufacturers instructions. Use all protective clothing. |
Peel-A-Way Embedding Molds | Polysciences | 18985 | |
| Penicillin–streptomycin | Gibco | 15070063 | |
| Petri dishes | Sarstedt | 83.3903 | 15 cm in diameter for cell culture |
| Plastic box | Esclain | ||
| PureCol EZ Gel Collagen | Cellsystems | 5074-35ML | 5 mg/mL. Gelatinous material. Pipette very slowly and carefully to avoid cells being lost in the bubble formations. |
| RPMI medium | Thermo Fisher Scientific | 21875034 | |
| Silicon rings | VWR International | 228-1580 | Inner/outer diameter: 4/5 mm. Should be sterilized before use. Avoid repeated autoclaving of unused rings. |
| Trypan blue | Fisher Scientific | T10282 | |
| Trypsin | Life Technologi | 15400054 | 0.50% |
| Weighing boats | VWR International | 611-0094 | |
| SOLUTIONS | |||
| Collagen-RPMI media mixture (1 mL) | Compelete RPMI Media 750 µL | ||
| PureCol EZ Gel Collagen 250 µL | |||
| Mix and use immediately | |||
| Complete RPMI media (500 mL) | RPMI Media 445 mL | ||
| FBS 50 mL | |||
| Penicillin–streptomycin 5mL | |||
| Store at 4 °C | |||
| PB (0.2 M; 1 000 mL) | Na2HPO4 (MW 141.76) 21.9 g | ||
| NaH2PO4 (MW 137.99) 6.4 g | |||
| add deionized water up to final volume of 1000ml | |||
| Store in RT | |||
| PFA (4 %) in 0.1 M PB (100 mL) | Deionized water 50 mL | ||
| 0.2 M PB 50 mL | |||
| Paraformaldehyde (PFA) 4g | |||
| heat to 60 °C in water bath | |||
| add 5 M NaOH 25 µL | |||
| Stir to dissolve the PFA powder | |||
| Store at 4 °C | |||
| TBST (1 000 mL) | 50mM Tris pH 7,4 50 mL | ||
| 150mM NaCI 30 mL | |||
| 0,1% Triton X-100 10 mL | |||
| H2O (MQ) 900 mL | |||
| Trypsin (0.05 %; 10 mL) | 1x PBS 9 mL | ||
| 10x Trypsin (0.5 %) 1 mL | |||
| 10 mL in total, Store at 4 °C |
Références
- Vasantharajan, S. S., et al. The epigenetic landscape of circulating tumour cells. Biochimica et Biophysica Acta - Reviews on Cancer. 1875 (2), 188514 (2021).
- Acloque, H., Adams, M. S., Fishwick, K., Bronner-Fraser, M., Nieto, M. A. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. Journal of Clinical Investigation. 119 (6), 1438-1449 (2009).
- Itoh, Y. Membrane-type matrix metalloproteinases: their functions and regulations. Matrix Biology. 44-46, 207-223 (2015).
- Przemyslaw, L., Boguslaw, H. A., Elzbieta, S., Malgorzata, S. M. ADAM and ADAMTS family proteins and their role in the colorectal cancer etiopathogenesis. BMB Reports. 46 (3), 139-150 (2013).
- Chu, P. Y., Koh, A. P., Antony, J., Huang, R. Y. Applications of the chick chorioallantoic membrane as an alternative model for cancer studies. Cells Tissues Organs. 211 (2), 222-237 (2021).
- MacDonald, I. C., Groom, A. C., Chambers, A. F. Cancer spread and micrometastasis development: quantitative approaches for in vivo models. Bioessays. 24 (10), 885-893 (2002).
- Palaniappan, T. K., Slekiene, L., Jonasson, A. K., Gilthorpe, J., Gunhaga, L. CAM-Delam: an in vivo approach to visualize and quantify the delamination and invasion capacity of human cancer cells. Scientific Reports. 10 (1), 10472 (2020).
- Carrillo, M., Kim, S., Rajpurohit, S. K., Kulkarni, V., Jagadeeswaran, P. Zebrafish von Willebrand factor. Blood Cells, Molecules and Diseases. 45 (4), 326-333 (2010).
- Leupold, J. H., Patil, N., Allgayer, H. The chicken egg chorioallantoic membrane (CAM) model as an in vivo method for the investigation of the invasion and metastasis cascade of malignant tumor cells. Methods in Molecular Biology. 2294, 17-26 (2021).
- Jia, Y., et al. Recombinant human endostatin endostar inhibits tumor growth and metastasis in a mouse xenograft model of colon cancer. Pathology and Oncology Research. 18 (2), 315-323 (2012).
- Liu, B., et al. RNAi-mediated inhibition of presenilin 2 inhibits glioma cell growth and invasion and is involved in the regulation of Nrg1/ErbB signaling. Neuro-Oncology. 14 (8), 994-1006 (2012).
- Qin, T., et al. Tumor necrosis factor superfamily 15 promotes lymphatic metastasis via upregulation of vascular endothelial growth factor-C in a mouse model of lung cancer. Cancer Science. 109 (8), 2469-2478 (2018).
- Ren, L., et al. Characterization of the metastatic phenotype of a panel of established osteosarcoma cells. Oncotarget. 6 (30), 29469-29481 (2015).
- Zang, G., Mu, Y., Gao, L., Bergh, A., Landstrom, M. PKCzeta facilitates lymphatic metastatic spread of prostate cancer cells in a mice xenograft model. Oncogene. 38 (22), 4215-4231 (2019).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nature Reviews Cancer. 11 (2), 135-141 (2011).
- Jung, J. Human tumor xenograft models for preclinical assessment of anticancer drug development. Toxicology Research. 30 (1), 1-5 (2014).
- Liu, M., et al. The histone methyltransferase EZH2 mediates tumor progression on the chick chorioallantoic membrane assay, a novel model of head and neck squamous cell carcinoma. Translational Oncology. 6 (3), 273-281 (2013).
- Steinmann, S., et al. DAPK1 loss triggers tumor invasion in colorectal tumor cells. Cell Death & Disease. 10 (12), 895 (2019).
- Andrieu, C., et al. MMP14 is required for delamination of chick neural crest cells independently of its catalytic activity. Development. 147 (7), (2020).
- Palaniappan, T. K., Slekiene, L., Gunhaga, L., Patthey, C. Extensive apoptosis during the formation of the terminal nerve ganglion by olfactory placode-derived cells with distinct molecular markers. Differentiation. 110, 8-16 (2019).
- Thiery, J. P., Acloque, H., Huang, R. Y., Nieto, M. A. Epithelial-mesenchymal transitions in development and disease. Cell. 139 (5), 871-890 (2009).
- Pineros, M., et al. Essential TNM: a registry tool to reduce gaps in cancer staging information. The Lancet Oncology. 20 (2), 103-111 (2019).
- Walsh, A. J., Cook, R. S., Sanders, M. E., Arteaga, C. L., Skala, M. C. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon