Method Article
Sottocoltura e crioconservazione degli organoidi dell'adenocarcinoma esofageo: pro e contro per la digestione a cellula singola
In questo articolo
Riepilogo
Questo protocollo descrive i metodi di sottocoltura e crioconservazione degli organoidi dell'adenocarcinoma esofageo con e senza digestione a singola cellula per consentire ai ricercatori di scegliere strategie appropriate in base al loro disegno sperimentale.
Abstract
La mancanza di adeguati modelli di ricerca traslazionale che riflettano la malattia primaria per esplorare la tumorigenesi e le strategie terapeutiche è un grosso ostacolo nell'adenocarcinoma esofageo (EAC). Gli organoidi derivati dal paziente (DOP) sono recentemente emersi come un notevole modello preclinico in una varietà di tumori. Tuttavia, ci sono ancora protocolli limitati disponibili per lo sviluppo di DOP EAC. Una volta stabilite le DOP, la propagazione e la crioconservazione sono essenziali per ulteriori analisi a valle. Qui, due diversi metodi sono stati standardizzati per la sottocoltura e la crioconservazione delle DOP EAC, cioè con e senza digestione a singola cellula. Entrambi i metodi possono ottenere in modo affidabile un'appropriata vitalità cellulare e sono applicabili per una diversa configurazione sperimentale. L'attuale studio ha dimostrato che la subculturazione di DOP EAC con digestione a singola cellula è adatta per la maggior parte degli esperimenti che richiedono il controllo del numero di cellule, la densità uniforme e una struttura cava che facilita il monitoraggio delle dimensioni. Tuttavia, il metodo basato su singole cellule mostra una crescita più lenta in coltura e dopo la ri-coltivazione da stock congelati. Inoltre, la subculturazione con digestione a singola cellula è caratterizzata dalla formazione di strutture cave con un nucleo cavo. Al contrario, l'elaborazione di DOP EAC senza digestione a singola cellula è favorevole per la crioconservazione, l'espansione e la caratterizzazione istologica. In questo protocollo, vengono descritti i vantaggi e gli svantaggi della sottocoltura e della crioconservazione delle DOP EAC con e senza digestione monocellulare per consentire ai ricercatori di scegliere un metodo appropriato per elaborare e studiare i loro organoidi.
Introduzione
Il cancro esofageo (EC) è la decima più comune e la sesta causa di morte per cancro in tutto il mondo1. L'adenocarcinoma esofageo (EAC) è uno dei principali sottotipi istologici della CE e si verifica principalmente nei paesi occidentali2. Nell'ultimo decennio, l'incidenza dell'EAC è aumentata significativamente in molti paesi sviluppati, tra cui la Germania3. A causa dell'aggressività del cancro e della mancanza di sintomi durante la fase iniziale dello sviluppo del tumore, la prognosi complessiva nei pazienti con EAC è scarsa, mostrando un tasso di sopravvivenza a 5 anni di circa il 20%2,4,5.
Dalla fine del XX secolo, sono stati stabiliti diversi modelli per la ricerca biomedica di EAC. Le classiche linee cellulari EAC umane che sono state stabilite nel 19906, estendono la nostra conoscenza della biologia tumorale EAC, genetica tumorale e strategie antitumorali, e sono comunemente usati nella ricerca EAC. Inoltre, alcuni gruppi di ricerca hanno sviluppato con successo modelli animali di EAC o esofago di Barrett esponendo gli animali a fattori di rischio noti come il reflusso gastroesofageo attraverso approcci chirurgici o infiammatori 7,8,9. Inoltre, sono stati sviluppati modelli di xenotrapianti derivati dal paziente (PDX) che innestano i tessuti tumorali primari EAC per via sottocutanea o ortotopica in topi immunodeficienti, per simulare il comportamento biologico del tumore EAC umano e l'ambiente tumorale 10,11,12. Tuttavia, nonostante questi modelli migliorino le applicazioni cliniche e la nostra comprensione dei meccanismi molecolari alla base della tumorigenesi e della progressione dell'EAC, c'è ancora una grande sfida per estrapolare i risultati di questi modelli di ricerca agli esseri umani.
Gli organoidi tumorali derivati dal paziente (DOP) vengono coltivati in un sistema di coltura 3D che imita lo sviluppo umano e la rigenerazione degli organi in vitro. Generate dal tessuto primario dei pazienti, le DOP ricapitolano le caratteristiche molecolari e fenotipiche del tumore umano e hanno mostrato applicazioni promettenti nello sviluppo di farmaci e nel trattamento personalizzato del cancro13,14. Confrontando dieci casi di EAC DOP con il loro tessuto tumorale accoppiato, le DOP EAC condividono caratteristiche istopatologiche e paesaggi genomici simili con il tumore primario, mantengono l'eterogeneità intratumorale e facilitano uno screening efficiente dei farmaci in vitro15. Le DOP EAC sono state utilizzate anche nello studio dell'interazione delle cellule tumorali EAC con i fibroblasti associati al cancro derivati dal paziente (CAF), indicando una potente applicazione nel campo della ricerca sul microambiente tumorale16. Sfortunatamente, sono stati disponibili protocolli limitati per lo sviluppo e la propagazione di DOP EAC. Qui, vengono descritti in dettaglio due diversi metodi per la subcoltura e la conservazione delle DOP EAC: con e senza digestione a singola cellula. I metodi standardizzati per il mantenimento delle DOP EAC e delle loro applicazioni possono aiutare i ricercatori a scegliere metodi appropriati per scopi diversi nella loro ricerca EAC DOP.
Protocollo
Una cultura DOP consolidata e ben cresciuta rappresenta la base per una sottocultura e una crioconservazione di successo descritte in questo protocollo. Qui, le DOP EAC sono state generate dal tessuto tumorale primario dei pazienti EAC utilizzando il protocollo descritto da Karakasheva T. A. et al17. I tessuti EAC sono stati raccolti dalla biobanca sotto l'approvazione di BioMaSOTA (approvato dal Comitato Etico dell'Università di Colonia, ID: 13-091).
NOTA: le DOP EAC sono state coltivate in un incubatore umidificato a 37 °C e 5% co2 utilizzando un terreno di coltura DOP (Tabella 1). Nei passaggi seguenti, vengono descritti in dettaglio due metodi della sottocultura. Una piastra a 12 pozzetti è consigliata per la subcoltura delle DOP con una densità di semina di tre cupole di gel a matrice extracellulare (ECM) per pozzetto, in quanto consente un uso flessibile di ciascun pozzo e una quantità appropriata di DOP per scopi diversi. Una tecnica asettica è obbligatoria durante la manipolazione delle DOP.
1. Preparativi in anticipo
- Preriscaldare una piastra a 12 pozzetti inserendola in un incubatore a CO2 a 37 °C durante la notte prima della sottocoltura per garantire il riscaldamento completo della piastra. Se disponibili, utilizzare pozzetti vuoti da un piatto con l'attuale cultura DOP.
NOTA: lo stoccaggio continuo di 1-2 piastre fresche a 37 °C è consigliato per una pianificazione flessibile della sottocoltura. - Pre-raffreddare punte da 1.000 μL e 200 μL con un orifizio largo a -20 °C (si consiglia la conservazione continua). Centrifuga pre-fredda a 4 °C.
- Impostare la temperatura dell'incubatore rotante a 37 °C (se viene eseguita la digestione a cella singola).
- Incubare un volume appropriato di gel ECM per 1 ora su ghiaccio per liquefare. Posizionare la soluzione di recupero cellulare sul ghiaccio.
2. Organoidi di raccolta
- Rimuovere la piastra con DOP in crescita dall'incubatore a CO2.
- Aspirare il vecchio mezzo usando una pompa per vuoto.
NOTA: Evitare di toccare le cupole. - Aggiungere un volume appropriato di soluzione di recupero delle cellule ghiacciate (500 μL/cupola) nel pozzo.
- Disintegrare il gel ECM tubando su e giù più volte per frammentare le cupole di gel ECM in piccoli pezzi utilizzando punte da 1.000 μL con un orifizio largo.
- Combinare la miscela di DOP, gel ECM e soluzione di recupero cellulare da un massimo di due pozzetti (sei cupole) e trasferirla in un tubo a bassa legatura da 5 ml (utilizzare un secondo tubo nel caso in cui vengano utilizzati più pozzetti per la sottocoltura).
NOTA: Facoltativamente, se il gel ECM non è stato sciolto completamente, aggiungere altri 1,5 ml di soluzione di recupero cellulare alla miscela di PDO, gel ECM e soluzione di recupero cellulare. - Incubare il tubo contenente la miscela al punto 2.5 su ghiaccio per 20 min, mescolare ogni 5 min invertendo il tubo cinque volte per garantire la liquefazione del gel ECM.
- Centrifuga a 500 x g per 4 min a 4° C.
- Se c'è un pellet visibile e stabile dopo la centrifugazione, procedere con il passaggio 2.10. In caso contrario, continuare con il passaggio 2.9.
- Se non c'è pellet visibile e le DOP sembrano ancora bloccate in una fase gel, rimuovere con cura il surnatante con una pompa per vuoto fino a raggiungere la fase contenente ECM gel-PDO-Solution e aggiungere 3 ml di soluzione di recupero cellulare ghiacciato.
- Capovolgere il tubo un paio di volte e incubare sul ghiaccio per altri 10 minuti. Mescolare invertendo il tubo di volta in volta.
- Centrifugare a 500 x g per 4 min a 4 °C e proseguire con il passo 2.10.
- Scartare accuratamente il surnatante utilizzando una pompa per vuoto o una pipetta da 1.000 μL. Cerca di rimuovere il surnatante il più possibile.
NOTA: A causa della bassa superficie di legame del tubo, il pellet non sarà stabile come al solito. - Conservare il pellet DOP su ghiaccio e procedere con il passaggio 3 (senza digestione) o il passaggio 4 (con digestione monocellulare) a seconda dei diversi scopi.
3. Subculturazione senza digestione
NOTA: Questo metodo mira ad aumentare le dimensioni e la densità delle DOP. Le dimensioni maggiori e la maggiore densità facilitano il processo di incorporamento, la caratterizzazione istologica e l'espansione della DOP. A seconda dei rapporti di divisione PDO (in base alla densità delle DOP, si consiglia un rapporto compreso tra 1:3 e 1:6), risospesere il pellet dal punto 2.8 in un volume appropriato di gel ECM liquido.
- Rimuovere le punte pre-raffreddate da 200 μL e 1.000 μL con un orifizio largo dal congelatore a -20 °C e riporle su un banco pulito.
- Risospendare il pellet dal punto 2.11 in gel ECM utilizzando punte pre-raffreddate da 1.000 μL. Mescolare con pipettaggio su e giù circa 10 volte per assicurarsi che le DOP non si aggregino e siano distribuite uniformemente nel gel ECM.
NOTA: Utilizzare gel/cupola ECM da 50 μL. Calcolare sempre per una cupola più del necessario (ad esempio, per nove cupole (cioè tre pozzi), risospesciare il pellet in 500 μL di gel ECM liquido (450 + 50 μL extra). Cerca di evitare di produrre bolle durante la risospensione! - Rimuovere la piastra preriscaldata a 12 pozzetti dall'incubatrice prima di seminare le cupole.
- Cupole di semi contenenti 50 μL di gel ECM nella piastra calda (tre cupole / pozzetto). Evitare di pipettare le bolle nelle cupole di gel ECM.
- Rimettere la piastra nell'incubatore a 37 °C e 5% CO2e incubare per 20-30 minuti per solidificare il gel ECM.
- Aggiungere con attenzione il mezzo DOP preriscaldato (Tabella 1) senza disturbare le cupole.
- Coltivare le DOP per 7-14 giorni fino a quando non si verificano la densità e la morfologia richieste.
4. Subculturazione con digestione monocellulare
NOTA: I seguenti passaggi mirano ad aumentare il numero di DOP per cupola. La digestione a singola cellula facilita il controllo del numero cellulare e l'espansione della DOP.
- Preparare il mezzo di digestione mescolando 2 mL di 0,25% di tripsina-EDTA e 20 μL di DNasi I (per la digestione di tre cupole).
- Risospesciare il pellet dal punto 2.11 con un volume appropriato di trivella-EDTA + DNasi I preriscaldato allo 0,25% e mescolarlo circa 10 volte pipettando su e giù usando una pipetta da 1.000 μL (utilizzare punte normali da 1.000 μL).
- Incubare per 10 minuti a 37 °C in un incubatore rotante con una velocità di rotazione di almeno 28 giri/min.
- Preparare un tubo da 15 mL contenente 6 mL di soluzione di inibitore della tripsina di soia (STI, Tabella 2) (per 2 mL di tripsina-EDTA allo 0,25%).
- Dopo la digestione, mescolare accuratamente le DOP digerite un paio di volte con una pipetta da 1.000 μL per interrompere le DOP.
- Trasferire le DOP digerite nel tubo da 15 ml contenente soluzione STI per arrestare il processo di digestione.
- Centrifugare a 500 x g per 4 min a 4 °C. Scartare accuratamente il surnatante utilizzando una pompa per vuoto o una pipetta da 1.000 μL. Risospentare il pellet in 1 mL di terreno basale (Tabella 3).
- Determinare la concentrazione e la vitalità cellulare utilizzando un contatore cellulare automatizzato o un emocitometro.
- Semi digeriti DOP in una piastra a 12 pozzetti con 2 x 104 celle per cupola.
- Calcola il numero di cellule in base alle cupole pianificate per la semina e trasferiscile in un tubo di legame basso da 1,5 ml fresco.
NOTA: Calcola per una cupola in più (+ 2 x 104 celle extra). Ad esempio, per seminare tre cupole in un pozzo, prendi 8 x 104 (2 x 104 * 3 + 2 x 104 extra) celle. - Centrifugare a 500 x g per 4 min a 4 °C.
- Nel caso in cui non ci sia pellet visibile, ricordare l'orientamento del tubo all'interno della centrifuga per sapere dove si trova il pellet.
- Scartare con attenzione il surnatante usando una pipetta da 1.000 μL. Rimuovere il surnatante il più possibile senza disturbare il pellet.
- Aggiungere il volume appropriato di gel ECM al pellet utilizzando una pipetta da 1.000 μL con punta dell'orifizio pre-raffreddata larga 1.000 μL (50 μL / cupola + 50 μL extra).
- Seguire i passaggi 3.3-3.7.
- Calcola il numero di cellule in base alle cupole pianificate per la semina e trasferiscile in un tubo di legame basso da 1,5 ml fresco.
5. Crioconservazione delle DOP digerite e non digerite
NOTA: le DOP digerite e non digerite a cella singola sono adatte per la preparazione di scorte di backup congelate. Si noti che le DOP ripredite dagli stock congelati a singola cellula richiedono un tempo più lungo per recuperare e raggiungere una certa dimensione.
- Crioconservazione delle DOP non digerite.
- Avviare il processo di crioconservazione con il pellet dal passaggio 2.8. Utilizzare 500 μL di mezzo di congelamento freddo per risospese il pellet e trasferirlo in un flaconcino criogenico.
NOTA: Conservare due cupole per flaconcino. - Congelare le DOP durante la notte in un congelatore a -80 °C utilizzando un contenitore di congelamento delle celle appropriato.
- Avviare il processo di crioconservazione con il pellet dal passaggio 2.8. Utilizzare 500 μL di mezzo di congelamento freddo per risospese il pellet e trasferirlo in un flaconcino criogenico.
- Crioconservazione delle DOP digerite a singola cellula
- Dopo la raccolta e la digestione delle DOP, iniziare la crioconservazione dal passaggio 4.8.
- Per conservare una fiala criogenica, trasferire 4-5 x 105 cellule in un tubo fresco da 1,5 ml a bassa legatura.
NOTA: Conservare tre cupole/flaconcino. - Centrifugare a 500 x g per 4 min a 4 °C. Scartare accuratamente il surnatante usando una pipetta da 1.000 μL. Rimuovere il surnatante il più possibile senza disturbare il pellet.
- Risospentare il pellet in un volume appropriato di mezzo di congelamento (500 μL/flaconcino) e trasferirlo in un flaconcino criogenico.
- Congelare le DOP durante la notte in un congelatore a -80 °C utilizzando un contenitore di congelamento a celle appropriato e trasferirle in un congelatore a -150 °C o azoto liquido per la conservazione a lungo termine.
Risultati
Questo protocollo presenta le procedure che includono la sottocoltura e la crioconservazione delle DOP EAC con e senza digestione a singola cellula.
La Figura 1 mostra immagini rappresentative a contrasto di fase delle due diverse strategie di sottocultura. Le DOP EAC hanno raggiunto una densità appropriata per la subcoltura (Figura 1, a sinistra). La sottoculturazione senza digestione a singola cellula richiede meno tempo per raggiungere una densità comparabile e porta principalmente a strutture compatte (Figura 1, riga superiore). Al contrario, le DOP digerite a cella singola mostrano strutture cave con un nucleo cavo (Figura 1, riga inferiore). La Figura 2 mostra la colorazione e immunoistochimica (IHC) di Ematossilina-E (H&E) delle DOP EAC incorporate in paraffina con strutture compatte e cave. La pan-citocheratina (Pan-CK) consente l'identificazione delle cellule tumorali epiteliali18. La citocheratina 7 (CK7) evidenzia le cellule tumorali differenziate ghiandolari19. La struttura compatta (fila superiore) esiste prevalentemente nella coltura non digerita, mentre la struttura cava (riga inferiore) è dominante nella coltura che ha subito la digestione a singola cellula.
La Figura 3 mostra la colorazione di immunofluorescenza (IHC) del tessuto EAC accoppiato e delle DOP con struttura compatta e struttura cava. Il Ki67 evidenzia le popolazioni cellulari con maggiore proliferazione cellulare20. Il Ki67 (rosso) e il Pan-CK (verde) sono stati distribuiti in modo simile tra il tessuto primario EAC, la struttura compatta EAC PDO e la struttura cava EAC PDO. La Figura 4 mostra le caratteristiche morfologiche delle DOP EAC il primo giorno di recupero da stock congelati con crioconservazione a singola cellula (a sinistra) e crioconservazione basata su DOP non digerita (a destra).
La Figura 5 riassume un diagramma di flusso del processo di sottocoltura delle DOP EAC con e senza digestione a singola cellula. In breve, una DOP EAC ben cresciuta è pronta per essere approvata. Le DOP EAC sono state raccolte e pellettate. Per la digestione a singola cellula, le DOP sono state digerite enzimaticamente per 5-10 minuti per ottenere singole cellule, che probabilmente crescevano in strutture cave che facilitano gli esperimenti che richiedono il controllo del numero di cellule, la densità uniforme e il monitoraggio delle dimensioni. Per la sottocultura non digerita, le DOP sono state divise per guadagnare più spazio di crescita senza interrompere enzimaticamente, che probabilmente si trasformavano in strutture compatte che facilitano le analisi istologiche, la rapida espansione e il recupero più rapido dalla crioconservazione.
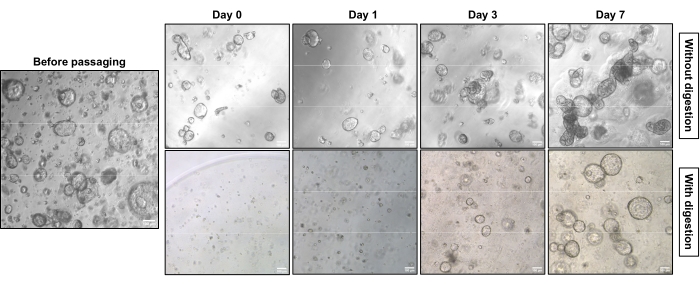
Figura 1: Caratteristiche morfologiche della sottocoltura EAC DOP con e senza digestione a singola cellula al microscopio a contrasto di fase. Le DOP EAC crescono fino a una certa densità prima della sottocultura (a sinistra). Dopo aver subculturato le DOP EAC senza digestione a singola cellula, le DOP crescono gradualmente da strutture cave a strutture compatte (a destra, fila in alto), mentre le DOP cresciute da singole cellule mostrano strutture prevalentemente cave (destra, riga inferiore). Le foto sono state scattate con un microscopio a luce invertita utilizzando un obiettivo 5x. Barra della scala: 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
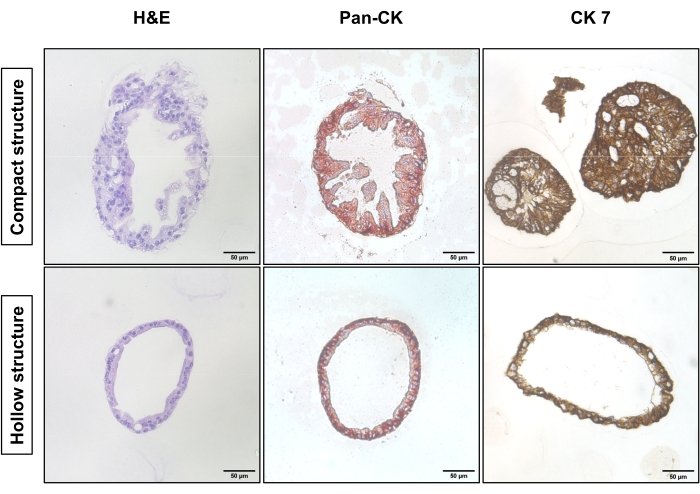
Figura 2: Caratteristiche istologiche della struttura compatta e cava delle DOP EAC. La colorazione H&E (a sinistra), la colorazione Pan-CK (al centro) e la colorazione CK7 (a destra) della struttura compatta (riga superiore) e della struttura cava (riga inferiore). Le foto sono state scattate con un microscopio a luce invertita utilizzando un obiettivo 20x. Barra della scala: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Colorazione immunoistochimica del tessuto EAC accoppiato e delle DOP. La colorazione di immunofluorescenza (IF) del tessuto EAC accoppiato (riga superiore), struttura compatta (riga centrale) e struttura cava (riga inferiore) con Pan-CK (verde), Ki67 (rosso) e DAPI (blu). Le foto sono state scattate con un microscopio a fluorescenza automatizzato invertito utilizzando un obiettivo 20x. Barra della scala: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Caratteristiche morfologiche delle DOP EAC il primo giorno di recupero da stock congelati. Immagini a contrasto di fase della ricoltivazione da crioconservazione basata su singola cellula (a sinistra) e crioconservazione basata su DOP non digerita (a destra) il primo giorno di recupero. Le foto sono state scattate con un microscopio a luce invertita utilizzando un obiettivo 5x. Barra della scala: 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Diagramma di flusso del processo di sottocoltura delle DOP EAC con e senza digestione a singola cellula. Fare clic qui per visualizzare una versione più grande di questa figura.
| Ceppo | Concentrazione finale | 50 ml | |||
| Mezzo basale (vedi tabella 3) | 24 ml | ||||
| Wnt-3A mezzo condizionato | 12 ml | ||||
| Mezzo condizionato R-Spondin1 da cellule Cultrex R-Spondin | 12 ml | ||||
| N-2 · | 100x | 1x | 500 μL | ||
| B-27 · | 50 volte | 1x | 1 ml | ||
| N-acetilcisteina | 0,5 M | 1 mM | 100 μL | ||
| CHIR-99021 · | 5 mM | 0,5 μM | 5 μL | ||
| Fattore di crescita epidermico umano ricombinante (EGF) | 100 μg/ml | 250 ng/ml | 125 μL | ||
| A83-01 | 25 metri quadrati | 0,5 μM | 1 μL | ||
| SB202190 · | 10 mM | 1 μM | 5 μL | ||
| Gastrina | 100 μM | 0,1 μM | 50 μL | ||
| Nicotinammide | 1 M | 20 μM | 1 ml | ||
| Gentamicina | 50 mg/ml | 10 μM | 5 μL | ||
| Penicillina/Streptomicina | 100x | 1x | 500 μL | ||
| Amfotericina B | 250 μg/ml | 0.60% | 300 μL | ||
| Aggiungi fresco in bene: | |||||
| Zucca | 100 μg/ml | 50 μL | |||
| Y-27632 · | 10,5 mM | 50 μL | |||
| Aggiungere quando si stabiliscono nuove DOP da tessuti primari o si recuperano da scorte congelate | |||||
| FGF-10a · | 100 μg/ml | 100 ng/ml | 50 μL | ||
Tabella 1: Preparazione del terreno di coltura EAC DOP.
| Inibitore della tripsina di soia (STI) | 12,5 mg |
| Regola a 50 ml con DPBS | |
| Filtrare attraverso un filtro sterile da 0,2 μm |
Tabella 2: Preparazione della soluzione di inibitore della tripsina di soia (STI).
| Reagente | Volume | Concentrazione finale |
| DMEM/F-12 avanzato | 48,2 ml | |
| HEPES (1 M) | 500 μL | 10 mM |
| L-Glutammina (100X) | 500 μL | 1X |
| Penicillina-Streptomicina (100X) | 500 μL | 1X |
| Amfotericina B | 300 μL | 0.60% |
| Gentamicina (50 mg/mL) | 5 μL | 5 μg/mL |
Tabella 3: Preparazione del mezzo basale.
| Digestione a singola cellula | |
| Pro | Contro |
| Controllo del numero di cella | Fragile durante l'incorporamento |
| Controllo di fattibilità | Più tempo necessario tra i passaggi |
| Applicabile ad esempio per lo screening dei farmaci, la citometria a flusso | Tempi di recupero più lunghi dalle scorte congelate |
| Senza digestione monocellulare | |
| Pro | Contro |
| La morfologia è utile per le analisi istologiche | Espansione delle DOP più in termini di dimensioni che di numero |
| Maggiore stabilità nel processo di incorporamento | Non applicabile alle analisi in cui la sospensione monocellulare è obbligatoria |
| Recupero rapido dalle scorte congelate | Mancanza di controllo del numero di cella e tracciamento delle dimensioni |
Tabella 4: Pro e contro per la subculturazione di DOP EAC con e senza digestione a singola cellula.
Discussione
In questo protocollo, vengono descritti due diversi metodi di sottocoltura e crioconservazione delle DOP EAC, cioè con e senza digestione a singola cellula. Diversi studi hanno raccomandato il passaggio di EAC DOP con digestione a singola cellula15,17, che è utile per la maggior parte degli esperimenti che richiedono il controllo del numero cellulare, densità uniforme e una struttura cava che facilita il monitoraggio delle dimensioni. Tuttavia, il metodo basato su singole cellule è caratterizzato da una crescita più lenta dopo la ricoltivazione da stock congelati e da una morfologia meno compatta durante il periodo di coltura. L'esperienza indica 2-3 settimane per la ricoltivazione basata su singole cellule per raggiungere la densità applicabile per il processo di sottocoltura. Al contrario, le DOP EAC congelate senza digestione monocellulare possono raggiungere le stesse dimensioni in un periodo più breve (circa 1 settimana) dopo la ricoltivazione. Una ragione potrebbe essere lo stress extra dalla digestione della tripsina per un tempo relativamente lungo (10 minuti). Pertanto, si raccomanda di conservare le DOP EAC non digerite in un rapporto di 1:1,5 (congelamento di due cupole di DOP EAC non digerite e semina in tre cupole per la ricoltivazione). Inoltre, l'uso di DOP EAC non digerite è raccomandato per una rapida espansione e caratterizzazione istologica mediante colorazione IHC o IF a causa della struttura compatta. I pro e i contro dei due metodi di sottocultura sono riassunti nella Tabella 4.
Diversi passaggi critici richiedono attenzione in questo protocollo. In primo luogo, le piastre per la coltura DOP devono essere preriscaldate durante la notte in un incubatore a 37 °C per garantire il processo di solidificazione delle cupole di gel ECM appena seminate. Si consiglia di utilizzare una piastra calda per mantenere la piastra a 37 °C mentre si tratta di una lunga durata di semina. In secondo luogo, durante il processo di sottocoltura sono necessari tubi a bassa legatura per evitare una significativa perdita di DOP. Per prevenire la perdita di gel ECM, le punte con un'ampia apertura del foro possono essere pre-raffreddate nel congelatore a -20 °C prima dell'uso. Qui, l'ampia apertura delle punte evita il danneggiamento delle strutture DOP durante la fase di raccolta. Successivamente, si consiglia di incubare le DOP per 20 minuti sul ghiaccio prima della prima fase di centrifugazione, per garantire la completa liquefazione del gel ECM. Si noti che la centrifuga deve essere impostata a 4 °C durante le fasi di centrifugazione per mantenere il gel ECM residuo allo stato liquido. Inoltre, per il metodo a singola cellula, si raccomanda di mescolare accuratamente le DOP dopo l'incubazione della tripsina utilizzando una normale punta da 1.000 μL per rompere i grumi cellulari prima di aggiungere la STI, piuttosto che filtrare direttamente la sospensione cellulare con i filtri cellulari, per evitare la perdita cellulare.
Alcune modifiche possono essere apportate a questo protocollo. La soluzione di recupero cellulare può essere sostituita da DPBS ghiacciato per sciogliere il gel ECM nella fase di raccolta. Tuttavia, le esperienze hanno mostrato una migliore capacità di sciogliere il gel ECM utilizzando la soluzione di recupero cellulare. Pertanto, il DPBS ghiacciato è piuttosto raccomandato solo come metodo di backup alternativo. Se il laboratorio non è dotato di un incubatore rotante, le DOP EAC possono essere incubate con tripsina a bagnomaria a 37 °C insieme alla miscelazione invertendo il tubo ogni 2-3 minuti. Tuttavia, un mezzo di congelamento commerciale con siero inferiore o assente è preferito a causa di un migliore recupero della DOP.
Alcune limitazioni devono essere affrontate in questo protocollo. Poiché questi metodi sono stati testati solo nelle DOP EAC, l'applicazione di questo protocollo ad altri tipi di DOP non è chiara. Sebbene le procedure per il passaggio di DOP con e senza digestione a singola cellula siano standardizzate per la maggior parte dei tipi di organoidi21,22, è ancora necessario tentare protocolli attuali su altri tipi di cancro per garantire la riproducibilità. Inoltre, un'incubazione di tripsina di 10 minuti allo 0,25% può stressare le cellule durante la digestione; pertanto, il tempo di incubazione potrebbe variare in base alla condizione DOP pre-sottocultura e alla diversità individuale della DOP. Durante i primi tentativi, si suggerisce di impostare tempi di incubazione della tripsina diversi per ogni DOP EAC.
In conclusione, questo è il primo protocollo che descrive e discute la sottocultura e la crioconservazione delle DOP EAC con e senza digestione a singola cellula. La sottoculturazione di DOP EAC con digestione a singola cellula è applicabile per esperimenti di confronto tra gruppi, mentre le DOP EAC non digerite sono utili per la caratterizzazione istologica, la crioconservazione e la rapida espansione. Qui, la manutenzione ordinaria delle DOP EAC è standardizzata, fornendo una guida per i ricercatori per scegliere i metodi appropriati per la generazione di organoidi EAC.
Divulgazioni
Gli autori non dichiarano conflitti di interesse in questo lavoro.
Riconoscimenti
Questo lavoro è stato sostenuto dal Köln Fortune Program / Facoltà di Medicina, Università di Colonia. Ringraziamo l'assistenza tecnica di Susanne Neiss, Michaela Heitmann e Anke Wienand-Dorweiler. Ningbo Fan è stato sostenuto finanziariamente dal Guangzhou Elite Scholarship Council (GESC). Gli autori ringraziano il Dr. Joshua D'Rozario per la sua assistenza nell'editing linguistico.
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| -20°C Freezer | Bosch | Economic | |
| -80°C Freezer | Panasonic | MDF DU500VH-PE | |
| Automated Cell counter | Thermo Fisher | AMQAX1000 | Countess II |
| Biological Safety Cabinet Class II | Thermo Scientific | 51022482 | Herasafe KS12 |
| Centrifuge | Heraeus | 75003060 | Megafuge 1.0R |
| CO2 Incubator | Thermo Scientific | 50116048 | Heracell 150i |
| Inverted automated fluorescence microscope | Olympus | IX83 | |
| Inverted light microscope | Leica | DMIL LED Fluo | |
| Pipette 1000 µL | Eppendorf | 3123000063 | Research Plus |
| Pipette 200 µL | Eppendorf | 3123000039 | Research Plus |
| Rotating Incubator | Scientific Industries, sc. | SI-1200 | Enviro-genie |
| Shaker | Eppendorf | 5355 000.011 | Thermomixer Comfort |
| Vacuum pump | Vacuubrand | 20727200 | BVC control |
| Waterbath | Medingen | p2725 | W22 |
| Material | |||
| 15 mL tube | Sarstedt | 62.554.502 | Inc Screw cap tube PP 15 mL |
| Cryo vial 2 mL | Sarstedt | 72.379 | CryoPure 2.0 mL tube |
| Low bind tube 1.5 mL | Sarstedt | 72.706.600 | Micro tube 1.5 mL protein LB |
| Low bind tube 5 mL | Eppendorf | 0030 108.302 | Protein LoBind Tube 5.0 mL |
| Pipette tip 200 µL | Starlab | E1011-8000 | 200 µL Graduated tip, wide orifice |
| Pipette tip 1000 µL | Starlab | E1011-9000 | 1000 µL Graduated tip, wide orifice |
| Pipette tip 1000 µL | Sarstedt | 70.3050 | Pipette tip 1000 µL |
| Sterile filter 0.2 µm | Sarstedt | 83.1826.001 | Filtropur 0.2 µm sterile filter |
| Tissue culture plate | Sarstedt | 83.3921 | 12 well-plate |
| Reagent/Chemical | |||
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| Amphotericin B | Thermo Fisher Scientific | 15290026 | |
| B-27 | Thermo Fisher Scientific | 17504001 | |
| Cell Recovery Solution | Corning | 354253 | |
| CHIR-99021 | MedChemExpress | HY-10182/CS-0181 | |
| DNase I grade II, from bovine pancreas | Sigma-Aldrich | 10104159001 | |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190094 | |
| Extracellular matrix (ECM) gel: Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 356231 | |
| FGF-10a | Peprotech | 100-26-100 | |
| Freezing medium: Recovery Cell Freezing Medium | Thermo Fisher Scientific | 12648010 | |
| Gastrin | Sigma | G9020 | |
| Gentamicin-25 (25 mg/ 500 µL) | PromoCell | C-36030 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| L-Glutamine 200 mM (100X) | Thermo Fisher Scientific | 25030024 | |
| N-2 | Thermo Fisher Scientific | 17502-048 | |
| N-Acetylcysteine | Sigma | A9165 | |
| Nicotinamide | Sigma | N0636-100 | |
| Noggin | Peprotech | 120-10C-50 | |
| Penicillin-Streptomycin 10,000 U/ mL (100X) | Thermo Fisher Scientific | 15140122 | |
| Recombinant human epidermal growth factor (EGF) | Peprotech | AF-100-15 | |
| R-Spondin1 conditioned medium from Cultrex R-Spondin Cells | Biotechne | 3710-001-01 | |
| SB202190 | MedChemExpress | 152121-30-7 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma-Aldrich | 93620-1G | |
| Trypsin-EDTA (0.25 %), phenol red | Thermo Fisher Scientific | 25200056 | |
| Wnt-3A conditioned medium | Wnt-3A expressing cell line was kindly provided by Prof. Hans Clevers' group | ||
| Y-27632 | Sigma | Y0503 |
Riferimenti
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Coleman, H. G., Xie, S. -. H., Lagergren, J. The epidemiology of esophageal adenocarcinoma. Gastroenterology. 154 (2), 390-405 (2018).
- Rumgay, H., et al. International trends in esophageal squamous cell carcinoma and adenocarcinoma incidence. The American Journal of Gastroenterology. 116 (5), 1072-1076 (2021).
- Qian, H., et al. Clinical characteristics, prognosis, and nomogram for esophageal cancer based on adenosquamous carcinoma: a seer database analysis. Frontiers in Oncology. 11, 603349 (2021).
- Lagergren, J., Smyth, E., Cunningham, D., Lagergren, P. Oesophageal cancer. Lancet. 390 (10110), 2383-2396 (2017).
- Rockett, J. C., Larkin, K., Darnton, S. J., Morris, A. G., Matthews, H. R. Five newly established oesophageal carcinoma cell lines: phenotypic and immunological characterization. British Journal of Cancer. 75 (2), 258-263 (1997).
- Hashimoto, N. Expression of COX2 and p53 in rat esophageal cancer induced by reflux of duodenal contents. ISRN Gastroenterology. 2012, 1-5 (2012).
- Quante, M., et al. Bile acid and inflammation activate gastric cardia stem cells in a mouse model of barrett-like metaplasia. Cancer Cell. 21 (1), 36-51 (2012).
- Kapoor, H., Lohani, K. R., Lee, T. H., Agrawal, D. K., Mittal, S. K. Animal models of Barrett's esophagus and esophageal adenocarcinoma-past, present, and future. Clinical and Translational Science. 8 (6), 841-847 (2015).
- Lan, T., Xue, X., Dunmall, L. C., Miao, J., Wang, Y. Patient-derived xenograft: a developing tool for screening biomarkers and potential therapeutic targets for human esophageal cancers. Aging. 13 (8), 12273-12293 (2021).
- Liu, D. S. H., et al. APR-246 potently inhibits tumour growth and overcomes chemoresistance in preclinical models of oesophageal adenocarcinoma. Gut. 64 (10), 1506-1516 (2015).
- Ebbing, E. A., et al. Esophageal adenocarcinoma cells and xenograft tumors exposed to Erb-b2 receptor tyrosine kinase 2 and 3 inhibitors activate transforming growth factor beta signaling, which induces epithelial to mesenchymal transition. Gastroenterology. 153 (1), 63-76 (2017).
- Simian, M., Bissell, M. J. Organoids: A historical perspective of thinking in three dimensions. The Journal of Cell Biology. 216 (1), 31-40 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Li, X., et al. Organoid cultures recapitulate esophageal adenocarcinoma heterogeneity providing a model for clonality studies and precision therapeutics. Nature Communications. 9, 2983 (2018).
- Ebbing, E. A., et al. Stromal-derived interleukin 6 drives epithelial-to-mesenchymal transition and therapy resistance in esophageal adenocarcinoma. Proceedings of the National Academy of Sciences of the United States of America. 116 (6), 2237-2242 (2019).
- Karakasheva, T. A., et al. Generation and characterization of patient-derived head and neck, oral, and esophageal cancer organoids. Current Protocols in Stem Cell Biology. 53 (1), 109 (2020).
- Ordóñez, N. G. Broad-spectrum immunohistochemical epithelial markers: a review. Human Pathology. 44 (7), 1195-1215 (2013).
- Maniar, K. P., Umpires, B. Cytokeratin 7 (CK7, K7). Pathology Outlines.com website. , (2021).
- Sun, X., Kaufman, P. D. Ki-67: more than a proliferation marker. Chromosoma. 127 (2), 175-186 (2018).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 3380-3409 (2020).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon